Los cultivos de tomate (Solanum lycopersicum L.) y chile (Capsicum annuum L.) son de importancia económica por su consumo en la dieta humana. México se posiciona en el décimo lugar en producción de tomate con 2,649,358 t y segundo lugar en chile, con una producción de 2,294,400 t (SIAP 2016). Sin embargo, la producción de ambos cultivos es afectada por enfermedades ocasionadas por diferentes patógenos; entre éstos, destaca el oomiceto Phytophthora capsici Leonian, el cual es un microorganismo fitopatógeno que causa serios daños económicos en la agricultura en todo el mundo (Chen et al., 2016a). P. capsici ocasiona “damping-off”, pudrición de raíz, daño en tallo, hoja o pudrición de frutos en más de 50 especies de plantas hospedantes (Erwin y Riveiro, 1996; Khan et al., 2011). Se ha reportado que este patógeno causa considerables pérdidas de rendimiento en la producción en un rango del 15 al 45% e incluso pérdida total de los cultivos de chile, tomate y berenjena (González et al., 2009; Wang et al., 2011). La alta humedad en el suelo y clima cálido que prevalece dentro de las plantaciones de tomate y chile, favorecen la dispersión y la sobrevivencia de P. capsici (Erwin y Riveiro, 1996).
En el manejo y control de este patógeno se han utilizado varias estrategias, incluyendo prácticas culturales, utilización de variedades resistentes (Yang et al., 2015; Gómez-Rodríguez et al., 2017), aplicación de fungicidas (Lamour et al., 2012) y manejo del agua (Sanogo y Ji, 2013), pero ninguna de estas prácticas de manera individual ha logrado controlar al patógeno por completo (Hausbeck y Lamour, 2004). Aunque algunos fungicidas específicos han logrado reducir la severidad de la enfermedad en forma rápida y efectiva, su uso indiscriminado ha ocasionado la aparición de cepas resistentes y contaminación al ambiente (Qi et al., 2012). Por lo anteriormente señalado, en la actualidad para el manejo de Phytophthora se han considerado nuevas alternativas, basadas en el control biológico, estrategia importante en el manejo de fitopatógenos que habitan en el suelo, ya que reducen la aplicación de agroquímicos (Nguyen et al., 2012; Rios-Velasco et al., 2016).
Distintos microorganismos han sido reportados por suprimir el crecimiento de P. capsici, incluyendo Streptomyces spp. (Ko et al., 2010; Nguyen et al., 2012), Paenibacillus spp. (Naing et al., 2014), Trichoderma sp. (Segarra et al., 2013), Clitocybe nuda (Chen et al., 2012) Aspergillus sp. (Kang y Kim, 2004) y Bacillus spp. (Zhang et al., 2010). El género Bacillus ha sido más estudiado dentro del control biológico y las especies de este género se consideran candidatos ideales para el control de enfermedades, debido a su potencial antagónica (Zhao et al., 2013; Torres et al., 2016). Los mecanismos de control incluyen la producción de antibióticos y enzimas líticas, interferencia física o química, competencia, inducción de resistencia al hospedero, hiperparasitismo y predación (Pal y Gardener, 2006).
Los objetivos de este trabajo fueron, determinar el efecto de inhibición germinativa de Bacillus spp. mediante el uso de células y filtrados bacterianos sobre zoosporas de P. capsici a nivel in vitro, y su biocontrol en plantas de tomate y chile; así como la identificación de estos microorganismos.
MATERIALES Y MÉTODOS
Material biológico
Los microorganismos utilizados en este estudio fueron, dos aislados bacterianos antagónicos del género Bacillus codificados como B17 y B32 y la cepa Phytophthora capsici pertenecientes al cepario del Laboratorio de Fitopatología del Centro de Investigación en Alimentación y Desarrollo, Unidad Culiacán. Las bacterias fueron aisladas de la rizósfera de campos agrícolas con cultivos de tomate y chile en distintas localidades geográficas de Sinaloa, se activaron en agar nutritivo (AN), se incubaron a 27 °C durante cinco días y se preservaron en buffer de fosfato a 4 °C hasta su uso. El patógeno Phytophthora capsici, se activó en medio de cultivo V8 (10% de jugo V8, 0.02% CaCO3 y 1.5% agar) y se incubó a 27 °C hasta su uso (Chen et al., 2016b).
Identificación morfológica y molecular
Para confirmar que los aislados bacterianos en estudio pertenecieran al género Bacillus, se identificaron mediante morfología de las colonias, célula, tinción Gram y tinción de flagelos (Castillo et al., 2004); adicionalmente, se identificaron mediante técnicas moleculares en el Laboratorio de Fitopatología CIAD Unidad Culiacán y en el Laboratorio Nacional de Genómica para la Biodiversidad (LANGEBIO) del CINVESTAV, Campus Irapuato, Gto., México.
Para identificar los aislados bacterianos se tomó una colonia purificada con alrededor de 48-72 h de crecimiento. La extracción de ADN, se realizó de acuerdo con la metodología de Heddi et al. (1999); subsecuentemente se realizó la amplificación de gen 16S del ADNr mediante la Reacción en Cadena de la Polimerasa (PCR), utilizando los iniciadores universales FD2 (5’-AGAGTTTGATCATGGCTCAG-3’) y RP1 (5’-TACCTTGTTACGACTTCACC-3’), los cuales amplifican un fragmento de 1500 pb; la amplificación se realizó en un termociclador T100 TM Thermal Cycler (Singapore). Las condiciones de tiempo y temperatura incluyeron: un paso inicial de activación de la enzima a 95°C por 5 min, un segundo paso que comprendió 30 ciclos incluyendo una desnaturalización a 94°C por 1 min, un paso de alineamiento a 56°C por 1 min, un paso de extensión a 72°C por 1 min y cuando los ciclos se completaron, una extensión final a 72°C por 10 min (McLaughlin et al., 2012).
Los fragmentos obtenidos de la PCR se analizaron mediante una electroforesis en gel de agarosa al 1% en una cámara PowerpacTM Basic (BIO-RAD). Una vez detectado el fragmento esperado correspondiente a la región 16S, se purificó, se secuenció y se comparó su secuencia nucleotídica con secuencias disponibles en la base de datos del NCBI (Altschul et al., 1990); por último, las secuencias obtenidas fueron depositadas en el banco de genes del NCBI.
Inhibición germinativa de zoosporas de P. capsici mediante el uso de suspensión celular de Bacillus spp.
El bioensayo de inhibición germinativa se llevó a cabo en portaobjetos cóncavos. Para inducir la formación de esporangios de P. capsici, se tomaron discos de 5 mm de agar con micelio del patógeno con 5 días de crecimiento, éstos se colocaron en cajas Petri con 10 mL de agua destilada e incubada a 25-27°C por 48 h. Para la liberación de zoosporas del esporangio, las cajas Petri se incubaron a 4°C por 30 min (Ko et al., 2010), logrando una concentración de 20 zoosporas/µL. Se colocaron 20 µL de suspensión de zoosporas en cada concavidad del portaobjeto, se añadió 20 µL de suspensión celular bacteriana de los aislados B17 y B32 a una concentración de 1 x 108 UFC 1:1 v/v, se cubrió con un cubreobjetos para prevenir la evaporación, y se incubó por 24 h a 25-27°C (Ko et al., 2010). Las zoosporas que no fueron inoculadas con la suspensión celular bacteriana se utilizaron como testigo. El porcentaje de inhibición germinativa de zoosporas, para los bioensayos con suspensión celular y filtrados bacterianos, se registró al contabilizar la germinación de 100 zoosporas en cada concavidad con la ayuda de un microscopio óptico (Carl Zeiss AXIO Imager.A2), con cámara integrada (AxioCam ERc5s) con los objetivos 10x y 40x. Cada tratamiento contó con siete repeticiones y el experimento se realizó por duplicado.
Inhibición germinativa de zoosporas mediante el uso de filtrado bacteriano
El filtrado bacteriano se obtuvo al colocar en un matraz Erlenmeyer, 50 mL de caldo nutritivo con 200 µL de una suspensión de esporas de los aislados bacterianos B17 y B32 con una concentración de 1 x 108 UFC. Los matraces se incubaron a 30°C en un agitador orbital (140 rpm) por 6 días. Los cultivos se filtraron utilizando filtros Millipore® de 0.22 µm para eliminar las células bacterianas (Chen et al., 2016b). Para la inhibición de la germinación, se colocaron 20 µL de suspensión de zoosporas (20 zoosporas/µL) en la cavidad del portaobjeto, mezclado con 20 µL del filtrado bacteriano (1:1 v/v), se cubrieron con cubreobjetos para prevenir la evaporación y se incubaron por 24 h a 25-27 °C (Ko et al., 2010). Las zoosporas sin filtrado bacteriano se utilizaron como testigo.
Antagonismo de Bacillus spp. sobre P. capsici in vivo, con el uso de suspensión celular y filtrados bacterianos en plantas de tomate y chile.
Las plántulas que se utilizaron para este estudio fueron, de tomate híbrido Malinche y de chile híbrido SV3198HJ con 3 semanas de desarrollo después de la germinación. La inoculación del patógeno P. capsici fue directa a la raíz, se colocó 1 mL de suspensión de zoosporas (1 x 103/mL) para ambos cultivos, en seguida fueron inoculadas con 10 mL de suspensión de células bacterianas (1 x 108/mL) o sus filtrados, las condiciones fueron las mismas para todos los tratamientos.
La severidad del daño o enfermedad se midió de acuerdo a una escala de síntomas de pudrición del cuello de raíz propuesta por Segarra et al. (2013) con la modificación de: 0 indica planta sin síntomas, 1 = síntomas de daños ˂ 10 mm, 2 = 10 a 19 mm de pudrición, 3 = 20 a 30 mm de pudrición y 4 = ˃ de 30 mm de pudrición. El porcentaje de la severidad del daño se calculó mediante la fórmula:
dónde: %SD= porcentaje de severidad de daño, GD= grado de daño, NP= número de plantas dañadas, EM= grado de daño máximo de la escala de severidad y TP= número de plantas del tratamiento (Shanmugam y Kanoujia, 2011; Li et al., 2012) y la eficacia de control se calculó utilizando la fórmula:
donde % EC = porcentaje de eficacia de control, SD del tratamiento = media de severidad de daño por tratamiento, SD del control = media de severidad de daño del control (Li et al., 2012); el experimento consistió en tres repeticiones por tratamiento bajo invernadero por duplicado. La unidad experimental fue una maceta con tres plántulas. Este estudio se realizó en dos fechas diferentes, los datos analizados se reportaron como promedios de las evaluaciones.
Análisis estadísticos
Para ambos bioensayos in vitro e in vivo se utilizó un diseño completamente al azar, y los datos obtenidos fueron analizados mediante un análisis de varianza (ANDEVA) con en el programa estadístico Minitab 17; así mismo, la comparación de medias mediante la prueba de Tukey (p≤0.05).
RESULTADOS
Identificación morfológica
Las colonias bacterianas de B17 y B32, mostraron características similares en cuanto a su forma y color. Las colonias del aislado B17 presentan una elevación en el centro (acuminada) con una consistencia cremosa y mucoide a diferencia del aislado B32, las cuales se observan planas y de consistencia seca y grumosa.
Ambos aislados resultaron Gram positivos y flagelos perítricos. Las medidas celulares del aislado B17 oscilaron entre 2.0 a 3.2 µm de longitud; a su vez, el tamaño celular del aislado B32 fue de 3.0 a 4.5 µm; además, en este aislado se observó la presencia de cristales parasporales (proteína Cry), coincidiendo con las características más importantes de las bacterias pertenecientes al género Bacillus, las cuales son de forma bacillar, movilidad por flagelos insertados en forma perítrica, tamaño celular de 0.5-2.5 y 1.2-10 µm y tinción Gram positivas.
Identificación molecular
Las secuencias obtenidas mediante la técnica molecular de PCR de los aislados B17 y B32, mostraron una identidad del 99 al 100% con Bacillus amyloliquefaciens y Bacillus thuringiensis respectivamente al ser comparadas con secuencias ya reportadas en la base de datos del Gen Bank (NCBI); las secuencias fueron depositadas en la base de datos donde se les asignó el No. de acceso KX953161.1 para la cepa B17 y KX953162.1 para B32.
Inhibición germinativa de zoosporas de P. capsici mediante el uso de suspensión celular de Bacillus spp.
Los resultados muestran que ambas bacterias inhiben la germinación de zoosporas; así como, deformación en el tubo germinativo después de 24 h (Figuras 1 y 2). En los tratamientos testigo, las zoosporas a las 24 h después de ser liberadas del esporangio presentaron un 100% de germinación. La cepa de B. amyloliquefaciens causó 88.15% de inhibición germinativa; mientras que, la cepa B. thuringiensis fue más efectiva al causar un 97.05% de inhibición (Cuadro 1).
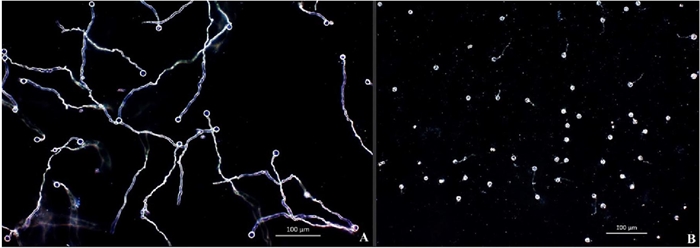
Figura 1 Efecto de la suspensión celular o filtrado de B. amyloliquefaciens y B. thuringiensis en la inhibición germinativa de zoosporas de (P. capsici) 24 h post-inoculación. (A) germinación de zoosporas sin tratamiento utilizado como control. (B) inhibición germinativa con tratamiento. Las fotografías fueron tomadas bajo microscopio con objetivo (10x) en campo oscuro.
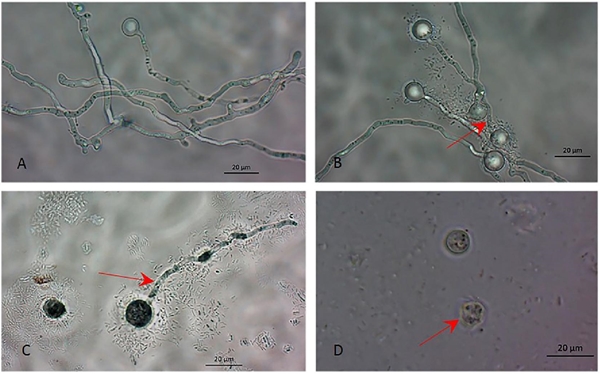
Figura 2 La morfología de la zoospora de P. capsici germinada con y sin tratamiento bacteriano (suspensión celular o filtrados) de B. amyloliquefaciens y B. thuringiensis. (A) Zoospora germinada sin inoculación. (B y C) tubo germinativo anormal y zoosporas sin geminación y (D) las paredes de la zoospora de P. capsici se lisaron cuando fueron tratadas con suspensión celular de B. amyloliquefaciens y B. thuringiensis. Las fotografías fueron tomadas bajo microscopio con objetivo (40x) en campo claro.
Cuadro 1 Inhibición de germinación de las zoosporas (P. capsici) mediante el uso de suspensión celular y filtrados de B. amyloliquefaciens y B. thuringiensis, 24 h después de la inoculación.
| Tratamientos | % de inhibición de la germinaciónx + DE | |
| Suspensión Cel. | Filtrados | |
| Control (Agua) | 0.00 ay | 0.00 a |
| B. amyloliquefaciens | 88.15±2.519 b | 24.30±6.280 b |
| B. thuringiensis | 97.05±1.191 c | 49.35±5.031 c |
xLas medias con letras distintas son significativamente diferentes (ANDEVA), de acuerdo a la prueba de Tukey (P ≤ 0.05)
yInhibición germinativa = (Número de zoosporas germinadas/Total de zoosporas) x 100 (Chen et al., 2016b). DE = Desviación estándar
Inhibición germinativa de zoosporas de P. capsici mediante el uso de filtrado de Bacillus spp.
Los filtrados bacterianos de B. amyloliquefaciens inhibieron la germinación de zoosporas de P. capsici a nivel in vitro 24.3%; mientras que con los filtrados de B. thuringiensis se obtuvo 49.35% de inhibición. En el testigo se observó el 100% de germinación (Cuadro 1).
Severidad de daño causada por P. capsici con el uso de suspensión celular y filtrados bacterianos en plantas de tomate y chile.
Los resultados indican que las plantas tratadas con suspensión celular de B. thuringiensis, presentan una incidencia de la enfermedad en ambos cultivos de 38.89% en plantas de chile y 22.22% en tomate; mientras que, las plantas tratadas con suspensión celular de B. amilolyquefaciens, se observa 61.11% de incidencia de la enfermedad en plantas de chile y 27.78% en tomate. Cuando las plantas fueron inoculadas con filtrados de B. amilolyquefaciens y B. thuringiensis, la severidad de los síntomas de la pudrición del cuello fue mayor 90 y 70% en plantas de chile y 60 y 40% en plantas de tomate respectivamente (Cuadro 2).
Cuadro 2 Severidad de daño por P. capsici en plántulas de chile y tomate tratadas con suspensión celular y filtrados de B. amyloliquefaciens y B. thuringiensis después de 7 d de inoculación.
| Tratamiento | Severidad de daño (%) x +DE | |||
| Chile | Tomate | |||
| S. celular | Filtrado | S. celular | Filtrado | |
| Control (Agua) | 0.00 cy | 0.00 c | 0.00 c | 0.00 c |
| P. capsici | 100 a | 100 a | 100 a | 100 a |
| B. amyloliquefaciens-P. capsici | 61.11±6.49 b | 94.44±2.26 ab | 27.78±4.18 b | 61.11±4.18 b |
| B. thuringiensis-P. capsici | 38.89±4.18 b | 72.25±418 b | 22.22±2.87 bc | 44.44±4.54 b |
xLas medias que no comparten una letra son significativamente diferentes (ANDEVA), de acuerdo a la prueba de Tukey (P ≤ 0.05)
ySeveridad de daño = [Σ (grado de daño x número de plantas dañadas)/(grado de daño máximo de la escala de severidad x total de plantas del tratamiento)] x 100 . DE = Desviación estándar
Eficacia biológica de Bacillus spp. sobre P. capsici, con el uso de suspensión celular y filtrados bacterianos en plantas de tomate y chile.
En los resultado obtenidos se observa que en las plantas que fueron inoculadas con suspensión celular de B. thuringiensis, se obtuvo una eficacia de biocontrol mayor al 60 y 77% en plantas de chile y tomate respectivamente; mientras que, en las plantas de chile y tomate tratadas con filtrados bacterianos se observó una eficacia menor al 28 y 56% respectivamente (Cuadro 3). La suspensión celular de B. amyloliquefaciens mostró una eficacia de biocontrol en plantas de chile tan solo de 38.89%; mientras que, en tomate fue significante con más del 72%; sin embargo, la eficacia de biocontrol de sus filtrados bacterianos estuvo por debajo de 6 y 38% en plantas de chile y tomate respectivamente (Cuadro 3, Figura 3).
Cuadro 3 Eficacia biológica de la suspensión celular y filtrados de B. amyloliquefaciens y B. thuringiensis sobre P. capsici en plántulas de chile y tomate.
| Tratamiento | Eficacia biológica (%)x +DE | |
| Chile | Tomate | |
| P. capsici | 0 cy | 0 d |
| S. Cel. B. amyloliquefaciens-P. capsici | 38.89±3.61 b | 72.25±2.20 a |
| S. Cel. B. thuringiensis-P. capsici | 61.11±5.03 a | 77.78±0.00 a |
| Filtrado B. amyloliquefaciens-P. capsici | 5.56±7.78 c | 38.89±3.61 c |
| Filtrado B. thuringiensis-P. capsici | 27.78±3.38 b | 55.56±0.00 b |
xLas medias que no comparten una letra son significativamente diferentes (ANDEVA), de acuerdo a la prueba de Tukey (P≤0.05)
yEficacia de control = (100 - media de severidad de daño por tratamiento)/(media de severidad de daño del control) x 100 (Li et al., 2012). DE = Desviación estándar

Figura 3 Eficacia de control de la enfermedad ocasionada por P. capsici en plántulas de chile y tomate mediante el uso de suspensión celular o filtrados de B. amyloliquefaciens y B. thuringiensis . Las plántulas fueron inoculadas con 1 µL de zoosporas 1x103 y 10 µL de suspensión celular o filtrado. (A) daño por P. capsici en plántulas de chile, (B) plántulas de chile con P. capsici +suspensión celular de B. thuringiensis, (C) daño por P. capsici en tomate y (D) plántulas de tomate con P. capsici+suspensión celular de B. thuringiensis.
DISCUSIÓN
La enfermedad producida por P. capsici es muy importante debido a que afecta a cultivos de importancia económica como tomate y chile (Agrios 2005; Hansen et al., 2012). Tomando en cuenta esta situación, y a que el control químico y la mayoría de las prácticas culturales no representan herramientas efectivas para disminuir la incidencia de daño por este patógeno en plántulas de tomate y chile, el uso de organismos de biocontrol pueden ser una alternativa promisoria (Bae et al., 2016; Thampi y Bhai, 2017).
Los microorganismos del género Bacillus se encuentra principalmente en suelo, en este estudio se trabajó con dos aislados bacterianos, cuyas características morfológicas pertenecen al género Bacillus. Estos fueron identificados mediante técnicas moleculares el aislado B17 como B. amyloliquefaciens y B32 mostró un alineamiento con B. thuringiensis y B. cereus; sin embargo, de acuerdo a diversos autores tal como Sánchez et al., 2016, mencionan que una de las principales diferencias entre B. thuringiensis y B. cereus, es la producción del cristal parasporal (proteína cry), característico de B. thuringiensis; en la que se observó en nuestro aislado B32.
Así mismo, se demostró que presentan efecto de biocontrol e inhibición de la germinación de zoosporas de P. capsici en plántulas de tomate y chile al observar que la inhibición de la germinación de zooporas de P. capsici a nivel in vitro fue del 88.15±2.5 y 97.05±1.19% al utilizar suspensión celular de B. amyloliquefaciens y B. thuringiensis, respectivamente. Torres et al. (2016) reportaron una inhibición del 56.5±2.1% sobre el crecimiento micelial de Macrophomina phaseolina mediante la técnica de cultivo dual, utilizando suspensión celular de B. amyloliquefaciens. De acuerdo con lo observado en el trabajo de Torres et al. (2016) y en el presente trabajo, se demuestra que la capacidad biocontroladora de B. amyloliquefaciens se ve afectada por la naturaleza del patógeno, ya que al confrontar la suspensión celular de B. amyloliquefaciens con zoosporas de P. capsici en medio de cultivo líquido, se observa una inhibición germinativa del 88.15%. Por otro lado, Chen et al (2016b), reportaron una tasa de germinación de zoosporas de P. capsici del 100% al ser confrontadas con filtrados obtenidos de un cultivo de Streptomyces plicatus, donde los ingredientes del medio de cultivo fueron papa y sucrosa; sin embargo, los resultados que obtuvieron al utilizar filtrados provenientes de medios de cultivo que contenían quitina, papa y sucrosa, alcanzaron una inhibición de la germinación de zoosporas del 100%, lo que demuestra que los agentes de biocontrol son más eficientes en presencia del patógeno a controlar, que si se encuentran en condiciones que no amenacen su desarrollo. Esto se demostró al utilizar filtrados bacterianos de B. amyloliquefaciens y B. thuringiensis, sobre una suspensión de zoosporas de P. capsici, donde se observó una inhibición de la germinación de 24.30±6.28 y 49.35±5.03% respectivamente, mucho menor a la que se observó al utilizar la suspensión celular.
Durante los experimentos in vivo, se observó una severidad de daño del 61.11±6.49 y 38.89±4.18% al utilizar suspensión celular de B. amyloliquefaciens y B. thuringiensis respectivamente, mientras que el control presentó el 100% de daño. Algunas especies de Bacillus son promisorias dentro del biocontrol, debido a su capacidad de producir una variedad de metabolitos antibacterianos y antifúngicos (Zhi et al., 2017). Debido a su versatilidad como productores de compuestos bioactivos, se están estudiando diferentes especies de Bacillus para varias aplicaciones potenciales (Torres et al., 2017). Por ejemplo, muchas cepas de Bacillus producen una variedad de lipopéptidos cíclicos antifúngicos (CLP), incluyendo miembros de las familias surfactina, iturina y fengicina (Torres et al., 2016). Se ha demostrado que los lipopéptidos pertenecientes a las familias iturina, fengicina y surfactina son los compuestos más importantes en la actividad de biocontrol de cepas de Bacillus contra diferentes hongos fitopatógenos de diferentes especies de plantas (Masmoudi et al., 2017; Abdallah et al., 2017). Por lo tanto, el control de las enfermedades fúngicas por los Bacillus, representaría una oportunidad relevante para la biotecnología agrícola.
Varios autores han reportado a B. amyloliquefaciens como una alternativa de biocontrol para diferentes patógenos (Yu y Lee., 2013; Wei et al., 2015; Zhang et al., 2015; Torres et al., 2016; Chen et al., 2016b; Abdallah et al., 2017); sin embargo, para el biocontrol de P. capsici en cultivos de tomate y chile no existen reportes donde B. amyloliquefaciens presente un biocontrol efectivo, por lo que, de acuerdo con los resultados obtenidos en este estudio, es necesario más investigación con este microorganismo. Así mismo, B. thuringiensis ha demostrado ser eficiente principalmente en el control de insectos, en distintos cultivos y frutos poscosecha (Zheng et al., 2013; Deepak y Jayapradha 2015; Kim et al., 2017). Mojica-Marín et al. (2009) reportaron el biocontrol de la marchitez del chile mediante el uso de B. thuringiensis, solo que el trabajo se realizó directamente en la germinación de semillas inoculadas con P. capsici, donde se observó una germinación entre 62 y 93% de las semillas tratadas; sin embargo, la información es casi nula con respecto al uso de B. thuringiensis en el biocontrol de P. capsici en plántulas de tomate y chile.
CONCLUSIONES
La suspensión celular de las especies B. amyloliquefaciens y B. thuringiensis causaron una inhibición significativamente mayor que sus filtrados sobre las zoosporas de P. capsici. Así mismo, presentaron potencial de control biológico en cultivos de tomate y chile contra P. capsici. Lo que sugiere la producción de metabolitos secundarios con actividad biológica. Por lo que estos microorganismos pueden ser usados como agentes de biocontrol de P. capsici en plantas de tomate y chile. Por lo tanto, se requieren de más estudios en la identificación de metabolitos secundarios o compuestos bioactivos, producidos por estas bacterias y evaluar su capacidad antifúngica.











 text in
text in 


