La roya asiática de la soya (ASR) causada por el patógeno Phakopsora pachyrhizi, es una de las principales amenazas para la producción de dicha oleaginosa en los trópicos y subtrópicos. En México, las pérdidas de rendimiento por la ASR oscilan entre el 25 y el 80 % (Terán-Vargas et al., 2007), lo que hace necesario el uso del control químico (Yañez-López et al., 2015). El estado de Tamaulipas, en el noreste de México, produce la mayor parte de soya en el país, aunque también posee el período más largo con condiciones climáticas favorables, para la infección del cultivo por la ASR (Yañez-López et al., 2015). Dado que todas las variedades comerciales de soya que actualmente se utilizan en México son susceptibles a la ASR, el costo por la aplicación de fungicidas es elevado.
El uso de variedades de soya resistentes a la ASR se considera la estrategia más rentable para el manejo de la enfermedad (Hartman et al., 2005). Aunque se han reportado siete genes de resistencia a la ASR, identificados como Rpp (resistencia a P. pachyrhizi) 1 a Rpp6 y Rpp1-b, no se pueden utilizar sin saber cuál gen es efectivo contra poblaciones específicas de ASR en cierta región. Así, las características patogénicas de poblaciones de P. pachyrhizi en países sudamericanos se han examinado mediante un conjunto de diferenciales de soya (Akamatsu et al., 2013, 2017). A partir de los resultados, se ha implementado en Sudamérica un esquema de mejoramiento genético para el desarrollo de variedades resistentes, utilizando una línea de soya que porta múltiples genes Rpp (Yamanaka et al., 2013, 2015).
En México existen pocos reportes sobre germoplasma de soya con resistencia a la ASR (Peña-del-Río et al., 2014). Debido a que se tiene poco conocimiento sobre cuáles genes Rpp confieren resistencia a poblaciones específicas de P. pachyrhizi, la incorporación de éstos no ha sido considerada en los programas de mejoramiento genético de soya. Por lo tanto, el objetivo de este estudio fue determinar las características patogénicas de poblaciones de P. pachyrhizi de México.
Durante el ciclo primavera-verano 2015, se colectaron en el noreste de México cuatro poblaciones de P. pachyrhizi en parcelas de soya no tratadas con fungicidas (Figura 1). Tres muestras se colectaron en los municipios de Reynosa, Matamoros y Altamira en el estado de Tamaulipas. En San Luis Potosí se colectó una población en el municipio de Tamuín. Las poblaciones se codificaron como MRP (población mexicana de roya asiática) -4, MRP-13, MRP-16 y MRP-19, respectivamente. En cada sitio de muestreo se recogieron varias hojas infectadas con ASR y se colocaron en una bolsa de plástico. Posteriormente se transfirieron a cajas de Petri y las hojas se cubrieron con algodón esterilizado y humedecido con agua destilada. Las muestras de ASR se exportaron al Centro Internacional de Investigación en Ciencias Agrícolas de Japón (JIRCAS), bajo el permiso de importación 27Y935. Una vez en Japón, se aislaron las urediniosporas y se suspendieron en 2 ó 3 mL de solución Tween 20 al 0.04 %. La variedad BRS184, susceptible a ASR, se inoculó con las suspensiones de urediniosporas (10-25 x 104 esporas/mL) para su multiplicación (Yamanaka et al., 2016). Las urediniosporas multiplicadas se utilizaron para las inoculaciones experimentales.
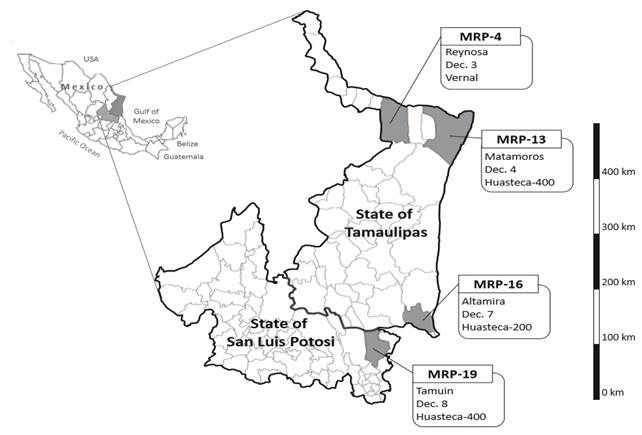
Figura 1. Localidades de México en donde se colectaron las poblaciones de Phakopsora pachyrhizi durante el 2015. En las etiquetas se indica el municipio, la fecha de muestreo y la variedad hospedera.
En este estudio se utilizaron 12 diferenciales de soya (Yamanaka et al., 2016) (Cuadro 1); diez portan un solo gen de resistencia a ASR: Rpp1, Rpp2, Rpp3, Rpp4, Rpp5, Rpp6 o Rpp1-b; No6-12-1 porta tres genes: Rpp2, Rpp4 y Rpp5; y BRS-154 fue el testigo susceptible.
Cuadro 1 Reacciones de 12 diferenciales de soya a cuatro poblaciones de Phakopsora pachyrhizi colectadas en el noreste de México durante el 2015. Las frecuencias de reacciones resistentes a poblaciones de P. pachyrhizi de México, Sudamérica y Japón en los 12 diferenciales de soya también se incluyen en este cuadro.
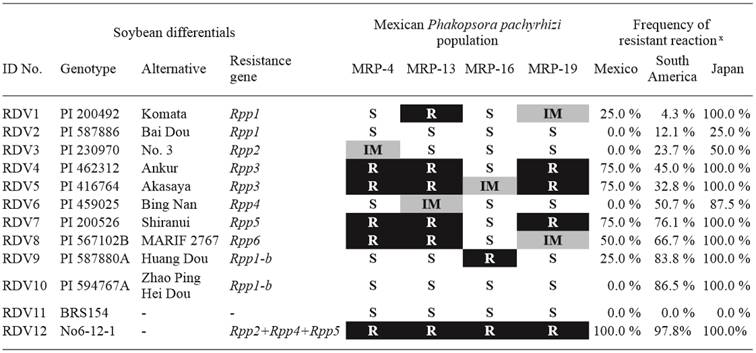
x Los datos de las poblaciones de Sudamérica fueron tomados de los reportes de Akamatsu et al. (2013; 2017), y los de las poblaciones de Japón de Yamanaka et al. (2015) y Yamaoka et al. (2014). S = Susceptible; IM = Intermedia; R = Resistente
Las plantas se cultivaron en una cámara de crecimiento a 24 °C bajo un fotoperiodo de 14 h, aproximadamente 19,000-23,000 lux proporcionados por lámparas fluorescentes. Los primeros folíolos trifoliados se separaron de las plantas, se inocularon con la suspensión de urediniosporas (5x104 esporas/mL), se colocaron en cajas de Petri y se incubaron en una cámara de crecimiento a 21 °C bajo un fotoperiodo de 12 h, aproximadamente 3,000 lux proporcionados por lámparas fluorescentes. Catorce días después de la inoculación, el nivel de esporulación de la roya (SL) se evaluó visualmente como nulo (0), bajo (1), moderado (2) o alto (3). Enseguida se retiraron las urediniosporas con un pincel y se determinó el número promedio de uredinias por lesión (NoU) en 30 lesiones. El tipo de reacción en cada diferencial se clasificó como resistente (R), intermedio (IM) o susceptible (S), de acuerdo con los valores de SL y NoU. Estos criterios, así como el procedimiento para determinar el SL se mencionan en Yamanaka et al. (2016).
Los resultados fueron comparados con los obtenidos de 145 poblaciones de ASR procedentes de países sudamericanos (Argentina, Brasil y Paraguay) y ocho de Japón (Akamatsu et al., 2013, 2017; Yamaoka et al., 2014), en donde se utilizaron los mismos diferenciales de soya. Las reacciones se convirtieron a valores numéricos: R=0, IM=1 y S=2. Se prepararon matrices de distancia, calculando las distancias Euclidianas entre muestras con el software R v. 3.0.1 (https://www.r-project.org), y se sometieron a una función de agrupación jerárquica, que construyó un dendrograma basado en el método de grupo de pares no ponderado, utilizando la media aritmética (UPGMA).
La población MRP-19 causó reacciones resistentes en los diferenciales PI 462312, PI 416764, PI 200526 y No6-12-1 (Cuadro 1); MRP-4 tuvo un efecto similar sobre los mismos diferenciales y además en PI 567102B. Los diferenciales que fueron resistentes a MRP-4 y PI 200492 fueron resistentes a MRP-13, mientras que MRP-16 causó reacciones de resistencia sólo en PI 587880A y No6-12-1. Aunque las poblaciones MRP-13, -4 y -19 produjeron reacciones similares sobre los diferenciales, éstas mostraron algunas diferencias en sus patrones patogénicos: MRP-4 y -13 generaron lesiones distintas en los diferenciales PI 200492 (Rpp1), PI 230970 (Rpp2) y PI 459025 (Rpp4).
MRP-4 produjo menos de 30 lesiones en PI 200492 (Rpp1), PI 416764 (Rpp3) y No6-12-1 (Rpp2 + Rpp4 + Rpp5); mostró solamente cinco lesiones en PI 200492, pero estas lesiones produjeron altos niveles de uredinia con abundantes urediniosporas (NoU = 4.2, SL = 3), dando como resultado el fenotipo S. Por el contrario, en PI 200492 la población MRP-13 produjo menores niveles de uredinia y de urediniosporas (NoU=0.8, SL=1), mostrando el fenotipo R. Fenotipos S e IM se observaron en PI 230970 y PI 459025 con la inoculación de MRP-13, respectivamente; mientras que fenotipos IM y S se registraron en los mismos diferenciales con la inoculación de MRP-4, respectivamente. MRP-19 provocó las mismas reacciones que MRP-4 y -13 en la mayoría de los diferenciales, pero la reacción fue intermedia en PI 567102B (Rpp6), el cual fue resistente a MRP-4 y -13. Esta población también mostró reacciones diferentes en PI 200492 en comparación con MRP-4 y -13 (Tabla 1). Por lo tanto, MRP-13, -4 y -19 tuvieron perfiles patogénicos muy similares en los 12 diferenciales de soya. MRP-16 fue la población más virulenta. Ésta produjo reacciones susceptibles en nueve diferenciales, mientras que en PI 416764 (Rpp3) fueron intermedias y en PI 587880A (Rpp1-b) y No6-12-1 (Rpp2 + Rpp4 + Rpp5) resistentes. MRP-16 produjo pocas uredinias y urediniosporas en PI 587880A (NoU = 1.0, SL = 0.8) y no esporuló en No6-12-1 (NoU = 0.0, SL = 0.0).
El dendrograma UPGMA reveló que MRP-4, -13 y -19 formaron un grupo distante de MRP-16; estos grupos no incluyeron poblaciones de P. pachyrhizi de Sudamérica y Japón (Figura 2). MRP-16, población altamente virulenta, se agrupó en el conjunto principal de muestras sudamericanas, mientras que el grupo formado por MRP-4, -13 y -19 se localizó distantemente, aunque algunas poblaciones de Japón y Paraguay formaron un grupo aparte.
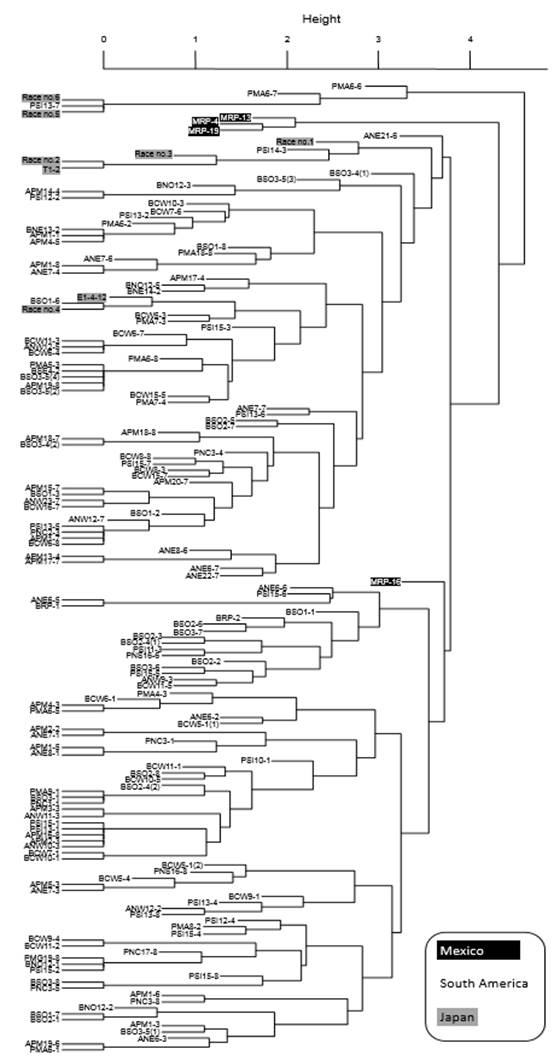
Figura 2. Dendrograma UPGMA que presenta las relaciones entre cuatro poblaciones mexicanas de Phakopsora pachyrhizi, 145 de Sudamérica y ocho de Japón, el cual se basa en la patogenicidad mostrada sobre 12 diferenciales de soya. Las poblaciones de México y Japón están coloreadas de negro y gris, respectivamente. Las poblaciones de Sudamérica están etiquetadas con ‘A’ para Argentina, ‘B’ para Brasil y ‘P’ para Paraguay. Los datos de las poblaciones de Sudamérica fueron tomados de los reportes de Akamatsu et al. (2013; 2017), y los de las poblaciones de Japón de Yamanaka et al. (2015) y Yamaoka et al. (2014).
Los perfiles patogénicos de las poblaciones MRP-4, -13 y -19 no fueron idénticos pero mostraron similitudes (Cuadro 1). Las semejanzas en la patogenicidad de MRP-4 y -13 podrían explicarse por la proximidad de los lugares de muestreo; ambas poblaciones se colectaron en el norte de Tamaulipas, aproximadamente a 80 km de distancia entre cada sitio. MRP-19, que causó reacciones similares a MRP-4 y -13 en la mayoría de los diferenciales, se colectó en el estado de San Luis Potosí (región Huasteca), aproximadamente a 450 km de los sitios de muestreo de MRP-4 y -13, pero a 75 km del sitio de colecta de MRP-16. Se esperaría que la patogenicidad de MRP-19 fuera parecida a la de MRP-16, sin embargo no fue el caso (Cuadro 1, Figura 2). Esto significa que, considerando la diferenciación geográfica, la patogenicidad de las poblaciones mexicanas de ASR se encuentra limitada a pequeñas regiones, a diferencia de las poblaciones de P. pachyrhizi colectadas en una área reducida de Japón, en donde se identificaron seis razas (Yamaoka et al., 2014). MRP-16 presentó la mayor virulencia de las cuatro poblaciones mexicanas de P. pachyrhizi. Se observaron uredinias y urediniosporas en todos los diferenciales, excepto en No6-12-1 (Rpp2 + Rpp4 + Rpp5), indicando que MRP-16 incluye al menos una raza que es virulenta a cualquier gen Rpp de los diferenciales. De acuerdo con estas observaciones, la ASR en México presenta alta diversidad patogénica y es fuertemente virulenta a los diferenciales de soya evaluados.
Las frecuencias de las reacciones resistentes en los diferenciales que portan el gen Rpp1-b con la inoculación de los patógenos de P. pachyrhizi de México, Sudamérica y Japón, muestran una clara diferencia entre las poblaciones mexicanas y las poblaciones procedentes de las otras dos regiones. Rpp1-b de los diferenciales PI 587880A y PI 594767A fue resistente a > 80 % de las poblaciones de ASR de Japón y Sudamérica. Por el contrario, fue menos eficiente contra las poblaciones mexicanas de P. pachyrhizi, ya que PI 587880A fue susceptible a tres de las cuatro poblaciones y PI 594767A fue susceptible a todas (Cuadro 1). Otra diferencia significativa entre las poblaciones mexicanas, sudamericanas y japonesas de P. pachyrhizi se detectó en PI 459025: hubo reacciones resistentes en aproximadamente el 50 y el 90 % de las poblaciones de Sudamérica y Japón, respectivamente; sin embargo, con las poblaciones mexicanas no se observó resistencia.
La ineficiencia de Rpp1-b detectada en México se observó previamente en Estados Unidos (Li, 2009; Walker et al., 2014). La similitud patogénica entre las poblaciones de ASR de México y Estados Unidos también se observa en Rpp3; ya que fue resistente a la mayoría de los patógenos de ASR (Walker et al., 2014, Paul et al., 2015). Por otro lado, Rpp5 (PI 200526) mostró diferencias geográficas entre México y Estados Unidos, confiriendo resistencia a tres de las cuatro poblaciones mexicanas de P. pachyrhizi, así como a todas las poblaciones japonesas y a la mayoría de las sudamericanas; sin embargo, Paul et al. (2015) informó sobre su susceptibilidad a 24 poblaciones estadounidenses de ASR. Por lo tanto, la virulencia del patógeno en México a Rpp5, al igual que la del patógeno en Sudamérica y Japón, es diferente a la del patógeno en Estados Unidos.
La mayoría de las poblaciones de P. pachyrhizi en Sudamérica son virulentas a Rpp1 (PI 200492 y PI 587886). Mientras que las poblaciones de Japón no provocaron síntomas en estos diferenciales (Yamanaka et al., 2010; Yamaoka et al., 2014). En Estados Unidos, Rpp1 (PI 200492) fue resistente en la mayoría de los casos (Li, 2009; Li et al., 2012; Twizeyimana y Hartman, 2012; Walker et al., 2014), pero en México, PI 200492 fue resistente a MRP-13, intermedia a MRP-19 y susceptible a MRP-4 y -16. Dado que MRP-4 produjo sólo pocas lesiones, es probable que la mayoría de las reacciones fueron de inmunidad, o que una raza dominante en MRP-4 fue asintomática en PI 200492. En este sentido, las poblaciones mexicanas de ASR evaluadas son moderadamente virulentas a Rpp1 (PI 200492), características que son diferentes a las de Sudamérica, Estados Unidos y Japón. En general, las poblaciones mexicanas de P. pachyrhizi presentan características patogénicas diferentes en comparación con las poblaciones de dichas regiones..
Los genes Rpp2 (PI 230970), Rpp1 (PI 587886), Rpp4 (PI 459025) y Rpp1-b (PI 594767A) no son útiles para conferir resistencia a la ASR en las variedades mexicanas de soya, ya que ninguno mostró resistencia a las cuatro MRPs. Además, Rpp1 (PI 200492) y Rpp1-b (PI 587880A) confirieron resistencia a una de las cuatro poblaciones solamente (Cuadro 1), por lo tanto, su uso en la generación de variedades mexicanas de soya resistentes a ASR sería muy limitado. Peña-del-Río et al. (2014) identificaron 23 genotipos de soya con baja susceptibilidad a poblaciones mexicanas de P. pachyrhizi en 2007; dos (PI 230970 y PI 417125) portando el gen Rpp2. Por lo que se sugiere que en México, Rpp2 ha mostrado ineficiencia contra ASR en el periodo de 2007 a 2015.
Considerando que Rpp3 (PI 462312 y PI 416764) y Rpp5 (PI 200526) son resistentes a tres de las poblaciones, y Rpp6 (PI 567102B) a dos (Tabla 1), podrían utilizarse como fuentes de resistencia en México. Sin embargo, el uso de estos genes por separado constituye un riesgo, ya que ninguno de los diferenciales que portan un solo gen Rpp, mostraron resistencia a las cuatro poblaciones mexicanas de ASR. Solamente No6-12-1 (Rpp2 + Rpp4 + Rpp5) fue resistente a las cuatro muestras del patógeno, no produciendo uredinias ni urediniosporas, lo que indica que la piramidación de genes (Yamanaka et al., 2015), puede conferir alto nivel de resistencia a un espectro amplio de razas de P. pachyrhizi en México.
Conclusiones
Una de las cuatro poblaciones mexicanas de P. pachyrhizi mostró alta virulencia en los diferenciales de soya resistentes y su patogenicidad fue completamente diferente a la de las otras tres. La patogenicidad de las poblaciones mexicanas de ASR para conferir resistencia estable a ASR en las variedades de soya en México.











 text in
text in 


