Introducción
El género Phytophthora es uno de los causantes de enfermedades del suelo con mayor impacto económico en todo el mundo (Lamour et al., 2012). Este patógeno es altamente dinámico y destructivo, ya que ataca las raíces, tallos, hojas y frutos de una gran variedad de hortalizas (Lamour et al., 2012). Además, posee ciclos sexual y asexual que dificultan el control de la enfermedad que causa (Ploetz et al., 2002).
Inicialmente, Rivera et al. (1992) y Olguín (2010) reportaron a Pythium sp., Fusarium oxysporum y F. sambucinum como agentes causales de la pudrición del chayote en Costa Rica y México, respectivamente. Más tarde, Olguín et al. (2013) identificaron a Phytophthora capsici como el agente causal de la pudrición de la zona de transición entre el tallo y la raíz de las plantas de chayote. Este oomiceto se encuentra presente en los suelos de las zonas productoras del estado de Veracruz, México, donde existe alta humedad.
Particularmente, la zona de Huatusco, Veracruz, México, es una de las principales zonas productoras de chayote (Sechium edule (Jacq.) Sw.) a nivel mundial. Recientemente, se han presentado en las huertas manchones de plantas con síntomas de marchitez en las hojas debido a la pudrición de la zona de transición entre el tallo y la raíz, que afecta la absorción de agua y que finalmente conduce a la muerte de la planta (Cadena-Iñiguez et al., 2006 y 2011; Cadena-Iñiguez y Arévalo-Galarza, 2008; Lira, 1992).
El rendimiento de la planta de chayote es de aproximadamente 130 ton de fruto ha-1 en plantaciones comerciales con densidades de 100 a 128 plantas ha-1. La producción por planta es aproximadamente de 47 a 120 kg en un periodo de seis meses, por lo que la muerte de varias plantas por hectárea representa pérdidas económicas significativas (Cadena-Iñiguez et al., 2008). A nivel nacional, entre 2010 y 2014 se obtuvo en promedio una producción de chayote de 162,600 toneladas (SIAP, 2016).
No obstante, se conoce muy poco sobre severidad inducida por P. capsici, dada su reciente confirmación etiológica. En este sentido, la medición y caracterización cuantitativa y cualitativa de la intensidad de una enfermedad (incidencia o severidad), es un requisito indispensable en estudios epidemiológicos básicos. Con esta información, se podrán generar en el futuro modelos de estimación de pérdidas, así como la importancia económica del daño (Campbell y Madden, 1990; Kranz, 1988). Por lo anterior, los objetivos del presente trabajo fueron determinar el grado de severidad de P. capsici en plantas de S. edule a nivel de cámara de crecimiento con ambiente controlado y elaborar una escala visual de severidad para su uso y evaluación en los sistemas de producción. Con lo anterior se pretende contribuir al establecimiento de las bases para un sistema de control de la enfermedad.
Materiales y métodos
Muestreo
La zona de muestreo correspondió a dos huertos comerciales del municipio de Huatusco, Veracruz, México, situados en las coordenadas: 19° 7´23.1” N, 97° 0´ 5.2” O y 19° 7´ 21.6” N, 97° 0´ 4.9” O, a una altitud de 1,333 msnm. Los tipos de suelos presentes en la zona de muestreo son Luvisoles y Cambisoles. El clima es semicálido-húmedo con una temperatura promedio de 18.8oC, precipitación pluvial media anual de 1,763 mm, y vegetación característica del subtropico perennifolio. Durante el mes de diciembre de 2014 se colectaron muestras de plantas chayote var. Ventlali que presentaba síntomas de pudrición característica (perdida de turgencia, reblandecimiento del tejido vegetal, presencia de micelio y olor penetrante) en frutos y de la zona de transición entre el tallo y la raíz. Las muestras fueron transportadas al laboratorio en bolsas de plástico debidamente rotuladas y colocadas en una hielera.
Aislamiento e identificación de microorganismos asociados con la enfermedad
Se colectaron 10 muestras, tanto de frutos como de la zona de transición entre el tallo y la raíz, de cada uno de los dos sitios de estudio. En este caso, se uniformizó el número de muestras tomadas de cada sitio, a diferencia de lo reportado por Olguín et al. (2013). El tejido enfermo de plantas y frutos de chayote fue lavado con agua destilada y cortado en 6 secciones de aproximadamente 5 mm de longitud. Como resultado se obtuvieron 60 secciones (30 de fruto y 30 de la zona de transición tallo-raíz). Así también, se analizaron 5 muestras asintomáticas de frutos y de la zona de transición tallo-raíz. Las secciones se desinfestaron con una solución de hipoclorito de sodio comercial al 1% por 1 min, se enjuagaron varias veces con agua destilada estéril y se secaron con papel absorbente estéril. Posteriormente, se realizó la siembra de las secciones en placas de agua-agar (acidificado con ácido láctico al 25%) y se incubaron a 28 °C. Una vez que se observó el crecimiento miceliar, con ayuda de un sacabocados, se tomaron discos de 0.5 cm de diámetro de las colonias desarrolladas y se resembraron en placas de medio jugo V8-agar (V8) y papa dextrosa agar (PDA) y se incubaron a 28°C por 48 h (French y Hebert, 1980; French-Monar et al., 2006). El oomiceto desarrollado fue purificado en placas de medio V8-agar empleando monoesporangios. Las características cualitativas y cuantitativas de las estructuras asexuales (esporangióforos y esporangios) del oomiceto fueron analizadas a partir de preparaciones semi-permanentes con la ayuda de un microscopio compuesto (OLYMPUS. Mod: CX31RBSFA). Los esporangios fueron medidos a los 10 días de incubación en medio V8. Con el resultado de 100 mediciones se identificó al oomiceto empleando las descripciones de Newhook et al. (1978), Stamps (1985), O’Donnell (1992) y Gallegly y Hong (2008). El resto de los aislamientos fúngicos presentes en las muestras se purificaron por transferencia de colonias y se identificaron empleando las claves de Barnett y Hunter (1998).
Prueba de patogenicidad del oomiceto aislado de chayote
El oomiceto que presentó la mayor frecuencia (76 %), fue utilizado para realizar la prueba de patogenicidad. Los frutos de chayote se lavaron con agua y jabón, y posteriormente se desinfestaron con alcohol al 70%. Con una navaja se hicieron dos incisiones de 1 cm de profundidad, en las que se colocó un disco de medio de cultivo de 0.5 cm de diámetro que contenía al oomiceto. Se inocularon 18 frutos de chayote. Los frutos testigo se les adicionó únicamente medio de cultivo sin crecimiento del oomiceto. Posteriormente, los frutos inoculados fueron colocados sobre una toalla de papel absorbente húmeda, que se encontraba sobre una base de unicel. Los frutos se mantuvieron dentro de bolsas deplásticocerradas.Alatoallaseleagregóagua destilada estéril para mantener condiciones de saturación de humedad en el sistema. Para estimular el desarrollo del oomiceto, la temperatura de incubación se mantuvo entre 24 y 27°C, con un fotoperiodo de 12-12 h. Una vez que los frutos fueron invadidos por el micelio del oomiceto, éste fue reaislado en placas de medio V8. La morfología de las colonias obtenidas se comparó con la del aislamiento original de las huertas comerciales. El ensayo de patogenicidad se realizó dos veces.
Amplificación del ADN y secuenciación del oomiceto
Después de cuatro días de crecimiento del oomiceto en placas de medio V8, se tomó una porción de aproximadamente 5 mm de micelio y se colocó en un tubo de reacción de 200 μL conteniendo 30 μL de la solución de lisis, Lyse N Go (Pierce, USA). Posteriormente se colocó el tubo a 95 °C durante 5 min y se centrifugó por 10 min a 5,000 x g. Finalmente se tomaron 5 μL del sobrenadante para realizar las amplificaciones de los ITS mediante PCR.
Para la amplificación de la región ITS se utilizaron los iniciadores universales ITS5 (5’-GGAAGTAAAAGTCGTAACAAGG-3’) e ITS4 (5’-TCCTCCGCTTATTGATATGC) (White et al., 1990), que amplifican un fragmento de 580 pares de bases aproximadamente (pb). Otro par de iniciadores utilizados fueron ITS5 y NL4 (5’-GGTCCGTGTTTCAAGACGG- 3’) (O’Donnell, 1992), para amplificar un fragmento de 1,100 pb, que incluyó la región del ITS y ~600 pb del gen 28S rRNA. La mezcla de reacción para PCR se preparó en un volumen final de 25 μL conteniendo la enzima 1X Taq DNA polimerasa, 0.8 mM deoxinucleosido trifosfatos (0.2 mM cada uno), 100 ng DNA, 20 pmol de cada iniciador y 2 unidades de GoTaq DNA (Promega, USA). Las amplificaciones se realizaron con un ciclo inicial de desnaturalización a 95°C por 2 min; 35 ciclos de desnaturalización a 95°C por 1 min, el alineamiento a 57°C por 1 min, y una extensión final a 72°C por 2 min; finalmente un ciclo de amplificación a 72°C por 10 min (Silva-Rojas et al., 2009).
Todas las reacciones de PCR se llevaron a cabo en un termociclador (Modelo: TECHNER TC512, marca: Bibby Scientific). Las amplificaciones se verificaron por electroforesis en un gel de agarosa al 1.2 % preparado con el amortiguador 1X TAE (Tris-Acetato-EDTA) y corrimiento a 87 V cm-3 durante 1 h. El gel se tiñó con bromuro de etidio (3 mg L-1), y las bandas se visualizaron en un transiluminador UV (Modelo: GL-3120, Marca: Scientific). Los productos amplificados se limpiaron con el kit de purificación (Modelo: QIAquick PCR, Marca: Qiagen), siguiendo las instrucciones del fabricante. Estos productos se secuenciaron en ambas direcciones con un sistema automatizado de secuenciación de DNA (Modelo 3730XL, Marca: Applied BioSystems), para asegurar que no hubiera lecturas de nucleótidos incorrectas.
Comparación de las secuencias ITS y LSU
Las secuencias de ambas regiones se ensamblaron y editaron usando BioEdit versión 7.0.5 (Hall, 1999), con el cual se creó una secuencia consenso. Esta secuencia, se comparó con las secuencias depositadas en el GenBank del National Center for Biotechnology Information (NCBI), mediante la opción BLASTN 2.2.19 (Brown et al., 2014; Zhang et al., 2000).
Evaluación de la severidad de la enfermedad Siembra del material vegetal
Para la pre-germinación de los frutos de chayote, se utilizó una bolsa negra de plástico de 40 x 60 cm donde se colocaron 20 frutos por 20 días. Los frutos previamente habían sido lavados con jabón y enjuagados con una solución de cloro al 0.6 %. Una vez que brotaron la raíz y el tallo, cada fruto germinado fue colocado en una bolsa de plástico negra (25 x 25 cm) que contenía 2,500 cm3 de sustrato compuesto por arena-agrolita-vemicomposta (40:40:20), tratado dos veces con vapor a 120 libras de presión por tres horas. Los frutos se mantuvieron en una cámara de crecimiento (Modelo CEL 37-14, Marca: SHERER,) a una temperatura de 26±1 °C, con un fotoperiodo de 14 horas luz y 10 de obscuridad y una intensidad luminosa de 6,768 lux de luz fluorescente. Las plantas inicialmente fueron regadas a capacidad de campo, y posteriormente se realizaron riegos cada tres días con 300 mL de agua por planta hasta el fin del experimento.
Preparación del inóculo
El oomiceto se cultivó en placas de medio V8 por 7 días a 28 °C. A cada caja de Petri se le agregó solución isotónica de cloruro de sodio al 0.9 % (AbbottMR) por 10 min. La solución isotónica se decantó y con la ayuda de una aguja de disección, la placa se dividió en cuatro partes. Cada parte del medio conteniendo el oomiceto se colocó en una caja de Petri estéril. Después se agregó agua destilada estéril hasta cubrir el medio, y las cajas se colocaron bajo una lámpara de luz blanca fría a 26 °C por 48 h. Posteriormente, se indujo la liberación de zoosporas exponiendo las cajas Petri a dos temperaturas (4 °C y temperatura ambiente) por 30 min. Finalmente, se cuantificó el número de zoosporas con un citómetro (Marienfeld®). La inoculación se efectuó cuando las plantas tenían en promedio 16 hojas (15 días después de la siembra) aplicando una suspensión de 1, 3 y 6 x 105 zoosporas por planta en la zona de transición entre el tallo y la raíz. Cada tratamiento (nivel de inóculo) consistió de cuatro plantas al igual que el testigo. Para la determinación del nivel de inoculo, se consideró el nivel mínimo de inóculo de P. capsici usado por Trujillo-Viramontes et al. (2005) en plantas de chile JEP.
El avance del daño inducido por P. capsici se midió en cm a partir de la zona de transición entre el tallo y la raíz. Además de la longitud de la necrosis, se determinó el número de hojas y guías marchitas así como presencia de micelio en la semilla a los 3, 5 y 7 días después de la inoculación (ddi). Con base en los síntomas y mediciones observadas, como se ha hecho con otros cultivos (Navarrete y Acosta, 1999), se diseñó una escala de severidad para evaluar la magnitud del daño de P. capsici en plantas de chayote en cámara de crecimiento bajo condiciones controladas. El ensayo de evaluación de la patogenicidad se montó en tres ocasiones con similares resultados.
Análisis estadístico
Los datos de cada variable se sometieron al análisis de varianza y a la comparación de medias empleando la prueba de Tukey (p≤ 0.05) (SAS Institute, 2002-2003).
Resultados y discusión
Detección de Phythopthora en plantas de chayote enfermas
De las 60 secciones (30 de fruto y 30 de tallo) sembradas en agar V8, en 46 (76 %) creció Phythopthora sp, en 9 (15 %) Fusarium y en 3 (4 %) Alternaria. El resto de las secciones correspondieron a hongos saprófitos y bacterias. Babadoost y Pavon (2013) indican que la alta frecuencia de P. capsici, así como su virulencia, determinan su papel como agente causal de enfermedad. No obstante, se requiere de las pruebas de patogenicidas para cada planta hospedera. Rivera et al. (1992) y Olguín (2010) reportaron inicialmente a Pythium sp., Fusarium oxysporum y F. sambucinum como agentes causales de la pudrición del chayote en Costa Rica y México, respectivamente. Sin embargo, la baja frecuencia de Fusarium encontrada en la presente investigación, podría ser indicativa de que la marchitez de las plantas de chayote no es inducida por este hongo.
Caracterización morfológica del oomiceto causante de la pudrición
Las colonias que se desarrollaron en placas de medio V8, presentaron hifas aéreas abundantes, de longitud considerable, algodonosas, poco radiadas y compactas. El micelio fue cenocítico, hialino, ramificado, de diámetro irregular. Los esporangios que se produjeron en placas de medio V8 y agua estéril (Figura 1a) presentaban tamaños y formas diferentes: ovoides, alimonadas (en promedio de 55 x 32 μm), con una papila prominente, caducos, principalmente con una sola papila (en pocas ocasiones se encontraron bipapilados) (Figura 1b), largos pedicelos persistentes, a veces simétricos y otros más asimétricos y con presencia de clamidosporas (Figura 1c). Los datos morfométricos de los esporangios indican la presencia de Phytophthora capsici en la zona de transición entre el tallo y las raíces y los frutos del chayote, lo que concuerda con lo reportado por Olguín et al. (2013), quienes indicaron que este oomiceto es el agente causal de la pudrición de plantas de chayote.
Prueba de patogenicidad de Phytophthora sp. en plántulas en cámara de crecimiento con ambiente controlado
El oomiceto que se inoculó en los frutos de chayote indujo la misma pudrición característica de los frutos donde se aisló: perdida de turgencia, pudrición y presencia de micelio blanco a los 5 días después de la inoculación (Figura 2a). Bajo condiciones de humedad, entre 80 y 100 %, el desarrollo del patógeno fue conspicuo (Figura 2b). En trozos de fruto con micelio que se colocaron en agua destilada estéril y bajo luz blanca continua (Figura 2c), se observaron abundantes esporangios esparcidos irregularmente (Figura 2d).

Figura 2. a) Frutos de chayote con presencia de micelio blanco, perdida de turgencia y síntomas de pudrición; b) Frutos bajo condiciones de humedad, entre 80 y 100 %, con desarrollo conspicuo del patógeno; c) trozos de fruto con micelio colocados en agua destilada estéril bajo luz blanca continua; y d) esporangios esparcidos irregularmente.
Análisis de secuencias de ADN
Las cuatro secuencias obtenidas en este estudio se depositaron en el GenBank-NCBI bajo los números de acceso KM087089, KM087090.1, KM087091 y KM087092. La secuenciación del ADN confirmó que la cepa aislada de las muestras de tejido necrótico de chayote, colectadas en la zona de estudio, correspondió a Phytophthora capsici, con una identidad de 99 y 100 %, con respecto a las secuencias de diferentes aislamientos del GenBank. Cabe señalar que la cepa con número de acceso KM087090.1, que presentó 100 % de identidad (Cuadro 1), fue utilizada en el ensayo de severidad.
Severidad de P. capsici en plantas de chayote
No se observaron diferencias significativas (α=0.05) entre los tres niveles de inóculo de P. capsici para las variables número de hojas marchitas, necrosis en la zona de transición entre el tallo y las raíces y marchitamiento de plantas de chayote (Figura 3a, b y c). Cuando las plantas fueron inoculadas con P. capcisi, se observaron diferencias con respecto a las plantas testigo (no inoculadas), igual como lo reportan Uribe-Lorio et al. (2014) en un trabajo realizado con plantas de chile. Las plantas testigos permanecieron sanas durante todo el experimento. Al igual que en el presente estudio, otros autores (Trujillo-Viramontes et al., 2005) reportan que la inoculación de 3 x 105 zoosporas del oomiceto es suficiente para inducir la respuesta de la planta de chile. Aunque no se encontraron diferencias significativas entre los tres niveles de inoculo de P. capsisci, empleados, si se observaron diferencias numéricas. Probablemente, 3 x 105 zoosporas por planta sea el limite umbral superior, arriba del cual el daño en plantas de chayote no será estadísticamente significativo.
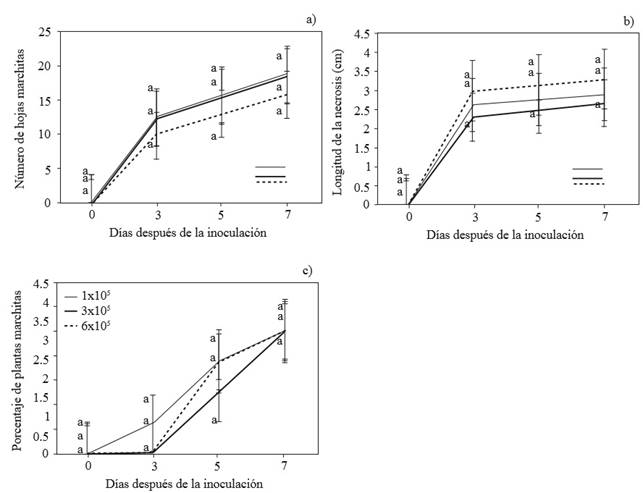
Figura 3. Número de hojas marchitas (a), longitud de la necrosis en la zona de transición entre el tallo y las raíces (b) y porcentaje de plantas de chayote marchitas (c) inoculadas con 1, 2 y 6 x 105 zoosporas de P. capsici. Cada punto corresponde al promedio de 4 repeticiones, Tukey (p≤0.05).
Con los datos obtenidos se construyó la curva de progreso de la enfermedad. Independientemente del nivel de zoosporas inoculado, a los tres ddi, se observó el 50 % de hojas marchitas y de 2.3 a 3.0 cm de necrosis en la zona de transición entre el tallo y las raíces (Figura 4). A los cinco ddi, el marchitamiento de las hojas fue de 80 % con un avance de la necrosis de 2.5 a 3.15 cm y presencia de micelio sobre la semilla (el fruto). A los siete ddi se presentó 100 % de marchitamiento de las hojas, necrosis de 2.67 a 3.3 cm y presencia de micelio en guías, semilla y la raíz. Así, los tres niveles de inóculo de P. capsici fueron igualmente efectivos para inducir el marchitamiento de las plantas de chayote. Comparativamente, el tiempo de aparición de los síntomas de la enfermedad fue menor al reportado por Olguín et al. (2013). El nivel del inóculo fue crucial, mientras que Olguín et al. (2013) usaron 11,500 esporangios mL-1, en la presente investigación se emplearon de 1, 3 y 6 x 105 zoosporas mL-1.

Figura 4. Avance de la necrosis en la zona de transición entre el tallo y las raíces de plántulas de chayote a los tres días de la inoculación con 300,000 zoosporas de P. capsici.
La necrosis de la zona de transición entre el tallo y las raíces fue observada desde los 3 días después de la inoculación, independientemente del nivel de inóculo. La necrosis temprana pudo acelerar el marchitamiento de las plantas.
A los cinco ddi, se observó más del 50 % de marchitez de las plantas, también independiente del nivel de inóculo, lo que demuestra la patogenicidad del aislamiento estudiado, de acuerdo a lo reportado por Olguín et al. (2013). A los siete ddi, el desarrollo de la necrosis fue en promedio de 3.0 cm, lo que coadyuvó al 100 % de plantas marchitas. Probablemente, la degradación de la pared celular y lamela media del tejido parenquimatoso del sistema vascular, causado típicamente por P. capsici, se presentó en la zona de transición entre el tallo y las raíces, lo cual no permitió el paso de agua y nutrimentos para el óptimo desarrollo de la planta (Li, et al., 2011; Wang et al., 2011).
El sustrato utilizado fue crucial en el experimento, ya que este proveyó condiciones de alta humedad que favorecieron el desarrollo y diseminación de P. capsici. La alta humedad favoreció la movilidad de zoosporas asegurando la infección por parte del oomiceto. Silva-Rojas et al. (2009) indican que efectivamente, dicho factor ambiental es crucial para la diseminación de P. capsici.
La curva de progreso de la enfermedad (Figura 4) sirvió como base para elaborar una Escala de Severidad (Cuadro 2), con la que es factible evaluar los daños producidos por P. capsici en chayote bajo condiciones controladas. La escala fue validada en tres ocasiones. Las variables utilizadas para elaborar la escala fueron: porcentaje de hojas marchitas, longitud de necrosis en la zona de transición entre al tallo y las raíces, porcentaje de planta marchita y presencia de micelio. Con lo anterior se pretende contribuir al establecimiento de las bases para un sistema de control de la enfermedad inducida por P. capsici en plantas de chayote.
Conclusiones
La cepa PCSE2 con número de acceso KM087090.1 identificada como P. capsici, aislada de plantas enfermas de chayote en Huatusco, Veracruz, México, indujo síntomas desde una nivel de inóculo de 1 x 105 zoosporas, resultando en la marchitez y muerte de plantas a los 5 y 7 ddi. La inoculación de 3 x 105 zoosporas promovió la presencia de plantas con síntomas de marchitez desde los 3 ddi, probablemente porque la necrosis en la zona de transición entre el tallo y las raíces no permitió el paso de agua y nutrimentos para el óptimo desarrollo de la planta.
Aunque no se observaron diferencias significativas (α=0.05) entre los tres niveles de inóculo de P. capsici para las variables número de hojas marchitas, necrosis en la zona de transición entre el tallo y las raíces y marchitamiento de plantas de chayote, con los datos del progreso de la enfermedad se diseñó una escala de severidad, como una herramienta inicial para evaluar el daño producido por P. capsici en plantas de chayote crecidas bajo condiciones controladas.











 text in
text in 





