Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista mexicana de fitopatología
On-line version ISSN 2007-8080Print version ISSN 0185-3309
Rev. mex. fitopatol vol.31 n.2 Texcoco 2013
Notas fitopatológicas
Reducción en la Germinación in vitro de Conidios de Alternaría alternata aislada de Eruca sativa con Jugo de Brócoli
Reduction in the in vitro Germination of Conidia of Alternaría alternata Isolated from Eruca sativa with Juice of Broccoli
Maria Antonia Flores Córdova1, María Teresa Martínez Damián2, Daniel Nieto Ángel3, Juan Enrique Rodríguez Pérez4, María Teresa Colinas León4 y Juan Martínez Solís4
1 Posgrado en Horticultura, Universidad Autónoma Chapingo Km 38.5 Carretera México-Texcoco. Chapingo. CP 56230, México.
2 Departamento de Fitotecnia. Universidad Autónoma Chapingo. Km 38.5 Carretera México-Texcoco. Chapingo. CP 56230, México.
3 Instituto de Fitosanidad, Colegio de Postgraduados, Campus Montecillo. Km 36.5 Carretera México-Texcoco. Montecillo, Edo. de México. CP 56230, México.
4 Departamento de Fitotecnia. Universidad Autónoma Chapingo. Km 38.5 Carretera México-Texcoco. Chapingo. CP 56230, México. Correspondencia: teremd13@gmail.com
Recibido: Octubre 18, 2013
Aceptado: Abril 11, 2014
Resumen
El hongo Alternaría alternata, es considerado uno de los principales patógenos de plantas, a nivel mundial ocasiona el síntoma de la mancha de la hoja en hortalizas. Aunque se han evaluado diferentes compuestos químicos para su control, el uso de productos biológicos representa una gran alternativa. Los glucosinolatos son productos naturales, derivados del brócoli, que contienen nitrógeno y azufre con actividad antifúngica. Con base en lo anterior, el presente trabajo tuvo como objetivo evaluar la eficacia del jugo de brócoli in vitro sobre la germinación de conidios de A. alternata. Para la realización del experimento, se colectaron hojas de Eruca sativa (arúgula) con síntomas de la mancha de la hoja de las cuales se aisló e identificó al hongo A. alternata. Los conidios del hongo se colocaron en medio PDA, con diferentes concentraciones de glucosinolatos presentes en el jugo de brócoli 0.15, 0.11, 0.07, 0.04, 0.01 y 0 µg/µL. Las concentraciones 0.07, 0.11, 0.15 µg/µL inhibieron en un 100 % la germinación de conidios de A. alternata a las 6 h de evaluación. La concentración letal media CL50 fue de 0.028 µg/µL. Se concluye que los glucosinolatos presentes en el jugo de brócoli, poseen un potencial antifúngico y puede ser usado como tratamiento en postcosecha, con el fin de disminuir los daños causados por A. alternata en hortalizas.
Palabras clave: Arúgula, glucosinolatos, antifúngico, identificación molecular, inhibición.
Abstract
The fungus Alternaría alternata, is considered one of the major plant pathogens worldwide causing the symptom of leaf spot in vegetables. Glucosinolates are natural products derived from broccoli, containing nitrogen and sulfur, with antifungal activity. Based on the above, the present study aimed to evaluate the effectiveness of broccoli juice in vitro on germination of conidia of A. alternata. To carry out the experiment, leaves of Eruca satíva (arugula) with symptoms of leaf spot were collected, from which the fungus A. alternata was isolated and identified. Conidia of the fungus were placed on PDA medium with different concentrations of glucosinolates found in broccoli juice 0.15, 0.11, 0.07, 0.04, 0.01, and 0 µg/µL. It was observed that the concentrations 0.07, 0.1, 0.15 µg/µL inhibited 100 % spore germination of A. alternata at 6 h evaluation. The average lethal concentration LC50 was 0.028 µg/µL. In conclusion, it can be mentioned that the glucosinolates present in broccoli juice, have an antifungal potential and can be used as post-harvest treatment, in order to reduce the damage caused by A. alternata in vegetables.
Keywords: Arugula, glucosinolates, antifungal, molecular identification, inhibition.
Las pérdidas económicas durante el manejo postcosecha de productos hortícolas causadas por diversos microorganismos pueden ser de considerable importancia económica (Fraire-Cordero et al., 2010; Bautista-Baños et al., 2000). Una de las causas principales de enfermedades en frutas y hortalizas son originadas por la acción de hongos fitopatógenos, entre las que destaca la causada por Alternaria alternata.
A. alternata es una especie cosmopolita que se encuentra como saprofito o fitopatógeno en un amplio rango de hospedantes y en subproductos (Andersen et al., 2001; Carrillo, 2003). Este hongo presenta un micelio de color oscuro, conidios grandes, alargados y oscuros, o bien multicelulares en forma de pera con septos tanto transversales como longitudinales. Los conidios germinan y se introducen por los tejidos susceptibles a través de heridas y en poco tiempo producen nuevos conidios que pueden ser diseminados por el viento (Carrillo, 2003; Agrios, 2005). Esta especie infecta de manera foliar y causa manchas en la hoja de plantas de la familia de las Brassicaceae (Nidhi et al., 2007), así como en frutos. En casi todos los casos, se comporta como un parásito de heridas. La penetración estomatal puede ocurrir cuando las plantas están fisiológicamente debilitadas, causando una destrucción relativamente lenta de los tejidos del hospedante. A medida que avanza la invasión de las hifas, destruyen las células de donde obtienen los nutrientes reduciendo el potencial fotosintético. La infección se caracteriza por la formación de lesiones necróticas de forma redonda sobre el haz de las hojas, su color se intensifica debido a la producción de estructuras propagativas del hongo (Thomma, 2003). La producción de conidios de Alternaría es óptima a 27 oC, pero es inhibida por debajo de 15 oC, aunque el rango de crecimiento está entre 0 y 35 oC (Rotem, 1994; Carrillo, 2003).
Este patógeno se ha observado en arúgula, planta perteneciente a la familia de las Brassicaceae que tiene su origen en la región Mediterránea y es conocida por su agradable sabor amargo y alto contenido de fitonutrientes como los carotenoides, vitamina C, fibra dietética polifenoles y flavonoides que promueven la salud (Barillari et al., 2005). Así mismo, tiene una larga historia de uso medicinal para diversos fines: astringente, depurativa, diurética, digestiva, emoliente, tonificante, estimulante y laxante (Durazzo et al., 2003). Esta planta se encuentra disponible todo el año en el mercado; ya que tienen la capacidad de rebrotar, lo que permite más de una cosecha al año (Koukounaras et al., 2010). Por lo que el consumo de hortalizas recién cortadas es cada vez más importante en la dieta de los consumidores debido a los hábitos de alimentación saludable que está adquiriendo la población (Oms-Oliu et al., 2006), teniendo como resultado que los consumidores demanden alimentos naturales, de apariencia y valor nutricional y microbiológicamente seguros (García et al., 2006). En relación a la carga microbiológica, arúgula es susceptible a Alternaría un hongo patógeno de postcosecha causante de la pérdida de calidad del producto por los importantes daños en el tejido, los cuales se presentan durante los procesos de comercialización desde la cosecha hasta el consumidor final, reduciendo su vida útil (Kader, 2007; Ferrato et al., 2012).
Es importante destacar que el manejo de las enfermedades fúngicas se basa, en la utilización de productos químicos sintéticos. En las últimas décadas, los esfuerzos se han dirigido a obtener una mejor comprensión de los efectos biológicos de compuestos aislados de plantas que tienen un efecto potencial en el control de enfermedades, debido a la reciente tendencia a utilizar alternativas menos perjudiciales al ambiente para el control de hongos y a reducir la dependencia de productos sintéticos. Se espera que el uso de compuestos naturales tenga un menor impacto sobre los ecosistemas, ya que a diferencia de los productos químicos, éstos son biodegradables y no se acumulan en el medio ambiente (Báez-Flores et al., 2008).
Entre las estrategias más comunes está el uso de compuestos naturales obtenidos de plantas como los aceites esenciales, compuestos aromáticos (Tripathi y Dubey, 2004) y las moléculas producidas por varios sistemas de defensa de las plantas, éste último grupo de componentes, incluye algunas moléculas como los glucosinolatos (GLs), que en pruebas biológicas específicas han mostrado una fuerte actividad contra un amplio intervalo de patógenos (Mari et al., 2008). Los glucosinolatos pertenecen al grupo de los tioglucósidos, formados por una β-tioglucosa, una oxima sulfonada, y una cadena lateral variable derivada de un aminoácido, se encuentran almacenados en vacuolas y son liberados al sufrir daño celular, luego de que entran en contacto con la enzima mirosinasa y son hidrolizados en diferentes productos (Molina-Vargas y Bentura-Castellanos, 2009). Con frecuencia son tres grupos de acuerdo a la naturaleza de su cadena lateral: alifáticos, aromáticos e indólicos. Se han aislado y caracterizado aproximadamente 120 GLs de especies de plantas de la familia Brassicaceae y familias relacionadas, como son: el brócoli, la col y coliflor entre otras, quienes contienen altos niveles de GLs. Estos vegetales y algunas plantas comestibles del orden Caparrales son la fuente de todos los GLs de la dieta humana (Campas-Baypoli et al., 2009).
El amplio intervalo de perfiles de GLs restringidos a las familias Brassicaceae, Capparidaceae y Resedaceae; almacenados en diferentes tejidos de la planta e involucrados contra las diferentes enfermedades vegetales, ofrece la posibilidad de seleccionar especies de plantas Brassicaceae como el brócoli, con mayor potencial fúngico. Autores como Brandi et al. (2006) y Sisti et al. (2006) probaron el jugo de Brassica oleracea, comprobaron la actividad antimicrobial y antifúngica del extracto, además se encontró ser efectivo en la inhibición y crecimiento de Blastoconidia y Candida albicans.
Por lo anteriormente expuesto el objetivo del presente estudio fue evaluar la eficacia del extracto de jugo de brócoli in vitro sobre A. alternata y proponer el uso posterior del mismo por su actividad antifúngica durante postcosecha en arúgula.
MATERIALES Y MÉTODOS
Aislamiento. Los aislados de hongos se obtuvieron a a partir de hojas de arúgula con síntomas de la mancha de la hoja procedentes del estado de Morelos, México. De los síntomas se realizaron cortes de tejido de la parte terminal de la lesión y se desinfestaron por inmersión en una solución de hipoclorito de sodio al 2 % durante 2 min. Posteriormente los tejidos se enjuagaron dos veces con agua destilada y se colocaron sobre toallas de papel absorbente para retirar el exceso de humedad. Cada porción de tejido se sembró en cajas de Petri con medio papa dextrosa agar (PDA).
Una vez que se observó el desarrollo de micelio se realizaron cultivos monoconidiales colocando 1000 µL de agua destilada con una micropipeta sobre cada uno de los aislamientos. El agua se mezcló con el micelio y los conidios se desprendieron con la ayuda de una varilla de vidrio estéril, posteriormente se recuperaron 100 µL de la suspensión de conidios, se colocaron en un tubo eppendorf de 1.5 mL de capacidad y se aforó con agua destilada. El contenido del tubo se vació a una caja de Petri con agua-agar (AA) se distribuyó en toda la caja y se dejó reposar por 5 s, posteriormente se desechó todo el exceso de agua contenido en la caja sobre sanitas estériles. Cada aislamiento se incubó a 27 oC durante 24 h.
Con la ayuda de un microscopio American Optical Microscope model 1130 (Microstar, USA), de cada aislamiento se seleccionó un conidio individual germinado y se transfirió para su incremento a medio PDA para mantenerse en incubación a 27 oC durante 6 d. La especie se identificó por medio de las claves morfológicas de Ellis (1971), Barnett y Hunter (1998) y Rotem (1994).
Identificación de Alternaria. Para identificar el hongo aislado, se sembraron cultivos monoconidiales en medio papa-zanahoria-agar (PZA), los cuales se mantuvieron por 8 d a temperatura de 27±2 oC con luz blanca fluorescente. La identificación se hizo con base a las características del micelio, color de colonia, forma de conidióforos; y forma, tamaño y color de los conidios. Para observar estas estructuras se hicieron preparaciones permanentes de los hongos en glicerol al 50 % acidificado con 0.5 mL de HCL al 12N y se observaron en el microscopio de luz Jenaval (Carl Zeiss, Germany). Para la identificación de los aislamientos a nivel de especie, se tomaron fotografías con una cámara digital instalada en el objetivo 40 X del microscopio compuesto y con el programa Motic M.C. Cámara (Motic, China); se midió el ancho y la longitud de 100 conidios y conidióforos, considerados al azar.
El color de la colonia se determinó examinando la masa conidial y micelial, las observaciones de los cultivos monoconidiales se realizaron a partir de aislamientos mantenidos a 27 oC durante 8 d.
Pruebas de patogenicidad. Para comprobar la patogenicidad del hongo, se inocularon hojas de arúgula, las mismas que se desinfestaron por inmersión en una solución de hipoclorito de sodio al 2 % durante 3 min y se enjuagaron con agua destilada dos veces. Del hongo aislado en PDA, se preparó con ayuda de un hematocitómetro una suspensión a una concentración de 1 X 106 conidios/mL.
La inoculación se realizó sobre el haz de la hoja, se colocaron 20 µL de la solución de conidios con una micropipeta, sobre heridas realizadas con un palillo de madera esterilizado, al testigo, solo se le adicionó agua destilada sobre las heridas. Las hojas inoculadas se mantuvieron en cámara húmeda a temperatura ambiente (24±2 °C) durante 10 d. Se realizaron 10 repeticiones, se consideró una planta como unidad experimental.
De acuerdo a los postulados de Koch, al concluir este periodo, se observó la presencia de síntomas (Agrios, 2005) y se compararon con los síntomas iniciales de donde se realizó el aislamiento; así mismo, se realizó el reaislamiento del hongo y se corroboró que correspondiera al aislamiento inoculado. La preservación de los cultivos monoconidiales se hizo en tubos de ensaye con medio PDA y cubiertos con aceite mineral estéril.
Identificación molecular. Para confirmar la identificación morfológica se llevó a cabo la extracción de DNA (ácido desoxirribonucleico). La extracción de DNA se realizó a partir de un cultivo monoconidial con el uso del DNeasy Mini kit (Qiagen, USA) de acuerdo a las instrucciones del fabricante. El DNA de cada uno de los aislamientos se conservó en refrigeración a -20 oC hasta su uso posterior.
Se realizó una amplificación de las regiones internas ITS1 e ITS2, ubicadas en los espacios transcritos internos de los genes ribosomales (rDNA) localizadas entre la subunidad pequeña 18S, 5.8S y la subunidad larga 28S, se utilizó una combinación de iniciadores ITS5 (GGAAGTAAAAGTCGTAACAAGG) / ITS4 (TCCTCCGCTTATTGATATGC). Las condiciones de la PCR usadas para la amplificación fue la siguiente: agua estéril ionizada (12.145 µL), Buffer PCR 5x, MgCI2 a 1.5 mM (2.75 µL), dNTP's a 0.2 mM (1.375 µL), Taq DNA-polimerasa 1.5 unidades (0.33 µL) (Promega, USA) iniciadores ITS5 e ITS4 a 10 pM (2 µL) de cada uno y muestra de DNA a una concentración de 20 ng (1 µL). La reacción de amplificación se realizó en un termociclador TC-512 (Techne, USA) con el siguiente programa: desnaturalización inicial a 95 oC durante 2 min, 30 ciclos de desnaturalización, alineamiento y extensión a 95 oC por 1 min, 50 oC por 30 s, 72 oC por 2 min y una extensión final a 72 oC por 10 min (White et al., 1990). El producto de PCR se purificó de acuerdo al protocolo del QIAquick PCR Purificación Kit (Qiagen, USA) y se ajustó a una concentración de 50 ng/µL con un volumen de 15 µL. La amplificación del producto se separó en un gel de agarosa al 1.5 % por electroforesis en 1x TAE buffer, las bandas se visualizaron en un transilluminador Dial Intensity UVP de luz UV modelo KD1208PTS (Scorpion Scientific, Taiwan). Los productos de PCR se secuenciaron en ambas direcciones en un 3730XL de Applied Biosystems.
Las secuencias obtenidas se ensamblaron y se compararon con las depositadas en la base de datos del National Center for Biotechnology Information (NCBI).
Preparación del extracto de jugo crudo de brócoli. Material vegetal. El material vegetal se obtuvo del mercado de abastos de la ciudad de Texcoco, México, el cual se trasladó al laboratorio de Postcosecha de frutales de la Universidad Autónoma de Chapingo. Para la extracción se utilizaron floretes y tallos de brócoli, los cuales se desinfestaron con hipoclorito de sodio a 100mg/L y se molieron en un extractor de jugo modelo 140-1-03 (Moulinex, México); posteriormente se dejaron reposar por espacio de 1 h. Después de este periodo la muestra se pasó a una centrífuga a 10,000 rpm por 10 min, obteniéndose un sobrenadante el cual se almacenó a -20 0C hasta su utilización.
Método para determinar glucosinolatos en brócoli, mediante espectrofotometría. Para el proceso de liofilizado, el jugo de brócoli se colocó en viales los cuales se congelaron a -20 oC, durante 24 h, posteriormente se colocaron en el liofilizador durante 5 d hasta su deshidratación. Para la determinación de los GLs se utilizó la metodología establecida por Jezek et al. (1999), se tomaron aproximadamente 0.5 mg de extracto liofilizado, se adicionaron 7.5 mL de buffer acetato 0.2 M, pH 4.2 y 1.5 mL de acetato de plomo y bario 0.5 M. La mezcla se agitó vigorosamente en vortex. Se adicionaron 0.4 g de polivinilpolipirrolidona (PVPP) y se incubó a temperatura ambiente, con agitación, por 15 min. Después se agregó 1.5 mL de sulfato de sodio 2 M y se centrifugó a 13,000 rpm por 5 min a temperatura ambiente, después de este tiempo se agregó 0.9 mL de extracto tratado con PVPP se mezcló con 0.9 mL de hidróxido de sodio 2M y se incubó a temperatura ambiente por 30 min. A la mezcla se adicionó 0.138 mL de ácido clorhídrico concentrado y se centrifugó a 4,000 rpm por 10 min. Para la determinación espectrofotométrica se tomaron 0.5 mL de sobrenadante y se mezcló con 0.5 µL de solución de ferricianuro 2mM en buffer fosfato 0.2 M pH 7.0. Finalmente se midió la absorbancia de la solución a 420 nm antes de 15 s usando buffer fosfato 0.2 M pH 7.0 como blanco. Adicionalmente, se realizó la medida del blanco de muestra para lo cual se tomaron 0.5 mL de extracto hidrolizado y 0.5 mL de buffer fosfato 0.2 M, pH 7.0. Para la construcción de la curva de calibración se utilizó el patrón sinigrina 5.60x10-3 M y se hicieron diluciones de 0, a 90 µL de solución. Las medidas se hicieron sobre cada dilución. Con los datos del espectrofotómetro se ajustó un modelo de regresión, para determinar la concentración de los GLs obtenidos del jugo de brócoli. El modelo utilizado fue: Y= -0.0041x+0.9313 (R2 de 0.97, P= 0.002) y la concentración de Glucosinolatos obtenida fue de 0.0029 µg/mL.
Evaluación del efecto del jugo de brócoli sobre la germinación de conidios. Bioensayo. Se colocaron 150 µL de medio de cultivo PDA en recipientes translúcidos con una capacidad de 300 µL. Antes de que el medio de cultivo solidificara, se mezcló con 50 µL del extracto puro de brócoli diluido en agua con la finalidad de que se obtuvieran las concentraciones utilizadas en los bioensayos (Cuadro 1).

Después se añadió 20 µL de la suspensión de conidios, sobre cada uno de los recipientes, los que se colocaron en cámara húmeda y se incubaron por 2, 4 y 6 h a 28±3oC. Posteriormente con la ayuda de un microscopio se cuantificó los conidios germinados, se consideraron 100 conidios al azar, de cada concentración se hicieron tres repeticiones.
Análisis estadístico. Los datos obtenidos se sometieron a un análisis de varianza y pruebas de comparación de medias (Tukey, p=0.05). Para el cálculo de la efectividad media se determinó la concentración efectiva 50 % (CL50) la cual se calculó mediante el procedimiento Probit (SAS Institute, USA). Así mismo se determinó el % de inhibición mediante la fórmula:
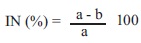
Donde: a= El total de conidios germinados del testigo
b= al total de conidios germinados del tratamiento
RESULTADOS Y DISCUSIÓN
Pruebas de patogenicidad. A los dos días después de la inoculación se observaron pequeñas manchas sobre la superficie de las hojas (Figura 1), las lesiones iniciales fueron pequeñas < 1 mm de diámetro, circulares y dispersas en las hojas, las cuales se manifestaron con la presencia de manchas circulares de color café oscuro, a medida que las lesiones se ampliaron se convirtieron en irregulares. Luego al unirse las manchas se observaron áreas necrosadas grandes que llegaron a cubrir la hoja entera. Estos síntomas coinciden con los reportados por Mercado Vergnes et al. (2006).
Caracterización morfológica de Alternaria. Se identificó al hongo causante de las manchas foliares como A. alternata, se caracterizó por presentar colonias de color verde oscuro, en medio de cultivo PZA. Al microscopio se observaron conidióforos simples de color café claro tabicados, lineal o a veces geniculado, con una longitud de 16.1-57.9 x 1-2.4 µm, conidios obclavados muriformes, con septa transversal, longitudinal variable de 1-7 y 0-3 respectivamente y conidios que van de 19.2- 55.9 µm de largo, y de 6.1 a 11.8 µm de ancho y con pico corto cilíndrico pálido, los septos son muriformes y de acuerdo a la clasificación de Saccardo (1877) los conidios son dictyoesporas. La catenulación presentó de 5 a 10 conidios, se presentó ramificación secundaria e incluso ramificación terciaria, características que corresponden a la especie de A. alternata de acuerdo a las claves y descripciones de Ellis (1971), Barnett y Hunter (1998) y Rotem (1994). Lo que corresponde con lo reportado por López y Cabral (1999), Andersen et al. (2001) y Fraire-Cordero et al. (2010) (Figura 1).
Identificación Molecular. Para determinar la especie, la secuencia se comparó con la opción BLAST del NCBI, obteniéndose un porcentaje de similitud de 99 %o con la especie A. alternata (Fríes), resultado que coincide con el trabajo realizado por Serdani et al. (2002) y Mercado Vergnes et al. (2006).
Efecto del jugo de brócoli sobre Alternaria. El análisis de varianza mostró diferencias estadísticamente significativas en el porcentaje de germinación de los conidios, en función de las concentraciones de GLs presentes en el jugo de brócoli, como se puede observar en el Cuadro 2.
El control presentó el porcentaje de germinación más alto a las 6 h, después de que los conidios se colocaron en el PDA.
Rotem (1994), menciona que en condiciones favorables, la mayoría de especies de Alternaria germinan en aproximadamente 1-3 horas. En las concentraciones de 0.15, 0.11 y 0.07 µg/µL, no se observó germinación, mientras que la concentración a 0.04, 0.01 µg/µL tuvieron un menor efecto, lo que indica que a mayor concentración menor crecimiento. En comparación con el testigo, todos los tratamientos con GLs presentes en el jugo de brócoli influyeron en el crecimiento del hongo. Se ha demostrado también que cuando se aplican los GLs de Brassica a una concentración de 0.054 µg/mL en forma de jugo acuoso crudo, el crecimiento de Candidas albicans se inhibe hasta un 95% después de 4 h de incubación (Sisti et al., 2006), resultados similares se han encontrados en el presente estudio.
En cuanto al porcentaje de inhibición de conidios de A. alternata, Troncoso-Rojas et al. (2005) reportan concentraciones de isotiosianatos derivados de los GLs de 0.025, 0.5, 0.1, 0.2 y 0.4 mg mL-1 con 75, 87 y 100 %, igual al encontrado en este trabajo, sin embargo cabe mencionar que ellos trabajaron con compuestos comerciales y en este estudio se utilizó el jugo de brócoli recién extraído. Igualmente Hafidh et al. (2011) probaron en (11 bacterias y 11 hongos) el efecto antimicrobiano del extracto de col roja y utilizaron concentraciones de 0 a 600 mg/mL para bacterias y de 0 a 350 mg/mL para los hongos, logrando obtener la concentración mínima para cada organismo.
Por otra parte, Hang y Flieming (1994) y Mucete et al. (2006) demostraron que los isotiocianatos derivados de los GLs tienen una eficaz actividad antibacterial en Escherichia coli, Candida albicans, Bacillus subtilis, Staphylococcus aureus, Agrobacterium tumefaciens y Rhizopus nigricans y bacterias de ácido láctico, con concentraciones de 142 mg/100 g-1, con efectos positivos a las 24 y 48 h. Comportamiento similar fue el que observó Marí et al. (2008) con un 85 %o en la inhibición de esporas de Monilia spp. a una concentración de 0.04 hasta 0.27 mg L-1 al utilizar diferentes isotiocianatos.
En la Figura 2 se puede apreciar el comportamiento de las concentraciones de jugo de brócoli con contenido de GLs sobre la germinación de conidios de A. alternata observadas en el microscopio.
Los GLs presentes en el jugo de brócoli influyeron en la inhibición de A. alternata, no presentaron germinación alguna de los conidios (Figura 2). Así mismo la concentración efectiva 50 % (CL50) que presentó la germinación de conidios de A. alternata al extracto de brócoli fue de 0.028 ug/uL y la concentración que inhibió por completo la germinación de conidios fue de 0.07 µg/µL.
El efecto inhibitorio de los GLs sobre la germinación de conidios de hongos fitopatógenos, ha sido observado por Vargas-Arispuro et al. (2005) quienes probaron extractos crudos de Brassica olareacea y reportan 100 % de inhibición en el crecimiento de Phymatotrichopsis omnivora (Duggar) Hennebert a una concentración de 10 mg mL-1.
Otro ejemplo del potencial fungicida del género Brassica spp. se ha comprobado en estudios in vitro, con extractos acuosos de nabo o colinabo, los cuales inhibieron completamente el crecimiento de oosporas de Aphanomyces euteiches, así como sustancias volátiles de plantas de Brassica rapa que inhibieron el crecimiento micelial de Rhizoctonia solani a una concentración de 20 mg/g-1 (Masahiro et al., 2006).
Brandi et al. (2006) utilizando jugo de Brassica oleracea reportan que la efectividad antimicrobiana se debe a un mecanismo de acción a través del bloqueo de los grupos sulfhidrilo en bacterias. Por otro lado, Delaquis y Mazza (1995), aluden que el efecto se debe a una inactivación de enzimas intracelulares, a través de la escisión oxidativa de enlaces de disulfuro. Así mismo, Kojima et al. (1971), Banks et al. (1986) y Troncoso-rojas et al. (2005), comentaron que el mecanismo por el cual los isotiocianatos (ITC) inhiben el crecimiento de hongos aún se desconoce. Sin embargo, algunas hipótesis sugieren que se debe a una no específica e irreversible interacción de ITC con los grupos sulfhidrilo, enlaces de disulfuro y grupos amino de las proteínas y los residuos de aminoácidos. El principal objetivo de compuestos lipófilos tóxicos en células eucariotas es la membrana celular, el (ITC) es un compuesto lipófilo, que puede reaccionar con otras enzimas presentes en el nivel del plasma de la membrana causando el crecimiento, inhibición y muerte celular.
Basado en lo anterior los resultados obtenidos en este estudio, muestran un óptimo control de A. alternata al inhibir su reproducción, además de ser biodegradable no producen un desequilibrio al ecosistema y por su origen vegetal desarrollará una resistencia lenta con respecto a los insecticidas sintéticos (Chirinos, 2009).
Por consiguiente el jugo de brócoli con contenido de GLs posee un potencial antifúngico y podría ser usado como tratamiento preventivo en la producción de arúgula o en postcosecha, con el fin de disminuir los daños causados por A. alternata.
CONCLUSIONES
El jugo de brócoli a una concentración de 0.07 µg/µL inhibió la germinación de conidios de Alternaria alternata, este método de control natural se puede considerar para el manejo de la enfermedad en campo y postcosecha.
LITERATURA CITADA
Agrios GN. 2005. Plant Pathology. Fifth edition. Elsevier Academic Press. New York, USA. 922p. [ Links ]
Andersen B, Kroger E and Roberts G. 2001. Chemical and morphological segregation of Alternaria alternata, A. gaisen and A. longipes. Mycological Reseach 105:291-299. [ Links ]
Báez-Flores ME, Troncoso-Rojas R y Tiznado-Hernández ME. 2008. Respuestas genéticas provocadas por el tratamiento con Isiocianatos en hongos del género Alternaria. Revista Mexicana de Fitopatología 29:61-68. [ Links ]
Banks JG, Board RG and Sparks, NH. 1986. Natural antimicrobial systems and their potential in food preservation of the future. Biotechnology and Applied Biochemistry 8:103-107. [ Links ]
Barillari J, Canistro D, Paolini M, Ferroni F, Pedulli GF, Iori R and Valgimigli L. 2005. Direct antioxidant activity of purified glucoerucin, the dietary secondary metabolite contained in rocket (Eruca sativa Mill.) seeds and sprouts. Journal of Agricultural and Food Chemistry 53:2475-2482. [ Links ]
Barnett HL and Hunter BB. 1998. Illustrated Genera of Imperfect Fungi. Fourth edition. APS Press. Minnesota, USA. 210p. [ Links ]
Bautista-Baños S, Hernández-López M and Barrera-Necha L. 2000. Antifungal Screening of plants of the State of Morelos, México against four fungal postharvest pathogens of fruits and vegetables. Revista Mexicana de Fitopatología 18:36-41. [ Links ]
Brandi G, Amagliani G, Schiavano GF, De Santi M and Sisti M. 2006. Activity of Brassica oleracea leaf juice on foodborne pathogenic bacteria. Journal of Food Protection 9:2274-2279. [ Links ]
Campas-Baypoli ON, Bueno-Solano C, Martínez-Ibarra DM, Camacho-Gil F, Villa-Lerma AG, Rodríguez-Núñez JR, López-Cervantes J y Sánchez-Machado DI. 2009. Contenido de sulforafano (1 -isotiocianato-4-(metilsulfinil)-butano) en vegetales crucíferos. Archivos Latinoamericanos de Nutrición 59:95-100. [ Links ]
Carrillo L. 2003. Los Hongos de los Alimentos y Forrajes. Universidad Nacional de Salta. Cuarta edición. 130p. [ Links ]
Chirinos J. 2009. Uso de extractos naturales como una alternativa ecológica para el control de enfermedades en plantas. INIA Divulga 14:40-42. [ Links ]
Delaquis PJ and Mazza G. 1995. Antimicrobial properties of isothiocyanantes in Food Preservation. Food Technology. Edited by James Giese, Associate Editor. 73-84 p. [ Links ]
Durazzo A, Azzini E, Lazzé MC, Raguzzini A, Pizzala R and Maiani G. 2003. IltalianWild Rocket (Diplotaxis Tenuifolia (L) DC.): influence of agricultural practices on antioxidant molecules and on cytotoxicity and antiproliferative effects. Agriculture 3:285-298. [ Links ]
Ellis MB. 1971. Dematiaceous Hyphomucetes. Cambrian Printers, Aberystwyth, Dyfed U.K. 465p. [ Links ]
Ferrato J, Firpo I, Ortiz MM, Rotondo R y Beltrán C. 2012. Pérdidas poscosecha de hortalizas en negocios minoristas, con distintos sistemas de manejo, en Rosario, Santa Fe, Argentina. Asociación Argentina de Horticultura 31:21-27. [ Links ]
Fraire-Cordero ML, Nieto-Ángel D y Cárdenas-Soriano E. 2010. Alternaria tenuissima, A. alternata y Fusarium oxysporum hongos causantes de la pudrición de florete de brócoli. Revista Mexicana de Fitopatología 28:25-33. [ Links ]
García IE, Gago CL y Fernández NJL. 2006. Tecnología del Envasado en Atmósfera Protectora. Dirección General de Universidades e Investigación. CIEM. Madrid. 141p. [ Links ]
Hafidh RR, Abdulamir AS, Vern LS, Bakar FA, Abas F, Jahashiri F and Sekawi Z. 2011. Inhibition of growth of highly resistant bacterial and fungal pathogens by a natural product. The Open Microbiology Journal 5:96-106. [ Links ]
Hang KK and Fleming HP. 1994. Antibacterial activity of cabbage juice against lactic acid bacteria. Journal of Food Science 59:125-129. [ Links ]
Jezek J, Barry G, Haggett D, Atkinson A and Rawson DM. 1999. Determination of glucosinolates using their alkaline degradation and reaction with ferricyanide. Journal Agricultural and Food Chemistry 47:4669-4674. [ Links ]
Kader AA. 2007. Tecnología Postcosecha de Cultivos Hortofrutícolas. Tercera edición. UCANR. Davis California. 580p. [ Links ]
Kojima M and Oawa K. 1971. Studies on the effect of isothiocyanates and their analogues on microorganisms. (I) Effects of isothiocyanates on the oxygen uptake of yeast. Journal of Fermentation Technology 49:740-746. [ Links ]
Koukounaras A, Siomos AS and Sfakiotakis E. 2010. Effects of 6-Ba Treatments on yellowing and quality of stored rocket (Eruca sativa Mill) Leaves. Journal of Food Quality 33:768-779. [ Links ]
López SE y Cabral D. 1999. Alternaria. Departamento de Ciencias Biológicas, Facultad de Ciencias Exactas y Naturales Ciudad Universitaria Buenos Aires Argentina Academic Press. 42-47p. [ Links ]
Mari M, Leoni O, Bernardi R, Neri F and Palmieri S. 2008. Control of brown rot on stonefruit by synthetic and glucosinolate-derived isothiocyanates. Postharvest Biology and Technology 47:61-67. [ Links ]
Masahiro K, Andriantsoa R, Yoko O, Motoaki T, Hitoshi H and Ryo F. 2006. Induction of soil suppressiveness against Rhizoctonia solani by incorporation of dried plant residues into soil. Phytopatology 96:1372-1379. [ Links ]
Mercado Vergnes D, Renard ME, Duveiller E and Maraite H. 2006. Identification of Alternaria spp. on wheat by pathogenicity assays and sequencing. Plant Pathology 55:485-493. [ Links ]
Molina-Vargas LF y Bentura-Castellanos JU. 2009. Efecto inhibitorio in vitro de cinco isotiocianatos sobre Rhizoctonia solani Kûhn AG-3. Revista de Investigación Agraria y Ambiental (RIAA) 1:37-40. [ Links ] Mucete D, Borozan A, Radu F and Jianu I. 2006. Antibacterial activity of isiothiocyanantes, active principles in Armoracia rusticana roots (I). Journal of Agroalimentary Processes and Technologies 2:443-452. [ Links ]
Nidhi S, Muhammad HR, Stephen S, Mohan T, Vipan KB and Nat NVK. 2007. Proteome-level changes in two Brassica napus lines exhibiting differential responses to the fungal pathogen Alternaria brassicae. Plant Science 172:95-110. [ Links ]
Oms-Oliu G, Aguiló-Aguayo I and Martín-Belloso O. 2006. Inhibition of browning on fresh-cut pear wedges by natural compounds. Journal of Food Science 71:216-224. [ Links ]
Rotem Y. 1994. The Genus Alternaria: Biology, Epidemiology and Pathogenicity. APS Press, American Phytopathological Society. 326p. [ Links ]
Saccardo PA. 1877. Fungi veneti novi vel critici vel Mycologiae Venetae addendi. Series VI. Michelia 1:1-72. [ Links ] Serdani M, Kang J, Andersen B and Crous P. 2002. Characterization of Alternaria species-groups associated with core rot of apples in South Africa. Mycological Research 106:561-569. [ Links ]
Sisti M, Amagliani G and Brandi B. 2006. Antifungal activity of Brassica oleracea var. botritys fresh aqueous juice. Fitoterapia 74:453-458. [ Links ]
Thomma BPHJ. 2003. Alternaria spp. From general saprophyte to specific parasite. Molecular Plant Pathology 4:225-226. [ Links ]
Tripathi P and Dubey NK. 2004: Exploitation of natural products as an alternative strategy to control postharvest fungal rotting of fruit and vegetables. Postharvest Biology and Technology 32:235-245. [ Links ]
Troncoso-Rojas R, Sánchez-Estrada A, Ruelas C and García HS. 2005. Effect of benzyl isothiocyanate on tomato fruit infection development by Alternaria alternata. Journal of the Science of Food and Agriculture 85:1427-1434. [ Links ]
Vargas-Arispuro I, Corrales-Maldonado C, Vallejo-Cohen S y Martínez-Téllez M. 2005. Correlación entre contenido de azufre y actividad antifúngica de variedades de Brassica oleracea L. para el control de Phymatotrichopsis omnivora (Duggar) Hennebert. Revista Mexicana de Fitopatología 23:320-322. [ Links ]
White TJ, Bruns T, Lee S and Taylor J. 1990. Amplification and Direct Sequencing of Fungal Ribosomal RNA Genes for Phylogenetics. In: PCR Protocols: A guide to Methods and Applications. Innis, M. A., Gelfand, D. H., Sninsky, J. J., and White, T. J. (eds). Academic Press, San Diego, CA. USA. 315-322p. [ Links ]














