Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Acta zoológica mexicana
On-line version ISSN 2448-8445Print version ISSN 0065-1737
Acta Zool. Mex vol.30 n.3 Xalapa Dec. 2014
Nota científica
Determinación de la frecuencia de apareamiento en la abeja cleptobiótica Lestrimelitta niitkib (Apidae, Meliponini) mediante el uso de microsatélites
Determination of the mating frequency in the cleptobiotic bee Lestrimelitta niitkib (Apidae, Meliponini) through microsatellite typing
Eloísa Guerrero-García,1,2 Erik Solórzano-Gordillo1 y Daniel Sánchez*
1El Colegio de la Frontera Sur, Carretera Antiguo Aeropuerto Km 2.5, CP 30700, Tapachula, Chiapas, México.
2Centro de Biociencias, Universidad Autónoma de Chiapas, Carretera a Puerto Madero Km 2, CP 30700. Tapachula, Chiapas 30700
*Autor de correspondencia: <dsanchez@ecosur.mx>
Recibido: 07/01/2014,
aceptado: 26/03/2014.
ABSTRACT
In this paper we determined the mating frequency in the cleptobiotic bee Lestrimelitta niitkib by microsatellite typing. We found 6 queens to be singly mated while only one mated twice. We confirm this genus to be mainly single mated.
Las abejas (Hymenoptera, Apoidea) son insectos que por su diversidad, hábitos de alimentación y comportamiento polinizan una gran variedad de especies de plantas silvestres y cultivadas (Klein et al. 2007). Sin embargo, son las abejas altamente sociales (Apoidea, Apidae), las que se manejan ampliamente para polinizar cultivos, debido al elevado número de individuos que constituyen las colonias de estas especies y a la relativa facilidad con la que se reproducen y transportan (Heard 1999, Velthius & Doorn 2006, Aizen & Harder 2009). A pesar de los beneficios derivados de la polinización, las prácticas agrícolas intensivas actuales ponen en peligro la sustentabilidad de este importante servicio ecológico. Un estudio reciente en Europa muestra la estrecha correspondencia entre el decremento en la diversidad vegetal y la pérdida de polinizadores (Biesmeijer et al. 2006). La reducción en las poblaciones de abejas puede tener otras consecuencias además del decremento en el número de individuos. En las abejas sociales el sexo se determina en el locus csd, de tal manera que individuos homocigotos en este locus dan origen a machos diploides estériles (Beye et al. 2003); al reducirse las poblaciones la probabilidad de consanguinidad incrementa y con ello los machos diploides; este fenómeno podría eventualmente llevar a un vórtice de extinción a las poblaciones que sufren cuellos de botella (Zayed & Packer 2005). La formación de congregaciones de zánganos es una estrategia para reducir la probabilidad de consaguinidad; se ha observado en abejas sin aguijón (Apidae, Meliponinae) y en Apis mellifera L. (Cameron et al. 2004, Kraus et al. 2008, Galindo-Cardona et al. 2012). A diferencia de A. mellifera, cuyas reinas se aparean hasta 45 veces (Fuchs & Moritz 1999), se ha demostrado que en el abejorro Bombus wilmattae Cockerell (Huth-Schwarz et al. 2011) y en algunos meliponinos como Scaptotrigona postica Latreille (Palmer et al. 2002), las reinas se aparean solamente con un macho; en otras especies ocurren múltiples apareamientos, como B. hypnorum L., Tetragonisca angustula Latreille, S. mexicana Guerin-Meneville y Melipona beecheii Bennett, pero sin llegar al extremo observado en A. mellifera (Estoup et al. 1995, Schmid-Hempel & Schmid-Hempel 2000, Tóth et al. 2004, Velthuis et al. 2005). Entre las abejas sociales destaca el género Lestrimelitta, único entre los meliponinos de América por la forma en que consigue recursos: se introduce en nidos de otras abejas sociales para robar materiales para la construcción y aprovisionamiento de sus nidos, comportamiento que se denomina cleptobiosis (Quezada-Euán 2002). Se desconoce el número de apareamientos que realiza L. niitkib Ayala y por ende la estructura genética de sus colonias. El presente estudio tuvo como objetivo determinar el número de apareamientos de reinas de L. niitkib mediante la reconstrucción del parentesco en obreras de la misma especie usando microsatélites desarrollados para T. angustula (Brito et al. 2009).
MATERIAL Y MÉTODOS
Los especímenes se obtuvieron de cuatro colonias de la ciudad de Tapachula, Chiapas y tres colonias de la ciudad de Mérida, Yucatán. La distancia entre cada colonia de la misma ciudad fue mayor a 1 km para asegurar que los especímenes no provinieran de las mismas colonias. Se colectaron varias obreras de la piquera usando pinzas entomológicas y se almacenaron en 10 ml de etanol al 96% a -20°C hasta su análisis. Se extrajo el ADN de 20 individuos de cada una de las diferentes colonias usando la técnica HotSHOT (Truett et al. 2000). Este tamaño de muestra se determinó usando la fórmula NSE = 1 - (1 - p)n donde NSE se refiere al error de no detectar obreras de otras patrilíneas, p representa la proporción de obreras que pertenecen a la misma patrilínea y n el número de obreras a muestrear, asumiendo p « 0.5 en caso de dos apareamientos; la probabilidad de no detectar genotipos idénticos de dos padres se calculó con la fórmula dp = n(Eq2), en donde qi es la frecuencia del -iésimo alelo (Bo-omsma & Ratnieks 1996). Los individuos fueron genotipificados en 4 loci: Tang11, Tang17, Tang60 y Tang70, siguiendo procedimientos estándares de amplificación (Brito et al. 2009). Los productos se visualizaron en un secuenciador semiautomati-zado LI-COR 4200 y su tamaño se determinó usando el software SAGA MX. Se utilizó el programa MATESOFT v1.0 (Moilanen et al. 2004) para inferir las frecuencias de apareamientos de la reina en cada una de las colonias muestreadas. En los casos en donde se detectó más de un apareamiento se calculó la frecuencia efectiva de apareamiento (kE) de acuerdo a Starr (1984).
RESULTADOS Y DISCUSIÓN
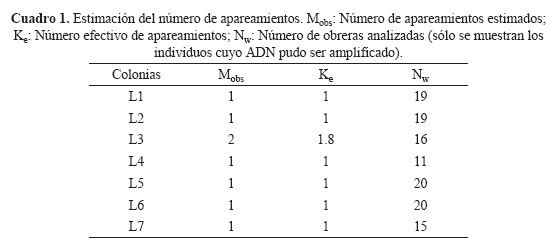
El ADN de algunos individuos no amplificó, por lo que en total se analizaron 120 individuos de las 7 colonias (Cuadro 1). En el caso de la colonia L3 con 11 individuos, el NSE es de 0.0005, por lo que la estimación de apareamientos es confiable. El análisis descriptivo de los genotipos obtenidos se muestra en el Cuadro 2. La probabilidad de no detectar genotipos idénticos fue de dp = 7.58 x 103, que significa que es poco probable que dos machos genéticamente idénticos se hayan apareado con una misma reina. En el cuadro 1 se muestra el número de apareamientos estimados para cada colonia. Nuestros resultados sugieren que las reinas de L. niitkib son predominantemente monándricas, apareándose 1.2 veces en promedio, observándose un doble apareamiento en sólo una colonia. Peters et al. (1999) encontró que L. limao se apareaba 1.22 veces, muy parecido a los datos de nuestro estudio. Siendo una especie rara, el bajo número de apareamientos de L. nittkib incrementa el riesgo de que sus poblaciones se vuelvan homocigotas en el gen csd, dando origen a machos diploides. Sin embargo, es posible que exista una estrategia que minimice esta situación. Un posible estudio debería incluir la determinación del número de machos diploides en congregaciones de L. niitkib, así como el número de colonias de las que provienen, tal como se ha realizado con S. mexicana (2008) y otras especies. De esta forma se tendría más conocimiento sobre las adaptaciones de esta especie para reducir la probabilidad de consanguinidad.

AGRADECIMIENTOS
Al soporte financiero otorgado por el CONACYT a través del proyecto no. 128702 "Evolución de la Cleptobiosis en Lestrimelitta (Apidae, Meliponini)" mediante una beca a la autora de este documento y a la adquisición de materiales y recursos.
LITERATURA CITADA
Aizen, M. A., & Harder, L. D. 2009. The global stock of domesticated honey bees is growing slower than agricultural demand for pollination. Current Biology, 19: 915-918. [ Links ]
Beye, M., Hasselmann, M., Fondrk, M., Page, R. & Omholt, S. 2003. The gene csd is the primary signal for sexual development in the honeybee and encodes an SR-type protein. Cell Biology International, 114: 1-20. [ Links ]
Biesmeijer, J. C., Roberts, S., Reemer, M., Ohlemuller, R., Edwards, M., Peeters, T., Schaffers, A., Potts, S., Kleukers, R., Thomas, C., Settele, J. & Kunin, W. 2006. Parallel declines in pollinators and insect-pollinated plants in Britain and the Netherlands. Science, 313: 351-354. [ Links ]
Boomsma, J. J., & Ratnieks, F. L. W. 1996. Paternity in eusocial Hymenoptera. Philosophical Transactions of the Royal Society B: Biological Sciences, 351: 947-975. [ Links ]
Brito, R. M., Francisco, F. O., Domingues-Yamada, A. M. T., Gonçalves, P. H. P., Pioker, F. C., Soares, A. E. E. & Arias, M. C. 2009. Characterization of microsatellite loci of Tetragonisca an-gustula (Hymenoptera, Apidae, Meliponini). Conservation Genetics Resources, 1: 183-187. [ Links ]
Cameron, E. C., Franck, P. & Oldroyd, B. P. 2004. Genetic structure of nest aggregations and drone congregations of the southeast Asian stingless bee Trigona collina. Molecular Ecology, 13: 2357-2364. [ Links ]
Estoup, A., Scholl, A., Pouvreau, A. & Solignac, M. 1995. Monoandry and polyandry in bumble bees (Hymenoptera-Bombinae) as evidenced by highly variable microsatellites. Molecular Ecology, 4: 89-93. [ Links ]
Fuchs, S., & Moritz, R. F. A. 1999. Evolution of extreme polyandry in the honeybee Apis mellifera L. Behavioral Ecology and Sociobiology, 45: 269-275. [ Links ]
Galindo-Cardona, A., Monmany, A. C., Moreno-Jackson, R., Rivera-Rivera, C., Huertas-Dones, C., Caicedo-Quiroga, L. & Giray, T. 2012. Landscape analysis of drone congregation areas of the honey bee, Apis mellifera. Journal of Insect Science, 12: 122. [ Links ]
Heard, T. A. 1999. The role of stingless bees in crop pollination. Annual Review of Entomology, 44: 183-206. [ Links ]
Huth-Schwarz, A., Leon, A., Vandame, R. & Moritz, R. 2011. Mating frequency and genetic colony structure of the neotropical Bumblebee Bombus wilmattae (Hymenoptera: Apidae). Apidologie, 42: 513-525. [ Links ]
Klein, A. M., Vaissiere, B. E., Cane, J. H., Steffan-Dewenter, I., Cunningham, S. A., Kremen, C. & Tscharntke, T. 2007. Importance of pollinators in changing landscapes for world crops. Proceedings of the Royal Society B: Biological Sciences, 274: 303-313. [ Links ]
Kraus, F., Weinhold, S. & Moritz, R. 2008. Genetic structure of drone congregations of the stingless bee Scaptotrigona mexicana. Insectes Sociaux, 55: 22-27. [ Links ]
Moilanen, A., Sundström, L. & Pedersen, J. 2004. MATESOFT: a program for deducing parental genotypes and estimating mating system statistics in haplodiploid species. Molecular Ecology Notes, 4: 795-797. [ Links ]
Palmer, K., Oldroyd, B., Quezada-Euan, J., Paxton, R. & May-Itza, W. J. 2002. Paternity frequency and maternity of males in some stingless bee species. Molecular Ecology, 11: 2107-2113. [ Links ]
Peters, J. M., Queller, D. C., Imperatriz-Fonseca, V. L., Roubik, D. W. & Strassmann, J. E. 1999. Mate number, kin selection and social conflicts in stingless bees and honeybees. Proceedings of the Royal Society B: Biological Sciences, 266: 379-384. [ Links ]
Quezada-Euán, J. 2002. Notes on the nest habits and host range of cleptobiotic Lestrimelitta niitkib (Ayala 1999) (Hymenoptera: Meliponini) from the Yucatan Peninsula, Mexico. Acta Zoológica Mexicana (n.s.), 86: 245-249. [ Links ]
Schmid-Hempel, R. & Schmid-Hempel, P. 2000. Female mating frequencies in Bombus spp. from Central Europe. Insectes Sociaux, 47: 36-41. [ Links ]
Starr, C. K. 1984. Sperm competition, kinship, and sociality in the aculeata Hymenoptera. , pp. 427-464. In: R. L. Smith (Ed.), Sperm Competition and the Evolution of Animal Mating Systems. Academic Press, New York. [ Links ]
Tóth, E., Queller, D. C., Dollin, A. & Strassmann, J. E. 2004. Conflict over male parentage in stingless bees. Insectes Sociaux, 51: 1-11. [ Links ]
Truett, G., Heeger, P., Mynatt, R., Truett, A., Walker, J. & Warman, M 2000. Preparation of PCR-quality mouse genomic DNA with hot sodium hydroxide and tris (HotSHOT). Biotechniques, 29: 52-54. [ Links ]
Velthius, H. H. W. & Doorn, A. V. 2006. A century of advances in bumblebee domestication and the economic and environmental aspects of its commercialization for pollination. Apidologie, 37: 421-451. [ Links ]
Velthuis, H. H. W., Koedam, D. & Imperatriz-Fonseca, V. L. 2005. The males ofMelipona and other stingless bees, and their mothers. Apidologie, 36: 169-185. [ Links ]
Zayed, A., & Packer, L. 2005. Complementary sex determination substantially increases extinction proneness of haplodiploid populations. Proceedings of the National Academy of Sciences, 102: 10742-10746. [ Links ]














