Introducción
El virus del Zika (ZIKV) es un virus ARN de la familia Flaviviridae. En 2015 el ZIKV fue detectado en América del Sur, y las devastadoras alteraciones en el sistema nervioso central (SNC) en neonatos llamaron la atención. En Brasil se reportó que tres niños presentaban microcefalia, calcificaciones cerebrales y alteraciones oculares, por lo que se presumía la transmisión vertical.1
Por otro lado, durante el brote de Tahití en 2013, en un paciente con hipospermia, el virus se encontró en el semen,2 por lo que se consideró que podía transmitirse por vía sexual. En 2016, Melo y colaboradores demostraron el ZIKV en el líquido amniótico, lo cual se asoció con la microcefalia.3
Las alteraciones neurológicas asociadas a la infección perinatal también se han documentado en pacientes adultos, especialmente el síndrome de Guillain-Barré,4 lo cual llevó a la Organización Mundial de la Salud (OMS) a impartir directrices para el seguimiento y reporte estricto de esta condición.5
La Organización Panamericana de la Salud (OPS) registró un aumento en el número de casos de microcefalia congénita y otras alteraciones del sistema nervioso central (SNC) en regiones con circulación activa por el ZIKV, denominando el síndrome Zika congénito (CZS, por sus siglas en inglés).6 Y para febrero de 2016, la OMS declaró a esta condición como emergencia de salud pública, de interés internacional.7
En general, la infección por el ZIKV se ha asociado a anomalías cerebrales y trastornos en el neurodesarrollo de niños expuestos durante la gestación, especialmente en el primer trimestre,8 pero existen reportes que no han identificado casos de CZS. A pesar de estas discrepancias, se recomienda la vigilancia de estos pacientes para identificar si tienen problemas en el neurodesarrollo.9,10
En el presente estudio se evaluaron las características del neurodesarrollo de niños expuestos al ZIKV utilizando la escala de Bayley III,11 en una población de niños en la ciudad de Neiva, Colombia.
Material y métodos
Se realizó un estudio descriptivo, observacional en el que inicialmente se incluyeron 129 niños con antecedente de exposición prenatal por ZIKV. El estudio se realizó entre octubre de 2016 y septiembre de 2017 en el Servicio de Pediatría del Hospital Universitario Hernando Moncaleano Perdomo, la cual es una institución de tercer nivel de atención, ubicada en la ciudad de Neiva, Huila, al sur de Colombia.
En 100% de los casos se descartó otra infección congénita, mediante serología para STORCH. Entre los tres y 18 meses de edad se realizó seguimiento clínico pediátrico en cuanto a su crecimiento y desarrollo, así como de neurología pediátrica, evaluando alteraciones del comportamiento, del tono muscular, reflejos osteotendinosos, persistencia de reflejos primitivos y presencia de crisis convulsivas. También se realizó evaluación oftalmológica.
Detección de IgG plasmática específica de NS1 de ZIKV
La exposición a ZIKV se confirmó mediante la detección de IgG anti-NS1 de ZIKV y de DENV NS1 en plasma mediante técnica de ELISA, con base en lo descrito por Tyson y Tsai.12,13 A continuación describimos brevemente la técnica: las placas de 96 pozos se cubrieron toda la noche a 4 oC, con 100 μL de ZIKV-NS1 recombinante purificada (cepa Suriname [Z1106033]) expresada en células eucariotas (Native Antigens Co). Al día siguiente, el contenido se removió y los pozos se bloquearon con 150 μL de una solución de leche descremada bovina 5% en PBS estéril, además de Tween 20, 0.1% (blotto), durante una hora. Luego, el contenido fue retirado y 100 μL de plasma diluido 1/200 en blotto al 2.5% se adicionó, incubando por dos horas a 37 oC. Pasado el tiempo, el contenido se retiró, se lavaron los pozos con buffer (PBS Tween 20, 0.1%) y se adicionaron e incubaron 100 μL de un anticuerpo biotinilado, originario de cabra anti-IgG humana, a una concentración de 0.5 μg/mL, por una hora a 37 oC. Los pozos se lavaron con buffer y se aplicaron e incubaron 100 μL en estreptavidina-peroxidasa a 0.5 μg/mL, por una hora a 37 oC. Por último, los pozos se lavaron y se aplicaron 100 μL de tetrametilbenzidina (TMB).
La reacción se detuvo con 50 μL de H2SO4 2M, para ser leída a 450 nm. Para detectar la IgG que se une a NS1 de DENV1-4, las placas se cubrieron con una mezcla de NS1 de los cuatro serotipos a una concentración conocida.14 Para validar los ensayos se usó el plasma de individuos no expuestos (control negativo) y de pacientes con infección confirmada de ZIKV (control positivo). Todas las muestras se analizaron por duplicado.
Evaluación del neurodesarrollo
Se utilizó la escala Bayley-III, el cual es un instrumento de evaluación del neurodesarrollo para niños desde un mes y hasta 42 meses de vida. Contiene cinco dominios para evaluar: habilidades cognitivas, comunicación receptiva, comunicación expresiva, motricidad fina y motricidad gruesa.9,15 La escala fue aplicada por un especialista en neurología pediátrica a los 12 ± 2 meses, considerando que a esta edad es apropiado identificar alteraciones relevantes en el neurodesarrollo, tales como falta de progreso de habilidades motoras gruesas y finas, desarrollo asimétrico e interacción social.9 Además, se hacen detectables las alteraciones específicas como persistencia de reflejos primitivos, anormalidades del tono muscular, del desarrollo psicosocial y respuesta a estímulo auditivo y visual.
Con la puntuación obtenida de la escala Bayley-III los pacientes se clasifican en: 1) neurodesarrollo normal (puntación ≥ 85); 2) retardo del desarrollo leve (puntuación de 70 a 84); 3) retardo del desarrollo moderado (puntuación 55 a 69); y 4) retardo del desarrollo grave (puntuación < 55).16
Imágenes
Se realizó la evaluación del SNC mediante ecografía Doppler transfontanelar, así como tomografía simple en cortes axiales y/o resonancia magnética (secuencias con información T1 y T2 en cortes axiales) a todos los pacientes con alteración neurológica, microcefalia o afección oftalmológica.
Aspectos éticos
Este trabajo se realizó con el aval del comité de ética de la institución Hospital Universitario Hernando Moncaleano Perdomo de Neiva, Huila, Colombia, acta No. 004-007 el 19-04-2016.
Análisis estadístico
Las variables cualitativas se expresan en frecuencias absolutas y relativas, y las cuantitativas con promedio y valores mínimo y máximo. La comparación entre dos grupos de las variables numéricas fue con t de Student, mientras que las variables categóricas con prueba exacta de Fisher y χ2. La significancia estadística se definió como un valor (p < 0.05). Se utilizó el programa GraphPad Prism 6.0.
Resultados
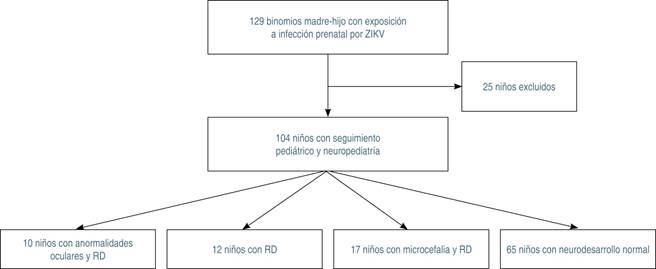
Del total de niños expuestos a infección durante el embarazo por ZIKV (n = 129, binomio madre-hijo), 104 cumplieron los criterios de selección. Se excluyeron 25 niños porque sus madres presentaron serología IgG NS1-ZIKV negativas, o bien por pérdida durante el seguimiento. La edad osciló entre 3.2 y 18.1 meses.
Se encontraron 39 niños con alteraciones en el neurodesarrollo, 17 de los cuales fueron diagnosticados con microcefalia. Además, hubo 12 niños que no tuvieron manifestaciones de CZS al nacimiento (Figura 1).
En la Tabla 1 se comparan las características de las madres, de acuerdo con la presencia o no de alteraciones en el neurodesarrollo. Como se muestra, la edad de las madres de niños con alteraciones fue estadísticamente menor (promedio 21 años versus 26 años), p < 0.001. En cuanto a las características del cuadro clínico, fiebre y exantema fueron también las más frecuentes en las madres de niños con alteraciones (p < 0.05), Pero no hubo diferencias en el trimestre que ocurrió la infección. Estas mismas variables se analizaron entre los 39 que tenían alteraciones en el neurodesarrollo, pero considerando la presencia de microcefalia (Tabla 2); se encontró que los niños con microcefalia (n = 17), su madre tenía menor edad y que la infección por ZIKV fue en los dos primeros trimestres del embarazo (p < 0.05).
Tabla 1: Comparación de las características de las madres con exposición a virus del Zika entre niños con y sin alteración en el neurodesarrollo (N = 104).
|
Característica |
Alteración en el neurodesarrollo N = 39 n (%) |
Neurodesarrollo normal N = 65 n (%) |
p |
|---|---|---|---|
| Edad materna (años), promedio [rango] | 21 [15-36] | 26 [16-41] | < 0.0001* |
| Duración del embarazo (semanas), media [rango] | 38 [30-41] | 38 [30-41] | 1.0 |
| Fiebre | 26 (67) | 56 (86) | 0.018 |
| Artralgias | 30 (77) | 53 (82) | 0.570 |
| Exantema | 35 (90) | 65 (100) | 0.019 |
| Trimestre en que se identificó la infección materna | |||
| Primer trimestre | 21 (54) | 32 (49) | 0.648 |
| Segundo trimestre | 13 (33) | 21 (32) | 0.914 |
| Tercer trimestre | 3 (8) | 12 (18) | 0.132 |
* Prueba t de Student, para las demás pruebas se utilizó χ2.
Tabla 2: Comparación de las características de las madres con exposición a virus del Zika en niños con alteración en el neurodesarrollo, con y sin microcefalia (N = 39).
|
Característica |
Microcefalia N = 17 n (%) |
Sin microcefalia N = 22 n (%) |
p |
|---|---|---|---|
| Edad materna (años), promedio [rango] | 21 [15-36] | 26 [16-41] | < 0.0001* |
| Duración del embarazo (semanas), media [rango] | 38 [30-41] | 38 [30-41] | 1.0 |
| Fiebre | 11 (65) | 15 (68) | 0.819 |
| Artralgias | 13 (76) | 17 (77) | 0.953 |
| Exantema | 14 (82) | 21 (95) | 0.386 |
| Trimestre en que se identificó la infección materna | |||
| Primer trimestre | 13 (76) | 8 (36) | 0.012 |
| Segundo trimestre | 2 (12) | 11 (50) | 0.012 |
| Tercer trimestre | 0 (0) | 3 (14) | 0.242‡ |
* Prueba t de Student.
‡ Prueba exacta de Fisher, para el resto de variables categóricas se utilizó χ2.
En la Tabla 3 se comparan los datos anormales de la evaluación neurológica entre los 39 niños con alteraciones del neurodesarrollo. Se observa que el porcentaje de niños con microcefalia con alteraciones es mucho mayor que quienes no la presentaron.
Tabla 3: Principales hallazgos neurológicos en 39 niños con síndrome congénito por virus del Zika.
|
Hallazgo clínico anormal |
Niños con microcefalia N = 17 n (%) |
Niños sin microcefalia N = 22 n (%) |
|---|---|---|
| Alteraciones del comportamiento | ||
| Irritabilidad | 9 (53) | 1 (4) |
| Llanto anormal | 9 (53) | 1 (4) |
| Alteraciones del tono | ||
| Hipertonía | 15 (93) | 1 (4) |
| Hipotonía | 0 (0) | 0 (0) |
| Alteraciones en los reflejos músculo-tendinosos | ||
| Hiperreflexia | 10 (59) | 1 (4) |
| Hiporreflexia | 0 (0) | 0 (0) |
| Respuestas primitivas persistentes | ||
| Puños cerrados | 11 (65) | 0 (0) |
| Prensión plantar | 15 (88) | 0 (0) |
| Convulsiones | 8 (47) | 1 (4) |
Hallazgos oftalmológicos
Veinticinco niños presentaron alteraciones oculares (24%). Como se observa en la Tabla 4, 11 bebés (44%) tuvieron anomalías en el nervio óptico, lo más frecuente fue hipoplasia (n = 6), seguido de atrofia bilateral (palidez, neuritis) en cuatro, y uno con coloboma bilateral. También en 11 recién nacidos se identificaron alteraciones en las retinas, siendo lo más frecuente coriorretinitis (n = 7).
Tabla 4: Hallazgos oftalmológicos en 25 niños expuestos a virus del Zika.
| Estructura | Hallazgo | n (%) |
|---|---|---|
| Nervio óptico | Hipoplasia | 6 (24)* |
| Coloboma | 1 (4)* | |
| Neuritis y atrofia | 4 (16)* | |
| Retina | Coriorretinitis | 7 (28)* |
| Moteado retiniano | 3 (12)* | |
| Maculopatía | 1 (4)‡ | |
| Músculos extraoculares | Estrabismo | 5 (20)* |
| Nistagmos | 3 (12)* | |
| Exotropía alternante | 1 (4)* |
* Bilateral.
‡ Unilateral.
Hallazgos en estudios de imagen
De acuerdo con la evaluación de los estudios de imagen, 10 pacientes tuvieron ventriculomegalia, tres con lisencefalia y 10 con calcificaciones cerebrales subcorticales. El adelgazamiento del cuerpo calloso fue documentado en tres pacientes, hipoplasia cerebelar y del tronco encefálico en un paciente y alteración en la surcación cerebral (paquigiria) en cinco niños. Además, en dos niños se observó trastorno migratorio cortical y en igual al número de casos se identificó escasa mielinización.
En la Figura 2 se muestran imágenes de algunos pacientes en quienes se detectaron estas alteraciones.

Figura 2: Hallazgos radiológicos de pacientes con síndrome de Zika congénito. A) Resonancia magnética, corte axial, información T2, pobre surcación (paquigiria-lisencefalia). B) Resonancia magnética, corte axial, información T2, hidrocefalia ex vacuo. C) Tomografía cerebral corte axial: calcificaciones intraparenquimatosas cerebrales.
Discusión
La epidemia de Zika en Las Américas conllevó un aumento en el número de casos de microcefalia congénita y otras alteraciones del SNC en regiones con infección activa por ZIKV.17-19 En Colombia, entre agosto de 2015 y mayo de 2016 se reportaron 18,576 casos de ZIKV postnatal en niños de un mes a 18 años.20,21 El proyecto de vigilancia de embarazadas con Zika, liderado por el Instituto Nacional de Salud en tres ciudades de Colombia (Barranquilla, Cúcuta y Cali) determinó que de 1,200 mujeres sintomáticas por Zika, 4.2% de sus hijos tuvo defectos oculares o cerebrales al nacimiento.22 El presente estudio es el primero que incluye información de la ciudad de Neiva.
Aunque no ha habido una nueva epidemia de ZIKV en Colombia, se siguen registrando nuevos casos. En 2021 se reportaron 66 casos, cinco con infección concomitante por el virus SARS-CoV-2, lo que deja ver la importancia de mantener programas de evaluación de parámetros de desarrollo neurológico en niños que durante la gestación tuvieron contacto con el ZIKV.23
El ZIKV ha mostrado su neurotropismo dirigido a células progenitoras neurales, neuronas y otras células cerebrales, provocando apoptosis de las células progenitoras neurales. Las células gliales también se han visto comprometidas, así como la diferenciación y proliferación neural. Todo lo anterior puede explicar el denominado CZS, que incluye microcefalia, adelgazamiento de la corteza cerebral, calcificaciones subcorticales, cicatrices maculares, manchas retinianas, entre otras. Además, estos pacientes pueden desarrollar convulsiones, problemas de audición y visión, dificultades para alimentarse y anomalía en la función motora.16 Los resultados del presente estudio confirman estas alteraciones, dado que 39 pacientes (38%) presentaron una o más de lo previamente reportado. Nuestros resultados son comparables a lo señalado por Renata Soares Martins y colaboradores en Brasil.24
La microcefalia fue uno de los hallazgos principales de este estudio, dado que fue identificado en 17 casos (16%), lo cual es consistente con otros estudios.6,25,26 La infección por este virus puede ocurrir en cualquier trimestre del embarazo,27 pero cabe señalar que, en este estudio, la infección ocurrió en el primer y segundo trimestre del embarazo en la mayoría de los pacientes y un número importante fueron hijos de madres jóvenes.
En general, se considera que las infecciones durante el tercer trimestre del embarazo no son teratogénicas porque la organogénesis está casi completa.28 Sin embargo, la retina y otras estructuras oculares se siguen desarrollando aún después del nacimiento.29 En este estudio 24% de los pacientes presentó anomalías oculares, relacionadas con el nervio óptico, la retina y los músculos extraoculares, lo cual ya ha sido mencionado previamente. En Brasil, en 2016,29 Ventura y colegas encontraron que la afectación ocular por infección congénita por el ZIKV fue más frecuente en bebés cuyas madres informaron síntomas durante el primer trimestre del embarazo, lo cual es similar al presente estudio.
La frecuencia de datos neurológicos anormales es similar a lo descrito en 2017 en Brasil,30 como alteraciones del comportamiento, del tono muscular, de los reflejos músculo-tendinosos, respuesta primitiva persistente y convulsiones. Por lo anterior, parece fundamental la evaluación neurológica para el seguimiento de este grupo de pacientes para identificar datos clínicos anormales del neurodesarrollo.31
Se ha descrito que el daño por ZIKV se traduce en alteraciones del neurodesarrollo en las áreas que evalúa la escala de Bayley III;32 en el presente estudio, con su aplicación a los 104 pacientes se demostró que 39 niños tenían alguna alteración, 33 (85%) en el área motora, igual número en la esfera cognitiva, y 13 (33%) en el lenguaje. En Brasil, todos los niños con síndrome congénito por ZIKV tuvieron alteración en el área motora gruesa, utilizando el mismo instrumento.33 En otro estudio con 32 lactantes en vigilancia por 16 meses también se encontró mayor compromiso en los dominios motor y cognitivo.34 Nielsen-Sains y colaboradores reportaron los resultados del neurodesarrollo en 146 niños con ZIKV al utilizar la escala de Bayley III. Describen que el 12% tuvo una puntuación inferior a 70 en un dominio, y el 28% con puntajes entre 85 y 70, siendo el área de lenguaje la más afectada.35 Lo cual es similar a otras publicaciones.29,36-38
Por último, se debe comentar que durante la vigilancia de los pacientes del presente estudio se encontraron alteraciones del neurodesarrollo en 12 pacientes (11.5%) sin microcefalia ni evidencia clínica de síndrome congénito, lo cual es semejante a lo reportado por Einspieler y colaboradores,39 quienes observaron 10% de hallazgos anormales, con predominio en el área motora. Asimismo, Mulkey y su equipo10 en otra cohorte de niños colombianos expuestos a ZIKV describen disminución en el puntaje de neurodesarrollo a lo largo del tiempo, por lo que plantean la necesidad de vigilarlos a largo plazo, a fin de detectar la aparición de alteraciones y otorgar tratamiento oportuno.
Conclusión
Los hijos de madres expuestas a infección por ZIKV durante la gestación tienen mayor frecuencia de alteraciones del neurodesarrollo. Estos hallazgos demandan medidas de salud pública en zonas endémicas de ZIKV, tales como la vigilancia postnatal para detectar este tipo de alteraciones de forma temprana.











 text new page (beta)
text new page (beta)