Introducción
Los teratomas constituyen la neoplasia germinal extragonadal más común en neonatos, cuya localización más frecuente involucra el cóccix y el sacro (sacrococcígeo), pero también se encuentran en otras localizaciones de la línea media, como en orofarínge, cuello, cerebro, mediastino, corazón y abdomen.1,2 El término teratoma tiene su origen en el griego terathos, que significa monstruo, el cual fue acuñado por Virchow, a finales del siglo XVIII al describir un tumor en la región sacrococcígea.3
Estos tumores están compuestos de células derivadas de las tres capas germinales del embrión, y se caracterizan por su rápido crecimiento en la etapa fetal.4 Histológicamente se dividen en maduros o inmaduros, dependiendo si las células son o no diferenciadas.
El diagnóstico prenatal ayuda en el pronóstico y manejo temprano del recién nacido; su identificación puede ser por ultrasonido obstétrico o por imagen de resonancia magnética (IRM). La estirpe celular se determina por histología y marcadores tumorales, como la alfafetoproteína (AFP) y gonadotropina coriónica humana (β-hCG). Estos últimos también son de utilidad para identificar actividad tumoral durante el seguimiento.5,6
El tratamiento es quirúrgico para tratar de extirpar completamente el tumor.7 Hay controversia sobre si es necesario que haya bordes quirúrgicos negativos, ya que puede ser difícil de lograr y porque las recaídas no son frecuentes. En algunos casos se utiliza quimioterapia, a base de carboplatino, pero es muy raro en la etapa neonatal.8
El objetivo de este reporte es presentar tres recién nacidos con teratomas maduros cuya localización fue órbita, orofarínge y a nivel sacrococcígeo, a fin de dar a conocer el proceso diagnóstico-terapéutico realizado.
Presentación de los casos
Caso 1
Recién nacido femenino de 38 semanas de gestación, peso 2,980 gramos (P50), talla 49 cm (P50), perímetro cefálico 36 cm (P90). Madre de 16 años, gesta 1; el embarazo transcurrió sin complicaciones, pero en ultrasonido obstétrico previo al nacimiento se detectó tumoración en el rostro del feto. Nació por cesárea, el apgar fue 9/9. A la exploración física se observó tumoración en el globo ocular izquierdo, de aproximadamente 4 × 5 cm, que ocasionaba exoftalmos (Figura 1A).
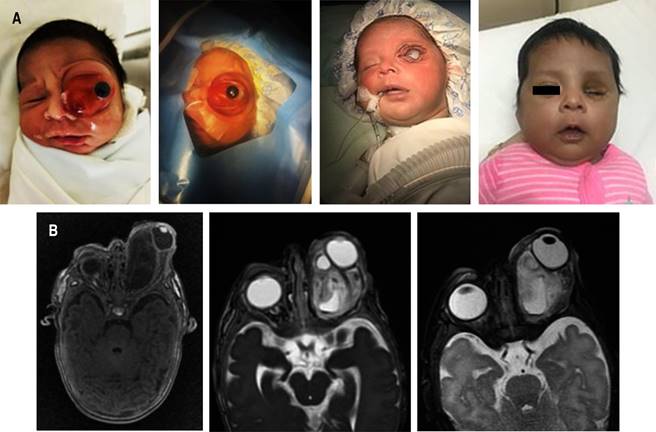
Figura 1: A) Teratoma orbitario en globo ocular izquierdo. B) Resonancia magnética nuclear de cerebro simple donde se observa que la tumoración desplaza al nervio óptico y al globo ocular izquierdo.
Ingresa estable a la unidad de cuidados intensivos neonatal (UCIN), sin apoyo ventilatorio. Se realiza punción del componente quístico de la tumoración por el servicio de Oftalmología, sin complicaciones. En la IRM, la tumoración se localiza como intraorbitaria del lado izquierdo, con componentes sólido y quístico, con dimensiones de 30 × 26 × 24 mm, la cual se extiende de manera supero-lateral al nervio óptico, causando protrusión y compresión del globo ocular (Figura 1B). Marcadores tumorales: AFP 32,721 ng/mL y b-HGC en 0.29 mUI/mL.
A los 10 días de vida, en nueva IRM se observa aumento del volumen de la tumoración a 43 × 32 × 32 mm. A los 15 días, se realiza exenteración orbitaria del lado izquierdo, sin complicaciones, colocando conformador orbitario pequeño. Por histopatología el diagnóstico es de teratoma maduro. Se egresa con seguimiento por oftalmología, oncología pediátrica, y neonatología. La AFP y b-HGC disminuyeron en el postquirúrgico a 1,210 ng/mL, 0.15 mUI/mL, respectivamente. En la cita de seguimiento a los seis meses de edad había un adecuado desarrollo psicomotor, y la visión del ojo sano se describe como normal.
Caso 2
Recién nacido femenino de 39 semanas de gestación, peso de 2,040 gramos (< P3), talla 47 cm (P10), perímetro cefálico 33 cm (P10-50). Madre de 42 años, gesta 3. En ecografía prenatal a las 28 semanas de gestación se detectó tumor de predominio sólido, con áreas quísticas y de bordes irregulares, identificándose como epignathus (Figura 2A a C).

Figura 2: A) Ultrasonografía 3D a las 28 semanas de gestación, se presenta tumoración dependiente de cavidad oral. B) Ultrasonografía realizada a las 28 semanas de gestación, presenta tumor con medidas 6 × 4 × 3 cm. C) Teratoma extirpado.
El producto se obtiene por cesárea programada por técnica Ex Utero Intrapartum Treatment (EXIT). Inmediatamente al nacimiento, por dificultad para acceso a la vía aérea, se realizó traqueostomía con lo cual se logró estabilizar. En orofaringe, a nivel del paladar óseo, se observó una tumoración sólida e irregular, con dimensiones de 6 × 4 × 3 cm. También se identificó una hendidura en el paladar blando. Se procedió a realizar resección parcial y poteriormente pasa a UCIN.
A los 15 días de vida, se realiza resección en bloque de la tumoración completa y del paladar duro, sin dañar estructuras óseas circundantes, con colocación de sonda de gastrostomía para su alimentación. Se extubó al tercer día postoperatorio, sin complicaciones. Al quinto día postquirúrgico se inicia la alimentación en infusión continua, con adecuada tolerancia. Se egresa con alimentación por gastrostomía. Unas semanas más tarde la paciente desarrolla acumulación de líquido subdural bilateral, así como a nivel subgaleal del lado derecho, por lo que se coloca derivación peritoneal subdural, sin complicaciones.
El reporte del estudio histopatológico fue de teratoma maduro. Con respecto a los niveles de AFP, antes de la cirugía fueron de 39.5 ng/mL y, posteriormente disminuyeron a 26.2 ng/mL, 8.6 ng/mL y 4.9 ng/mL al mes, seis meses y al año del postquirúrgico.
Al tercer mes de vida, la succión mostraba mejoría, ya que en los primeros dos meses del postoperatorio estaba disminuida, requiriendo ejercicios de rehabilitación. A los seis meses de edad, el desarrollo motor grueso era normal.
Caso 3
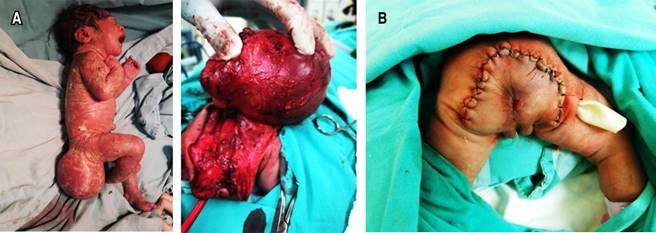
Recién nacido femenino de 35.6 semanas de gestación, peso 2,800 gramos (P50), talla 48 cm (P50), perímetro cefálico 33 cm (P50). Producto de una madre de 35 años, gesta 2, embarazo sin complicaciones. En el segundo trimestre del embarazo se detectó por ultrasonido tumor en región sacrococcígea, que se confirmó por IRM fetal. La recién nacida fue obtenida por cesárea, sin complicaciones; desde el nacimiento se observa tumoración en región sacrococcígea de 10 × 10 cm (Figura 3A), y se ingresa a la UCIN para tratamiento.
En nueva IRM se identifica que se trata de un teratoma sacrococcígeo macroquístico; en marcadores tumorales se determinaron los niveles de AFP en 11,033 ng/mL. A los ocho días de vida se realizó resección completa (Figura 3B), con escisión del cóccix y de toda la masa.
El diagnóstico por patología fue de teratoma sacrococcígeo maduro. La AFP disminuyó a 1.49 ng/mL en el postquirúrgico. Se egresa al mes de edad.
A los tres meses de edad se evaluó por ecografía y no se encontraron anormalidades en región sacrococcígea, pero el vaciamiento vesical era difícil y había constipación. A los seis meses había adecuado desarrollo motor grueso.
Discusión
En este artículo describimos tres RN con teratomas de diferentes localizaciones. La localización más frecuente de los teratomas neonatales es en la región sacrococcígea (40%), mientras que los de orofaringe se describen en alrededor de 8%, mientras que en la órbita es de 2%.9 Como en otras publicaciones, para los tres casos la detección de la tumoración fue prenatal, lo cual ayudó a planear el manejo.10 Yamaguchi y colaboradores describieron que la tumoración se identifica fácilmente por ecografía, con base en el aspecto característico de una masa compleja, de consistencia sólida y quística, y muy vascularizada,11 lo cual contribuye para la corrección quirúrgica.12
En particular, el manejo de los pacientes con teratoma orbitario tiene como meta salvar el ojo, asegurar el desarrollo orbitofacial, mantener una visión óptima y lograr apariencia facial normal.13 El uso de IRM tiene el potencial de coadyuvar en estas metas; por ejemplo, al detectar si hay extensión intracraneal.
Con respecto a epignathus, se trata de un teratoma orofaríngeo que comúnmente se origina en el paladar o la faringe, y que puede tener extensión al espacio intracraneal. En este tipo de tumores, la mayor preocupación es la preservación de las vías respiratorias y la función orofaríngea, lo que depende del tamaño y la extensión del tumor, por lo que las imágenes prenatales y la coordinación entre ginecólogos, neonatólogos y cirujanos son de suma utilidad para obtener el mejor resultado posible.14,15 Halterman y colaboradores describieron que el diagnóstico prenatal permite programar la cesárea y realizar traqueostomía inmediata al momento del parto por especialistas en otorrinolaringología,16 lo cual fue semejante a lo ocurrido en la segunda paciente descrita en el presente reporte.
Gera y Bhatia informaron de fuga de líquido cefalorraquídeo, por lo que fue necesaria la reconstrucción de la base del cráneo.11 Sorprendentemente, en la recién nacida que presentamos no se detectó comunicación intracraneal-extracraneal en el piso de la fosa craneal anterior. Sin embargo, desarrolló acumulación de líquido subdural que, muy probablemente, se debió al rápido cambio en el volumen del contenido intracraneal después de la resección del tumor.
El teratoma sacrococcígeo es uno de los tumores congénitos más comunes en recién nacidos, ocurriendo en uno de cada 20,000-40,000 nacimientos, con más casos en mujeres.17 La tasa de mortalidad prenatal puede ser hasta de 24%, lo cual se ha relacionado con el gran tamaño del tumor.18 Desde el punto de vista histopatológico, la mayoría son benignos (en los casos que predomina el componente quístico) por el contrario, en los tumores malignos predominan las masas sólidas.19,20 Por los datos observados en nuestra paciente, corresponde a un teratoma maduro. El buen resultado quirúrgico fue similar a lo reportado por Hu y colaboradores.21
Se ha descrito que, a pesar de la resección completa del teratoma sacrococcígeo puede reaparecer años después, por lo que se recomienda el seguimiento de estos casos hasta la edad adulta;22 en este contexto, la determinación de marcadores tumorales séricos como AFP y b-hCG puede ser de mucha utilidad durante la vigilancia.23











 text new page (beta)
text new page (beta)