Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista de investigación clínica
On-line version ISSN 2564-8896Print version ISSN 0034-8376
Rev. invest. clín. vol.57 n.4 Ciudad de México Jul./Aug. 2005
Artículo original
Disminución de ácido fólico y alteraciones cognitivas en pacientes con epilepsia tratados con fenitoína o carbamazepina, estudio piloto
Decrease of folic acid and cognitive alterations in patients with epilepsy treated with phenytoin or cartnabazepine, pilot study
Raúl Hernández,* Ma. de los Ángeles Fernández,* Gabriela Miranda,* Roberto Suástegui**
* Instituto Nacional de Neurología y Neurocirugía Manuel Velazco Suárez.
** Hospital Infantil de México Federico Gómez.
Reimpresos:
Dr. Roberto A. Suástegui–Román
Departamento de Neurología del
Hospital Infantil de México Federico Gómez.
Dr. Márquez No. 162, Col. Doctores,
06720, México, D.F.
Tel: y fax: 5555889392
Correo electrónico: suastero@hotmail.com; suastero@terra.com.mx
Recibido el 9 de diciembre de 2003.
Aceptado el 27 de mayo de 2005.
ABSTRACT
Introduction. Phenytoin and carbamazepine were the antiepileptic drugs most frequently used in Mexico and throughout the world. Epileptic patients who take these drugs have a variety of collateral effects including the decrease of Mates plas–matic level. Low serie folie acid concentration has been associated with a decline in cognitive functions. The administration of a combined treatment with folie acid could ameliorate these difficulties.
Objective. To describe the effect of the folie acid in the cognitive function in epileptic patients who take phenytoin and carbamazepine.
Methods. We chose patient who have epilepsy and that are being treated with phenytoin, carbamazepine or both and formed two groups. The study group was treated with a daily dose of 5 mg of folie acid and the control group was administered placebo for a period of six months, with nine patients in each group of same age, sex, education level, epilepsy's evolution, frequency of seizures, EEG abnormalities and antiepileptic drugs plasma levels. We registered data at the beginning (basal) and at the end of the study.
Results. Measurements of basal folie acid plasma levels in both groups were under the referential value. The neuropsychological assessment at the beginning (Mini–Barcelona test) showed a deficit in the verbal memory skills in both groups. After six months of treatment with folie acid (study group), the folie acid plasma level was 12.2 mg/mL (p < 0.01) higher than the basal value. Verbal memory test has improved with respect to the basal value (p < 0.05). The numbers of seizures and the plasma levels of the antiepileptic drugs remained unchanged. On the other hand, the group treated with placebo did not improve.
Conclusion. Treatment with folie acid is safe and without side effects, it improved the cognitive function in patients with epilepsy treated with phenytoin and carbamazepine.
Key words. Cognition. Carbamazepine. Epilepsy. Folie acid. Phenytoin.
RESUMEN
Introducción. La difenilhidantoína (DFH) y la carbamazepina (CBZ) son los antiepilépticos más empleados en México y en el mundo, los pacientes con epilepsia que emplean estos fármacos presentan una disminución en las concentraciones séricas de ácido fólico, una de las causas que pueden contribuir a un deterioro cognitivo, por lo que la terapia sustitutiva con ácido fólico pudiera mejorar estas alteraciones.
Objetivo. Describir el efecto de la disminución del ácido fólico en la cognición de pacientes con epilepsia tratados con difenilhidantoína y carbamazepina.
Material y métodos. Incluimos pacientes tratados con carbamazepina, fenitoína o ambos, con epilepsia. Formamos dos grupos: Un grupo experimental recibió ácido fólico 5 mg/día y otro grupo control recibió placebo durante seis meses, nueve pacientes en cada grupo; pareados en la edad, sexo, escolaridad, tiempo de evolución, námero de crisis, alteraciones EEG, niveles séricos de anticonvulsivos, realizamos estudios neuropsicológicos al inicio (básales) y al final del estudio a ambos grupos.
Resultados. Las básales del ácido fólico en ambos grupos estuvieron por debajo del valor de referencias. En las pruebas neuropsicológicas (básales) (prueba de Mini–Barcelona) se halló un déficit en el área de la memoria verbal en ambos grupos. Después de seis meses de tratamiento con ácido fólico (grupo experimental) los niveles de ácido fólico alcanzaron 12.2 ng/mL (p < 0.01) con respecto a su basal; las pruebas de memoria verbal mejoraron con respecto a su basal (p < 0.05); el námero de crisis y los niveles séricos de los anticonvulsivos no se modificaron. El grupo con placebo no presentó ninguna mejoría.
Conclusiones. El tratamiento coadyuvante con ácido fólico es seguro, libre de efectos adversos y mejoró las alteraciones cognitivas (memoria verbal) de estos pacientes.
Palabras clave. Ácido fólico. Carbamazepina. Difenilhidantoína. Cognición. Epilepsia.
INTRODUCCIÓN
La epilepsia es una condición patológica caracterizada por crisis recurrentes no provocadas, sin embargo, la presencia de las crisis sólo es una fracción del problema global; los pacientes con epilepsia desarrollan una variedad de problemas neuropsiquiátricos tales como: afección cognitiva sobre todo en el ámbito de la memoria, trastornos del humor, episodios psicóticos y disfunciones sexuales.1 Las causas de las alteraciones cognitivas son máltiples; se han relacionado con disfunción estructural propia del encéfalo, anormalidades en el EEG, efecto agudo y crónico de las crisis y el impacto de los medicamentos anticonvulsivos.2 Autores como Raush demostraron la existencia de un deterioro cognitivo en los pacientes con epilepsia del lóbulo temporal.3
Dentro de las funciones cognitivas probablemente la memoria sea la más afectada en los pacientes con epilepsia del lóbulo temporal, encontrándose una relación directa entre estructuras hipocámpicas dañadas con defectos de memoria.4 Se propuso que estos defectos en la memoria están en relación con el námero de crisis, sin embargo, se ha observado que pacientes sin crisis convulsivas, pero con la presencia de actividad epileptiforme en regiones mesiales del lóbulo temporal, demostrada por electroencefalograma (EEG), presentan déficit de memoria.5–7 Otros autores han observado que las alteraciones cognitivas no sólo se presentan en focos en el lóbulo temporal y se han descrito independientemente de la localización del foco de desearga.8,9
Dodrill encontró una relación entre un mayor grado de déficit cognitivo con lesión estructural y con mayor tiempo de evolución de las crisis2 y describe que este deterioro puede ser secundario al efecto acumulativo de las crisis durante varios años y a la ingesta de antiepilépticos en forma crónica. El efecto que pudieran tener estos fármacos en la función cognitiva de los pacientes con epilepsia está en relación con el tipo de medicamento, la dosis, los niveles séricos, el uso de monoterapia vs. politerapia, así como variables propias del paciente tales como edad de presentación y tipo de crisis.10
Otros factores que se han descrito y que pueden ocasionar un déficit cognitivo son: deficiencia de ácido fólico y trastornos en el metabolismo hormonal.11–15 La deficiencia de ácido fólico en estos pacientes está en relación con la ingesta de anticomiciales como la difenilhidantoína (DFH) y la carbamazepina(CBZ),16–19 por este hecho algunos autores han sugerido la adición de ácido fólico a la terapia de los pacientes que toman DFH, tratando de reducir los efectos adversos asociados a la disminución de ácido fólico, por otro lado, con el uso de ácido fólico se tiene la posibilidad de obtener un mejor control de las crisis al alcanzar niveles terapéuticos de DFH más rápido por la acción del ácido fólico como cofactor en el metabolismo de este fármaco.15,20
Los mecanismos por los cuales antiepilépticos como DFH y CBZ disminuyen los niveles de ácido fólico pueden ser por:
1. Inhibición de la absorción intestinal del ácido fólico.21
2. Inducción enzimática de los fármacos antiepilépticos, con una depleción del ácido fólico secundaria.22
El deterioro cognitivo ocasionado por la deficiencia de ácido fólico se ha descrito por varios autores.15,23–27
Por otro lado, algunos autores han descrito la posibilidad del efecto epileptogénico de ácido fólico, sin embargo, hasta el momento no se ha demostrado ninguna neurotoxicidad del ácido fólico en humanos.28–30 Pese a estas observaciones anecdóticas, en estudios prospectivos en grandes grupos de pacientes comparados con controles no se ha demostrado que exista un mayor námero de crisis en estos pacientes que recibieron ácido fólico además de sus medicamentos anticonvulsivos.31–33
Por los argumentos anteriormente descritos se efectuó el presente protocolo para evaluar:
• El estado cognitivo de los pacientes con epilepsia bajo tratamiento con DFH y/o CBZ.
• El efecto del ácido fólico en la cognición como terapia de adición en estos pacientes.
Las funciones conocidas de la vitamina B12 y el ácido fólico en el metabolismo intracelular son varias. La vitamina B12 intracelular se mantiene en forma de dos coenzimas activas, metilcobalamina y desoxiadenosilcobalamina. La metilcobalamina actáa como dador de grupo metilo para la conversión de homocisteína en metionina. El metiltetrahidrofolato es el principal análogo del folato suministrado a las células y la fuente primaria del grupo metilo para la formación de metilcobalamina. Además, cuando las concentraciones de vitamina B12 son inadecuadas, el folato queda "atrapado" como metiltetrahidofolato y causa deficiencia funcional de otras formas intracelulares vitales del ácido fólico.
MATERIAL Y MÉTODOS
Procedimiento
Fueron incluidos pacientes mayores de 18 años y menores de 50 años con el diagnóstico de epilepsia criptogénica (primaria), todos contaban con tomografía axial computarizada de encéfalo simple y contrastada (TAC) y/o resonancia magnética nuclear de encéfalo (IRM) dentro de normalidad, deberían de tener un electroencefalograma (EEG) de al menos un mes de haberse efectuado. Medicamentos: que estuvieran en tratamiento con DFH, CBZ o ambos, con algán otro antiepiléptico, con respuesta de al menos una reducción de 50% de las crisis, con un adecuado desarrollo psicomotriz durante los primeros años de su vida y con una escolaridad entre seis y 12 años. Los pacientes se seleccionaron en un periodo de 12 meses, de la consulta externa de la clínica de epilepsia del Instituto Nacional de Neurología y Neurocirugía "Manuel Velazco Suárez" de la ciudad de México, D.F. La selección para terapia de adición con ácido fólico o placebo fue de manera aleatoria. Se siguió a los pacientes por seis meses a partir del ingreso al protocolo, con consultas mensuales, en las cuales se les cuantificó el námero de crisis además de una revisión neurológica. A todos se le informó de las características de protocolo y los participantes firmaron una carta de consentimiento.
Mediciones y procedimientos básales
1. Se registró el námero de crisis de al menos tres meses previos de iniciar el protocolo.
2. Se midió la concentración sanguínea de ácido fólico, vitamina B12 y los niveles séricos de los antiepilépticos que tomaban. En aquellos pacientes con niveles séricos subterapéuticos de los fármacos se corrigieron a niveles de referencia: DFH 10–20 µg/ dL, CBZ 4–8 µg/dL ácido valproico (AVP) 50–125 µg/dL (por el método de radioinmunoensayo) y posteriormente se les administró el placebo o el ácido fólico. Después de llevar las concentraciones séricas dentro de intervalos terapéuticos no se modificó el tratamiento a lo largo de todo el estudio.
3. Con los niveles de los antiepilépticos dentro de intervalos de referencia se prosiguió a la aplicación de la prueba abreviada del Test de Barcelona (Mini–Barcelona), esta prueba fue aplicada de una manera ciega por una psicóloga experimentada, desconociendo a qué grupo pertenecía cada paciente.
Esta prueba es un estudio ya avalado en población hispana considerado como un examen que permite valorar el estado funcional de las áreas neuropsicológicas más importantes, que exige de 30 a 45 minutos en su aplicación y que en estudios previos ha demostrado que puede ser un indicador átil para el diagnóstico de deterioro cognitivo.34–36
4. En forma aleatorizada se dividieron los pacientes en dos grupos. El primer grupo recibió ácido fólico, además de su antiepiléptico de base (grupo experimental) a dosis de 5 mg/día durante un periodo de seis meses, mientras que el segundo grupo recibió placebo, también además de su antiepiléptico de base, durante el mismo tiempo. En ninguno de los grupos se modificó el esquema de sus anticonvulsivos y con niveles terapéuticos de los fármacos.
Medidas y procedimientos finales
A los seis meses de iniciado el tratamiento con placebo o ácido fólico se les efectuó una nueva determinación de ácido fólico, de vitamina B12 y de niveles séricos de anticonvulsivos, se aplicó nuevamente la prueba neuropsicológica (por la misma psicóloga que aplicó la prueba basal), además de la cuantificación de las crisis epilépticas que habían sido registradas mes con mes. El registro de esta variable se efectuó por un neurólogo que desconocía a qué grupo pertenecía cada paciente.
Estadística
Se empleó la media como pruebas de tendencia central y desviación estándar como medida de dispersión. Para la comprobación de hipótesis se emplearon pruebas estadísticas permitiendo un error alfa de 5% y un error beta de 20%, con dos colas, se empleó prueba paramétrica de t de Student para el promedio de los diferentes grupos y no paramétrica de Mann–Whitney para el análisis intragrupo, para la correlación de dos variables se utilizó la prueba no paramétrica de Spearman.
RESULTADOS
Se reclutó a todos los pacientes que cumplieron con los criterios de inclusión en el periodo de 12 meses. De estos pacientes uno tuvo que ser excluido por presentar un aneurisma de la vena de Galeno y dos pacientes abandonaron el estudio, por lo que el análisis se realizó con 18 pacientes. De éstos, nueve fueron incluidos en el grupo experimental (los que recibieron sus antiepilépticos más ácido fólico) y los nueve restantes pertenecieron al grupo con antiepilépticos más placebo.
Tipo de crisis
En el grupo con ácido fólico, cuatro pacientes presentaron crisis convulsivas tónico clónicas generalizadas (CCTCG) y cinco pacientes presentaron crisis parciales complejas (CPC), en el grupo con placebo, tres presentaron CCTCG y seis pacientes presentaron CPC. El promedio de crisis epilépticas por mes en el grupo experimental fue de 3.1 crisis (± 2.1), mientras que en el grupo con placebo fue de 2.6 (± 2.5).
Los estudios de TAC o de IRM de encéfalo resultaron normales en todos los pacientes. En el EEG se observaron alteraciones focales en seis pacientes del grupo experimental y en tres alteraciones difusas. En el grupo con placebo los resultados fueron muy similares, cinco pacientes con alteraciones focales y cuatro con alteración difusa.
Medicamentos antiepilépticos
En el grupo experimental tres pacientes tomaban DFH, cuatro pacientes CBZ, un paciente tomaba ambos medicamentos y otro paciente tomaba además de estos dos, AVP. La dosis media de DFH fue de 340 mg/día con niveles séricos promedio de 12.6 mg/dL (± 7.7) (niveles de referencia de 10–20 mg), la CBZ tenía una dosis media de 716 mg/día con niveles séricos promedio de 5.9 1 µg/dL (± 1.9) (valores de referencia 4–8 mg/dL), el tiempo de tratamiento promedio con estos fármacos fue de 4.2 años ± 2.7. En el grupo con placebo tres pacientes tomaban DFH, cuatro CBZ, un paciente ambos medicamentos y otro paciente tomaba además de los anteriores AVP. La dosis promedio de DFH fue de 360 mg/día, con una media en los niveles séricos de 8.2µg/dL (± 5.9), la dosis promedio de CBZ fue de 600 mg/día, niveles séricos promedio de 4.5 µg/dL (± 1.8); con un tiempo promedio de tratamiento de 3.5 años ± 2.2. En todas estas medidas básales no se encontraron diferencias estadísticas significativas entre ambos grupos (ínter–grupo) (Cuadro 1).
Al término del estudio el námero de crisis en el grupo experimental disminuyó en seis pacientes, en tres no cambió y en ningán paciente aumentaron; en el grupo con placebo en dos pacientes disminuyó, en seis no hubo cambios y en un paciente aumentaron muy discretamente.
Determinación de ácido fólico y de vitamina B12
Los valores básales de ácido fólico plasmático en el grupo experimental fueron de 2.1 ng/mL a 10.3 ng/mL (media de 6.6 ng/mL DE ± 2.7) mientras que en el grupo con placebo fue de 4.3 ng/mL a 13.5 ng/mL (media de 8.5 ng/mL DE ±2.6) (intervalos de referencia 3.5 a 16.1 ng/mL, con una media de 9.8 ng/ mL), no se encontró diferencia estadísticamente significativa al comparar ambos grupos (Figura 1).

Al final del estudio los niveles sanguíneos de ácido fólico se elevaron en el grupo experimental hasta 12.2 ng/mL (DE ± 0.9) con una diferencia estadísticamente significativa al comparar con su basal (intragrupo) (p < 0.01) (Mann–Whitney). En el grupo con placebo hubo una discreta elevación de 8.5 ng/ mL (± 2.6) a 9.6 ng/mL (± 1.8), sin que representara una diferencia estadísticamente significativa con su basal. En análisis Intergrupo postratamiento de ácido fólico, se observó una diferencia estadísticamente significativa, p = 0.03 (Mann–Whitney).
No se observó ningán efecto adverso en los pacientes que recibieron ácido fólico.
La vitamina B12, en el grupo experimental promedio 503 pg/mL (DE ± 448) mientras que para el grupo con placebo 546 pg/mL (DE ± 460) (intervalos de referencia de 157 a 1,051 pg/mL. Con una media de 608 pg/mL). Al finalizar el estudio en el grupo experimental el promedio fue 435.2 pg/mL (DE ± 271) y en el grupo con placebo 427 pg/mL (DE ± 213), no se encontró ninguna diferencia estadísticamente significativa entre estas mediciones al compararlas antes y después del tratamiento ni intra o intergrupo.
Pruebas neuropsicológicas
Se les aplicó la prueba de Mini–Barcelona. Esta evaláa 12 diferentes aspectos del área cognitiva con la realización de 20 subpruebas diferentes. En el cuadro 2 se especifica la organización de esta prueba.
Los resultados obtenidos de cada una de las pruebas son comparados con los de una tabla de valores de referencia de acuerdo con la escolaridad de los pacientes. Al resultado de cada prueba se le da una calificación en escala decimal y cada resultado se compara con el esperado en el patrón de referencia.
De acuerdo con el puntaje obtenido en cada prueba se puede clasificar como: máximo, medio, bajo, mínimo e inferior, así como correlacionarlo con el percentil estimado segán el puntaje obtenido.
Los resultados en la valoración basal (pretratamiento) de ambos grupos, así como la obtenida al final del experimento (postratamiento a seis meses después de la primera medición) se pueden observar en las figuras 2, 3 y 4.
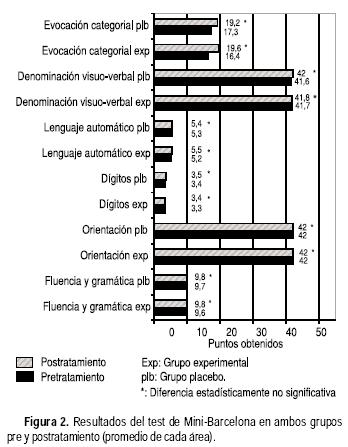


En la valoración inicial, en ambos grupos los promedios estuvieron ubicados entre los niveles medio y superior. Sin embargo, en las cuatro pruebas que valoraron la memoria verbal (memoria de textos inmediata evocada, memoria de textos inmediata preguntada, memoria de textos diferida evocada y memoria de textos diferida), ambos grupos obtuvieron medias ubicándose entre los niveles bajo y medio (Figura 4).
Resultados de la valoración neuropsicológica posterior al tratamiento con ácido fólico vs. placebo
Al final del seguimiento se le aplicó a ambos grupos nuevamente la prueba de Mini–Barcelona. Los resultados obtenidos se pueden observar en las figuras 2, 3 y 4. En general fueron muy similares en la mayoría de las pruebas a los recabados en la valoración inicial, con mínimas variaciones con resultados promedios, entre las categorías media y superior.
En la valoración de memoria verbal, que había resultado baja en las mediciones básales, en la revaloración postratamiento los pacientes del grupo experimental presentaron una discreta mejoría, mientras que en el grupo con placebo no sucedió esta mejoría (Figura 4).
En el análisis por separado de cada una de estas pruebas de memoria verbal y a pesar de la mejoría en el grupo experimental, estadísticamente no hubo diferencia; sin embargo, al analizar la memoria verbal como unidad (al reunir las cuatro pruebas), el promedio postratamiento fue de 52.7 (DE ± 9.4) contra el promedio pretratamiento de 43.3 (DE ± 12.8) (grupo experimental) con una p = 0.0015 bilateral (t de Student grupos relacionados) (Figura 4).
Se efectuó un estudio de correlación lineal entre el ácido fólico y los resultados de la prueba de memoria de Mini–Barcelona, resultando un coeficiente de correlación (prueba de Spearman) de 0.63 que nos permite considerar que a menores concentraciones de ácido fólico, menor puntaje en las pruebas de memoria (Figura 5).

En el análisis del ácido fólico con otras variables, se evidenció que el uso de politerapia se relacionó con un decremento significativamente estadístico de las concentraciones séricas de ácido fólico, en comparación con los pacientes que tomaban un solo anticonvulsivo.
En el análisis de la puntuación del Mini–Barcelona (memoria) con otras variables, se pudo observar que en los pacientes con más de 10 años de evolución de la epilepsia, más de tres crisis al mes, un EEG con alteraciones difusas, más de cuatro años de tratamiento anticonvulsivo y las concentraciones por debajo de 8 ng/mL de ácido fólico se asocian con un mayor deterioro de la memoria sin que sea estadísticamente significativa.
DISCUSIÓN
Los pacientes epilépticos, con un buen control de las crisis con monoterapia habitualmente no presentarán problemas serios en sus funciones cognitivas. Sin embargo, hasta en 70% de los pacientes con epilepsia se encuentran alteraciones en las funciones cognitivas que pueden ser de leves a muy severas, ya sea por la propia epilepsia o por otros factores como el uso de los antiepilépticos. El déficit en la atención, la concentración, la memoria y el lenguaje son los más cománmente observados y estas alteraciones cognitivas pueden afectar la vida de los pacientes ocasionándoles dificultades a nivel laboral, escolar o familiar.37
Las causas que se han relacionado con un deterioro cognitivo en pacientes con epilepsia son varias: El daño cerebral previo, la edad de inicio de las crisis, el tipo y frecuencia de éstas y el uso de los anticonvulsivos. Timbre et al.38 observaron que las crisis convulsivas tonicoclónico generalizadas recurrentes, el trauma cra–neoencefálico, el uso de DFH y los niveles bajos de ácido fólico están relacionados con el deterioro cognitivo de los pacientes con epilepsia,38 las evaluaciones de estos pacientes se han efectuado con pruebas neuropsicológicas sencillas, lo que podría ocasionar confusión en los resultados, así que en el presente estudio se decidió evaluar a los pacientes con la prueba de Mini–Barcelona que permite un análisis más detallado en las diferentes áreas de cognición.
Todos los medicamentos antiepilépticos, especialmente cuando se usan en forma combinada pueden producir afección cognitiva principalmente en atención, concentración, memoria, velocidad del pensamiento y coordinación motriz. Este déficit puede estar en relación con el daño cerebral, sin embargo, la CBZ y la DFH ocasionan disminución en las concentraciones séricas de ácido fólico14 que a su vez puede provocar trastornos en la cognición.15 Por este mecanismo la CBZ y el DFH podrían ocasionar trastornos en la cognición de manera indirecta. El otro mecanismo por el cual estos fármacos pudiesen alterar las funciones cognitivas está en relación con el hecho de que ambos fármacos influyen en el metabolismo de algunos neurotransmisores como la acetilcolina.12 Por lo anterior, podemos decir que existen evidencias clínicas y razones bioquímicas para sustentar que la CBZ y el DFH pueden afectar la cognición de los pacientes que lo están tomando, por tal motivo, se realizó el presente estudio para tratar de demostrar esta hipótesis. Dividimos a los pacientes en dos grupos, a uno se le administró ácido fólico suplementario y al otro se administro placebo, ambos grupos continuaron con su tratamiento antiepiléptico basal y todos con niveles séricos terapéuticos, se efectuaron mediciones al inicio del protocolo y al término del estudio.
Los niveles séricos básales de ácido fólico mostraron que 66% de los pacientes tenían valores por debajo de la media establecida (9.8 ng/mL) característica observada también por Edeh, quien encontró que 60% de los pacientes se encontraban por debajo de la media calculada.27 A nivel experimental se han observado resultados similares, en ratas después de 10 días de tratamiento con DFH las concentraciones de ácido fólico disminuyeron en el tejido hepático, adrenal, plasmático y cerebral.39 Froscher encontró que en un grupo de pacientes epilépticos en tratamiento con algán antiepiléptico 15% tuvieron niveles séricos bajos de ácido fólico, en relación con 2% de un grupo control de pacientes que padecían radiculopatía.15
Los mecanismos propuestos por los cuales los antiepilépticos disminuyen las concentraciones de ácido fólico son los siguientes:
• La existencia de una inhibición intestinal de la absorción del ácido fólico causada por estos medicamentos.21
• Interacción con el metabolismo hepático de los anticonvulsivos,40 debida a una inducción de las enzimas hepáticas microsomales, que origina una disminución de las concentraciones séricas de ácido fólico.22
En este ensayo clínico, en ninguno de los pacientes observamos deterioro cognitivo grave, en las pruebas realizadas al inicio y al final del estudio, del mismo modo que Lesser, el cual observó que los pacientes con epilepsia, relativamente bien controlada, raramente sufren de un decremento significativo de su funcionamiento global intelectual.41 Dentro de las afecciones observadas existen el predominio de algunas áreas de la función cognitiva,42 a nivel del lenguaje pueden desarrollar problemas de anomia, alteraciones en la fluencia y en la generación del lenguaje, así como en la comprensión de lecturas,43 en el área de la memoria se llegan a encontrar alteraciones en la memoria verbal, en el aprendizaje verbal y en la memoria no verbal.44,45 En el área de ejecución pueden tener problemas en la formación de conceptos y en la se–cuenciación motora.46 En el presente estudio se empleó en la evaluación neuropsicológica la prueba de Mini–Barcelona que permite evaluar diferentes áreas cognitivas. Los resultados observados en las diferentes áreas investigadas, con excepción de la memoria verbal, se ubican entre los niveles medio y superior.
Los resultados en la memoria verbal fueron inferiores a las otras áreas en ambos grupos.
Las alteraciones en la memoria verbal son frecuentemente encontradas en pacientes con crisis convulsivas generalizadas y crisis parciales complejas especialmente con focos epileptiformes en el lóbulo temporal izquierdo.43,44
Para tratar de comprobar la hipótesis de deterioro cognitivo, secundario a la disminución de ácido fólico por DFH y CBZ, se decidió administrar ácido fólico a un grupo y placebo al otro grupo, observamos datos interesantes: En cuanto al námero de crisis hubo una disminución de éstas en el grupo de los pacientes que recibieron ácido fólico de 3.1 crisis mensuales a 1.8 crisis, mientras que en el grupo con placebo prácticamente no hubo variación, ambos grupos con niveles terapéuticos de sus antiepilépticos, sin llegar a encontrar una diferencia estadísticamente significativa. Este resultado difiere de otros estudios; en observaciones de casos aislados y estudios no controlados se ha descrito que con tratamiento coadyuvante con ácido fólico en los pacientes que toman DFH ocasiona una disminución de los niveles séricos de DFH y por lo tanto un posible descontrol de las crisis.30,40 Sin embargo, otros investigadores, en estudios controlados con humanos, no observaron efectos adversos o incremento de las crisis, con terapia coadyuvante de ácido fólico, por lo que la mayoría de los pacientes epilépticos no sufren efectos adversos serios con la administración concomitante de ácido fólico.15 Los niveles séricos de CBZ y DFH al inicio y al final del estudio mejoraron en ambos grupos: en el caso de la CBZ no se encontró una diferencia estadísticamente significativa, mientras que en el caso de DFH los niveles séricos del grupo con placebo mejoraron de 8.2 mg/dL a 11.4 mg/dL y en el grupo con ácido fólico de 12.6 mg/dL a 16.4 mg/dL, una diferencia significativamente estadística p < 0.05 (Mann–Whitney) en ambos grupos. La explicación de la elevación de los niveles séricos de los antiepilépticos en ambos grupos fue debida probablemente a la vigilancia estrecha en que se tuvo a estos pacientes a lo largo de todo el estudio, ocasionando un mejor apego al tratamiento. Por otro lado, Lewis sugiere que el ácido fólico funciona como un cofactor en el metabolismo de la DFH y que por lo tanto una deficiencia de folatos explicaría un estado de seudoestabilidad en las concentraciones de DFH, lo que provoca que al inicio del tratamiento con ácido fólico disminuyan inicialmente los niveles séricos de DFH, pero que a la larga lleva a obtener niveles estables de este medicamento. Por lo que se recomienda que el ácido fólico se debe de iniciar en forma conjunta con la DFH para disminuir los efectos adversos asociados a la deficiencia de folatos, para un mejor control de las crisis sin que exista una perturbación de la far–macocinética de la DFH.19
Como era de esperarse, los niveles sanguíneos de ácido fólico mejoraron de 6.6 ng/mL a 12.2 ng/mL en el grupo experimental (p < 0.01) (Mann–Whitney), encontrando que al final del estudio todos los pacientes de este grupo tuvieron una concentración de ácido fólico por arriba de la media calculada de 9.8 ng/ mL. La elevación sérica de ácido fólico involucra a toda la economía, incluyendo al cerebro como lo observado en animales de experimentación, quienes bajo tratamiento con DFH, al administrarles folatos 20 mg/kg/día oral, aumentaron las concentraciones de ácido fólico en los tejidos hepático, cerebral y adrenal.39
Las pruebas neuropsicológicas básales fueron muy similares en ambos grupos. En la memoria verbal, ambos grupos presentaron resultados en promedio, menores a 44 puntos, sin embargo, en la evaluación final en el grupo experimental (con ácido fólico) se elevó el puntaje promedio por arriba hasta 52.7 y en grupo con placebo a 46 puntos, cuando se analizaron estas pruebas como una unidad (las cuatro juntas) se observó una diferencia estadísticamente significativa (p = 0.0015 bimarginal) (t de Student grupos relacionados), para el grupo experimental, mientras que en el grupo con placebo no se encontró diferencia en los resultados estadísticamente significativa. En un estudio de 116 pacientes con epilepsia se encontró una correlación entre las alteraciones en la memoria y los niveles de ácido fólico.47 Froscher observó una mejoría en varios parámetros de las funciones mentales en cuatro pacientes epilépticos durante la administración de ácido fólico, con un deterioro de algunas de éstas posterior a la descontinuación de los folatos.15 En otras patologías neurológicas tales como el deterioro cognitivo de los ancianos, se ha encontrado una relación entre la deficiencia de ácido fólico y alteraciones en la memoria.48 En un estudio realizado por Nisson et al. en pacientes ancianos previamente diagnosticados con una deficiencia de ácido fólico, se encontró una mejoría del puntaje en la prueba del Minimental posterior a la administración de folatos.49 Estos datos al igual que nuestro trabajo apoyan la correlación entre la deficiencia de folatos y algunas alteraciones cognitivas, en nuestro estudio ocasionado por el tratamiento con DFH y/o CBZ.
En la correlación de diferentes variables con la disminución de ácido fólico, se pudo observar que la politerapia anticonvulsiva colabora a una disminución de los niveles sanguíneos de ácido fólico al comparar con los pacientes con monoterapia (p < 0.01) (Mann–Whitney); resultados similares son observados por Calandre et al.50 Por otro lado, otros autores han encontrado una correlación de deficiencia de ácido fólico20 y tiempo de evolución de la epilepsia, situación que no observamos en este estudio, probablemente porque se requiera de mayor tiempo de seguimiento en estos pacientes.
Algunas condiciones relacionadas con mayor déficit cognitivo son los niveles séricos de los antiepilépticos por arriba de las concentraciones terapéuticas,51 en este grupo ningán paciente presentó concentraciones séricas por arriba de los valores de referencia, otro factor son las crisis convulsivas tonicoclónicas generalizadas, en comparación con las crisis parciales,37 variables que en el presente estudio no encontramos correlación.
Los resultados obtenidos en el presente estudio sugieren modificar parcialmente la terapéutica de estos pacientes agregando ácido fólico a su tratamiento establecido. Como se ha comentado, los efectos colaterales por la ingesta de ácido fólico a las dosis sugeridas prácticamente son nulos y el costo en nuestro país es muy bajo, accesible para nuestros pacientes, sin embargo, sería importante efectuar estudios similares con mayor námero de pacientes, para dar mayor poder a los hallazgos e involucrar a la población infantil que se encuentra tomando estos mismos fármacos.
REFERENCIAS
1. Blum D, Bortz J. Neurobehavioral aspects of epilepsy. Curr Op Psych 1998; 11: 321–6. [ Links ]
2. Dodrill CB. Neuropsychological aspects of epilepsy. Psych Clin North Am 1992; 15: 384–94. [ Links ]
3. Rausch R. Neuropsychological and psychosocial follow up of patients with temporal lobectomy surgery for intractable epilepsy: result at 1 year an 10 years. Epilepsia 1995; 36(Suppl. 1) 4: S 318. [ Links ]
4. Kilpatrick C, Murrie V, Cook M, Andrews D. Degree of left hippocampal atrophy correlates with severity of neuropsychological deficits. Seizure 1997; 6: 213–18. [ Links ]
5. Krauss GL, Summerfield M, Brandt J, Breiter S. Mesial temporal spikes interfere with working memory. Neurology 1997; 49: 975–80. [ Links ]
6. Helmstaedter C, Elger C, Lendt M. Postictal courses of cognitive deficits in focal epilepsies. Epilepsia 1994; 35: 1073–8. [ Links ]
7. Tisher PW, Holzer JC, Greenberg M, Benjamin S. Psychiatric presentations of epilepsy. Harv Rev Psychiatry 1993; 1: 219–28. [ Links ]
8. Devinsky O, Gerhengorn J, Brown E, Perrine K. Frontal functions in juvenile myoclonic epilepsy. Neuropsy Neuropsych, Behav Neurol 1997; 10: 243–6. [ Links ]
9. Helmstaeder C, Kemper B, Elger C. Neuropsychological aspects of frontal lobe epilepsy. Neuropsych 1996; 34: 399–406. [ Links ]
10. Prevey M, Delaney R, Cramer J, Catanach L, Effect of valproate on cognitive functioning. Comparison with carbamazepine. Arch Neurol 1996; 53: 1008–16. [ Links ]
11. Schmitz. Psychiatric syndromes related to antiepiletics drugs. Epilepsia 1999; 40: S65– S70. [ Links ]
12. Reynolds EH, Trimble MR. Adverse neuropsychiatric effects of anticonvulsivants drugs. Drugs 1985; 29: 570–81. [ Links ]
13. Gigli GL, Maschio M, Diomedi M, Placidi F. Cognitive performances in newly referred patients with temporal lobe epilepsy: comparison with normal subjects in basal condition and after treatment with controlled–release carbamazepine. Int J Neusrosci 1996; 88: 97–107. [ Links ]
14. Reynolds E, Travers R. Serum anticonvulsivant concentrations in epileptic patients with mental symptoms. Br J Psychiat 1974; 124: 440–5. [ Links ]
15. Froscher W, Maier V, Laage M, Wolfersdorf M. Folates deficiency, anticonvulsivant drugs, and psychiatric morbidity. Clin Neuropharmacol 1995; 18: 165–82. [ Links ]
16. Gogging T, Gough H, Bisseassar A, Crowley M, Baker M. A comparative study of the relative effects of anticonvulsivant drugs and dietary folate on the red cell folates status of patients with epilepsy. Q J Med 1987; 65: 911–14. [ Links ]
17. Deb S. Effects of folate metabolism on the psychopathology of adults with mental retardation and epilepsy. Am J Merit Retard 1994; 98: 717–23. [ Links ]
18. Berg M, Fincham R, Ebert E, Schottelius D. Decrease of serum folates in healthy male volunteers taking phenytoin. Epilepsia 1988; 29: 67–73. [ Links ]
19. Botez M, Ypung S. Effects of anticonvulsivants treatment and low levels of folate and thiamine on amine metabolites in cerebrospinal fluid. Brain 1991; 114: 333–48. [ Links ]
20. Lewis DP, Van Dyke DC, Willhite LA, Stumbo PJ, Berg MJ. Phenytoi–folic acid interaction. Ann Pharmacoth 1995; 29: 726–35. [ Links ]
21. Hendel J, Mogens D, Lenart G, Winkel P. The effects of carabamazepine and valproate on folate metabolism in man. Acta Neurol Scand 1984; 69: 226–31. [ Links ]
22. Kishi T, Fujita N, Euguchi T, Ueda K. Mechanism for reduction of serum folate by antiepileptics drugs during prolonged therapy. J Neurol Sci 1997; 145: 109–12. [ Links ]
23. Hassing L, Wahlin A, Winbland B, Backman L. Further evidence on the effects of vitamin B12 and folate levels episodic memory functioning: a population–based study of health very old adults. Biol Psychiatrya 1999; 45: 1472–80. [ Links ]
24. Skerrit UM. A prevalence study of folate deficiency in a psychiatric in patient population. Act Psychiat Scan 1998; 97: 228–32. [ Links ]
25. Hutto BR. Folate and cobalamine in psychiatric illness. Compare Psychiatry 1997; 38: 305–14. [ Links ]
26. Muller WH, Froscher W. Neurologic and psychologic disorders in folie acid deficiency. Fortschr Neurol Psychiatr 1989; 57: 395–401. [ Links ]
27. Edeh J, Toone K. Antiepileptic therapy, folate deficiency, and psychiatric morbidity: A general practice survey. Epilepsia 1985; 26: 434–40. [ Links ]
28. Campbell N. How safe are folic acid supplements. Arch Inter Med 1996; 156: 1638–44. [ Links ]
29. Chien L, Krumdieck C, Scott C, Butterworth Harmful effect of megadose of vitamins: electroenchephalogram abnormalities and seiuzure induced for intravenous folate in drug–treated epileptics. Am J Clin Nutr 1975; 28: 51–8. [ Links ]
30. Seligmann H, Potasman I, Weller B, Schwartz M. Phenytoin–folic interaction: A lesson to be learned. Clin Neuropharm 1999; 22: 268–72. [ Links ]
31. Baylis EM, Crowley JM, Preece JM, Sylvester PE, Marks V. Influence of folic acid on blood–phenytoin levels. Lancet 1971; 1: 62–4. [ Links ]
32. Norris JW, Pratt RF, A controlled study of folie acid in epilepsy. Neurology 1971; 21: 659–64. [ Links ]
33. Bergins PS, Thompson PJ, Fish DR, Shorvon SD. The effect of seizure in memory for recently learned material. Neurology 1995; 45: 236–40. [ Links ]
34. Peña–Casanova, Guardia J, Bertrán–Serra, Maner R, Jarne A. Versión abreviada del Tes. Barcelona (I) subtest y perfiles normales. Neurología 1997; 12: 9–23. [ Links ]
35. Guardia J, Peña–Casanova J, Bertrán–Serra I, Mañero R, Meza M. Versión abreviada del Tes. Barcelona (II) puntación global normalizada. Neurología 1997; 12: 24–9. [ Links ]
36. Peña–Casanova J, Meza M, Bertrán–Serra I, Mañero R, Espel G. Versión abreviada del Tes. Barcelona(III) Validez de criterio con el ADAS–Cog. Neurología 1997; 12: 29–31. [ Links ]
37. Perrine K, Kiolbasa T. Cognitive deficits in epilepsy and contribution to psychopathology. Neurology 1991; 53(Suppl. 2): S39–S48. [ Links ]
38. Trimble MR. Cognitive hazards of seizure disorders. Epilepsia 1988; 29(Suppl. 1): S19–S24. [ Links ]
39. Carl GF, Smith DB. Interaction of phenytoin and folate in the rat. Epilepsia 1983; 24: 494–501. [ Links ]
40. Rivey MP, Schottelius DD, Berg MJ. Phenytoin–folic acid: a review. Drug Intell Clin Pharm 1984; 18: 292–301. [ Links ]
41. Lesser RP, Luder H, Wyllie E, Dinner DS, Morris H. Mental deterioration in epilepsy. Epilepsia 1986; 27: S105–S123. [ Links ]
42. Smith DB, Craft BR, Collin J, Mattson RH. Behavioral characteristic of epilepsy patients compared with normal controls. Epilepsia 1986; 27: 760–8. [ Links ]
43. Mayeux R, Bradt J, Rosen J, Benson DF. Interictal memory and language impairment in temporal lobe epilepsy. Neurology 1980; 30: 120–5. [ Links ]
44. Herman BP, Wyaler AR, Richey ET, Rea JM. Memory function and verbal learning ability in patients with complex partial seizures of temporal lobe origin. Epilepsia 1987; 28: 547–54. [ Links ]
45. Barr WB, Consortium BE. The right temporal lobe and memory: a critical reexamination. J Int Neuropsychol Soc 1995; 1: 139–49. [ Links ]
46. Dodrill CB. Correlates of generalized tonic–clonic seizure with intellectual, neuropsychological emotional and social function in patients with epilepsy. Epilepsia 1986; 27: 399–411. [ Links ]
47. Butlin AT, Danta G, Cook ML. Anticonvulsivants, folie acid and memory dysfunction in epileptic. Clin Exp Neurol 1984; 20: 57–62. [ Links ]
48. Hassing L, Wahlin A, Winblad B, Backman L. Further evidence on the effects of vitamin B12, and folate levels on episodic memory functioning: a population–based study of healthy very old adults. Biol Psychiatry 1999; 45: 1472–80. [ Links ]
49. Nilsson K, Gustafson L, Hultberg B. Improvement of cognitive functions after cobalamin/folate supplementation in elderly patients with dementia and elevated plasma homocysteine. Int J Geriatr Psychiatry 2001; 16: 609–14. [ Links ]
50. Calandre EP, Jorde F, Rodriguez E. Serum folate concentrations in epileptic patients treated with carbamazepine and val–proate. Epilepsia 1991; 32: SI: S75. [ Links ]
51. Meador K, Loring D. Cognitive effect of antiepileptic drugs. En Devinky O, Theodore W (Eds.). Epilepsy and behavior. New York: Wiley–Liss; 1991, pp. 151–70. [ Links ]














