Introducción
El tratamiento de la tuberculosis multifarmacorresistente (TB-MDR) tradicionalmente ha sido poco exitoso (tasa global de éxito: 54% en 2016).1 Esto se debe a múltiples factores que incluyen el diagnóstico tardío, la pérdida al seguimiento, las reacciones adversas a los fármacos antituberculosis (RAFA) y la efectividad del régimen estandarizado.
El esquema convencional con duración de 20-24 meses incluye un fármaco inyectable de segunda línea (ISL), una fluoroquinolona (FQ; habitualmente levofloxacino [Lfx]), etionamida/protionamida (Eto/Pto), cicloserina (Cs) y pirazinamida (Z). La Eto/Pto y la Cs son en general bacteriostáticos (la Pto puede ser débilmente bactericida a dosis altas) y existe muy poca evidencia que apoye la superioridad de uno de estos dos últimos fármacos sobre el otro.2 Es evidente que el esquema podría beneficiarse con la inclusión de otros fármacos con mayor efectividad que la Eto/Pto o la Cs.
El linezolid (LZD) es un antibiótico sintético perteneciente a la clase de las oxazolidonas que actúa inhibiendo la síntesis proteica de Mycobacterium tuberculosis (M. tuberculosis). El fármaco ha demostrado gran efectividad en el tratamiento de la TB extremadamente resistente (TB-XDR), a pesar de que ésta se trata de una forma de TB con un patrón de resistencia más complejo que el de la TB-MDR,3,4 cuando no sólo se ha perdido la oportunidad de utilizar rifampicina, sino también las FQ. Los principales inconvenientes para su uso ha sido su elevado costo y su toxicidad, especialmente la aparición de neuropatía y anemia.5
A continuación, describimos nuestra experiencia con el uso de LZD y la presencia de RAFA en una serie de casos con TB-MDR, micobacteriosis o RAFA, que obligaron a modificar el esquema terapéutico, que fueron tratados en la Clínica de Tuberculosis del Hospital General Tijuana.
Pacientes y métodos
En una revisión retrospectiva de los archivos de la clínica que incluyó 745 expedientes se documentan 11 pacientes que recibieron LZD (1.47%): siete pacientes con TB-MDR o resistencia a rifampicina (RR), uno con resistencia a isoniacida que presentó RAFA a varios fármacos antituberculosis y que requirió cambio de esquema, y tres pacientes con micobacteriosis. Los pacientes recibieron o se encuentran aún recibiendo LZD como parte de su esquema (Tabla 1).
Tabla 1: Características de los pacientes tratados con linezolid.
| No. | Edad | Sexo | Perfil de resistencia | Estado actual | RAFA | Dosis de linezolid |
|---|---|---|---|---|---|---|
| 1 | 47 | Masculino | R, H, Z, E | En tratamiento | No | 600 mg |
| 2 | 40 | Masculino | R, H, E, RFB | En tratamiento | No | 600 mg |
| 3 | 20 | Masculino | R, H, E, S | Curación | No | 600 mg |
| 4 | 21 | Femenino | R | Curación | No | 600 mg |
| 5 | 13 | Masculino | R, H, S | Curación | No | 600 mg |
| 6 | 52 | Masculino | R, H | Defunción | No | 600 mg |
| 7 | 50 | Masculino | R, H, RFB | Abandono | No | 600 mg |
| 8 | 16 | Masculino | H* | Curación | Anemia | 600 mg |
| 9 | 47 | Masculino | MNT | Curación | No | 600 mg |
| 10 | 41 | Masculino | MNT | Curación | No | 600 mg |
| 11 | 43 | Masculino | MNT | Curación | No | 600 mg |
R = rifampicina; H = isoniazida; Z = pirazinamida; E = etambutol; S = estreptomicina; RFB = rifabutina; H* = paciente tratado como MDR por RAFA; MNT = micobacteria no tuberculosa.
Resultados
Diez de ellos eran varones, con una edad al inicio del tratamiento de 32.8 ± 15.9 años; los pacientes con TB-MDR o RR habían recibido en promedio LZD por 523 ± 95.1 días (mediana 424.5 días). Todos los pacientes habían convertido su cultivo a los 92.2 ± 48.7 días. La mayoría de los pacientes con TB-MDR presentaba extensas lesiones pulmonares a su ingreso a tratamiento (Figura 1).
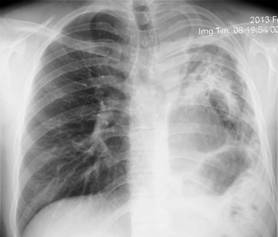
Figura 1: Radiografía de tórax del paciente número 3 (Tabla 1) que muestra extensas lesiones en pulmón izquierdo.
Un paciente con RAFA y tres pacientes con micobacteriosis (dos con M. abscessus complex y uno con M. gordonae) recibieron LZD por 182.5 ± 42.4 días (rango 121 a 268 días).
De los 11 pacientes recibiendo LZD, sólo uno desarrolló anemia (9%); no fue necesario interrumpir el tratamiento pues se añadió tratamiento con eritropoyetina, corrigiéndose las cifras de hemoglobina. No se presentaron casos de neuropatía u otros efectos adversos y ninguno presentó alguna RAFA que ameritara modificación del régimen o suspensión del medicamento.
Discusión
El LZD se ha utilizado poco en nuestro país para el tratamiento de la TB-MDR por tres razones principales:
Las guías internacionales lo habían recomendado básicamente para pacientes con TB-XDR y pre-XDR;
El perfil de toxicidad del fármaco, y
El costo del medicamento.
A raíz de la publicación de la guía OMS 2016 para TB-MDR,6 que incluye ya al LZD en el grupo C junto con la clofazimina (Cfz), la Eto/Pto y la Cs, este fármaco ya forma parte de las opciones de tratamiento para la TB-MDR; la recomendación vigente es seleccionar una FQ (Grupo A), un ISL (Grupo B) y dos fármacos del grupo C más la Z.
Una reciente revisión sistemática y metaanálisis recuperó 23 estudios realizados en 14 países con un total de 507 pacientes tratados con LZD demostrando la eficacia de este fármaco. La tasa de éxito global fue de 77.36% (IC95% = 71.38-82.83%) y la conversión del cultivo se logró en el 88.45% (IC95% = 83.82-92.38) de los pacientes, sin que estas dos variables estuvieran relacionadas con la dosis de LZD (600 mg vs. > 600 mg).7
El costo comercial del LZD sigue siendo muy elevado (actualmente en México, el equivalente a $48 USD por cada Tableta); sin embargo, ahora es posible adquirirlo a un precio mucho más accesible ($1.20 USD por cada Tableta) a través de la Global Drug Facility (GDF) de la organización StopTB,8 como lo hace ya la mayoría de los países de Latinoamérica, por lo que el argumento del costo ya no debe ser considerado como válido (sobre todo al restarle el costo del medicamento que va a substituir).
El perfil de toxicidad de LZD (especialmente neuropatía y anemia) ha sido motivo de preocupación; sin embargo, los estudios iniciales que reportaron altas tasas de RAFA utilizaban dosis de LZD hasta de 1,200 mg;9 existe evidencia que muestra que la tasa de reacciones adversas es mayor cuando se utilizan dosis de LZD superiores a 600 mg diarios.10 En especial se ha reportado una frecuencia significativamente mayor de mielosupresión con dosis de LZD > 600 mg.7
La decisión sobre si utilizar Eto/Pto, Cs o LZD para completar un esquema con cinco fármacos va a depender de la eficacia del medicamento, la probabilidad de RAFA y de la resistencia cruzada entre los fármacos. Eto/Pto provocan importante toxicidad gastrointestinal, manifestada por náusea y vómito, motivo frecuente de pérdida de seguimiento; con menor frecuencia pueden provocar adicionalmente hipotiroidismo. Además, las mutaciones en la región inhA del M. tuberculosis confieren resistencia a Eto/Pto así como resistencia de bajo grado a isoniacida (H). Por el contrario, a la fecha no se ha reportado resistencia cruzada entre LZD y otras clases de fármacos antituberculosis.11 La Cs se asocia a toxicidad neuropsiquiátrica significativa y debe evitarse en pacientes con historia de depresión y otros trastornos de salud mental.12 En el caso de la Z, la OMS6 recomienda su uso aun cuando la prueba de sensibilidad se reporte con resistencia al fármaco, debido a la pobre reproducibilidad del ensayo.
La administración simultánea de LZD con agentes serotoninérgicos, es decir, antidepresivos como los inhibidores selectivos de la recaptación de serotonina (ISRS) que incluyen, por ejemplo, el citalopram, el escitalopram, la fluoxetina, la paroxetina y la sertralina, puede provocar reacciones graves (a veces mortales) como el síndrome de serotonina o reacciones similares al síndrome neuroléptico maligno.13
Limitaciones del estudio
Nuestro estudio tiene fortalezas y limitaciones, la principal fortaleza es que representa el trabajo clínico cotidiano en un centro de referencia para tuberculosis farmacorresistente y el apego a las Guías Internacionales para el Tratamiento de la TB-MDR. Las principales limitaciones consisten en el carácter retrospectivo del estudio y el que no se utilizó de manera rutinaria un sistema internacional en la clasificación de las RAFA.
Conclusión
De acuerdo con las recomendaciones más recientes de la OMS, el LZD es un fármaco que debe considerarse para todos los regímenes de pacientes con TB-MDR y no sólo para pacientes con TB-XDR o pre-XDR. En nuestra limitada experiencia las RAFA no fueron frecuentes con el uso del LZD (9%) y no fue necesario en ningún caso modificar el esquema terapéutico. Para reducir el riesgo de toxicidad hematológica se debe administrar LZD una vez al día a 600 mg por día. En caso de anemia se puede utilizar eritropoyetina después de consultarlo con hematología. Los pacientes deben ser monitoreados de cerca para detectar el desarrollo de toxicidad neurológica o hematológica.











 text new page (beta)
text new page (beta)


