INTRODUCCIÓN
El virus del papiloma humano (VPH) representa un problema de salud pública en México debido a que es el principal factor de riesgo para cáncer cervicouterino y en las últimas décadas se ha visto un aumento en la detección de este virus, no solo en pacientes adultas, sino en adolescentes1. De acuerdo con autores mexicanos hasta el 40.9% de las mujeres con reporte de citología normal pueden tener VPH, mientras que, en aquellas con una lesión intraepitelial escamosa de alto grado, la prevalencia logra alcanzar el 100% 2. Incluso el 46% de las embarazadas presentan una infección por VPH en el tercer trimestre de gestación3. A pesar de que aproximadamente el 90% de estas infecciones se resuelven de manera espontánea, hay tipos de VPH que se reconocen con poder oncogénico como el 16, 18, 31, 33, 35, 39, 45, 51, 2, 56, 58, 59, 66 y 68, mientras que entre los de bajo riesgo se encuentran el 6, 11, 40, 42, 43, 44, 54, 61, 62, 67, 81, 83 y 89.4
El tumor de Buschke-Löwenstein, también denominado condiloma acuminado gigante fue descrito por primera vez por Abraham Buschke y Ludwig Löwenstein, en 1925, en pacientes masculinos; no obstante, fue hasta 1969 cuando se observó en mujeres5. Es una lesión verrugosa, papilomatosa, de crecimiento lento, pero agresivo, con ulceraciones y áreas necróticas en el área genital6. Se transmite por vía sexual y se asocia principalmente con los subtipos 6 y 11 de VPH, aunque se han señalado otros factores de riesgo como inmunosupresión, infecciones por VIH, múltiples parejas sexuales, irritación crónica e incluso pobre higiene personal7.
Se estima que tiene una incidencia del 0.1% en la población; sin embargo, en las mujeres embarazadas se han publicado solo 6 casos8. La infección por VPH puede transmitirse al producto de forma vertical por medio del canal de parto o durante la ruptura de membranas, inclusive representa un factor de riesgo para papilomatosis laríngea juvenil8,9. Se ha reportado que la transmisión fetal consigue alcanzar hasta un 20%10.
PRESENTACIÓN DE CASO
Paciente primigesta de 14 años, con un embarazo de 21 semanas de gestación, quien acudió a urgencias ginecología del Hospital Juárez de México, por una masa dolorosa en región perineal. Refiere que 5 meses previos presentó una lesión redondeada, no dolorosa, de aproximadamente 1 × 1 cm en región perineal. Acudió con un médico particular quien indicó antibióticos no especificados, sin mejoría. Dicha tumoración aumentó de tamaño hasta impedir la sedestación y parcialmente la deambulación. A la exploración física se encontraron en región perineal 2 lesiones exofíticas, coliformes, irregulares, ulceradas de aproximadamente 20 × 10 cm con presencia de secreción amarillenta fétida, sugerentes de tumor de Buschke-Löwenstein (figura 1). Se realizó un ultrasonido obstétrico reportado sin alteraciones, se tomaron estudios paraclínicos que incluyeron panel viral, los cuales resultaron negativos; mientras que, el exudado vaginal mostró Mycoplasma hominis y Ureaplasma parvum para lo que se administró tratamiento. Se decidió realizar resección con cierre de la herida bajo bloqueo peridural, la escisión fue total, y no requirió de reconstrucción (figuras 2 y 3); no obstante, 5 días después se realizó un lavado de herida quirúrgica por dehiscencia y se optó por cierre por segunda intención. Se colocaron parches de hidrogel para inducir la granulación del tejido, los cuales se cambiaban cada 5 días (figura 4). Por parte de patología se evidenció un condiloma acuminado gigante sin lesión en borde quirúrgico. La prueba por PCR detectó el genotipo 53 del virus de papiloma humano. La paciente refiere que recibió 2 dosis de la vacuna contra VPH a los 12 años de edad en la escuela secundaria, negó comorbilidades asociadas. Después de 12 semanas se presentó reepitelización completa de la herida (figura 5).
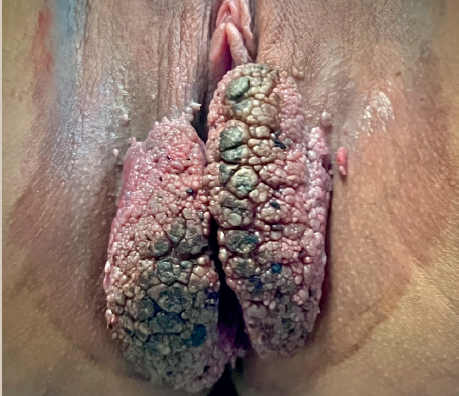
Imágenes: Sotres Guerrero et al.
Figura 1 Tumor de Buschke-Löwenstein. Se observan dos lesiones exofíticas, coliformes, irregulares, ulceradas con secreción amarillenta fétida en labios mayores y menores, que se extienden hacia la horquilla vulvar.
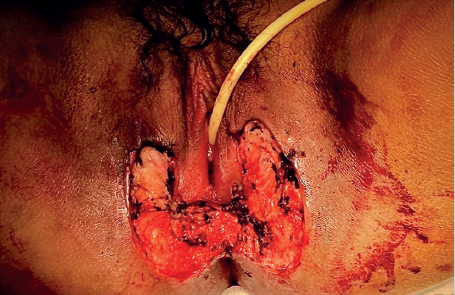
Imágenes: Sotres Guerrero et al.
Figura 2 Se llevó a cabo una escisión total hasta tejido celular subcutáneo con bordes libres de tumor.

Imágenes: Sotres Guerrero et al.
Figura 3 Se realizó cierre en un plano con sutura absorbible, liberando tensión con la disección de los bordes a afrontar.
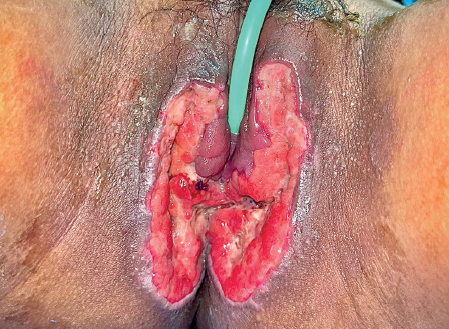
Imágenes: Sotres Guerrero et al.
Figura 4 Evolución 2 semanas después de lavado quirúrgico y debridación. Se colocaron parches de hidrogel para inducir la granulación del tejido.
DISCUSIÓN
El tumor de Buschke-Löwenstein es una lesión sumamente infrecuente con una relación de hasta 2.7 a 1 en hombres y mujeres11. Este caso es notorio debido a que se presentó en una adolescente gestante en la que se detectó el subtipo 53 del VPH. Se ha descrito que el VPH se aloja en las células basales de la epidermis por microabrasiones que generan inflamación crónica. Este virus permanece indetectable por largos periodos gracias a los genes E6 y E7 que afectan a las células presentadoras de antígenos12. El resultado es un mayor estrés oxidante que daña al ADN de las células infectadas y las hace susceptibles de malignizarse13. En el embarazo se dan cambios en los genitales externos que, sumados a los efectos inmunológicos de este, facilitan la replicación del VPH3.
Los pacientes refieren placas keratósicas que progresan de manera lenta a masas exofíticas, coliformes, ulceradas que despiden un olor fétido, especialmente en región vulvar; no obstante, también puede afectar la región anorectal14. Histológicamente, se observa epitelio hiperplásico bien diferenciado con hiper o paraqueratosis, y papilomatosis con la membrana basal intacta. Asimismo, se aprecian coilocitos que son característicos de la lesión por VPH e incluso se han reportado casos de atipia15.
Entre las opciones terapéuticas se reportan la escisional, la tópica, y la sistémica; sin embargo, en la gestación se vuelve más complicado. Se debe considerar el tamaño, la localización, la afección de tejidos vecinos, al igual que los abordajes previos16. La escisión con o sin reconstrucción con injerto es la terapia más descrita, con una tasa de éxito de hasta 90%; pese a esto, no existe un consenso en cuanto al tratamiento13. La infección por VPH requiere de un tejido intacto o en proceso de reparación, además de un ambiente proinflamatorio, lo que apoya como primera línea la resección amplia de la lesión, con bordes libres de tumor, con cierre por segunda intención en lugar de reconstrucción con mallas o tejidos. El VPH se adhiere al epitelio escamoso estratificado, por lo que en un cierre por segunda intención, el riesgo de recurrencias es menor, dado que solo hay fibrosis, no así en una reconstrucción17. En un caso de condiloma acuminado gigante en una mujer gestante, se realizó vulvectomía parcial con adecuados resultados y sin recurrencia 6 meses después5.
Otros abordajes durante el embarazo son: el uso de ácido tricloroacético, crioterapia, terapia con láser o electrodesecación10. Se encuentra descrita la resección con electrocauterio para reducción de volumen, seguido de un rasurado de la tumoración a fin de preservar la piel y las terminaciones nerviosas. En una publicación en que utilizaron este método, posterior al evento quirúrgico se colocó podofilina y crioterapia, con el objeto de disminuir el riesgo de recurrencias18. Asimismo, se han reportado manejos con terapia fotodinámica o una combinación de cirugía con escisión-vaporización y cirugía láser con dióxido de carbono, ya que conlleva mayor hemostasia y control de lesión de tejidos14.
Con respecto a la terapia tópica, esta se ha combinado con crioterapia (óxido nítrico o nitrógeno líquido) con respuesta favorables para lesiones pequeñas9. El uso de podofilina sola ha mostrado pobres resultados19. El imiquimod, un modulador de la respuesta inmune, ha contribuido al tratamiento, y se mencionan casos de regresión completa, incluso en niños16. No obstante, ninguno de estos compuestos es seguro durante el embarazo. Se encuentran publicados otros abordajes con quimioterapia con 5-fluoracilo y radiación; pese a que, esta última puede ocasionar una transformación anaplásica del tumor16,20. Los interferones, por sus acciones antivirales y antiproliferativas, han sido utilizados a manera de inyecciones locales con resultados positivos en cuanto a reducción del tamaño tumoral21. Otras sustancias que comprenden el dióxido de carbón, el argón y la terapia con láser se han empleado como recursos en el abordaje de las recurrencias9.
A pesar de que el condiloma acuminado gigante es considerado benigno, se han reportado tasas de malignidad de 30 a 56%, por lo que es imprescindible reforzar las medidas de tamizaje y prevención del VPH9. Existen 3 vacunas aprobadas por la Organización Mundial de la Salud (OMS) contra el VPH: bivalente (Cervarix contra VPH 16, 18), tetravalente (Gardasil para VPH 6, 11, 16, 18), y nonavalente (Gardasil-9 frente a VPH 6, 11, 16, 18, 31, 33, 45, 52, 58)22. La OMS recomienda emplear un esquema de 2 dosis para niñas menores de 15 años de edad, a los 0 y 6 meses, así como 3 dosis en mujeres mayores de 15 años o inmunodeprimidas; sin embargo, en el 2022 emitió un comunicado en que un grupo de expertos consideran que una dosis otorga protección similar al esquema de 2 dosis en mujeres de 9 a 20 años, mientras que en aquellas mayores de 21 años se sugieren 2 dosis con un intervalo de 6 meses22,23.
En nuestro país, se aplica un esquema de 2 dosis con un intervalo de 0 y 6 meses para niñas de quinto año de primaria y de 11 años de edad no escolarizadas y un esquema de 3 dosis en mujeres de 11 a 49 años, con VIH con vacuna monovalente y/o tetravalente22. Se ha reportado que la vacunación es capaz de disminuir las verrugas genitales en un 31-93%, las lesiones NIC 2-3 en un 31-85% y, en general, las infecciones por VPH, específicas de cada vacuna, hasta en un 66 a 90%. En países en vías de desarrollo, como en la India, se ha demostrado una eficacia de 30.1% y 93.3% con la vacuna Gardasil con 2 y 3 dosis, respectivamente, y hasta 95.4% con la misma en monodosis en niñas de 10 a 18 años de edad, después de 9 años de seguimiento24. Incluso existe una protección cruzada contra los tipos de VPH 31, 33, 45, 52 y 58. La eficacia en mujeres mayores de 25 años es menor, pese a esto, se ha señalado que 3 dosis de vacuna bivalente o tetravalente otorgan una protección similar al esquema de 3 dosis en menores de 25 años para VPH 16 y 18.25
Con relación a la seguridad, las vacunas bivalente y tetravalente han mostrado efectos adversos leves como dolor e inflamación en el sitio de aplicación, cefalea, mialgias, fiebre26.
CONCLUSIÓN
El tumor de Buschke-Löwenstein es una entidad con una incidencia muy baja, se presenta sobre todo entre la cuarta y quinta décadas de la vida. No existe un consenso en cuanto al manejo, puesto que son lesiones que alcanzan grandes dimensiones y a la alta tasa de recurrencia. Su presencia durante el embarazo presenta un gran reto; sin embargo, en los pocos casos publicados, la escisión con márgenes amplios es la técnica más descrita. En artículos recientes se ha demostrado que el cierre por segunda intención posterior al evento quirúrgico disminuye el riesgo de recurrencias. Debido a la morbilidad y a un porcentaje de malignidad de hasta el 56%, es indispensable reforzar las medidas de prevención del VPH humano, tales como: la vacunación, la educación sexual, el tamizaje y el tratamiento oportuno.











 nueva página del texto (beta)
nueva página del texto (beta)





