EL ENDOTELIO SANO
Generalidades del endotelio
El endotelio está formado por una capa única de células aplanadas llamadas células endoteliales que revisten la parte interna de los vasos sanguíneos, los vasos linfáticos y el corazón; forma un epitelio altamente especializado. Wilheim His en 1865 acuñó el término endotelio, al aludir a su localización, por su etimología de raíces griegas, endo: interno o dentro; telio: a partir del epitelio1,2. En un ser humano de talla promedio se calcula que el endotelio está formado por aproximadamente 60 billones de células, que pesan en total 1 kg y cubren una superficie aproximada de 4000 a 7000 m2-5. Esta gran extensión se debe a que, en casi todos los órganos y tejidos existen vasos sanguíneos, así que el endotelio vascular es ubicuo en todo el cuerpo1. En la figura 1 se observa el endotelio en un corte histológico de una arteria muscular.

Foto: González Villalva et al.
Figura 1 Fotomicrografía de un corte histológico de arteria de ratón teñido con H-E, en la cual se observan células endoteliales señaladas con puntas de flecha. Se observan aplanadas, con un núcleo alargado y muy poco citoplasma.
Además de la función de barrera, se considera un órgano capaz de regular el tono vascular, el flujo de sangre local, el intercambio de sustancias, la respuesta inflamatoria y la hemostasia. Cabe mencionar también que estas funciones son muy heterogéneas y la expresión de genes también, que dependen de su localización5. En esta revisión se considerará únicamente al endotelio vascular.
A pesar de su heterogeneidad, el endotelio normal en cualquier localización está quiescente o “en reposo”, esto es: no prolifera, no migra y no expresa o expresa mínimamente marcadores de adhesión. Sin embargo, el endotelio en reposo no está realmente inactivo, pues está sintetizando una gran cantidad de moléculas que le permiten cumplir todas sus funciones. Para permanecer quiescente, requiere que la vía de señalización del factor de crecimiento transformante beta (TGF-ß) se encuentre inhibida por medio de diferentes vías de señalización que mantienen esta inhibición. De hecho, si la célula endotelial es más susceptible a activar la vía del TGF-ß hay mayor posibilidad de desarrollar ateroesclerosis5.
Morfología del endotelio sano
Las células endoteliales tienen su característica forma aplanada que depende del citoesqueleto, principalmente de los microfilamentos o filamentos de actina, los cuales están relacionados física y funcionalmente con la glucocálix y con las uniones intercelulares6. Estas células miden aproximadamente 30-50 µm de longitud, 10-30 µm de anchura y 0.1-10 µm de espesor. Tienen polaridad, su superficie luminal es la que está en contacto con la sangre y su superficie basolateral, se encuentra limitada por la membrana basal, que también está constituida por glucoproteínas que las mismas células endoteliales producen7. Sus organelos están principalmente en la zona paranuclear: complejo de Golgi, retículo endoplasmático, mitocondrias, endosomas y lisosomas están presentes en un número variable de copias en relación con el estado funcional de la célula8.
Poseen estructuras subcelulares específicas: caveolas, fenestras, canales transendoteliales y orgánulos vesículo-vacuolares. La descripción morfológica de dichas estructuras se revisa detalladamente por Stan (2007) y se puntualizan algunos puntos a continuación1. Las caveolas o vesículas plasmalémicas son invaginaciones esféricas de la membrana plasmática de forma y tamaño regulares (~70 nm de diámetro exterior medio). Aparecen solas o en racimos en forma de uva adheridos a ambos lados del endotelio y pueden o no tener diafragma estomático, el cual es una barrera proteica delgada (~5-7 nm). Son mucho más abundantes en los capilares comparados con otros tipos de vasos9. Las fenestras endoteliales son ventanas circulares que atraviesan el cuerpo celular. Las fenestras individuales tienen un diámetro constante (~62-68 nm) y están provistas de un diafragma, excepto en los capilares del glomérulo renal. Los canales transendoteliales son poros que atraviesan el cuerpo celular endotelial, desde la luz hasta la porción basal, y parecen estar formados por la fusión de cadenas de 2 a 4 caveolas. Son resultado de la transcitosis, es decir, del paso de moléculas de un lado al otro del endotelio1.
Una característica del endotelio no capilar, sobre todo del endotelio arterial, es la presencia de los cuerpos de Weibel-Palade (WPBs), que son gránulos en forma de vara unidos a la membrana, de 3 a 4 mm de longitud. Los WPBs inmaduros contienen al factor de von Willebrand (VWF), sintetizado en retículo endoplásmico rugoso y aparato de Golgi, donde se liberan al citoplasma. Los WPB pueden contener citocinas y además reciben otras moléculas mediante endosomas, por lo que son considerados “organelos relacionados con los lisosomas” (LORs). El VWF al ser liberado forma fibras que permiten la adhesión de las plaquetas a la colágena y, por otro lado, permiten la unión del factor VIII de la coagulación, lo que impide su degradación y favorece sus niveles normales en sangre8,10.
Función de barrera y permeabilidad
El endotelio mantiene la integridad vascular, forma una barrera semipermeable que regula la extravasación de líquido y de los componentes de la sangre, media la transferencia de iones, solutos, fluidos, oxígeno y nutrientes entre la sangre y los compartimentos intersticiales y tejidos adyacentes3,11,12.
La permeabilidad vascular es una función que responde a características del tejido u órgano donde se encuentre. El endotelio tiene diferencias que dependen de su localización; por ejemplo, el endotelio de los vasos sanguíneos de gran calibre tiene muy baja permeabilidad ya que su función es conducir la sangre. También el endotelio cerebral tiene baja permeabilidad en comparación con el endotelio del riñón que presenta una gran permeabilidad para el intercambio de sustancias7. En este sentido, el endotelio puede ser 1) continuo, el cual se caracteriza por células unidas entre sí y rodeadas por una membrana basal continua; se encuentra en arterias y venas, así como en capilares del cerebro, piel, corazón y pulmones; 2) fenestrado, que tiene ventanas o fenestras que se describieron previamente y se encuentra en glándulas exocrinas y endocrinas, mucosa gástrica e intestinal, y 3) discontinuo, el cual se caracteriza por la presencia de grandes poros y una membrana basal subyacente discontinua. Se encuentra en lechos vasculares sinusoidales en hígado, bazo y médula ósea5,9,13,14. En la figura 2 se observan las características de estos tipos de endotelio. El endotelio que tiene una mayor permeabilidad es el que se encuentra en capilares sinusoidales en hígado, capilares fenestrados sin diafragma en riñón, así como el endotelio de las vénulas que son los vasos que se especializan en la migración o diapédesis de los leucocitos12.
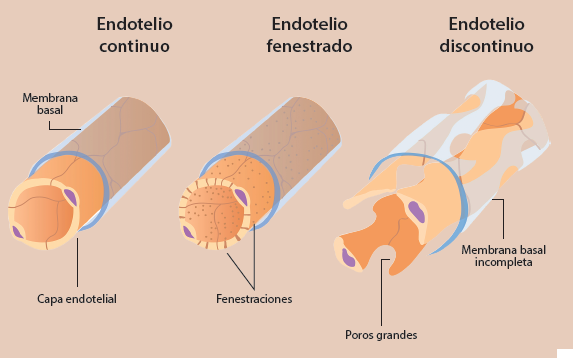
Figura 2 Tipos de endotelio en los capilares sanguíneos. Se observa el endotelio continuo, fenestrado que tiene poros pequeños y el discontinuo que presenta grandes poros, por lo que es el más permeable de todos.
En la función de barrera juega un papel importante el glucocálix, formado por glucoproteínas, glucosaminoglucanos y proteoglucanos que otorgan una carga negativa que evita el contacto de las células sanguíneas con el endotelio y repele moléculas mayores de 70 kD como la albúmina14. Las uniones intercelulares también forman parte de la función de barrera y son: 1) ocluyentes, que son importantes en las barreras; por ejemplo, la hematoencefálica, donde se encuentran zónulas ocluyentes con sus proteínas transmembranales ocludinas y claudinas asociadas con proteínas zonula ocluddens (ZO), junction-associated molecules (JAMs) y a filamentos de actina15; 2) adherentes, que mantienen la integridad de la capa endotelial, la proteína transmembranal VE-cadherina es fundamental y se une, a través de las cateninas a los filamentos de actina del citoesqueleto16, y 3) las uniones comunicantes (nexo o tipo GAP), formadas por proteínas conexinas que integran canales que permiten el paso de iones y moléculas entre las células endoteliales.
Todas estas uniones se regulan entre sí; por ejemplo, las uniones ocluyentes influyen en la estabilidad de las uniones adherentes a través de la proteína ZO-1 que promueve la unión de la VE-cadherina al citoesqueleto; por otro lado, las uniones adherentes promueven la estabilidad de las ocluyentes porque la VE-cadherina induce la expresión de la claudina 5 (Cldn5). Además, los cambios en conexina 43 se asocian a disminución en la VE-cadherina12.
Regulación del tono vascular
El endotelio mantiene la homeostasis vascular, al mantener el balance entre vasodilatación y vasoconstricción. El endotelio sano tiene un fenotipo vasodilatador, en el cual hay síntesis de óxido nítrico (NO) y prostaciclina (PGI2) y muy poca concentración de especies reactivas de oxígeno (ROS). El glucocálix es capaz de detectar los estímulos mecánicos, como las características del flujo sanguíneo, para que el endotelio sintetice y libere vasodilatadores o vasoconstrictores15. El NO se sintetiza a partir de la L-arginina y el cofactor NADPH y esta reacción es catalizada por la isoforma óxido nítrico sintetasa endotelial (eNOS) que es dependiente de Ca2+. Por su naturaleza gaseosa, el NO puede difundir entre las células y tejidos para llegar a la capa media de los vasos sanguíneos y ejercer su efecto sobre el músculo liso. En las células musculares aumenta el GMPc que a su vez activa una cascada de señalización para favorecer la vasodilatación9. Aunque la eNOS es la isoforma que constitutivamente expresan las células endoteliales, las citocinas proinflamatorias propician que el endotelio exprese la isoforma óxido nítrico sintetasa inducible, iNOS no dependiente de Ca2+, para completar el incremento en la producción de NO que necesita el organismo17.
La PGI2 es otra de las moléculas vasodilatadoras que produce el endotelio. Es derivada del ácido araquidónico y se producen por acción de las enzimas ciclooxigenasas 1 y 2. Actúa a través de su receptor acoplado a proteínas G, que aumenta el adenosin monofosfato cíclico (AMPc), activa a la proteína cinasa A (PKA) que tiene como consecuencia la inhibición de la proteína cinasa de cadena ligera de la miosina, con lo que previene la vasoconstricción y estimula la relajación del músculo liso vascular y la vasodilatación7.
El endotelio sintetiza vasoconstrictores como la endotelina-1 (ET-1), prostaglandina H2 y tromboxano A2 (TXA2)7. Sobre todo, en arterias pequeñas y arteriolas, particularmente en pulmón produce la enzima convertidora de angiotensina (ACE), parte del sistema renina-angiotensina, que transforma a la angiotensina I en angiotensina II, importante en la regulación del tono vascular9. También el endotelio produce ACE2, que a diferencia del ACE produce la molécula angiotensina (1-7) que tiene un efecto vasodilatador y antiinflamatorio. La ACE2 últimamente ha cobrado mayor importancia por ser la molécula a través de la cual ingresan los coronavirus, específicamente el SARS-CoV y SARS-CoV-29. En la pandemia de la enfermedad por coronavirus (COVID-19), se llegó a la conclusión de que las complicaciones inflamatorias y trombóticas eran causadas en gran parte por la endotelitis, disfunción y muerte endotelial18.
Función en la inflamación
El endotelio en condiciones fisiológicas tiene un efecto predominante antiinflamatorio. El NO tiene efectos antiinflamatorios, reduce la expresión de mediadores inflamatorios y de moléculas de adhesión en la superficie de las células endoteliales. Posteriormente se hablará de la expresión de estas moléculas que son importantes para la respuesta inflamatoria. Otra función del NO es mantener estable la unión entre el factor nuclear kappaB (NF-kB) y su inhibidor Ikß. Con esta unión se mantiene al NF-kB secuestrado en el citoplasma del endotelio y se puede evitar la inflamación4.
Como parte del sistema inmunitario las células endoteliales permiten el transporte de las células inmunitarias móviles y forman una barrera mecánica contra los posibles patógenos; además, secretan quimiocinas, interleucinas, interferones y factores de crecimiento; organizan el reclutamiento de las células inmunitarias y regulan la extravasación de los leucocitos en los lugares de inflamación mediante la expresión inducible de moléculas de adhesión que forman parte del glucocálix. De hecho, los 4 signos clásicos de inflamación (dolor, calor, rubor y tumor) son reacciones mediadas por las células endoteliales a través de cambios locales en la función de barrera de los vasos. Las células endoteliales no son células inmunitarias en el sentido clásico (porque no pueden matar, fagocitar ni producir anticuerpos) pero en esencia coordinan la respuesta inmunitaria19.
Las células endoteliales expresan moléculas del complejo mayor de histocompatibilidad tipo I (MHCI) y receptores de reconocimiento de patrones (PPR) para detectar patrones de moléculas asociadas a patógenos (PAMP). Incluso, se ha reportado que pueden expresar MHCII para presentar antígenos ante la presencia de patógenos9.
Función en la hemostasia
El endotelio mantiene la hemostasia, forma una capa que no es adherente, previniendo la activación plaquetaria y el inicio de la coagulación4, esto es consecuencia de la producción de moléculas antitrombóticas y fibrinolíticas que permiten mantener la sangre fluida19.
El endotelio sano produce NO, que además de ser vasodilatador, inhibe la adhesión y agregación plaquetaria. Difunde hacia las plaquetas circulantes y activa a la guanilato-ciclasa (GC), que convierte el GTP a GMPc, el cual impide el aumento del calcio intracelular, que es indispensable para la activación plaquetaria. La PGI2, como se mencionó anteriormente, inhibe también la movilización de calcio e impide la activación y degranulación plaquetaria. Ambas moléculas pueden actuar de manera independiente o hacen sinergia para impedir que las plaquetas respondan a estímulos cuando el endotelio se encuentra intacto4.
El adenosín trifosfato (ATP) y adenosín difosfato (ADP) son agonistas plaquetarios liberados por las plaquetas activadas y también por el endotelio en bajas dosis, que incrementan en condiciones de daño vascular. El endotelio regula la acción de estos activadores plaquetarios a través de una enzima membranal, la ectonucleósido trifosfato difosfohidrolasa 1 o ENTPDasa1/CD 39, capaz de degradar el ATP y ADP a adenosina, con lo que impide la activación y agregación plaquetaria4,7.
La trombina es el factor más importante de la coagulación, ya que es un activador plaquetario y es indispensable para la generación de fibrina a partir del fibrinógeno (factor I) que hace que el coágulo sea estable20. El endotelio puede inhibir a la trombina a través de la síntesis constitutiva de trombomodulina (TM), que es un receptor transmembranal para la trombina que disminuye su concentración y, además, el complejo trombina-trombomodulina activa a la proteína C que a su vez se une a la proteína S, ambas producidas en el hígado, con efecto anticoagulante porque inhiben a los factores Va y VIIIa4,20.
La antitrombina III (ATIII) es un anticoagulante producido por el hígado, pero es en la superficie endotelial donde se enlaza a proteoglucanos que contienen heparán sulfato y ahí puede formar complejos con la trombina (factor II) y con otros factores de la coagulación e inhibir su función7.
El factor tisular es una proteína membranal importante para el inicio de la coagulación, que se expresa en diferentes tejidos incluidas las células endoteliales. El endotelio sano produce el inhibidor del factor tisular (TFI) que impide este efecto procoagulante4. Las células endoteliales también sintetizan factores fibrinolíticos, como el activador tisular del plasminógeno (t-PA), para generar la plasmina, enzima que disuelve el coágulo al degradar la malla de fibrina3,14. De esta forma, el endotelio sano tiene función predominantemente antitrombótica y trombolítica. En la figura 3, es posible identificar algunas moléculas importantes para las funciones del endotelio sano.
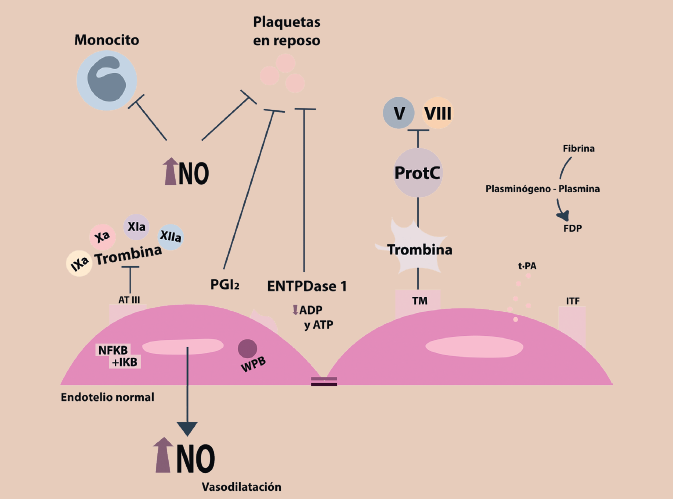
Figura 3 Endotelio sano (vasodilatador, antiinflamatorio y antitrombótico). Produce NO y PGI2 que vasodilatan e inhiben la activación plaquetaria. El NO inhibe la activación y diapédesis de leucocitos. La inflamación está inhibida también porque el NKFB se encuentra unido a su inhibidor IKB. La enzima ENTPDasa disminuye el ATP y ADP previniendo la activación plaquetaria. La producción ITF inhibe al TF, la AT III inhibe a la trombina y a otros factores de la coagulación y la TM también inhibe a la trombina y activa proteínas anticoagulantes naturales como la proteína C.
ACTIVACIÓN Y DISFUNCIÓN ENDOTELIAL
La activación es un proceso fisiológico en el que el endotelio responde a los cambios en el medio para favorecer la inflamación o para inducir la formación de un coágulo si un vaso sanguíneo se rompe. Se caracteriza por el aumento en la síntesis de citocinas y la expresión de marcadores endoteliales como la E-selectina (CD62e), la molécula de adhesión endotelial ICAM-1(CD54) y la molécula soluble de adhesión vascular VCAM-1(CD106), que permiten el reconocimiento y la extravasación o diapédesis de los leucocitos, lo que se traduce en el cambio de un estado antiadherente hacia otro adherente y proinflamatorio21. De acuerdo con Jun Zhang en 2022, la activación endotelial puede ser tipo I cuando es un evento inmediato y tipo II cuando puede llevar horas o días. En estos procesos, se activan vías de señalización que inducen cascadas de fosforilación, enzimas y movilización de calcio22.
Cuando existe una desregulación de las funciones del endotelio, se produce la disfunción endotelial, que se caracteriza por una capacidad vasodilatadora reducida, propiedades proinflamatorias, proaterogénicas y protrombóticas23. Se puede diferenciar a la activación endotelial de la disfunción endotelial porque, entre otras cosas, en esta última se presenta apoptosis y necrosis de las células endoteliales. Otra característica en la disfunción endotelial es el desequilibrio en la producción y biodisponibilidad de NO derivado del endotelio, por lo que hay una respuesta vasodilatadora disminuida14,15.
Las fluctuaciones de calcio en la activación endotelial pueden dar lugar a alteraciones mitocondriales con una producción excesiva de ROS, que lleva al estrés oxidante, disfunción y muerte. El endotelio disfuncional adquiere marcadores de senescencia con o sin acortamiento de telómeros, que contribuyen al desarrollo de enfermedades cardiovasculares9. Uno de los principales mecanismos de disfunción endotelial es el estrés oxidante, que desacopla la eNOs, disminuye el NO, activa la NADPH oxidasa (Nox 1 y Nox2) y aumenta la expresión de ET-115.
En un estado de estrés crónico que induce el ciclo estrés oxidante-inflamación, la activación de NF-KB aumenta la expresión de genes de las moléculas de adhesión y quimiocinas24 que inducen un estado de inflamación crónica como el que se presenta en la aterosclerosis u otras patologías cardiovasculares22. La disfunción endotelial es la etapa inicial de la enfermedad arterial periférica, enfermedad venosa crónica, insuficiencia renal crónica, infecciones, cáncer y obesidad, entre otras patologías25.
La tabla 1 muestra las diferencias entre los eventos que ocurren en la activación endotelial y lo que se puede observar en la disfunción endotelial.
Tabla 1 Diferencias entre los eventos que ocurren en la activación endotelial y lo que se puede observar en la disfunción endotelial
| Activación endotelial | Disfunción endotelial | |
|---|---|---|
| Características | Activación sostenida de NF-κB que puede progresar a apoptosis o necrosis Desprendimiento de la célula endotelial de la membrana basal subyacente y la denudación del vaso Niveles reducidos de óxido nítrico | |
| Tipo I: | Liberación de proteínas almacenadas como vWF, P-selectina, trombina, histamina | |
| Tipo II: | Hipertrofia de la célula endotelial, expresión de E-selectina, ICAM-1, VCAM-1, vWF, MCP-1, TF | |
Efectos proinflamatorios del endotelio disfuncional
En condiciones proinflamatorias, las citocinas como el TNF-α, inducen que la célula endotelial presente modificaciones en el ordenamiento de los filamentos de actina que generan un cambio morfológico, su glucocálix disminuye y se modifican las uniones intercelulares para permitir la migración de los leucocitos14,26. Otras moléculas proinflamatorias que participan en estos cambios son los lipopolisacáridos de la pared bacteriana (LPS) y algunas interleucinas como IL-127. Las células endoteliales activadas producen quimiocinas y otros factores proinflamatorios para atraer a los leucocitos, tales como IL-8, proteína epitelial atrayente de neutrófilos ENA-78, factor quimioatrayente de monocitos 1 (MCP-1) y 3 (MCP-3), entre otras familias de quimiocinas28, así como también expresan marcadores de adhesión como ICAM-1, VCAM-1 y la molécula de adhesión endotelial-plaquetaria PECAM-129.
Las uniones adherentes se desensamblan en respuesta a mediadores inflamatorios como la histamina y bradicinina que inducen la fosforilación de VE-cadherina, la cual es endocitada, ubiquitinada y degradada para aumentar la permeabilidad12. Todos estos eventos ocurren en principio, para que se conserve la homeostasis y para mantener la vigilancia inmunológica en todo el organismo; sin embargo, bajo condiciones patológicas o por alteraciones metabólicas, las células endoteliales disfuncionan, dando lugar a un estado inflamatorio crónico30.
Efectos protrombóticos del endotelio disfuncional
En la ruptura de un vaso sanguíneo, el endotelio sano se activa y libera los WPB que contienen el VWF y otras moléculas que promueven la activación plaquetaria e inducen la coagulación10. Sin embargo, en un endotelio disfuncional, aún sin ruptura del vaso sanguíneo, el endotelio es protrombótico, es decir, que favorece la formación anormal de trombos. Este fenotipo puede ser inducido por múltiples factores como la hiperlipidemia, la diabetes y el hábito tabáquico31. El fenotipo protrombótico del endotelio se debe a la disminución de factores antitrombóticos y/o la sobrerregulación de mediadores inflamatorios protrombóticos32. La activación plaquetaria también puede inducir este fenotipo endotelial7.
El NO es la molécula antitrombótica por excelencia, y se encuentra disminuida en la disfunción endotelial. El NO inhibe la activación plaquetaria, así que, al estar disminuido, aumenta la reactividad plaquetaria y esto contribuye al riesgo de trombosis. La misma situación sucede con la disminución en la síntesis de PGI231. La inflamación desencadena la movilización de los WPB con la consecuente liberación del VWF y la adhesión de las plaquetas a la colágena del subendotelio33-35. La célula endotelial disfuncional expresa al factor tisular (FT) que activa al factor VII de la coagulación, el cual es necesario para la generación de la trombina que, a su vez, aumenta el riesgo de trombosis13,36,37. Además, en las arterias y las venas, las células endoteliales expresan los receptores activados por proteasas (PAR) que interactúan con el complejo FT/VIIa (PAR1, PAR3 y PAR4) y son determinantes para la activación plaquetaria. La activación de receptores PAR en el endotelio, produce una respuesta inflamatoria con liberación de citocinas, quimiocinas y la expresión de moléculas de adhesión fundamentales en la relación inflamación-hemostasia37. Además del aumento de la generación de trombina, el endotelio disfuncional no sintetiza adecuadamente a la TM, uno de sus inhibidores, lo que contribuye también al riesgo trombótico31.
La síntesis y liberación de IL-1 y TNF-α por las células inflamatorias promueve la sobreexpresión de moléculas de adhesión para leucocitos y plaquetas, y, por otro lado, la síntesis de citocinas por el endotelio, con lo que se hace un círculo vicioso entre inflamación y estado protrombótico33,37.
DISFUNCIÓN ENDOTELIAL Y RIESGO CARDIOVASCULAR
La disfunción del endotelio arterial se considera el inicio de los cambios que llevan al desarrollo de enfermedades cardiovasculares. La enfermedad cardiovascular ateroesclerótica inicia con el incremento en la permeabilidad del endotelio disfuncional, así las lipoproteínas circulantes ingresan al subendotelio, se oxidan y sufren modificaciones fisicoquímicas que inician una inflamación crónica, que comienza con la entrada de monocitos circulantes a la íntima, donde se transforman en macrófagos que fagocitan las lipoproteínas modificadas. Los macrófagos se denominan células espumosas y, junto con los lípidos, forman la estría grasa. Posteriormente, el endotelio y los macrófagos activados secretan quimiocinas y factores de crecimiento que actúan sobre las células musculares lisas vecinas que proliferan y migran al subendotelio. La placa se rodea de una cubierta fibrosa que envuelve un núcleo necrótico rico en lípidos con diferentes grados de calcificación. Las células inflamatorias que rodean la placa contribuyen a la inestabilidad estructural de la misma y finalmente puede romperse con la salida de un contenido altamente trombogénico, y desencadenan una oclusión aterotrombótica que puede producir un infarto miocárdico o un evento cerebrovascular14,38,39.
En condiciones de flujo sanguíneo alterado, se estimula la presencia del marcador CD36 que aumenta la permeabilidad a los lípidos, principalmente lipoproteínas de baja densidad (LDL) oxidados, además este estímulo mecánico se relaciona con el aumento de NF-KB que induce un fenotipo proinflamatorio, con aumento en la expresión de VCAM-1 e ICAM-140. La disfunción endotelial permite la adhesión de leucocitos, desacopla la eNOS y disminuye el NO. Además, existe alteración del metabolismo de las células endoteliales, estrés oxidante, vasoconstricción, lesión y muerte celular, senescencia y transición endotelio-mesénquima41. La transición endotelio-mesénquima consiste en la pérdida de las características propias endoteliales y la diferenciación en células derivadas de mesodermo, contribuye a la pérdida de uniones del endotelio y la síntesis de matriz extracelular que aumenta el engrosamiento de la capa íntima arterial y permite el progreso de la placa de ateroma9,14. En la figura 4, se esquematizan algunas consecuencias de la disfunción endotelial que permiten la formación y progreso de la placa de ateroma.

Figura 4 Endotelio disfuncional productor de ROS y con disminución de NO. Las plaquetas se activan y liberan factores protrombóticos y citocinas. Hay expresión de marcadores de adhesión VCAM-1, ICAM-1 y E-selectina que activan monocitos y permiten su diapédesis y diferenciación a macrófagos, que producen otras citocinas proinflamatorias. El endotelio produce NFKB e IL-1. Hay disminución de ocludinas y claudinas, con lo que aumenta la permeabilidad. Las LDL se oxidan (LDLOX) e ingresan al subendotelio donde son fagocitadas por los macrófagos, que se observan como “células espumosas” que inician la inflamación crónica y la formación de la placa de ateroma. El endotelio disfuncional puede tener daño y presentar apoptosis o necrosis. Libera micropartículas o EMP y aumenta la liberación de TF y VWF, que, aunado a la disminución de factores procoagulantes, promueven la trombosis.
Se han reportado numerosos factores que desencadenan la disfunción endotelial como: los lípidos (LDL modificada, lisofosfatidilcolina, fosfatidilcolina oxidada y cristales de colesterol); inflamación por citocinas proinflamatorias, infección por bacterias o virus, hiperglucemia, la homocisteína y el flujo alterado; el estrés oxidante que incluye H2O2, superóxidos, ROS mitocondrial; incremento en la expresión de algunos miRNA; fármacos contra el virus de la inmunodeficiencia humana, el agente anticanceroso doxorrubicina y los inhibidores del factor de crecimiento endotelial vascular; además de otros factores de riesgo como envejecimiento, el tabaquismo, la inactividad física, la dieta poco saludable, la irradiación, el estrés psicológico, y la contaminación del aire por partículas finas y ultrafinas39-42.
BIOMARCADORES DE DISFUNCIÓN ENDOTELIAL Y RIESGO CARDIOVASCULAR
Existen biomarcadores que se han utilizado para identificar la disfunción endotelial y el riesgo cardiovascular, que serán abordados brevemente en esta revisión y que se pueden observar en la tabla 2. Algunos muy inespecíficos como las proteínas de fase aguda, que son marcadores de inflamación producidos por los hepatocitos, como la proteína C reactiva (PCR), el fibrinógeno y el amiloide sérico A (SSA). La PCR es capaz de inhibir la eNOs y disminuir la producción de NO, así como aumentar la expresión de VCAM-1, ICAM-1 y E-Selectina. El fibrinógeno es el factor I de la coagulación que al ser activado por la trombina se convierte en fibrina. Tiene un papel importante en la coagulación y en la inflamación, en parte es regulado por efecto del endotelio y su aumento en plasma se ha asociado con el riesgo cardiovascular de manera consistente en diferentes estudios. Por otro lado, el amiloide sérico (SSA) es una familia de apolipoproteínas que tienen efecto proaterogénico e inducen inflamación crónica15.
Tabla 2 Biomarcadores de disfunción endotelial y riesgo cardiovascular
| 1. Proteínas de reacción aguda | |
| Proteína C reactiva | Se expresa en condiciones de inflamación. Aumenta la expresión de moléculas de adhesión |
| Fibrinógeno | Factor I de la coagulación, que al activarse se transforma en fibrina. Importante en la tromboinflamación |
| Amiloide sérico A (SSA) | Induce inflamación crónica |
| 2. Citocinas proinflamatorias | |
| Factor de necrosis tumoral alfa (TNF-α) | Molécula proinflamatoria, induce la producción de otras citocinas y aumenta la expresión de marcadores de adhesión |
| IL-6, IL-8, IL-18 | Citocinas proinflamatorias y quimioatrayentes. Relacionadas con la progresión de la ateroesclerosis |
| 3. Moléculas de adhesión | |
| VCAM-1 | Es una molécula de adhesión de leucocitos cuando existe inflamación. Su forma soluble, promueve la quimiotaxis de monocitos |
| ICAM-1 | Media la adhesión y migración paracelular de leucocitos. Sus niveles aumentan en sangre cuando hay estrés oxidante, diabetes tipo 2, obesidad, enfermedades cardiovasculares, etc. |
| E-selectina | Molécula de adhesión que se incrementa por la acción de IL-1ß y TNF-α |
| 4. Células y derivados celulares | |
| Monocitos | Células sanguíneas que en los tejidos se diferencian a macrófagos. Su aumento indica inflamación, se pueden elevar en la progresión de la ateroesclerosis |
| Micropartículas derivadas del endotelio (EMP) | Son partículas pequeñas que se desprenden del endotelio. Existen otras micropartículas derivadas de otras células. Su aumento se asocia con citocinas proinflamatorias y son marcadores de daño endotelial |
Las citocinas proinflamatorias como el TNF-α, IL-6, IL-8 y IL-18 promueven la inflamación crónica y la disfunción endotelial y están asociadas al riesgo cardiovascular. El TNF-α, como ya se mencionó, induce la secreción de citocinas y la expresión de marcadores de adhesión en el endotelio. La IL-6 regula la expresión de proteínas de fase aguda que aumentan el riesgo cardiovascular. La IL-8 es un quimioatrayente de neutrófilos y linfocitos T y algunos estudios demuestran que es un marcador de riesgo cardiovascular independiente de otros como la PCR. La IL-18 es producida por los macrófagos e induce la producción de otras citocinas proinflamatorias involucradas en la aterogénesis15.
Las moléculas de adhesión VCAM-1, ICAM-1 y E-selectina, promueven la migración de leucocitos y se aumentan sus niveles en la activación endotelial. En condiciones de estrés oxidante, obesidad, diabetes y enfermedades cardiovasculares, sus niveles aumentan aún más9,41; sin embargo, se sugiere que deben medirse junto con otros biomarcadores para poder establecer la presencia de disfunción endotelial y riesgo cardiovascular15.
Se pueden usar como biomarcadores algunos derivados celulares, como las micropartículas derivadas del endotelio (EMP), que aumentan en la disfunción endotelial y en las enfermedades cardiovasculares. Por otro lado, se sugiere que las EMP regulan la producción de citocinas por parte de los monocitos y macrófagos. Los mismos monocitos pueden ser utilizados como biomarcador de disfunción endotelial, ya que los niveles elevados en sangre se asocian a eventos de riesgo cardiovascular y se correlacionan con aumento de ROS y disminución de NO endotelial15. Otros nuevos posibles biomarcadores como la adiponectina, endocan, galectina 3, entre otros, no se mencionan en esta revisión.
Para la evaluación del daño endotelial y el riesgo cardiovascular en pacientes, estos marcadores endoteliales en su porción soluble pueden medirse en plasma, y se ha demostrado la utilidad de medir la respuesta del endotelio a vasodilatadores o vasoconstrictores. Se considera el estándar de oro la medición del flujo mediado por dilatación con acetilcolina (FMD) en la arteria braquial41. Otras moléculas cuyo aumento se asocia a disfunción endotelial, al aumento del riesgo cardiovascular y a mayor extensión de la enfermedad arterial coronaria son PECAM-1 o CD31, VWF y el factor de crecimiento endotelial vascular (VEGF)43.
MEDIDAS PREVENTIVAS O TERAPÉUTICAS PARA LA DISFUNCIÓN ENDOTELIAL Y EL RIESGO CARDIOVASCULAR
Se cuenta con medidas generales para prevenir o tratar la disfunción endotelial y el riesgo cardiovascular, como las modificaciones en el estilo de vida: el ejercicio, la dieta y evitar el tabaquismo. El ejercicio regular es una recomendación para prevenir y para tratar las enfermedades cardiovasculares, porque ha demostrado que disminuye las ROS, induce a la eNOs y aumenta el NO. En cuanto a las recomendaciones dietéticas, se encuentra la dieta estilo mediterránea, con disminución en el consumo de grasas saturadas, rica en consumo de vegetales y fruta, granos enteros, pescado, aceite de oliva, con bajo consumo de carnes rojas, azúcares y granos refinados. Este tipo de dieta impide la resistencia a la insulina, disminuye la lipidemia, es rica en antioxidantes, es antiinflamatoria y antitrombótica. También se han estudiado algunos extractos de plantas con efecto antioxidante que pudieran en un futuro ser empleados para disminuir el riesgo cardiovascular. Evitar o dejar el tabaquismo también contribuye a la disminución del riesgo15.
Los medicamentos que se han propuesto como preventivos o terapéuticos son: 1) los medicamentos antidiabéticos que disminuyen la glucosa en sangre: metformina41 y empaglifozina, un inhibidor del cotransportador sodio-glucosa 2 (SGLT2i); 2) las estatinas simvastatina y atorvastatina, que reducen la síntesis de colesterol, también disminuyen los niveles de marcadores de adhesión y las citocinas proinflamatorias en las células endoteliales41; 3) los antihipertensivos como los inhibidores de la enzima convertidora de angiotensina, los bloqueados del receptor de angiotensina II y los bloqueadores de canales de calcio disminuyen la disfunción endotelial; 4) los antioxidantes, como la vitamina C y E, N-acetilcisteína, entre otros, actúan disminuyendo las ROS así como previenen la oxidación de las LDLs; 5) los medicamentos antiinflamatorios no esteroideos como la aspirina o inhibidores selectivos de la ciclooxigenasa 2 pueden revertir la disfunción endotelial y disminuir el riesgo cardiovascular41. Existen otros antiinflamatorios que aún requieren mayores estudios, como el tocilizumab que bloquea el receptor para IL-6, que disminuye los niveles de PCR, pero se asoció con hiperlipidemia. El tofacitinib que es un inhibidor de la tirosina Janus quinasa (JAK) disminuye marcadores de adhesión, IL-1 y TNF-α, el imatinib también inhibidor de JAK, aumenta la disponibilidad de NO, disminuye los niveles de lípidos en sangre y la PCR, por lo que disminuye la disfunción endotelial; y 4) los nuevos antiplaquetarios como voraxapar que disminuye IL-1, IL-8, TNF-α, aumenta una citocina antiinflamatoria, la IL-13 e induce a la eNOs. El ticagrelor, un antagonista del receptor P2Y12, en combinación con aspirina disminuye la apoptosis endotelial y aumenta el NO, comparado con coplidogrel con aspirina15. Existen otros medicamentos que tienen potencial terapéutico y se siguen evaluando, como el AVE3085 que aumenta la actividad de la eNOS, inhibidores de tirosinas fosfatasa endotelial, medicamentos dirigidos al glucocálix, entre otros41.
CONCLUSIONES
El endotelio vascular en condiciones fisiológicas tiene una gran cantidad de funciones que permiten la homeostasia al regular procesos importantes como la formación de barreras, el intercambio de sustancias, la vasodilatación y vasoconstricción, la inflamación y la hemostasia. Es importante resaltar que esta capacidad de regular se refleja en las moléculas que sintetiza, ya que tiene agonistas y antagonistas que secreta según se requiera. Su activación es autolimitada y muy importante ya que favorece los procesos de inflamación y la coagulación. Sin embargo, existen condiciones en las cuales el endotelio pierde su capacidad de regulación y se transforma en un endotelio disfuncional, vasoconstrictor, proinflamatorio y protrombótico que puede iniciar una enfermedad ateroesclerótica que progresa y aumenta el riesgo cardiovascular. En la medicina clínica, estos conceptos básicos son importantes para entender la fisiología del endotelio, cómo ocurre la disfunción endotelial y cómo se evalúa a través de biomarcadores. A medida que se conozcan más los aspectos básicos, se podrán diseñar medidas preventivas o terapéuticas para la población general y con esto disminuir la morbimortalidad relacionada con las enfermedades cardiovasculares.











 text new page (beta)
text new page (beta)