INTRODUCCIÓN
La ausencia de enfermedad no es la única condición de salud, sino también la presencia de bienestar. Por ello, la búsqueda de placer y el evitar el dolor (sufrimiento), es una tarea que el humano como especie ha tratado de cubrir. A lo largo de la historia de la humanidad se puede reconocer la existencia de plantas medicinales cuyo objetivo ha sido no solo controlar la nocicepción, sino también el dolor y generar bienestar y placer. Así, se observa que los opiáceos/opioides que reducen el dolor también facilitan el bienestar. Es decir, de alguna manera facilitan el placer, y es debido a estos mecanismos que los opiáceos/opioides pueden generar adicción.
En este contexto, la Ley General de Salud de los Estados Unidos Mexicanos (16 de mayo de 2022)1, establece en el artículo 234 que los opiáceos y los opioides son estupefacientes, y en el artículo 235 se indica que son moléculas reguladas en su siembra, posesión y prescripción y otros aspectos. Es decir, se reconocen sus beneficios terapéuticos para el tratamiento de la nocicepción y dolor, pero los regulan porque advierten su potencial adictivo. Asimismo, el artículo 245 clasifica a la naloxona como una sustancia psicotrópica en la fracción IV (las moléculas que tienen amplios usos terapéuticos y constituyen un problema menor para la salud pública). La International Association for the Study of Pain (IASP) define al dolor como una sensación emocionalmente desagradable, asociada con un daño tisular real o potencial2. A pesar de que esta definición está ampliamente aceptada, la misma IASP determina que el dolor es diferente a la nocicepción. Este término acuñado por Sherrington (1906) describe que el estímulo nociceptivo es un estímulo mecánico, térmico, químico, que es transformado en un estímulo eléctrico por un receptor sensorial, transportado por un potencial de acción. Ahora se puede agregar que para transmitirlo a una siguiente neurona se requiere de un neurotransmisor. Interpretarlo, por otro lado, es decir, entender su magnitud y anticipar sus consecuencias, es un proceso diferente y más elaborado. El estímulo nociceptivo se percibe y se reconoce como una señal de daño, pero esta señal, cuando incluye su interpretación se transforma en dolor. Entonces, el dolor en gran medida es el sufrimiento asociado al estímulo nociceptivo y esto es por la interpretación que se le da; es decir, su magnitud y sus consecuencias. Así que los sistemas que conducen la nocicepción permiten sentir el estímulo dañino, ubicarlo, alertar y activar sistemas antialgésicos. Estos aspectos parece que serían suficientes para explicar la percepción dolorosa. Sin embargo, hay otro sistema cerebral, y es el de defensa, que genera ansiedad y detecta el conflicto, genera evitación del estresor y búsqueda de ayuda (ver más adelante la explicación del sistema de defensa). Este sistema genera en la esfera cognoscitiva un pensamiento que es adaptativo, a pesar de generar sufrimiento; promueve que una persona busque ayuda, se apoye en su red social y fortalezca sus vínculos afectivos. En este contexto se ve cómo el humano ha usado el opio, la morfina y los opioides sintéticos para reducir la sensación nociceptiva, pero principalmente el dolor. Para reducir el dolor se tiene que reducir la activación del sistema de defensa y activar el sistema de recompensa (ver adelante la descripción del sistema de recompensa) que induce bienestar y antagoniza al sistema de defensa3, lo que reduce de esta manera la ansiedad. Es decir, los opiáceos y los opioides no solo reducen la nocicepción, sino también el dolor, al activar al sistema de placer y con ello reducir la actividad del sistema de defensa, al minimizar la interpretación catastrofizante que se da al estímulo nociceptivo a consecuencia de la activación del sistema de defensa.
El dolor es uno de los síntomas más persuasivos para que una persona, de cualquier edad, reconozca que se siente mal y busque ayuda. Si son niños posiblemente solo se quejarán y serán los cuidadores primarios los que se encargarán de proveerles de la atención especializada, si es necesaria. Sin embargo, conforme la intensidad y cronicidad del estímulo nociceptivo aumenta, el sufrimiento del paciente se exacerba. El dolor produce cambios afectivos, especialmente si es crónico, ya que activa y fortalece al sistema de defensa. Produce enojo, tristeza, ansiedad y muchas veces la sensación de estar solo. Otro tipo de consecuencias adversas que produce son alteraciones del sueño, v. gr., insomnio a consecuencia de la activación del sistema de defensa. Lo contrario también es cierto. Trastornos como la depresión facilitan el dolor y la nocicepción. Esta última lo hace porque hay una caída de monoaminas, que más adelante se explicará que son cruciales en la regulación del sistema antialgésico4.
El dolor, como tal, no existe; existe la nocicepción. El dolor es una conceptualización que el sujeto hace, que lo lleva a interpretar al estímulo nocivo como insoportable y a anticipar sus potenciales consecuencias. Así que la persona que lo sufre sabe que es una sensación y una percepción, porque el estímulo activa los sistemas neuronales especializados en conducirlo, pero que también es una emoción, porque lo motiva a hacer algo para mitigarlo, e incluso puede entenderlo como un sentimiento, cuando declara que sufre. Es una emoción de valencia negativa que puede llevar al paciente a la desazón y a la desesperanza. Es un sentimiento porque lo puede calificar como intenso y desagradable y lo vive con sufrimiento. Lo puede calificar de insidioso e incluso lo puede objetivar y hablar con él, como si fuera una persona y pedirle que se vaya, que lo deje en paz. El dolor es motivación, también, porque cuando se sufre, cuando se tiene dolor, se busca refugio, se busca ayuda, se busca consuelo en la red de apoyo.
El dolor es un formidable oxímoron que busca bienestar y avisa que algo está lastimando, destruyendo y atenta contra la integridad del cuerpo por lo que exige protección y finiquitar al enemigo que lo produce, pero termina abatiendo con su estentórea voz a tal punto que se busca combatirlo, como si el dolor mismo fuera el enemigo.
LOS MECANISMOS ANTIALGÉSICOS
Es interesante reconocer que el sistema nervioso central (SNC) tiene mecanismos para reducir e incluso hacer desaparecer al dolor. Frecuentemente, cuando una persona accidentalmente se lastima alguna parte de su cuerpo, después de un corto tiempo refiere que el dolor se ha mitigado. El pensamiento común acepta que el dolor ya desapareció y lo asocia con un proceso curativo. Pero nadie del común de la gente se pregunta cómo desapareció. El SNC posee sistemas que inhiben la sensación nociceptiva. Son los mecanismos antialgésicos. Son sistemas que se generan en la sustancia gris periacueductal y que activan al núcleo locus coeruleus, al núcleo rafe magnus y al área rostroventral de la médula oblongada5. Estos mecanismos adicionales activan a las interneuronas que producen a las encefalinas que son morfinas endógenas o endorfinas y terminan con el dolor al actuar como morfina (ver abajo). Estas encefalinas son los ligandos endógenos para estos receptores en los que actúa la morfina6. Así que, cuando los médicos administran morfina a un paciente, lo que están haciendo es potenciar el efecto de las encefalinas y de otras morfinas endógenas y la sensación nociceptiva se controla. Pero no solo produce ausencia de nocicepción y de dolor, también induce placer, porque también activan al sistema de motivación y recompensa por lo que el sujeto puede correr el riesgo de buscar ese tipo de placer que la morfina le produce, pero ahora sin tener necesidad de controlar la nocicepción y el dolor.
LAS ENDORFINAS
A todas las sustancias que se extraen del opio, como la morfina, se les conoce como opiáceos. Sin embargo, existe un tipo de proteínas que el cerebro produce y que tienen efectos semejantes a la morfina a las cuales se les llama opioides endógenos. Genéricamente se les llama endorfinas (que es la yuxtaposición de las palabras endógenas y morfinas); aunque hay una familia de opioides endógenos a los cuales se les conoce específicamente como endorfinas.
Actualmente se han caracterizado al menos 4 familias de endorfinas; sin embargo, el crédito por la primera descripción corresponde a Hughs y a Kosterlitz, de la Unidad para la Investigación de Sustancias Adictivas del Marischal College de la Universidad de Aberdeen, Reino Unido, quienes, en 1975, describieron las primeras endorfinas a las que llamaron encefalinas7.
Al año siguiente se aislaron la alfa y la betaendorfina de la beta-lipotropina8,9, originalmente aislada de la glándula pituitaria de borrego10. El grupo de Goldstein describió las dinorfinas11. La última familia descrita en la década de los 80 es la de hemorfinas, que son péptidos asociados a la hemoglobina12. Al primero que se describió la llamaron kiotorfina y mostraron que producía analgesia en el ratón de manera dependiente de la dosis13. Asimismo, se han descrito las exorfinas, como las casomorfina y las gliadorfinas, que son derivadas de la caseína de la leche humana y de otros mamíferos y péptidos derivados del trigo, que también tienen propiedades de opioides14.
LOS RECEPTORES DE OPIOIDES
La morfina es un opiáceo puro que se une a varios receptores en el cerebro, los cuales originalmente fueron descritos por 3 grupos independientes de científicos en 1973: Pert y Snyder, de la Escuela de Medicina John Hopkins, Estados Unidos; Simon y su grupo del Departamento de Medicina del Centro Médico de Nueva York, Estados Unidos; y Terenius y su grupo, de la Universidad de Uppsala, Suecia6. Se creyó al principio que el receptor de la morfina era uno solo, pero otros trabajos sugirieron que eran al menos 3. Los μ que actualmente se clasifican como MOR (mu opioid receptor) y que fueron caracterizados como aquellos a los que la morfina se une con mayor afinidad; los K (detectados con ketociclazocina) actualmente KOR (kappa opioide receptor); y los DOR (delta opioid receptor) descritos por Hughes y Kosterlitz. Lo identificaron con encefalinas en el vas deferens del ratón, en donde sus efectos no fueron bloqueados por el antagonista naloxona6.
Los opiáceos y opioides ejercen su efecto antinociceptivo y también su efecto promotor de adicción a través de su receptor MOR. También, los receptores KOR tienen una función muy importante en el desarrollo de adicción, como lo prueba el uso de Salvia divinorum (ver más adelante en esta revisión).
EL OPIO (DEL GRIEGO OPOS: JUGO)
Los usos del opio se han documentado desde 4,200 años antes de nuestra era. Por lo menos es lo que se estima a partir de residuos encontrados en la Cueva de los Murciélagos en España. Se ha documentado que los primeros cultivos fueron hechos en Mesopotamia, por los sumerios, 3,200 años antes de nuestra era. La planta era llamada hul gil, que quiere decir: la planta de la felicidad. El opio siempre se utilizó para aliviar el dolor y para anestesiar. Muchos y diversos procedimientos quirúrgicos se llevaron a cabo gracias a que se podía inducir cierto grado de anestesia con el opio. En Nippur, un centro ceremonial sumerio al sur de Bagdad, se encontraron unas tablillas indicando cómo procesar el opio. En estas tablillas se indicaba que el aratpapal (o jugo de la amapola) debía colectarse por la mañana. Esta costumbre la continuaron los asirios, quienes además se la enseñaron a los babilonios y estos a los egipcios. Los egipcios comercializaron con el opio y contribuyeron a distribuirlo por todo el mediterráneo. Los griegos adoptaron sus usos, y tanto trascendió en esa cultura que los mismos dioses Hypnos, Nyx, Apolo y otros, fueron representados rodeados de amapolas. El uso del opio se extendió en el imperio islámico, a pesar de que las santas escrituras islámicas prohibían cualquier tipo de intoxicación, debido a que los médicos islámicos podían recetarlo. Estos lo introdujeron a China entre el año 400 y 1200 denuestra era. El opio fue estigmatizado entre el siglo XIV y el XVI, en Europa; sin embargo, fue Paracelso (1493-1541), el médico suizo cuyo verdadero nombre era Theophrastus Philippus Aureolus Bombastus von Hohenheim, y quien bautizó al alcohol con ese nombre, quien introdujo, en sus frecuentes viajes a diferentes sitios de Arabia, al láudano en el arsenal médico después de haberse enterado de la existencia del opio y sus propiedades curativas. El láudano (aparentemente derivó su nombre del latín, laureado) de Paracelso, también llamado tintura de opio, se usó ampliamente durante el Renacimiento. Simplemente era opio disuelto en alcohol, aunque hay evidencias que Paracelso le agregó azafrán, clavo y canela. Llegó a ser muy popular a lo largo de la historia. Con todo, el preparado de láudano comercialmente más famoso fue el de Thomas Sydenham (1624-1689), el cual también alcanzó notoria popularidad; por ejemplo, Mary Todd Lincoln, la esposa del presidente de los Estados Unidos de América, Abraham Lincoln, llegó a ser adicta al láudano.Aún se expende comercialmente (Marathon Pharmaceuticals) en Estados Unidos15-17. Solo con receta médica y un poco modificado; por ejemplo, el láudano actual está compuesto de 1 g de morfina por 100 ml de alcohol (solución al 1%).
El opio es la fuente original y natural de la morfina y la Oficina de Naciones Unidas contra la Droga y el Delito (UNODC, por sus siglas en inglés)18 ha estimado que en el 2021 se produjeron alrededor de 8,000 toneladas de opio en el mundo, de las cuales un poco menos de 7 fueron procesadas para producir morfina y convertirla en heroína. El opio contiene aproximadamente 10-16% de morfina, también contiene codeína, papaverina, tebaína, oripavina y noscapina en menor proporción19. A pesar de que su uso siempre persiguió fines medicinales, su capacidad adictiva ha contaminado sus aplicaciones.
OPIÁCEOS
La morfina
Es el primer principio activo aislado de una planta. Fue aislada en Paderborn, Alemania, en 1803. El honor lo tuvo el químico farmacéutico Friedrich Wilhelm Adam Sertürner (1783-1861), quien aisló compuestos cristalizados del opio y decidió demostrar que eran el principio activo del opio20,21. Para mostrar que ciertamente estos cristales producían el mismo efecto que el opio, decidió administrárselo a sí mismo. Entre los efectos que sintió fue la somnolencia, por lo que decidió bautizar a esta sustancia como morfium, recordando que en la mitología griega existía el dios de las ensoñaciones llamado Morfeo. Más tarde, el nombre fue cambiado a morfina, por Joseph Louis Gay-Lussac (1778-1850), mejor conocido por sus trabajos sobre la física de los gases22. A partir de 1853, el uso de la morfina se popularizó, en gran medida a consecuencia de la invención de la aguja hipodérmica. Este pequeño artefacto, inventado por un médico ortopedista francés Charles Gabriel Pradaz (1791- 1853) y simultánea e independientemente por un Médico escocés Alexander Woods (1817-1884), fue desarrollado para poder administrar morfina rápida y eficazmente con el fin de reducir la neuralgia del trigémino23. En 1925 se diseñó y patentó un método muy eficiente para aislar la morfina de la Papaver somniferum, que es la variedad de amapola que produce el opio. El inventor del método fue Janos Kabay (1896-1936). Desde que la morfina se empezó a utilizar, se apreció su capacidad sedante, relajante y su capacidad para reducir o eliminar el dolor. Gracias a Kabay la morfina se empezó a utilizar más ampliamente. La fórmula de la morfina no se dedujo hasta 1925, cuando el laureado con el premio Nóbel (1947), Sir Robert Robinson (1886-1975), realizó este trabajo. Pero no todo empezó con la morfina ni ha terminado con ella. En realidad, hay mucha historia antes y después de su aislamiento.
La morfina constituye el 10-16% de la goma cruda del opio. A pesar de que el opio fumado se ha usado con fines recreativos desde tiempos remotos, como ya se mencionó, la morfina se administra con fines médicos por vía parenteral: intramuscular o endovenosa. También la vía oral se puede usar, pero no tiene la eficiencia que la vía parenteral. Con todo, raramente se abusa de la morfina, por lo menos comparada con la heroína, que es la molécula de elección de los usuarios de opioides. La morfina en realidad tiene poca capacidad de alcanzar el cerebro. Comparada con la heroína, cruza pobremente la barrera hematoencefálica. Se calcula que solo un 20% de la morfina que se administra llega al cerebro. Sin embargo, la morfina se distribuye bien por el resto del cuerpo e incluso atraviesa la barrera placentaria. Esto quiere decir, que una mujer embarazada que ingiere morfina, también se la hará llegar al feto que está dentro de su útero. La morfina se degrada preferentemente por el hígado, pero se genera un metabolito activo, la morfina-6-glucurónico que es 10-20 veces más potente como analgésico que la morfina. De hecho, el efecto analgésico de la morfina está mediado en parte, por este metabolito. La morfina ejerce sus efectos en el cuerpo durante cerca de 3 horas. La morfina y sus metabolitos se excretan por orina; por lo que en una prueba de orina para detectar este fármaco resulta positiva por 2-4 días después de su administración. La heroína, como tal, no se puede detectar, ya que esta se metaboliza en el hígado a monoacetilmorfina y este metabolito se degrada a morfina.
En medicina, la morfina se usa preferentemente para el tratamiento del dolor, pero también produce una sensación de euforia, aunque relajada. Como diría Charles Baudelaire (1821-1867), es como un paraíso artificial. Friedrich Wilhelm Adam Sertürner, quién la aisló del opio en 1804, la comercializó para el tratamiento del dolor y para combatir la adicción al alcohol y al opio en 1817. Si el sujeto no se duerme, cuando recibe morfina, tiene una sensación de tranquilidad, su ansiedad se reduce y sus preocupaciones parecen ser menos importantes. Es un estado de tranquilidad y al mismo tiempo de exaltación que el sujeto experimenta, y que raramente se experimenta en la vida diaria. Mientras el sujeto está bajo los efectos de la droga, la perspectiva de que una vez que pase el efecto tendrá los síntomas de la abstinencia y sufrirá, no le importa. Tampoco le importa si la dosis que se ha tomado esta vez lo puede matar. La muerte es bienvenida en este estado. Todo parece tolerable. Es un estado en el que el concepto de dolor y sufrimiento se desdibuja.
Lo que se pretende con el uso de la morfina es tener una sensación de bienestar. Esto incluye la ausencia de dolor. Sí, el dolor es lo que más aflige al humano. De hecho, en la clínica observamos que la mayoría de los pacientes acuden a la consulta, incluso de urgencia, solo si se queja de dolor. El dolor cumple su función de ser una voz de alarma que no solo le indica al paciente que su cuerpo de alguna manera está dañado, sino que puede dañarse más. El paciente se preocupa y lo único que parece exigirle a su doctor es que desaparezca el dolor. Si este desaparece, entonces el tratamiento fue bueno o eso cree el paciente. En este contexto, no es de extrañar que el opio como pócima y la morfina como medicamento haya sido considerado una bendición de los dioses por los pacientes, y por los médicos.
Codeína (metilmorfina)
Como hemos dicho, en la goma de opio también está contenida la codeína en aproximadamente un 0.5%. Fue aislada en 1832 por el francés Pierre Jean Robiquet (1780-1840) a partir del opio. Robiquet también aisló la narcotina, que es igualmente un componente del opio. La codeína se comercializa como antitusígeno y como analgésico (combinado con antihistamínicos o con ácido acetil salicílico o acetaminofén). Como la codeína se metaboliza en el hígado a morfina, la mayoría de estas presentaciones hacen de los usuarios dependientes de codeína. De hecho, se calcula que un 40% de los usuarios de jarabes para la tos que contienen codeína, los usan porque ya son dependientes de este fármaco. Incluso se ha sugerido que muchos de los problemas de depresión en usuarios de jarabes para la tos, son resultado de la codeína que tiene la mayoría de dichos jarabes. El efecto de la codeína dura aproximadamente 4 horas. Se ha calculado que un paciente que reciba por vía oral 200 mg de codeína, estará generando aproximadamente 30 mg de morfina. Los jarabes utilizados para el control de la tos, frecuentemente vienen en presentaciones de 1.26 mg/ml. La dosis recomendada es de 15 ml cada 6 horas. Esta posología nos da 76 mg/día, lo que en un período corto entraña poco peligro de desarrollar adicción. Los frascos frecuentemente tienen un total de 125 ml (157.5 mg) o 250 ml (315 mg), lo que aumenta la probabilidad de un consumo riesgoso.
Salvia divinorum, el opio mexicano
Esta es una planta del tipo al que se le llama menta. Su principio activo ha sido aislado y se la ha llamado salvinorina A. Está presente en las hojas secas de la salvia en un 0.2%. Esta morfina mexicana no es un alcaloide, como la morfina y la codeína, ya que no tiene átomos de nitrógeno. Se le considera un diterpenoide. La salvinorina A tiene una alta afinidad por el receptor K-opioide (KOR) (4 nM), por lo que es muy potente, ya que es capaz de producir efectos con solo 20 microgramos24. Esto la equipara con el fentanilo y la hace la molécula, psicotrópica de ocurrencia natural, más poderosa que se conoce. Su efecto lo lleva a cabo preferentemente a través de los receptores KOR. Se ha mostrado, en algunos modelos animales, que tiene propiedades antialgésicas25. Testimonios de investigadores mexicanos han mostrado que la S. divinorum induce un estado más parecido a una ensoñación consciente, más parecido a un sueño vívido que a una alucinación26. Se ha mostrado, en modelos animales, que facilita el consumo de alcohol27.
OPIOIDES SEMISINTÉTICOS
Heroína
La búsqueda de remedios que reduzcan el dolor y, en general, el sufrimiento humano ha llevado a los científicos a crear sustancias que se han convertido en el monstruo de Frankenstein para la humanidad. Este es el caso de la morfina transformada en diacetilmorfina, mejor conocida como heroína.
La diacetilmorfina fue sintetizada por el químico Charles Romley Alder Wright en 1874 a partir de morfina. La idea fue sintetizar una droga que ayudara a reducir la adicción que ya representaba un problema entre los usuarios de morfina. Resultó ser mucho más poderosa que la misma morfina para crear adicción. Hoy en día, es una de las sustancias más adictivas que existen entre los usuarios de drogas. Junto con su competidora, la cocaína, el humano ha creado el llamado speed o speedball, una combinación de heroína y cocaína que es altamente adictiva.
A pesar de que, como ya dijimos, fue Alder Wright quién sintetizó por primera vez la heroína, este hecho no tuvo ningún efecto sobre la medicina o ninguna otra área, como se podría esperar, si se considera el prominente efecto que hoy tiene. No fue sino hasta 23 años después cuando ocurrió su redescubrimiento por Félix Hoffmann (1868-1946). Una vez descubierta, la heroína se comercializó por Bayer como un analgésico y como antitusígeno. De 1898 a 1910, Bayer vendió heroína como una sustancia sin riesgo para la adicción. Actualmente, la heroína pertenece a la clase I en el control de drogas, lo que la clasifica como una sustancia sin utilidad médica y con alto potencial adictivo.
La heroína no es más que morfina acetilada. Esta modificación hace que tenga una farmacocinética diferente. Primero, la hace más liposoluble, lo cual permite que ingrese más rápidamente al cerebro. Segundo, una vez dentro del cerebro se desacetila, por lo que se convierte en una morfina monoacetilada, la 6-monoacetilmorfina (6-MAM) y en morfina, la cual es la que finalmente ejerce sus efectos. Como vimos antes, la morfina se une a sus receptores, preferentemente a los MOR, y asimismo lo hace la 6-MAM. Sin embargo, la heroína como tal se une pobremente a estos receptores.
El cocodrilo (desomorfina)
Es un derivado de la codeína desarrollado por los laboratorios Roche en Estados Unidos en 1932. Se ha comercializado con el nombre de Permonid aunque en el mercado negro se la llama “heroína-comecarne” o “heroína-pudre-carne”. Sus características son las de producir efectos analgésicos y sedantes con una latencia muy corta, pero también con una duración muy corta, lo que puede resultar de alguna utilidad en la clínica. Aparentemente su producción casera a partir de la codeína de jarabes que se expenden como antitusígenos, es fácil. Sus efectos son extremadamente adictivos y el proceso de rehabilitación por suspensión de la droga e inducción del síndrome de abstinencia, médicamente es de lo más intenso y difícil de controlar. Lo más conspicuo en el síndrome de abstinencia es el dolor intenso con el que el paciente cursa. Además, este dolor puede continuar hasta por un mes. Dicho período es muy prolongado comparado con la heroína ya que durante el síndrome de abstinencia de esta se observa el mismo efecto, pero solamente por una semana.
Parece que su sobrenombre “cocodrilo” o “krokodile” lo ha derivado de que el usuario desarrolla características en la piel que lo asemejan a la piel de un cocodrilo, por ejemplo, verdosa, abultada, y escamosa. Epidemiológicamente se dice que el primer brote de consumo de “cocodrilo” ocurrió en Rusia, en Siberia, en 2003, a raíz de intensificar la prohibición de uso de heroína. Aún no se ha observado gran uso en el mundo, incluido Estados Unidos. Se ha estimado que el uso frecuente del cocodrilo puede matar al usuario en 3 años. De hecho, en 2012 se estimó que el cocodrilo había matado alrededor de 30 mil personas por año, en los últimos 10 años. Si el paciente se rehabilitara y sobreviviera tendría secuelas irreversibles. En México se detectó el caso de una mujer de 17 años que aparentemente consumió cocodrilo en Houston, Estados Unidos. No se documentó el caso adecuadamente. Hoy por hoy, es una de las drogas más adictivas, más difíciles de reducir su consumo y la que mayor cantidad de secuelas deja.
La oxicodona
Es una molécula sintetizada en 1916 a partir de la tebaína, producto natural del opio. Tiene efectos similares a la morfina, ya que activa a los receptores MOR y KOR, pero se considera que tiene 1.5 veces su potencia (la afinidad de algunos opiáceos y opioides al receptor MOR puede ser consultada en la tabla 1). Tiene usos médicos, por lo que se expende en tabletas/cápsulas de 5-30 mg (Oxycontin, comercializado por Purdue Pharma de 1995) para su uso oral. Su efecto analgésico se empieza a sentir en 15 minutos y dura aproximadamente 6 h. Se puede encontrar en combinación con ácido acetilsalicílico o paracetamol (Percocet). Su prescripción es para controlar el dolor crónico intenso. En el año 2020, se extendieron aproximadamente 13 millones de recetas. También parece tener un efecto benéfico sobre el síndrome de Tourette y sobre el síndrome de piernas inquietas. Se ha creído que la presentación con paracetamol reduce su potencial adictivo, pero esto no está sistemáticamente probado y parece improbable. A las dosis usualmente recomendadas para el tratamiento del dolor, el paciente no desarrolla tolerancia ni dependencia hasta pasadas varias semanas, aproximadamente 8 o más.
Tabla 1 Afinidad de algunos opiáceos/opioides al receptor MOR
| Opioide/opiáceo | Constante de Inhibición Ki (nM) al MOR |
|---|---|
| Leu-encefalina | 9.5 |
| Met-encefalina | 2.2 |
| Beta-endorfina | 1.8 |
| Dinorfina | 7.6 |
| Morfina | 1.4 |
| CodeC-na | 734 |
| Oxicodona | 25.90 |
| Fentanilo | 1.35 |
| Carfentanilo | 0.22 |
| Alfentanilo | 7.39 |
| Sufentanilo | 0.138 |
| Tramadol | 2100.00 |
| Naloxona | 14.00 |
| Metadona | 3.38 |
| Buprenorfina | 0.216 |
Sin embargo, su uso no médico sí provoca adicción. Debido a su alto poder para producir una sensación placentera, es apreciada en el mercado negro. Se han registrado asaltos a farmacias en Estados Unidos, con el solo propósito de robar oxicodona. Su precio en el mercado negro es de 50 centavos a un dólar por miligramo. Al considerar que, en el 2009, el miligramo de oro se cotizaba en 3 centavos de dólar, entonces el gramo está en 30 pesos, mientras que el gramo de oxicodona está entre 1,500 a 3,000 pesos.
OPIOIDES SINTÉTICOS
La familia fentanilo
Esta es una familia de opioides sintéticos que activan preferentemente al receptor MOR. Entre ellos se encuentran el fentanilo, el carfentanilo, el alfentanilo, sufentanilo y otros. Se han usado como coadyuvantes en anestesia, desde que se autorizó el uso del fentanilo por la Food and Drug Administration (FDA), en 1968. La mayoría de estos opioides se utilizan combinados con el propofol que es un anestésico cuyo mecanismo de acción no está claro, aunque se sugiere que puede estar mediado por el sistema GABAérgico.
El fentanilo
Es una molécula que fue sintetizada por Paul Janssen y su equipo en los laboratorios Janssen en 1960. Está en la lista de medicamentos esenciales de la Organización Mundial de la Salud. El fentanilo es 50-100 veces más potente que la morfina y sus efectos son mediados por los MOR. Su administración endovenosa provoca efectos anestésicos en los primeros 30 segundos y alcanza un máximo a los 15 minutos, teniendo una duración media clínica de 60 minutos. El efecto epidural puede durar hasta 2 horas.
En la década de los 80 se autorizó su prescripción para el control del dolor y la solución inyectable se puede administrar vía endovenosa o epidural. Se puede administrar por vía transdérmica por medio de parches o por vía oral, por tabletas dispersables sublinguales. También hay atomizadores para administración intranasal. Las presentaciones que existen en Estados Unidos contienen desde 50 a 800 microgramos.
El carfentanilo
Es otro opioide sintético de esta familia, y que también fue sintetizado por Paul Janssen y su equipo en 1972; se ha usado con fines anestésicos en animales de gran envergadura, como elefantes, osos y otros. Su potencia se estima que es de 10,000 veces la de la morfina, 4,000 veces la de la heroína y 100 veces la del fentanilo. Su administración es intramuscular, con dardos que se disparan a la distancia.
Otros miembros de la familia fentanilo
El alfentanilo, producido por Janssen en 1976, tiene un 20-30% de la potencia del fentanilo. Su efecto es a través de los MOR. Su uso médico se considera más seguro que el fentanilo por su duración corta. Asimismo, el remifentanilo, agonista de los MOR, el cual tiene una potencia 15 veces la del fentanilo, pero una duración ultracorta, aproximadamente 5 minutos. El sufentanilo es el miembro de la familia con una potencia de mil veces la de la morfina y con una duración media de cerca de 3 horas. Tiene una acción selectiva sobre los MOR
Tramadol
Este fármaco es altamente prescrito por los médicos para el control del dolor moderado a grave. Sus efectos los ejerce interaccionando con los receptores MOR, KOR y DOR, pero con mayor afinidad por los MOR. La presentación en la mayoría de los países es en tabletas y las dosis frecuentemente usadas para el control del dolor son entre 50-100 mg. Sin embargo, el uso frecuente de dosis arriba de 200 mg induce los mismos efectos reforzantes que la morfina.
LA TOLERANCIA A LOS EFECTOS
Los opiáceos y opioides inducen tolerancia a sus efectos y así se propicia la adicción. Los mecanismos de tolerancia incluyen la baja disponibilidad del receptor MOR, por lo que los opioides ya no inducen su efecto indirecto sobre las neuronas dopaminérgicas; es decir, ya no producen la masiva liberación de dopamina y por lo mismo, la sensación subjetiva de placer se reduce. A pesar de que esta tolerancia participa de manera crucial en la generación de la adicción, y que se discutirá brevemente en la siguiente sección, en el área clínica también es preocupante. Aquí representa un grave problema cuando se trata de mantener bajo sus efectos analgésicos a un paciente que se queja de dolor extremo por una condición médica. En este tipo de pacientes, la frecuencia con que se debe administrar la morfina hace que se desarrolle tolerancia con gran rapidez. Un paciente puede pasar de recibir 50-60 mg por día a 500 mg por día en un período tan breve como 10 días. Claramente, este factor representa un enorme costo para el paciente y para el usuario recreativo. El costo, como ya sugerimos, no solo es en dinero, sino que las altas dosis ponen en riesgo la vida del sujeto por inducir depresión respiratoria.
HIPERALGESIA
La hiperalgesia por uso de opioides es un efecto paradójico indeseado28. La hiperalgesia es el aumento de la sensibilidad al dolor. Esta se presenta, en el caso de los opioides, una vez que ya no está presente el efecto de analgésico29. Se ha observado con frecuencia cuando se usa remifentanilo30 en una intervención quirúrgica. Se sabe que la hiperalgesia es ocasionada por cambios plásticos en el sistema nervioso central y periférico que producen una sensibilización de las vías nociceptivas. Recientemente se ha documentado que hay cambios plásticos en el núcleo talámico ventroposterolateral30. La consideración de este efecto durante el tratamiento con opioides es de relevancia médica, ya que tiene que ser identificado en el paciente lo antes posible. El tratamiento para la hiperalgesia por uso de opioides es dependiente del tipo de opioide que provocó la hiperalgesia y/o de la posología. Los tratamientos suelen ser la reducción de las dosis, el tratamiento complementario con moduladores de los receptores de N-metil-D-aspartato (NMDA) como ketamina, metadona, dextrometorfano y otros como la gabapentina, el propofol e inhibidores de la COX230,31.
LOS OPIOIDES Y EL SISTEMA DE RECOMPENSA
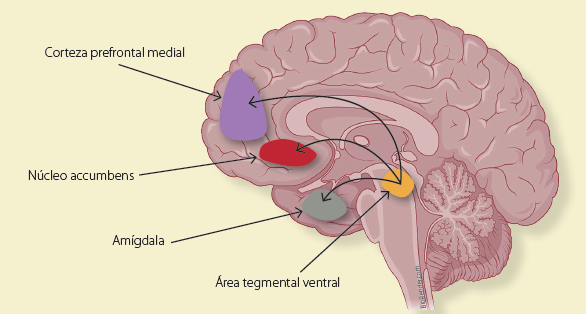
Los efectos reforzadores que producen los opiáceos y opioides son inicialmente mediados por la activación del sistema de motivación y recompensa. Este sistema, formado por el área tegmental ventral (ATV) y el núcleo accumbens (NAc), para modular la motivación, el ATV y la corteza prefrontal medial (CPFm) para regular la recompensa (figura 1), tiene una gran cantidad de neuronas dopaminérgicas. Las neuronas GABAérgicas, que se encuentran en el ATV, pero que en su mayoría están en un área llamada región rostromedial tegmental (RMTg) o cola de la ATV, inhiben a las células dopaminérgicas de la ATV, de tal manera que reducen la motivación y sensación de placer. Lo que hacen los opiáceos/opioides es reducir la actividad de las neuronas GABAérgicas y consecuentemente aumentan la actividad de las neuronas dopaminérgicas, produciendo así un aumento de la motivación por consumirlas y en la sensación placentera. Esto es un reforzamiento positivo, ya que los opiáceos/opioides provocan una sensación de placer que hace que el usuario quiera volver a sentirla. Sin embargo, esta gratificación solo ocurre con las primeras administraciones. Pasado un tiempo y dependiendo de la cantidad y frecuencia con que se administren estos opiáceos/opioides, el sistema de recompensa dejará de responder al efecto, ya que los receptores MOR que regulan a la baja a la actividad GABAérgica se endocitan32, por lo que las neuronas GABAérgicas ya no se inhiben en presencia el opioide, y regresan a ejercer el efecto inhibidor que producían en las neuronas dopaminérgicas, con ello hay una caída en la liberación de dopamina33. El consumo alto y prolongado, simultáneamente provocará que se desarrolle la respuesta del sistema de defensa.
LOS OPIOIDES Y EL SISTEMA DE DEFENSA
Durante el síndrome de abstinencia, el paciente cursa con una serie de eventos que lo llevarán a sentirse extremadamente mal. Estos signos y síntomas son mediados por el sistema de defensa, que básicamente está formado por el complejo amigdalino (Ami), el núcleo cama de la estría terminal (NCST), el núcleo paraventricular hipotalámico (PVN), el lóbulo de la ínsula, la circunvolución del cíngulo anterior, entre otras (figura 2). Así que, cuando el usuario deja de consumir por un periodo de horas, en el cerebro hay una enorme liberación de noradrenalina, que hará que el sujeto entre en un estado de hiperalerta. Hay una reducción de la dopamina en el NAc y un incremento del factor liberador de corticotropina (CRF) proveniente del PVN que se libera en la amígdala34,35. Las neuronas de la amígdala que expresan el receptor CRFR1 y que proyectan a la región más caudal del NAc36, son activadas y promueven la búsqueda de los opioides. Esto es un reforzamiento negativo, ya que el usuario busca consumir las drogas porque siente el síndrome de abstinencia y las drogas lo disminuyen. La actividad del sistema de defensa subyace al síndrome de abstinencia: deseo intenso por la droga, irritabilidad, escalofríos, fiebre, sudoración, depresión, náusea y vómito, aumento de la frecuencia respiratoria que progresa a depresión debido a parálisis de la musculatura torácica que induce rigidez torácica (pecho de madera), y dolor intensísimo en todo el cuerpo. Con todo, para evitar este síndrome, el usuario recurre a una dosis que puede ser letal.
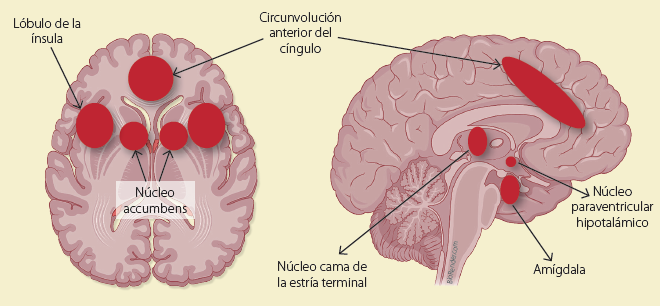
Figura 2 Sistema de defensa. Muestra algunas de las áreas que se ven afectadas durante el síndrome de abstinencia: la amígdala, el núcleo de la estría terminal, el núcleo paraventricular hipotálamico, el lóbulo de la ínsula, la circunvalación del cingulo anterior y el núcleo accumbens en el que hay una reducción de la dopamina.
SOBREDOSIS DE OPIOIDES Y MUERTE
El fentanilo
En el año 2019, el fentanilo se recetó en Estados Unidos alrededor de 3.2 millones de veces; en 2020, 2.7 millones de veces; y en 2021, se prescribió 2.4 millones de veces37. Durante el 2017, se recetó aproximadamente 5 millones de veces y este es el año en que se registraron más muertes por sobredosis de fentanilo. En números redondos, al fentanilo se le atribuyeron cerca de 30 mil muertes. El año anterior se había estimado que la sobredosis de fentanilo había matado a cerca de 20 mil usuarios, y en el 2020, se estimó que el número de muertes fue de 57 mil38. En México, en noviembre del 2022, los medios difundieron que en Nuevo León se habían decomisado 20 mil pastillas de fentanilo, lo que sugirió que en México la producción clandestina y el uso no médico va en aumento. El efecto indeseado que pone en peligro la vida es la depresión respiratoria, que puede llevar a la muerte si no se detecta y atiende. Esta depresión es potenciada por alcohol y benzodiacepinas.
La heroína
La UNODC, en 2022, reportó que desde 2015 se ha registrado un millón de usuarios de heroína en Estado s Unidos. También reporta que han muerto alrededor de entre 10 mil a 15 mil personas por sobredosis de heroína, desde el 2014 hasta el 2020 (figura 3). Los Centros de Integración Juvenil reportan que Chihuahua es uno de los estados del país con más consumo de heroína (13%). La UNODC, en 2022, reporta que en 2019 en México se estaba asistiendo a cerca de 120 mil personas para que pudieran controlar su consumo de heroína.
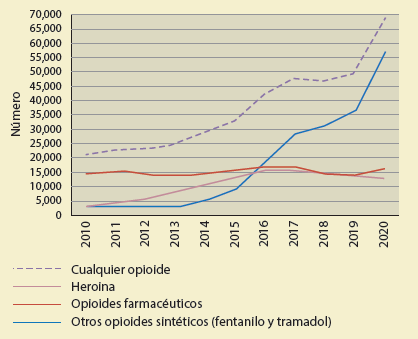
Gráfico basado en: United States, Centers for Disease control and Prevention, National Center for Health Statistics, Datos online del Epidemiologic Research (CDC WONDER, https://wonder.cdc.gov/mcd.html). Disponible en: https://nida.nih.gov/sites/default/files/Overdose_data_1999-2020_15.22.xlsx
Figura 3 Tendencia en las muertes por sobredosis de opioides por tipo de droga principal (considerada sola o en combinación con otras sustancias), Estados Unidos, 2010-2020.
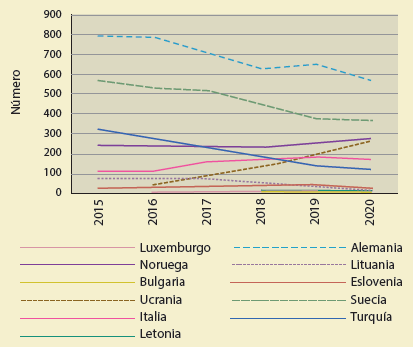
El tramadol
En países como el Reino Unido, Finlandia, Francia y otros, en los que se ha estimado el número de muertes inducidas por tramadol, se han reportado alrededor de 50 a 300 muertes en 202018 (figura 4). Lo más alarmante del tramadol es que en la mayoría de los países, México incluido, se expende sin receta médica y no se tiene un estimado de cuánto se receta o consume.
Fuente: UNDOC, respuestas al cuestionario de informe anual; EMCDDA, “Statistical Bulletin 2021”, y Trimbos Institute. “Nationale Drug Monitor”, “5.7.3 Sterfte in Nederland” (disponible en: http://.www. nationaledrugmonitor.nl/opiaten-sterfte-in-nederland/(in Dutch)).
Figura 4 Tendencia en las muertes relacionadas directamente con los opioides en países europeos seleccionados, 2015-2020.
El fármaco que es de gran utilidad en antagonizar el efecto agudo de los opiáceos y opioides, y que ha salvado la vida a personas severamente intoxicadas con los opioides, es la naloxona.
TRATAMIENTO AGUDO Y CRÓNICO DE LA DEPENDENCIA A LOS OPIOIDES
Naloxona
Es un fármaco que interacciona con los receptores de opioides endógenos, MOR, KOR y DOR, ero como antagonista. Desde su presentación en el mercado en 1961, hasta el momento, la literatura científica ha mostrado que la naloxona no tiene propiedades psicotrópicas y no tiene potencial adictivo. En 1971, la FDA la aprobó para su uso en casos de intoxicación aguda por opioides/opiáceos ya que el usuario puede morir por depresión respiratoria, y la naloxona lo protege en minutos de este efecto. La naloxona no se puede vender sin receta médica, está clasificada en el artículo 245 en la fracción IV de la Ley General de Salud de México. En México, el tratamiento por uso de opioides ha ido en aumento de 2011 a 2019 y ha mostrado una diminución en el 2020 (figura 5). El fentanilo es uno de los opioides que más muertes ha causado en Estados Unidos y uno de los aspectos a considerar es que un paciente intoxicado puede morir en minutos. Trasladar a una persona intoxicada a un hospital o centro de atención puede ocupar un tiempo que resulta vital. Tener naloxona en todo momento o tener la opción de comprarla sin receta médica puede salvar la vida del usuario. El 15 de julio de 2022, la Comisión de Salud del Senado de la República Mexicana avaló el retiro de la naloxona del artículo 245, fracción 4, para que su venta no requiera receta médica.
La naloxona se administra por vía endovenosa (2 mg), y produce un efecto rápido en 2 minutos; mientras que su administración intramuscular tiene una latencia de 5 minutos. Su vida media es de 60-90 minutos en el adulto. El atomizador para administración intranasal, aprobado por la FDA en 2015, tiene una sola aplicación con 2-4 mg y tiene una latencia de 20 minutos, la ventaja es que es más fácil de traer consigo. En mayo del 2021, la misma FDA aprobó una dosis más alta, de 8 mg, para administración intranasal.
Metadona
Es un fármaco sintético que se elaboró por Gustav Ehrhart y Max Bockemühl en 1939, en los laboratorios I. G. Farbenkonzern en Frankfurt, Alemania, al cual le asignaron el número Va 10820 y posteriormente llamaron amidon39. Se ha mostrado que es ligeramente más potente que la morfina. En 1947, la llamaron metadona y fue autorizada por la FDA para control del dolor. A partir de 1972, la FDA también la aprobó para el tratamiento de la adicción a opioides. Interacciona con los receptores MOR con mayor afinidad que con los otros receptores opioides. Se prescribe en una dosis inicial de 30 mg/ día y se titula lentamente hasta los 80-150 mg/día. La presentación es una solución para administración oral en tabletas solubles en agua. Debido a que sus efectos son prolongados, 8-36 h, es muy útil para reducir el síndrome llamado hambre por opioides y controlar el síndrome de abstinencia. No está exenta de efectos colaterales, uno fundamental es el de la depresión respiratoria. La sobredosis por metadona ha matado a cientos de usuarios, sobre todo cuando la combinan con benzodiacepinas.
Buprenorfina
Fue inicialmente sintetizada a partir de tebaína y comercializada por los laboratorios Reckitt-Colman, en 1981, para control del dolor. Es un agonista parcial de los receptores MOR, pero tiene una mayor actividad analgésica que la morfina. Tiene efectos analgésicos con una dosis de 200 microgramos. Asimismo, bloquea parcialmente los efectos de los opioides, i.e., heroína, fentanilo, por lo que resulta útil en el tratamiento de la adicción a opioides, aunque el tratamiento depende de una dosis mucho mayor, alrededor de 2 mg. La buprenorfina se aprobó por la FDA para el control de la adicción a opioides en 200240. Actualmente se comercializa para su administración parenteral: intramuscular o endovenosa y como parches para administración transcutánea. La buprenorfina se ha administrado en combinación con naloxona en tabletas sublinguales (2 mg/0.5 mg; 8 mg/2 mg). Las guías publicadas por la Substance Abuse and Mental Health Services Administration (SAMHSA) ofrecen un claro esquema de cómo iniciar el tratamiento de desintoxicación y mantenimiento de la rehabilitación de la adicción a opioides.
CONCLUSIONES
Como se puede apreciar, la morfina y los compuestos afines son altamente apreciados en la medicina clínica, pero también por los usuarios buscadores de placer. Es fascinante conocer cómo esta droga ha acompañado al humano a lo largo de su historia y no se puede negar que ha jugado una función crítica en generar felicidad. Con felicidad no nos referimos solo a su capacidad para mitigar la nocicepción y el dolor, sino a su capacidad para producir placer.
Este tipo de moléculas nos sugieren que, dentro de la fisiología del cerebro, el dolor y el placer son polos opuestos regulados por sistemas que se autorregulan como procesos oponentes. Claramente, cuando uno se activa se reduce la actividad del oponente.
El opio y sus derivados y análogos son capaces de inclinar la balanza hacia la reducción de la nocicepción y del dolor y el aumento del placer, pero no por mucho tiempo. Poco a poco su eficacia para producir placer y mitigar el dolor se reduce y la balanza se inclina ahora hacia el sufrimiento. Así que el usuario tiene que aumentar la dosis tanto, que llega un momento en que ingiere estas sustancias ya no para sentir placer, si no para reducir el sufrimiento que siente. El usuario con el uso frecuente de opio o sus derivados y análogos va fortaleciendo lenta y sistemáticamente a ese sistema de dolor físico y afectivo que en algún momento cobrará tal fuerza que ninguna dosis de opio lo detendrá. Muchos de ellos solo encontrarán alivio con una sobredosis de heroína o similares, que corre el riesgo de matarlos.
Detrás de toda esta tragicomedia, tipo Woody Allen, está el cerebro, con su exigencia de mantener los polos balanceados. El cerebro sabe cuándo estar feliz y cuándo triste, cuándo llorar y cuándo reír. Lo demás son fuegos de artificio que se apagarán y ojalá solo desaparecieran, pero la felicidad artificialmente generada por estas sustancias produce un monstruo de infelicidad, de ansiedad y de dolor que acecha al usuario hasta que el tratamiento implementado por un grupo de expertos, le dé una segunda oportunidad.











 text new page (beta)
text new page (beta)