INTRODUCCIÓN
La función y la estructura del tejido nervioso siguen siendo un tema relevante de estudio, ya que con las nuevas posibilidades técnicas en imagenología para identificar, en el momento, los cambios estructurales que ocurren -a la par de las funciones que interesa explorar-, se ha podido entender la relación morfofuncional. Santiago Ramón y Cajal, desde 1888, describió el tejido nervioso de diversas especies, con la ayuda de las técnicas de impregnaciones argénticas1. Aún ahora, sus dibujos asombran por su detalle y acuciosidad, si recordamos que su herramienta era un microscopio de luz, además de su gran interés por la estructura del sistema nervioso.
Además de ilustrar las formas de las diferentes neuronas, también mostró la comunicación entre ellas: la sinapsis; este investigador describió unas estructuras, en las dendritas, a las que llamó espinas dendríticas1.
Haremos una breve descripción de la sinapsis y detallaremos la estructura y función de las espinas dendríticas, estructuras de gran relevancia en la memoria y el aprendizaje; de igual forma abordaremos brevemente algunos de los estados patológicos en donde estas pequeñas estructuras pueden presentar cambios y, como resultado, afectar su función (Tabla 1).
Tabla 1 Cambios morfológicos en las espinas dendríticas y su relación con diversas entidades nosológicas
| Patología |
Disminución en la densidad espinosa |
Aumento en la densidad espinosa (como mecanismo de protección) |
Menor arborización dendrítica |
Alteraciones en forma |
Tamaño | |
| Pequeño | Grande | |||||
| Enfermedad de Alzheimer20 | * | * | * | * | ||
| Enfermedad de Parkinson20 | * | * | ||||
| Demencia fronto-temporal20 | * | * | ||||
| Enfermedad de Huntington20 | * Etapas tardías |
* Etapas tempranas |
* Etapas tardías |
* | ||
| Esclerosis lateral amiotrófica 20 | * | |||||
| Abuso de alcohol 4 | * | |||||
| Uso de drogas estimulantes23 | * | |||||
| Encefalitis espongiforme4 | * | |||||
| Malnutrición4 | * | |||||
| Síndrome de Down y retardo mental4 | * | * | * | |||
| Epilepsia4 | * | * | ||||
| Alteraciones metabólicas25,26 | * | * | ||||
| Trastorno de ansiedad y trastorno depresivo mayor27-31 | * | * | ||||
| Esquizofrenia24 | * | * | ||||
| Enfermedad de Pick y de Creutzfelt Jacob4 | * | * | ||||
| Deprivación de sueño32 | * De forma crónica |
* De forma aguda |
* | |||
DE: densidad espinosa.
La comunicación entre las neuronas
Las sinapsis son sitios de comunicación neuronal presentes en todas las estructuras cerebrales. La forma más común de contacto se establece en pequeñas estructuras membranosas ricas en actina, que sobresalen de la dendrita, llamadas espinas dendríticas (ED), y su morfología es un poderoso y cuantificable índice de los circuitos cerebrales, ya que las ED, al ser sitios de sinapsis glutamatérgicas, pueden regular la cantidad de sinapsis excitatorias en una determinada región del cerebro2,3.
Las espinas dendríticas
En un inicio, Santiago Ramón y Cajal, quien dio nombre a estas estructuras y las describió como “protuberancias postisinápticas”1, realizó sus descripciones basado en el método de impregnación argéntica de Golgi, técnica que aún es de gran utilidad para el estudio del sistema nervioso, ya que ha ayudado a identificar alteraciones morfológicas asociadas a varios desórdenes del sistema nervioso. Con este método se logran distinguir fácilmente las ED con microscopía de campo claro, como protuberancias que surgen de las dendritas4. Posteriormente, con el poder de resolución del microscopio electrónico, se confirmó que las espinas dendríticas son estructuras postsinápticas que establecen el contacto sináptico con las terminales del axón y que forman parte de la porción postsináptica de la mayoría de las sinapsis excitatorias, cuya principal función es la compartimentalización e integración de las señales locales2-5. De esta, forma al conocer ampliamente su función, el estudio de su ultraestructura, densidad y plasticidad nos permite establecer una correlación entre su morfología y funciones cognitivas como el aprendizaje y la memoria6,7.
Las diferencias en la morfología de las espinas dendríticas
La estructura de las espinas dendríticas clásicas consiste en una cabeza conectada con el eje dendrítico por un cuello estrecho; en la cabeza se identifica la densidad postsináptica (PSD) la cual tiene receptores, canales y sistemas de señalización involucrados en la transmisión sináptica así como proteínas involucradas en la plasticidad sináptica8. Algunas espinas presentan retículo endoplásmico liso (aparato espinoso) el cual participa en la modulación de la concentración de calcio intracelular9. La forma de las espinas dendríticas (ED) es relevante para su función como compartimiento eléctrico o bioquímico de la sinapsis10.
Una de las características más llamativas de las espinas dendríticas, especialmente en las neuronas piramidales, es su diversidad morfológica. Se han identificado diversas formas de espinas dendríticas: espinas en forma de hongo que tienen una gran cabeza y un cuello delgado; éstas son formas maduras de ED, son ricas en F-actina y G-actina; las espinas pequeñas que tienen una cabeza grande pero no tienen cuello perceptible, las espinas delgadas, tipo filipoideas, las cuales son protuberancias delgadas, sin cabeza visible, bifurcadas y multirramificadas11,12; se han descrito las espinas en forma de copa, que se encuentran durante el desarrollo del sistema nervioso, por lo que son formas inmaduras13. La ED delgadas y pequeñas poseen mayor motilidad y suelen ser transitorias que establecen sinapsis débiles; mientras que las espinas grandes y en forma de hongo son más estables y forman sinapsis más fuertes, ya que su densidad postináptica proporciona mayor superficie de contacto (Figura 1)13,14. Morfológicamente las espinas pueden adoptar diversas formas, que pueden variar de acuerdo con su grado de madurez (Figuras 2, 3 y 4)13. El desarrollo de tecnologías de microscopía de alta resolución han permitido revelar la heterogeniedad en la morfología de éstas12.
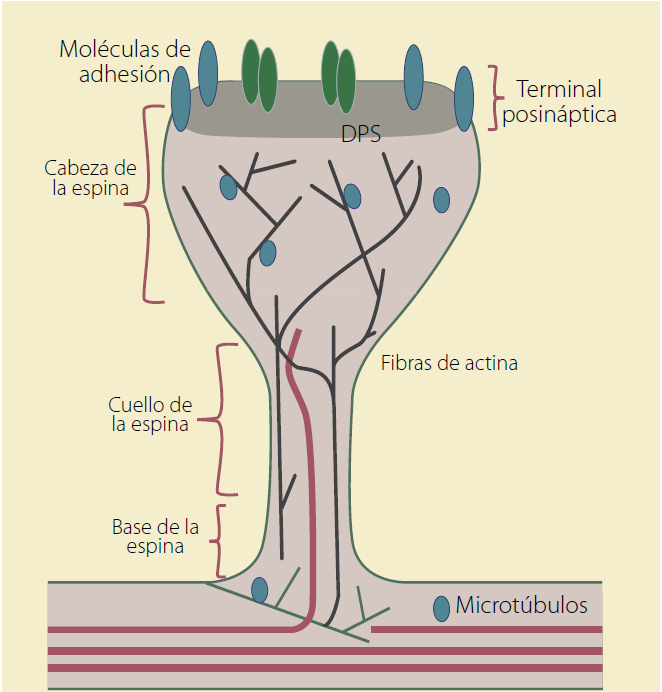
Figura 1 Representación esquemática de las diversas formas de espinas dendríticas: filipodia, delgada, cortas, en forma copa y hongo. (Modificada de Nathalie L, et al. 20121).

Figura 2 Representación esquemática de una espina en forma de hongo en donde se muestran los elementos más representativos de su citoesqueleto. ( Modificada de Hotulainen P, et al. 201033.
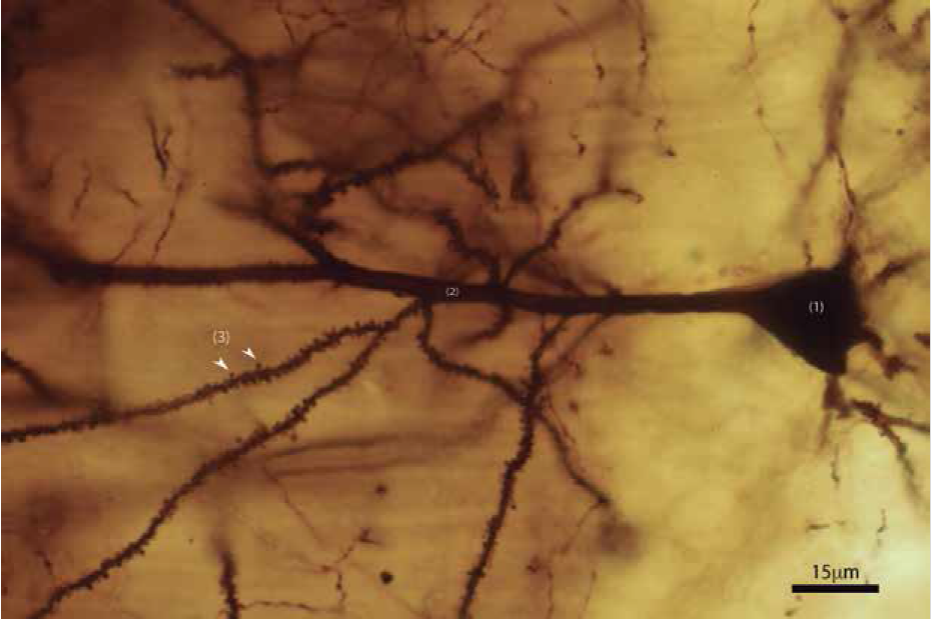
Foto: otorgada por los autores
Figura 3 Micrografía en campo claro de espinas dendríticas en una neurona piramidal de hipocampo CA1 procesada con técnica de Golgi 100x, en donde se muestran diferentes partes de la neurona: 1) cuerpo neuronal, 2) dendrita apical y 3) espinas dendríticas en una dendrita terciaria.

Foto: otorgada por los autores
Figura 4 Micrografía en campo claro de espinas dendríticas de una neurona piramidal de hipocampo CA1 procesada con técnica de Golgi, en donde se muestran diferentes tipos de espinas: a) en forma de hongo, b) de cuello corto y c) delgada.
Se ha descrito la participación de las espinas dendríticas en diversas funciones, como: incrementar el área receptiva optimizando la interconectividad neuronal mediante el contacto sináptico que se establece con la porción presináptica, también mantienen la potenciación a largo plazo y regulan la dinámica del calcio4,15.
Su tamaño y morfología dependen del tipo de neurona y de diversos factores como estado hormonal, manipulación farmacológica actividad sináptica etc.; miden entre 0.5-2 (m de longitud, aunque las espinas de las neuronas piramidales de CA3 del hipocampo pueden medir hasta 6 mm16.
Densidad espinosa
Las ED se distribuyen equitativamente a lo largo del árbol dendrítico; sin embargo, en las neuronas piramidales neocorticales se encuentran ausentes en la poción inicial de la dendrita apical y su densidad aumenta de forma exponencial conforme aumenta la distancia desde el soma.
La densidad espinosa (DE) varía de neurona a neurona, la estimación exacta puede realizarse mediante la técnica de Golgi, técnicas de fluorescencia, microscopía confocal o con microscopía de reconstrucción óptica. Independientemente de su tamaño, se estiman de 2 a 4 espinas por micrómetro en una dendrita madura de una neurona piramidal de CA-1 del hipocampo, neuronas granulosas del hipocampo, mientras que en las células de Purkinje se encuentra un número de espinas mayor a 10 por micrómetro17,18.
Espinas dendríticas y su relación con algunas patologías del sistema nervioso central
Las alteraciones patológicas de las espinas dendríticas se pueden clasificar en 2 categorías: las que afectan su distribución y aquellas que afectan su morfología4.
Los cambios en la distribución incluyen: incremento o decremento en la DE, así como espinas en localización ectópica. Las alteraciones en la morfología incluyen: disminución del tamaño, cambio de forma, hipertrofia del aparato espinoso, incremento el la densidad del citoplasma, aumento del volumen y formación de sinapsis aberrantes4.
Existen diferentes condiciones que conducen a un decremento en el número de espinas dendríticas debido a la agenesia de éstas, como sucede en el retraso mental, malnutrición, intoxicaciones, abuso de alcohol, epilepsia, encefalitis espongiforme y enfermedades neurodegenerativas, entre otras4.
La disminución en el número de espinas dendríticas puede ser causada por la pérdida neuronal y por la pérdida de axones que realizan sinapsis con las ED y, como consecuencia, se retraen al sufrir deaferentación, como se observa en muchas formas de retraso mental, infecciones prenatales, malnutrición, exposición a toxinas, epilepsia, encefalitis por priones y varios tipos de enfermedades neurodegenerativas4. Sin embargo, la pérdida de ED no siempre guarda relación con la pérdida axonal. La pérdida de ED que ocurre en días posteriores a la deaferentación, frecuentemente va seguida de un brote reactivo de nuevas aferencias con una recuperación parcial del número de ED, y si estas nuevas aferencias también son destruidas, la recuperación es menor4,19,20.
El incremento en el número de espinas se presenta de forma normal durante el desarrollo del sistema nervioso, donde posterior a un exceso de sinapsis y de ED ocurre una poda de estas hasta llegar a la DE habitual. La interrupción de esta poda puede explicar el incremento de la DE en patologías que interfieran con la madurez del sistema nervioso21. Sin embargo, también ocurre un exceso de ED en la formación reticular, el núcleo vagal y ventrolateral de la médula espinal de niños con síndrome de muerte súbita infantil22, aparentemente relacionado con el fracaso en la falta de eliminación de las sinapsis durante el desarrollo, y a su vez relacionado con la falla cardiorespiratoria que se presenta en esta patología22.
Otro ejemplo de aumento en la DE de forma patológica es en el uso de drogas psicoestimulantes, el cual conduce a un incremento en la DE23; sin embargo, se desconoce el mecanismo por lo que ocurre esto, en algunos casos, la atrofia de las dendritas es tan severa que las pocas existentes pueden mostrar mayor número de ED para compensar esta pérdida4.
La densidad y tamaño de las ED se pueden reducir en la corteza prefontal de pacientes con esquizofrenia, con desorden bipolar y en la corteza motora de niños con síndrome de Down24.
Las alteraciones en la morfología de las espinas dendríticas se presenta en muchas formas de retraso mental, a menudo se ven espinas largas, tortuosas, con protuberancias y con una cabeza mal definida, morfología similar a la que tienen las espinas durante el desarrollo, debido a la deaferentación, ya que ésta produce distorsión de las ED.
Otra alteración de la morfología de las ED es la formación de varicosidades acompañada de pérdida de ED que aparecen como consecuencia del daño neuronal que se observa en la excitotoxicidad causada por anoxia o isquemia y en casos de epilepsia y en enfermedades neurodegenerativas como la enfermedad de Huntington, Alzheimer, enfermedad de Pick y de Creutzfelt-Jakob20.
De igual forma, alteraciones metabólicas como estados de hiperglucemia y el síndrome metabólico se han propuesto como factores de riesgo importantes para el desarrollo de demencias como la enfermedad de Alzheimer.
En modelos animales se ha demostrado una asociación entre alteraciones en la regulación de la glucosa y alteraciones en la memoria y el aprendizaje; estas alteraciones podrían explicarse a través de modificaciones en las dendritas del hipocampo, en el que se puede observar una menor arborización dendrítica y pérdida de ED observadas en modelos animales de síndrome metabólico, diabetes mellitus y consumo de bebidas azucaradas25,26.
Alteraciones en las ED en el trastorno de ansiedad y el trastorno depresivo mayor
El hipocampo es una estructura muy sensible al estrés y también altamente involucrada con la interacción con el medio y la asociación de los estímulos que son potencialmente dañinos. En el hipocampo el estrés crónico genera retracción de las ED y disminución en la arborización de las dendritas, especialmente en la región CA3, aunque este fenómeno también se observa de manera similar en CA1 y en el giro dentado.
Asimismo el estrés crónico provoca pérdida de ED27. En estudios postmortem en humanos que han experimentado un gran distrés psicológico se han observado cambios estructurales regresivos. Dentro de los mecanismos mediante los cuales el estrés crónico puede provocar cambios estructurales en las ED se propone que un aumento en los niveles de glucocorticoides, los cuales se elevan en respuesta a situaciones de estrés, induce atrofia en el hipocampo; asimismo, el aumento en los niveles de glutamato, que actúa a través de los receptores NMDA aumentando el tono serotoninerigico (excitatorio) e inhibe a las sinapsis inhibitorias por alteración de las interneuronas inhibitorias y ácido gamma-aminobutírico (GABA)28. Otras neurotrofinas como el factor neurotrófico derivado de cerebro (BNF), la hormona liberadora de corticotropina (CRH), el activador de plasminógeno de proteasa extracelular (tPA) y la glicoproteína transmembrana M6a, son factores que intervienen en alteraciones de la plasticidad de las ED en situaciones de estrés crónico29.
Los trastornos de ansiedad se caracterizan por presentar temor excesivo en respuesta a situaciones que no representan un daño o peligro potencial; su prevalencia en la población general es de hasta 30%. Los síntomas más comunes que caracterizan a este trastorno son: alteración cognitiva, aprehensión, pobre capacidad de concentración y depresión del afecto; diversas regiones del cerebro actúan en conjunto para mediar los síntomas de la ansiedad, tanto normales como anormales; sin embargo, algunas tienen mayor relevancia, como son el hipocampo, la región prefrontal y la amígdala. Las neuronas de estas regiones presentan una alta capacidad plástica y presentan transformaciones importantes que dependen de la actividad, ya que se presentan cambios morfológicos en las ED que responden a un ambiente dañino, como son el cambio de la forma y el aumento de longitud de la densidad sináptica y de receptores AMPA (receptor glutamatergico, del ácido a-amino-3-hidroxi-5metilo-4-isoxazolpropiónico), por lo que las espinas dendríticas son componentes cruciales que inducen, en el largo plazo, cambios en la función sináptica, plasticidad y patrones de conectividad ante situaciones de estrés, como un mecanismo de adaptación a situaciones que generan ansiedad. Estos mecanismos podrían verse afectados en condiciones donde la ansiedad sea patológica30.
El trastorno depresivo mayor es una enfermedad con elevada prevalencia que causa grandes pérdidas tanto materiales como humanas. En modelos animales de depresión se han observado cambios estructurales en las dendritas, como es la disminución en la arborización dendrítica y la disminución de la DE en el hipocampo y corteza prefrontal; por otra parte se aprecia una mayor DE en la amígdala y el núcleo accumbens basolateral; estas alteraciones en la conectividad de las sinapsis podrían explicar los síntomas conductuales de la depresión. De igual manera existe evidencia de que el tratamiento antidepresivo crónico puede evitar o revertir las alteraciones que ocurren en las sinapsis espinodendríticas provocadas por el estrés31.
Enfermedades neurodegenerativas y espinas dendríticas
En las enfermedades neurodegenerativas se ha observado muerte neuronal, acumulación anormal de proteínas y evidente alteración en las espinas dendríticas, como en la enfermedad de Alzheimer (EA), la cual es la principal causa de demencia en personas de edad avanzada4, el avance en los estudios de neuroimagen podría ser una herramienta para la detección temprana de esta enfermedad, ya que se ha encontrado que las alteraciones fisiopatológicas comienzan décadas antes de que ocurran las manifestaciones clínicas. La degeneración dendrítica y la pérdida de ED en EA se han descrito principalmente en la corteza perirrinal, endorrinal, en hipocampo, así como en la corteza auditiva, y en los casos tempranos de EA se ha reportado una reducción significativa de la arborización dendrítica, así como de las espinas dendríticas en la corteza visual y auditiva lo que se relaciona con la presencia de depósitos de ( amiloide y con el deterioro gradual de la precepción visual y auditiva de las personas con EA20.
De 30 a 50% de los sujetos de edad avanzada que padecen EA nunca muestran manifestaciones clínicas en su vida, por lo que se han propuesto mecanismos de resiliencia cognitiva en personas con esta entidad patológica. La pérdida de la sinapsis neuronal muestra una correlación más fuerte con el deterioro cognitivo que los marcadores patológicos clásicos de EA, por lo que la remodelación sináptica podría ser un factor que contribuye a la resiliencia cognitiva para proteger a los individuos con EA.
Estudios recientes postmortem en personas con EA han mostrado que la DE es menor en personas con EA clínicamente evidente y que además muestran menos espinas en forma de hongo y delgadas en comparación con los controles, y que es similar entre sujetos control y sujetos que albergan EA pero no tienen manifestaciones clínicas y que en éstos la extensión de las espinas es mayor comparada con controles y con EA manifiesta. Por lo que estas observaciones proporcionan evidencia celular que respalda la hipótesis de que la plasticidad de las espinas dendríticas proporciona un mecanismo de resiliencia cognitiva que protege a las personas con EA de desarrollar demencia20.
Las demencias frontotemporales (DFT) son un grupo de trastornos caracterizados clínicamente por presentar síntomas conductuales como: cambios de personalidad y conducta social desordenada o disfunción en el lenguaje. Este tipo de demencia pertenece a un grupo de desórdenes conocidos como taupatías, las cuales resultan de una mutación en la proteína tau; esta proteína está fisiológicamente localizada dentro de los axones donde forma parte del citoesqueleto, y su partrón de fosoforilación determina el sitio de localización de ésta; si se hiperfosforila, estos patrones de localización forman agregados fibrilares, los cuales tienen efectos neurotóxicos. En modelos animales de taupatías el número de espinas dendríticas en las neuronas piramidales de la corteza cerebral y del hipocampo está significativamente reducido20.
La enfermedad de Huntington, es una enfermedad hereditaria autosómica dominante, caracterizada clínicamente por movimientos involuntarios, incoordinados, rigidez y alteraciones posturales, que puede estar acompañada de síntomas afectivos, cognitivos y conductuales. Dichas alteraciones se presentan como consecuencia de la pérdida de neuronas estriatales de proyección. En etapas tempranas del desarrollo de la enfermedad se ha observado un aumento en la arborización dendrítica así como una mayor DE y espinas de mayor tamaño, y en etapas avanzadas se observa disrupción en las arborizaciones dendríticas, edema de las ED y disminución de la DE20.
La esclerosis lateral amiotrófica (ELA) afecta principalmente a las neuronas motoras tanto de la corteza motora como de la médula espinal. Lo que conduce clínicamente a presentar rigidez muscular y debilidad progresiva que puede estar acompañada de cambios cognitivos sutiles o demencia. La demencia asociada a ELA es la tercera enfermedad neurodegenrativa más común después de Alzheimer y Parkinson. Esta forma de demencia puede presentar una acumulación de inclusiones de ubiquitina, ubiquilina2 y p62 dentro de las ED. En modelos animales de esta enfermedad se ha observado disminución de la de DE y deterioro de la plasticidad sináptica20.
La enfermedad de Parkinson (EP) está caracterizada por la degeneración gradual de las neuronas dopaminérgicas de la sustancia nigra, y acumulación intraneuronal de (-sinucleína. Es el trastorno neurodegenerativo más frecuente después de la EA. Se caracteriza por presentar alteraciones motoras como temblor de reposo, acinesia e hipertonía20. En estudios posmortem en personas con EP en donde se analiza la DE en neuronas estriatales del caudado y putamen en comparación con personas de la misma edad pero sin la enfermedad, se observa una reducción de la DE del 27% en ambos núcleos. Además, la cantidad de arborizaciones dendríticas, así como la longitud de las dendritas en ambos núcleos es menor en personas con EP20.
Trastornos del sueño y su repercusión en las espinas dendríticas
Una de las funciones del sueño es la consolidación de lo aprendido durante el día, lo que ocurre en 2 etapas: de inicio sucede la consolidación sináptica y después la de los sistemas por los que ocurre la consolidación.
La deprivación crónica del sueño se ha identificado como un factor de riesgo para una amplia variedad de trastornos psiquiátricos, ya que el sueño juega un papel esencial en la regulación de la plasticidad cerebral. En un estudio en ratones donde se evaluó la DE posterior a la deprivación de sueño por 24 h, se reportó que la deprivación incrementa el número de espinas en la corteza prefrontal y lo disminuye en la región CA1 del hipocampo, lo que tiene relevancia en el procesamiento de información y de la memoria. Se ha observado en otros estudios que el porcentaje de pérdida de ED es de hasta 30% en una deprivación del sueño de 5 h, y se acompaña de disminución en la longitud de las dendritas, lo que podría reducir el área sináptica y alterar la eficacia sináptica en el hipocampo. Estos cambios pueden revertirse con 3 h de sueño reparador. Es de importancia señalar que la deprivación aguda del sueño puede incrementar la DE en el hipocampo en CA1 posiblemente como un mecanismo de protección al daño; sin embargo, la exposición repetida a este tipo de estrés conducirá a una menor DE en esta región. Se ha demostrado que estos cambios en la DE inducidos por la deprivación del sueño interfieren en la consolidación de la memoria32.
Por otra parte, durante la etapa del sueño profundo REM, se ha observado en modelos animales que existe una poda de las sinapsis excesivas posterior al aprendizaje motor y solo se mantienen aquellas espinas de reciente formación, lo que facilita la incorporación de éstas a los circuitos sinápticos preexistentes. Lo que sugiere que durante esta etapa del sueño es donde se lleva a cabo la consolidación de la memoria, la cual podría verse afectada durante la deprivación de sueño en algunos trastornos32.
Conclusión
Desde el reconocimiento y descripción de las ED por Santiago Ramón y Cajal como posibles sitios de contacto sináptico, estas especializaciones dendríticas han cobrado gran relevancia con el advenimiento de las nuevas tecnologías que nos permiten estudiar con precisión su forma, dinámica y ultraestructura, y así reconocerlas -desde hace algunas décadas- como sitios de contacto sináptico e integradoras de señales neuronales. Su alteración en forma, cantidad y tamaño se relaciona estrechamente con el detrimento cognitivo, de la memoria y el aprendizaje, tanto en modelos animales como en estudios postmortem de personas que padecen ciertas patologías capaces de modificarlas.











 nueva página del texto (beta)
nueva página del texto (beta)



