Introducción
La región cromosómica 11p15.5 contiene dos grupos de genes improntados de expresión monoalélica uniparental, regulados por dos regiones cis diferencialmente metiladas, denominadas centros de control de impronta 1 (IC1 o H19/IGF2 o H19-DMR) y 2 (IC2 o KCNQ1OT1).1,2 El IC1 (paterno metilado inactivo/materno no metilado activo) regula la expresión de H19 (tumor supresor de expresión materna) e IGF2 (factor de crecimiento tipo insulina 2 de expresión paterna),3,4 con efectos antagónicos sobre el crecimiento. El IC2 (materno metilado y paterno no metilado), de expresión monoalélica paterna, bloquea la transcripción de expresión materna de CDKN1C (inhibidor del ciclo celular) y KCNQ1 (canal de potasio dependiente de voltaje), como se observa en la Figura 1, los cuales regulan negativamente el crecimiento celular (Figura 1).5 Los defectos epigenéticos y genómicos de 11p15.5 involucran un crecimiento excesivo, como sucede en el síndrome de Beckwith-Wiedemann (SBW), sobrecrecimiento lateralizado aislado y tumor de Wilms no sindrómico; o bien, un crecimiento deficiente como en el síndrome Silver-Russell (SSR) o hemihipoplasia aislada.6-11 El ensayo de amplificación de sondas dependientes de ligación múltiple sensible a metilación (MS-MLPA) para la región 11p15.5 evalúa el estado de metilación y variaciones en el número de copias,3,5,7,12-14 sin estudios en México.

Figura 1 Representación de la región cromosómica 11p15.5. Los cuadros blancos representan los genes de expresión materna (→); los grises, los de expresión paterna (→); y los genes con líneas oblicuas verticales, los transcripcionalmente inactivos (⊣). El promotor para KCNQOT1 (IC2) se encuentra en el intrón 10 del gen KCNQ1 y está normalmente metilado (●) en el alelo materno y desmetilado en el paterno (◯), lo que hace que se transcriban solo de los genes KCNQ1 y CDKN1C de origen materno. El centro de impronta intergénico H19/IGF2 (IC1) está metilado en el alelo paterno (●) y desmetilado en el materno (◯), por lo que H19 tiene de forma exclusiva solo expresión materna e IGF2, solo expresión paterna. Modificada de Baskin et al.4 y Shuman et al.5
El SBW (OMIM #130650), o síndrome de exonfalos, macroglosia, gigantismo, es un síndrome de sobrecrecimiento con predisposición a tumores (1:10 340 recién nacidos), que incluye (según el BWS Concensus Statements, BWSCS)6 macroglosia, onfalocele, sobrecrecimiento lateralizado, tumor de Wilms multifocal o bilateral, hiperinsulinismo severo persistente y hallazgos histopatológicos, cada uno con valor diagnóstico de dos puntos. Los siguientes factores son sugestivos (un punto): peso al nacimiento > 2 desviaciones estándar, nevus flammeus, polihidramnios o placentomegalia, fosetas o crestas auriculares, hipoglucemia transitoria, tumores típicos del SBW (neuroblastoma, rabdomiosarcoma, tumor de Wilms unilateral, hepatoblastoma, carcinoma adrenocortical o feocromocitoma), nefromegalia o hepatomegalia y hernia umbilical o diastasis recti. Su diagnóstico clínico requiere ≥ 4 puntos.6 Su espectro en 11p15.5 incluye casos de sobrecrecimiento lateralizado y atípicos.15 El SBW es un trastorno de impronta genómica por metilación de la región 11p15.5 que incluye (en 80 % de los casos) lo siguiente:3,5,6,8
– Pérdida de metilación (PDM) materna del IC2 (50 %).
– Disomía uniparental (DUP) paterna del cromosoma 11p15.5 (DUP(11)Pat) (20 %), con PDM del IC2 y ganancia de metilación del IC1.
– Ganancia de metilación materna en el IC1 (5-10 %).
La frecuencia de sus manifestaciones varía por defecto molecular (Tabla 1) y excluye etiologías detectadas por otros métodos como la secuenciación para mutaciones intragénicas de CDKN1C (5 %), cariotipo (< 1 %) o microarreglos (9 %); en 20 % de los casos no es posible identificar defectos.4-6
Tabla 1 Características clínicas y defectos epigenéticos en los síndromes Beckwith-Wiedemann y Silver-Russell
| Síndrome Beckwith-Wiedemann | Síndrome Silver-Russell | ||||
|---|---|---|---|---|---|
| Pérdida de metilación del IC2 | DUP paterna | Ganancia de metilación del IC1 | |||
| Características cínicas† | % | % | % | Características cínicas‡ | % |
| Macroglosia | 91 | 75 | 83 | Pequeño para edad gestacional | 92 |
| Macrosomía | 54 | 61 | 67 | Falla crecimiento posnatal | 95 |
| Sobrecrecimiento lateralizado | 24 | 76 | 35 | Macrocefalia relativa | 82 |
| Anomalías de orejas | 60 | 39 | 31 | Frente prominente | 95 |
| Nevus flammeus | 47 | 31 | 17 | Asimetría corporal | 73 |
| Hipoglucemia | 39 | 46 | 38 | Dificultad alimentación/IMC bajo | 98 |
| Onfalocele | 43 | 8 | 6 | Facies triangular | 94 |
| Hernia umbilical | 20 | 28 | 23 | Clinodactilia de quintos dedos | 75 |
| Diastasis recti | 12 | 15 | 32 | Sudoración excesiva | 54 |
| Anomalías renales | 9 | 26 | 32 | Voz aguda o chirriadora | 45 |
| Organomegalia | 26 | 41 | 56 | Anomalías genitales en varones | 40 |
| Anomalías cardiacas | 11 | 7 | 11 | Retardo del lenguaje/motor | 37-40 |
| Tumores embrionarios | 2 | 15 | 25 | Hipoglucemia | 22 |
| MS-MLPA¥ ensayo de metilación | HipoMet de IC2 | DUP paterna | HiperMet del IC1 | HipoMet del IC1 | |
| Origen parental región 11p15.5 | (P/M) | (P/P) | (P/M) | PM | |
| Metilación del IC1 | 50 % (normal) | GDM | GDM | PDM | |
| Metilación del IC2 | PDM | PDM | 50 % (normal) | 50 % (normal) | |
| Relación posdigestión de IC1 | 0.5 (normal) | GDM | GDM | PDM | |
| Relación posdigestión de IC2 | PDM | PDM | 0.5 (normal) | 0.5 (normal) | |
| Frecuencia | 50 % | 20 % | 5-10 % | 35-50 % | |
| Correlación genotipo-fenotipo†, ‡ | Onfalocele TW raro | Sobrecrecimiento localizado, onfalocele raro, TW y HB frecuentes | Onfalocele raro, TW frecuente | Hipometilación de IC1: asimetría corporal Duplicación 11p15/DUP materna: retardo psicomotor y del lenguaje | |
Del: deleción; DUP: disomía uniparental; GDM: ganancia de metilación; HB: hepatoblastoma; HiperMet: hipermetilación; HipoMet: hipometilación; IC1: centro de impronta 1; IC2: centro de impronta 2; M: materno; MS-MLPA: amplificación de sondas dependiente de ligación múltiple sensible a metilación; P: paterno; PDM: pérdida de metilación; TW: tumor de Wilms.
†Mussa et al.3 y Brioude et al.;6
¥Modificada de MRC Holland.20
El SSR (OMIM #180860), a considerar en recién nacidos pequeños para su edad gestacional (1:30 000-1:100 000),7 se caracteriza por (según los criterios revisados del Netchine-Harbison-Clinical Scoring System, NH-CSS)16-18 retraso del crecimiento pre y posnatal, macrocefalia, frente prominente, asimetría corporal, dificultades para la alimentación o índice de masa corporal ≤ 2 desviaciones estándar (Tabla 1). Clínicamente se tratará de SSR si se presentan cuatro o más de estas manifestaciones, distinguiéndose de los recién nacidos pequeños para su edad gestacional.17 La mayoría de los casos de SSR se produce por alteraciones en la región 11p15.5, principalmente hipometilación del IC1 (aproximadamente entre 35 y 50 %), detectable por MS-MLPA (Tabla 1) o disomía uniparenteal materna mosaico del cromosoma 11, duplicaciones maternas de 11p15.5 o disomía uniparental materna del cromosoma 7 (aproximadamente entre 7 y 10 %).7,18,19
Se presenta la experiencia con el uso de MS-MLPA para la región 11p15.5 en el diagnóstico y correlación genotipo-fenotipo de pacientes con diagnóstico clínico de SBW y SSR, nacidos en el Hospital Civil de Guadalajara “Dr. Juan I. Menchaca”, en Guadalajara, Jalisco, México.
Métodos
Se estudiaron dos mujeres con diagnóstico clínico de SBW y dos con SSR, detectadas en un periodo de tres años en el Centro de Registro e Investigación sobre Anomalías Congénitas, programa hospitalario de vigilancia de defectos congénitos de nuestro hospital. Se realizó historia clínica, evaluación antropométrica, exámenes de laboratorio (glucosa, insulina, alfa-fetoproteína, antígeno carcinoembrinario, entre otras) y de gabinete (ultrasonografías abdominal, renal y cardiaca). Las pacientes cumplieron con los criterios para el diagnóstico de SBW (BWSCS)6 y SSR (≥ 4, NH-CSS).7 Se obtuvo aprobación de la Junta de Ética en Investigación de la Secretaría de Salud de Jalisco con el registro #0200/18 HCJIM/2017.
Se realizó extracción de ADN de sangre periférica (ADN Blood Mini Kit, Qiagen). La búsqueda de variaciones en el número de copias y la evaluación del estado de metilación de la región 11p15.5 se realizó utilizando SALSA MS-MLPA® Probemix ME030-C3 BWS/RSS (MRC-Holland, Ámsterdam, Países Bajos) de 27 sondas específicas de SBWS y SSR, 13 de ellas con un sitio de reconocimiento para HhaI, específico de las regiones diferencialmente metiladas H19/IGF2 y KCNQ1. Una alícuota se sometió a ligación y otra a ligación más digestión con HhaI. Fueron amplificadas por PCR, separadas por electroforesis capilar (ABI-3100 genetic analyzer) y analizadas con el programa Coffalyser® (MRC-Holland, Ámsterdam, Países Bajos), con el que se interpretaron las variaciones en el número de copias y patrones de metilación.20
Resultados
Paciente 1 (SBW)
Paciente femenina con diagnóstico prenatal (a las 28 semanas de gestación) de onfalocele y polihidramnios. Hija de de padres sanos no consanguíneos, sin productos previos alterados, con peso de 3710 g (> p90) y talla de 50 cm (p75-90). Como hallazgos clínicos (Figura 2 y Tabla 2) se encontró puntuación de 9 con los criterios BWSCS,6 comunicación interauricular tipo ostium secundum por ultrasonografía cardiaca y nefromegalia por ultrasonografía renal. Los resultados de laboratorio fueron normales. Falleció al mes de edad por sepsis relacionada con el onfalocele. Con el ensayo de MS-MLPA no se detectaron variaciones en el número de copias y su análisis de metilación mostró ganancia de metilación del IC1 y PDM del IC2 (Tabla 2 y Figura 3), indicativas de DUP(11)Pat.
Tabla 2 Hallazgos fenotípicos y resultados del ensayo de MS-MLPA en las pacientes estudiadas con los síndromes Beckwith-Wiedemann y Silver Russell
| Pacientes con síndrome de Beckwith- Wiedemann | ||
|---|---|---|
| Características clínicas | Paciente 1 | Paciente 2 |
| Sexo | Femenino | Femenino |
| Edad gestacional (semanas) | 37 | 38 |
| Manifestaciones cardinales† | ||
| Macroglosia | + | + |
| Onfalocele | + | + |
| Sobrecrecimiento lateralizado | − | − |
| Características sugestivas | ||
| Macrosomía | + | + |
| Nevus flammeus | + | + |
| Polihidramnios o placenta grande | +/Se ignora | - /Se ignora |
| Fosetas o crestas en auriculares | + | + |
| Hipoglucemia transitoria | − | + |
| Nefromegalia o hepatomegalia | + | − |
| Ensayo de MS-MLPA | ||
| Sin digestión con Hhal | rsa 11p15.5(MLPA ME030) x2 | rsa 11p15.5(MLPA ME030) x2 |
| Número de copias (NC) | 2 (MM) | 2 (MM) |
| Relación de NC | 1.09 | 1.11 |
| Porcentaje de metilación | 100 % | 100 % |
| Relación NC posdigestión Hhal | KCNQ1OT1 (0.15)/H19 (1.36) | KCNQ1OT1 (0.07)/H19 (0.55) |
| Mecanismo causal | DUP paterna | Hipometilación del IC2 |
| Pacientes con síndrome de Silver-Russell | ||
| Paciente 3 | Paciente 4 | |
| Sexo | Femenino | Femenino |
| Edad gestacional (semanas) | 36 | 38 |
| Criterios NH-CSS‡ | ||
| Retraso del crecimiento prenatal | + | + |
| Retraso del crecimiento posnatal | + | + |
| Macrocefalia relativa | + | + |
| Frente prominente | + | + |
| Asimetría corporal | + | + |
| Problemas para alimentación | + | + |
| Ensayo de MS-MLPA | ||
| Sin digestión con Hhal | rsa 11p15.5(MLPA ME030) x2 | rsa 11p15.5(MLPA ME030) x2 |
| Número de copias (NC) | 2 (MM) | 2 (MM) |
| Relación de NC | 1.03 | 1.16 |
| Porcentaje de metilación | 100 % | 100 % |
| Relación NC posdigestión Hhal | H19 (0.15) | H19 (0.19) |
| Mecanismo causal | Hipometilación del IC1 | Hipometilación del IC1 |
†Criterios del BWS Concensus Statements (BWSCS).6
‡Puntuación clínica de Netchine-Harbison y Clinical Scoring System (NH-CSS).17

Figura 2 Características fenotípicas de los pacientes con síndrome de Beckwith-Wiedeman (SBW) y Silver-Russell (SSR). El paciente 1 (A-C) y el paciente 2 (D-F) con SBW mostraron crestas lobulares (A-D) y fosetas retroauriculares (B,E), además de un onfalocele pequeño (C) y grande (F), respectivamente. El paciente 3 (G) y el paciente 4 (H) con SSR presentaron hemihipoplasia de miembro pélvico inferior derecho (G) e izquierdo (H), respectivamente.
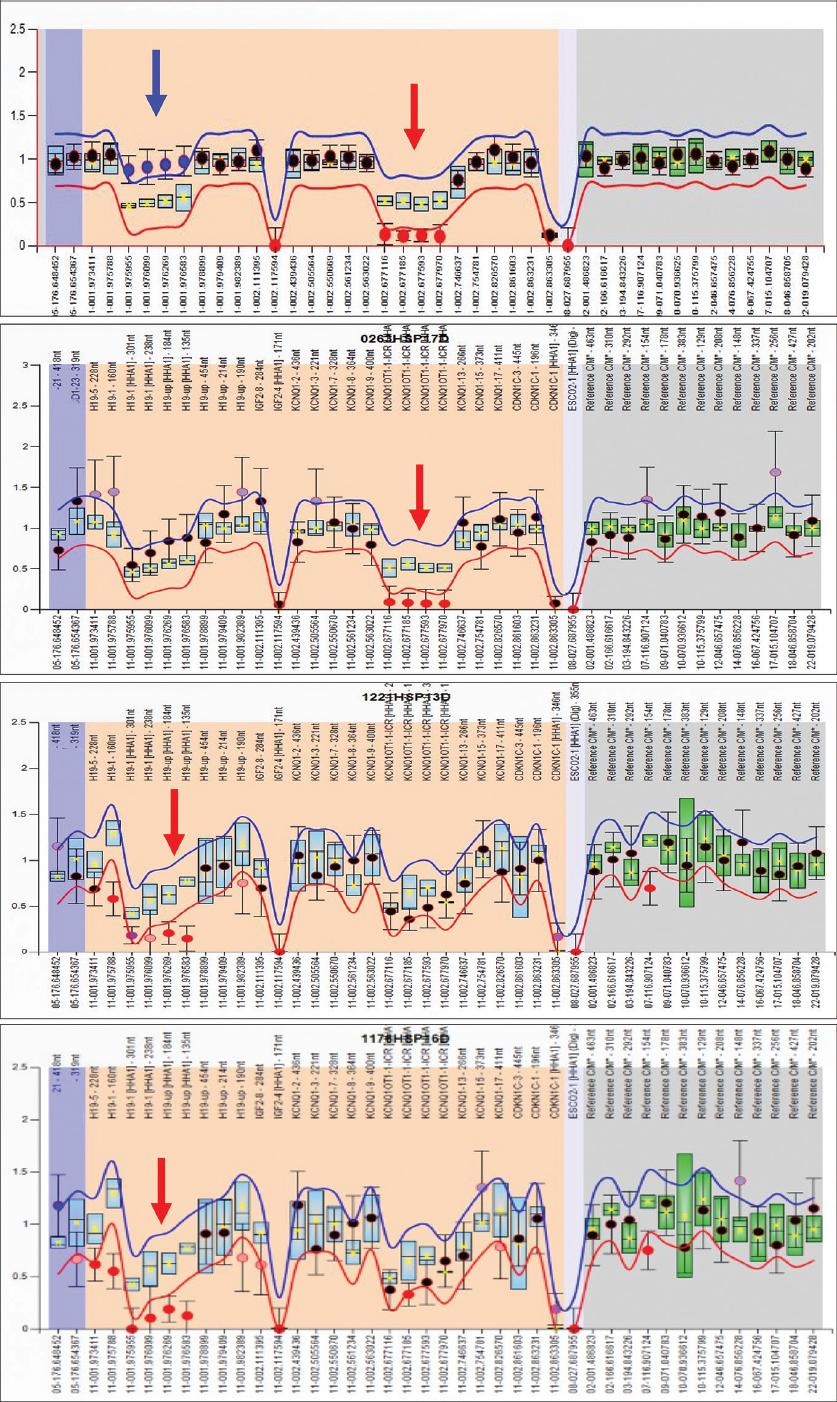
Figura 3 Gráfico de distribución del análisis de metilación mediante MS-MLPA de la región 11p15.5 en las pacientes estudiadas con síndrome de Beckwith-Wiedemann (SBW) (a, b) y síndrome de Silver-Russell (SSR) (c, d). En la paciente 1 con SBW (a) se identificó pérdida de metilación en KCNQ1 (círculos y flecha rojas) y ganancia de metilación en H19 (círculos y flechas azules), que indican disomía uniparental paterna del IC1 e IC2. En la paciente 2 con SBW (b) se observó pérdida de metilación en el gen KCNQ1OT1 (círculos y flecha rojas), que demuestra pérdida de metilación del IC2 en el cromosoma materno. En la paciente 3 (c) y en la paciente 4 (d) con SSR, la distribución obtenida mostró en ambas una pérdida de metilación en el gen H19 (círculos y flechas rojas), lo que correlaciona con un patrón de hipometilación del IC1 en el cromosoma paterno.
Paciente 2 (SBW)
Paciente femenina producto de padres sanos no consanguíneos, sin antecedentes heredofamiliares relevantes, con peso de 4020 g (> p90) y talla de 59 cm (> p 90). Como hallazgos clínicos (Figuras 2 y Tabla 2), con puntuación de 9 conforme a los criterios del BWSCS.6 Presentó lóbulo auricular izquierdo bífido y comunicación interauricular tipo ostium secundum. La tomografía axial computarizada de cráneo y la ultrasonografía abdominal fueron normales. Sin desarrollo de tumores en ocho años. El ensayo de MS-MLPA no detectó variaciones en la número de copias en 11p15.5 ni en la metilación, pero identificó un patrón de PDM del IC2 del cromosoma materno (Tabla 2 y Figura 3).
Paciente 3 (SSR)
Paciente femenina hija de padres sanos no consanguíneos, producto de embarazo normoevolutivo, con retardo del crecimiento intrauterino identificado por ultrasonografía prenatal. Nació a las 36 semanas de gestación, con peso de 1680 g (< p10), talla de 41 cm (< p10) y perímetro cefálico de 33 cm (p50-75). Los hallazgos clínicos se describen en la Tabla 2, con seis manifestaciones según los criterios NH-CSS.17 Se observó facies triangular, labios delgados, clinodactilia y pliegue único de flexión en quintos dedos, pliegue palmar transverso único en mano derecha y zigodactilia de artejos, así como franca hemihipoplasia del miembro pélvico derecho (Figura 2). La tomografía axial computarizada y los estudios de laboratorio fueron normales. El ensayo de MS-MLPA no detectó variaciones en el número de copias en 11p15.5 y en su análisis de metilación se identificó un patrón de PDM del IC1 paterno (Figura 3).
Paciente 4 (SSR)
Paciente femenina valorada por asimetría de miembro pélvico izquierdo, hija de padres sanos no consanguíneos. Cursó con retraso del crecimiento intrauterino y oligohidramnios. El peso al nacimiento fue de 1935 g (< p10), talla de 39.5 cm (< p10) y perímetro cefálico de 32.9 cm (p50). Los hallazgos clínicos relevantes se describen en la Tabla 2 y Figura 3. Se identificaron las seis manifestaciones de los criterios NH-CSS.17 Además, presentó hipertricosis frontal y auricular, nevus flammeus frontal, clinodactilia de quintos dedos y pliegue palmar transverso único bilateral. La resonancia magnética nuclear de cráneo, las ultrasonografías renal y cardiaca, así como los estudios de laboratorio fueron normales. El ensayo de MS-MLPA no detectó variaciones en el número de copias en 11p15.5 y el análisis de metilación mostró un patrón de PDM del IC1 paterno (Figura 3).
Discusión
El análisis de MS-MLPA permitió identificar defectos moleculares en la región improntada 11p15.5 en las cuatro pacientes, y usarlos para diagnóstico, manejo, asesoramiento genético y riesgos de recurrencia de los SBW y SSR,3,6,7,14 a un costo relativamente bajo. La cohorte fue pequeña, pero representativa del periodo evaluado.
En el SBW, la metilación de 11p15.5 por MS-MLPA resulta anormal, independientemente de si el mecanismo implicado es una PDM del IC2, ganancia de metilación del IC1, variaciones en el número de copias o por DUP(11)Pat (PDM del IC2, con ganancia de metilación simultánea del IC1), excepto mosaicismos de baja proporción.6,21 El MS-MLPA de la paciente 1 indicó claramente una DUP(11)Pat (Tabla 2 y Figura 3), resultado que recomendaríamos confirmar mediante análisis de microsatélites. Contrario a lo observado en esta paciente, la PDM del IC2 en los casos de DUP(11)Pat se ha asociado previamente a una mayor frecuencia de sobrecrecimiento lateralizado (76 %) y menor frecuencia de onfalocele (8 %),3,6 mientras que la ganancia de metilación del IC1 parece implicar un riesgo aumentado de tumores (de 15 a 25 %), por pérdida de la función supresora de H19, como ocurre en los tumores con alteración epigenética aislada.22 Otras manifestaciones asociadas a la DUP(11)Pat son anomalías renales, nefrocalcinosis y trastorno de espectro autista.3
El onfalocele pequeño que presentó la paciente 2 se correlaciona con la ganancia de metilación del IC2 identificada mediante MS-MLPA (Tabla 2 y Figura 3), acorde con este subgrupo molecular (Tabla 1) y con riesgo bajo de tumor de Wilms (2.6 %),3,6 no observado en esta paciente.
La cardiopatía congénita en ambas pacientes concuerda con PDM del IC2.3 Los defectos de metilación encontrados mediante MS-MLPA en la paciente 1, con DUP(11)Pat, y en la paciente 2 (con PDM del IC2) indican riesgo de recurrencia bajo, como se observó en 85 a 90 % de los casos con SBW sin presentación familiar.23 Solo las mutaciones puntuales de CDKN1C (40 % de casos familiares) y las microdeleciones de IC1 o microduplicaciones del IC2 suponen riesgo de recurrencia alto (en 50 % de los casos).3,5
Las dos pacientes con SSR presentaron las seis características diagnósticas indicadas en los criterios NH-CSS17 e hipometilación del IC1 paterno en 11p15.5, una expresión paterna reducida de IGF2 y una expresión materna incrementada de H19, que resulta en una severa restricción del crecimiento fetal (Figura 1), por lo que la MS-MLPA puede ser un estudio de primera línea en esta entidad.7,10,12-14,18 La hipometilación del IC1 paterno ocurre en 60 % de los casos de SSR y correlaciona con la presencia de manifestaciones más clásicas y severas, incluida afectación del peso y talla al nacimiento, asimetría corporal, macrocefalia relativa y rasgos faciales característicos (Tabla 1), no observados en los casos que no involucran el IC1 de 11p15.5,7,17 como en la disomía uniparental materna del cromosoma 7 de fenotipo leve; solo se registra 20 % con manifestaciones completas de SSR.18 La marcada asimetría de extremidades observada (Figura 2) puede atribuirse a una variación tisular en el grado de hipometilación de IC1.10 Finalmente, en 40 % de los pacientes con diagnóstico clínico de SSR no se logra identificar el defecto molecular o la causa.7,18
Conclusiones
El análisis de MS-MLPA detectó defectos epigenéticos en la región 11p15.5 en las pacientes estudiadas. En las pacientes con SBW identificó DUP(11)Pat y PDM del IC2 materna, respectivamente. En las pacientes con SSR identificó hipometilación paterna del IC1. En ambas entidades, observamos una adecuada correlación genotipo-fenotipo con los defectos de metilación encontrados. Se confirmó la utilidad de la técnica como estudio de primera línea en pacientes con el diagnóstico clínico de SBW y SSR.











 text new page (beta)
text new page (beta)


