Introducción
En México, las cardiopatías congénitas complejas (CCC) son una de las causas más frecuentes de morbimortalidad en los recién nacidos.1 Alrededor del mundo, incluyendo nuestro medio, la supervivencia de los neonatos con CCC se ha incrementado debido a los avances en el cateterismo diagnóstico o terapéutico, así como en la cirugía, ya sea paliativa o correctiva. Sin embargo, en los sobrevivientes, el riesgo para presentar comorbilidades neurológicas es hasta de 59 %, sin que se haya dilucidado con claridad el momento en el que ocurren,2,3 ni reconocido totalmente los mecanismos del daño. Algunos autores señalan que existen factores genéticos, epigenéticos y algunos externos. En los fetos con coartación de la aorta y ventrículo izquierdo hipoplásico está demostrado que a partir del tercer trimestre de la gestación hay detención en el crecimiento del cerebro, por lo que en los recién nacidos se ha observado retraso en la maduración de la sustancia blanca, reducción del N-acetil-aspartato y aumento en el lactato e, incluso, alteraciones en las circunvoluciones.4,5
Los niños con CCC nacen con hipoxemia, caracterizada clínicamente por cianosis o falla cardiaca. El cateterismo diagnóstico o terapéutico y las cirugías paliativas o correctivas, algunas realizadas con circulación extracorpórea, contribuyen a que aumente el riesgo de daño neurológico, por el uso de anestésicos, eventos hipóxico-isquémicos y hemorragia, entre otros, ya sea antes, durante o después de dichos procedimientos. Estos problemas son inherentes a la evolución o tratamiento de la cardiopatía, por lo que en los niños es importante conocer la influencia de esta sobre la morfología cerebral.6-8
Para demostrar los cambios cerebrales, en numerosos pacientes se realizan estudios de imagen, los cuales tienen como limitante no poder establecer con detalle el tipo de alteración, a pesar de su sensibilidad para localizar los sitios de daño.9,10 Por lo tanto, consideramos que la autopsia es útil para precisar el tipo de lesión ocurrida, tanto prenatal como posnatalmente.11 Nuestro objetivo fue describir las alteraciones anatomopatológicas cerebrales en neonatos con CCC a quienes se les realizó autopsia.
Métodos
Se trató de un estudio transversal, retrospectivo y descriptivo realizado en el Hospital de Pediatría “Dr. Silvestre Frenk Freund” del Centro Médico Nacional Siglo XXI, Instituto Mexicano del Seguro Social, unidad de tercer nivel de atención con poco más de 200 camas censables y una población aproximada de dos millones de derechohabientes de cero a 17 años.
Entre los recién nacidos, las CCC son una de las principales causas de morbimortalidad. Se revisaron las bases de datos de autopsias de los Servicios de Neonatología y de Patología, realizadas de 2009 a 2019; se estudiaron todos los cerebros de los neonatos portadores de CCC que fallecieron. Este estudio fue sometido al comité local de investigación y ética.
Las autopsias se realizaron de una a seis horas después de la defunción. Una vez extraído el cerebro, se suspendió en formol a 10 %, entre 10 y 15 días. Las regiones supra e infratentorial se pesaron por separado. Se hizo una inspección macroscópica, tanto del aspecto externo como de los cortes coronales de 1 cm de espesor. Las muestras que se obtienen rutinariamente son de médula espinal cervical, bulbo, puente, mesencéfalo, cerebelo, corteza cerebral frontal, incluyendo cuerpo calloso, ganglios basales, tálamo, hipocampo (asta de Amón) y corteza occipital (calcarina). También se obtiene muestras de las áreas macroscópicamente anormales: con leucomalacia, hemorragia, absceso, etcétera. Los cortes se procesaron para ser incluidos en parafina y su espesor fue de 6 a 8 mm; se tiñeron con hematoxilina y eosina. Las laminillas de todos los casos fueron valoradas por uno de los investigadores y las lesiones hipóxico-isquémicas se clasificaron como de sustancia blanca o gris y como agudas, subagudas y crónicas:
– Agudas, se caracterizan principalmente por necrosis coagulativa. Aproximadamente a las 12 horas se presentan nódulos microgliales y entre las 12 y 48 horas, edema axonal referido como “balonización axonal”, sin leucocitos.
– Subagudas, caracterizadas por el reblandencimiento de la sustancia gris o blanca.
– Crónicas, caracterizadas por la presencia de macrófagos lipidizados y cavitación. Otro hallazgo constante es gliosis, distinguida por astrocitos gemistocíticos y microcalcificaciones.
Resultados
En 10 años se realizaron 243 autopsias, 72 (29.6 %) fueron de recién nacidos con cardiopatía congénita, de los cuales solo 21 (29 %) fueron elegidos para esta investigación por disponer con estudios de cerebro. En la Tabla 1 se muestran las características principales de los casos que se presentan.
Tabla 1 Características generales y diagnósticos de 21 neonatos con cardiopatía congénita a quienes se les realizó autopsia
| Mediana | Rango intercuartilar | |
|---|---|---|
| Edad al ingreso (días) | 5 | 0, 105 |
| Estancia hospitalaria (días) | 7 | 1, 69 |
| Peso al nacer (g) | 2500 | 1885, 3375 |
| Peso al ingreso (g) | 2595 | 1720, 3232 |
| n | % | |
| Sexo | 62 | |
| Masculino | 13 | 38 |
| Femenino | 8 | |
| Semanas de gestación al nacimiento | ||
| < 37 semanas | 6 | 28.5 |
| ≥ 37 semanas | 15 | 71.4 |
| Diagnósticos | ||
| Patología de aorta (coartación e hipoplasia) | 5 | 23.8 |
| SVDH con atresia pulmonar | 3 | 14.2 |
| Atresia pulmonar | 2 | 9.5 |
| CATVP | 2 | 9.5 |
| Tronco arterioso | 2 | 9.5 |
| Transposición de grandes vasos | 2 | 9.5 |
| Estenosis/agenesia pulmonar | 1 | 4.7 |
| Canal auriculoventricular | 1 | 4.7 |
| Tetralogía de Fallot | 1 | 4.7 |
| Heterotaxia visceral con CATVP | 1 | 4.7 |
| Atresia tricuspídea IIB | 1 | 4.7 |
CATVP: conexión anómala total de vasos pulmonares; SVDH: síndrome de ventrículo derecho hipoplásico.
Del total, un caso presentó trisomía 18; otro, síndrome dismórfico no especificado y hernia diafragmática; una niña, síndrome de Mckusick-Kaufman y otro caso, además, onfalocele. Las alteraciones del arco aórtico y el síndrome de ventrículo derecho hipoplásico con atresia pulmonar se observaron en 38 % de los niños.
Los procedimientos y cirugías realizados antes de la muerte se resumen en la Tabla 2. En seis niños (28.5 %) no se realizó cateterismo ni cirugía cardiovascular, aunque un niño de este grupo requirió gastrostomía por perforación gástrica. Seis niños fueron sometieron a cirugía con circulación extracorpórea; de los nueve sin circulación extracorpórea, siete fueron sometidos a cirugía paliativa. Un niño a quien se le realizó fístula sistémica pulmonar también requirió cierre de pared abdominal por onfalocele.
Tabla 2 Procedimientos y cirugías realizadas antes de la muerte a 21 neonatos con cardiopatía congénita estudiados mediante autopsia
| Procedimiento | n | % |
|---|---|---|
| Cirugía con circulación extracorpórea | 6 | 28.5 |
| Cirugía sin circulación extracorpórea | 9 | 42.8 |
| Cateterismo intervencionista: atrioseptostomía (Rashkind) | 4 | 19 |
| Sin procedimientos cardiovasculares | 6 | 28.5 |
| Gastrostomía | 1 | 16.6 |
Hallazgos anatomopatológicos
En la Tabla 3 se resume la relación entre el tipo de cardiopatía y las alteraciones anatomopatológicas de cerebro. En todos los niños se observó alteración hipóxico-isquémica de diferente grado; 11 (52.3 %) presentaron depleción por necrosis, de moderada a intensa, de las neuronas piramidales del asta de Amón (Figuras 1A-B). En 15 (71.4 %) casos se apreció depleción, de intensidad variable, de las neuronas cerebelosas de Purkinje (Figura 1C). En 17 niños (81 %) se encontraron lesiones hipóxico-isquémicas incipientes, en dos (9.5 %) intermedias y en cuatro (19 %) tardías, caracterizadas por desorganización en la laminación de la corteza, focal y leve; así como necrosis, gliosis, edema axonal y otros. Se observó hemorragia parenquimatosa en cinco niños (23.8 %): cerebelosa petequial (Figura 1D) en cuatro (19 %) y en uno (4.7 %) también hemorragia aracnoidea.
Tabla 3 Alteraciones anatomopatológicas y tipo de cardiopatía, así como síndromes asociados en 21 neonatos con cardiopatía congénita a quienes se les realizó autopsia
| Cardiopatía (n) | Alteración asociada | Cerebelo: Disminución de células de Purkinje (Figura 1C) | Hipocampo: disminución de neuronas en asta de Amón (C1 y C2) (Figuras 1A-B) | Corteza/sustancia blanca: necrosis, gliosis/necrosis, edema axonal, otros | Otros: hemorragia |
|---|---|---|---|---|---|
| Patología de arco (5) | Dismorfia y hernia diafragmática | 4 | 3 | 5 (Figura 3) | 3 |
| Atresia pulmonar (2) | — | 2 | 1 | 2 | 0 |
| Ventrículo derecho hipoplásico (3) | — | 3 | 1 | 2 (Figura 4) | 1 (Figura 1D) |
| CATVP (2) | — | 0 | 2 | 2 (Figura 5) | 0 |
| Tronco arterioso (2) | (Figura 2) | ||||
| Tipo 1 | T18 (1) | 1 | 0 | 1 | 1 |
| Tipo 3 | 0 | 0 | 0 | 0 | |
| Agenesia válvula pulmonar (1) | — | 1 | 1 | 1 | 0 |
| Transposición de grandes vasos (2) | — | 2 | 2 | 1 | 0 |
| Heterotaxia visceral+CATVP (1) | — | 0 | 0 | 1 | 0 |
| Canal auriculoventricular (1) | Síndrome de Mckusick-Kaufman | 1 | 0 | 1 (Figura 6) | 0 |
| Tetralogía de Fallot (1) | — | 0 | 1 | 1 | 0 |
| Atresia tricuspídea IIB (1) | — | 1 | 0 | 0 | 0 |
| Total | 15 | 10 | 17 | 5 |
CATVP: conexión anómala total de venas pulmonares; T: trisomía.

Figura 1 Alteraciones hipóxico-isquémicas presentes en la mayoría de los casos. A: hipocampo, necrosis neuronal de zonas CA2 y CA1 del asta de Amón; la celularidad disminuye progresivamente en las zonas 2 y 1 (HPA 2012-06, síndrome de ventrículo derecho hipoplásico). Tinción con hematoxilina-eosina (100×). B: detalle de la muerte neuronal individual en el asta de Amón; el citoplasma neuronal se torna hipereosonifílico y el núcleo picnótico (flechas). Tinción con hematoxilina-eosina (400×). C: cerebelo, disminución considerable en el número de las neuronas de Purkinje, algunas en vía de necrosis (flechas). Tinción con hematoxilina-eosina (400×). D: hemorragia cerebelosa, petequial reciente. Tinción con hematoxilina-eosina (100×).

Figura 2 Imágenes de estudios de cerebro de una niña de 17 días de vida extrauterina con tronco arterioso común. A-C: aspecto macroscópico de hemorragia aracnoidea y parenquimatosa superficial en hemisferio izquierdo, lóbulos frontal y parietal. D: en el puente se encontró necrosis neuronal individual y reactivación leve de la microglía.
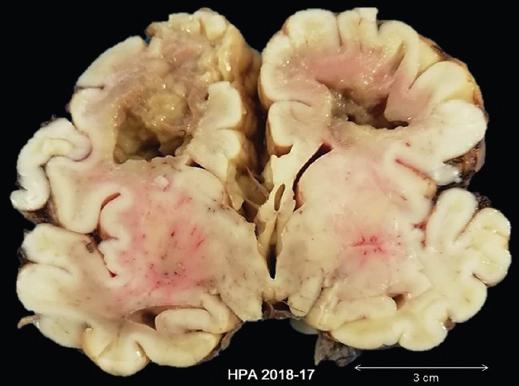
Figura 3 Imagen cerebral de un niño de cinco días de edad, de término, con hipoplasia de arco e istmo aórticos diagnosticada post mortem. Aspecto macroscópico, corte coronal. Necrosis licuefactiva extensa, frontoparietal bilateral.

Figura 4 Imágenes de estudios de cerebro de un niño de 27 días de edad, edad gestacional 34 semanas, con síndrome de ventrículo derecho hipoplásico, a quien se le realizó derivación sistémica pulmonar. Macroscópicamente se observa hemorragia parenquimatosa en región occipital derecha. Microscópicamente se aprecia hemorragia acompañada de necrosis en diferentes etapas de evolución, algunas zonas aún muestran macrófagos microvacuolados (C). Lóbulo frontal izquierdo, corte coronal: se observa leucomalacia periventricularbilateral y hemorragia petequial (D). Sustancia blanca, periventricular, edema axonal focal caracterizado por aumento del calibre de los axones (E), acompañado de gliosis y mineralización (F).
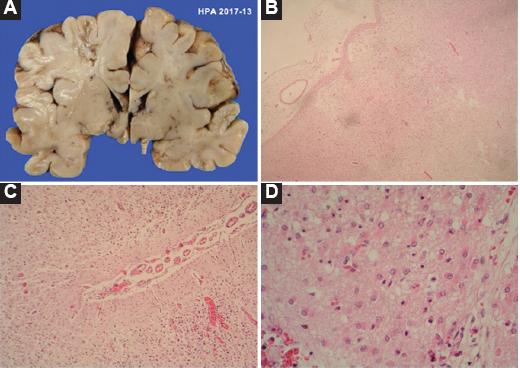
Figura 5 Niño de 60 días; edad gestacional 41 semanas, con situs ambiguo, variedad asplenia. Se le realizó fístula sistémica pulmonar y corrección de conexión anómala de venas pulmonares (supracardiaca). A: necrosis subaguda extensa de la corteza; en hemisferio izquierdo, zona deprimida amarillenta. B-D: vacuolación acentuada de la corteza cerebral con proliferación glial intensa. Tinción con hematoxilina-eosina.

Figura 6 Niña de 90 días con síndrome de McKusick-Kaufman. Canal auriculoventricular desbalanceado. A: aspecto macroscroscópico de hemorragia acentuada en polo occipital derecho. B: microscópicamente se encuentran (balonización axonal). Aspecto con tinción con hematoxilina-eosina (400 ×). C: edema axonal (balonización axonal). Aspecto con tinción de Bielschowsky (400 ×). D: mineralización focal adyacente a la cavidad formada por la necrosis (fase crónica).
Conclusión
Entre las malformaciones congénitas, las cardiacas representan una causa importante de morbimortalidad pediátrica. En este estudio, como en otros publicados,12,13 las más frecuentes fueron las anomalías del arco aórtico y del ventrículo derecho hipoplásico.
En nuestra serie, la mayoría de los casos fueron neonatos a término del sexo masculino, como se ha descrito en la literatura.2-4 La edad mediana al ingreso fue de cinco días. Debido a que los pacientes con cardiopatía grave son referidos al hospital, se retrasa su diagnóstico y tratamiento.
En 42.8 % de los niños se realizó cirugía sin circulación extracorpórea, cuyo objetivo fue paliativo en 77.7 %, lo que indicó la gravedad de la cardiopatía. De los pacientes sin procedimientos cardiológicos, dos fallecieron antes de las 12 horas posteriores al ingreso hospitalario, uno de ellos con perforación gástrica.
Aunque se han considerado diversos factores de riesgo para daño neurológico en los niños con CCC, como fluctuaciones hemodinámicas, problemas respiratorios, cirugía cardiaca mayor con uso de derivación cardiopulmonar, uso de anestésicos y complicaciones posoperatorias (circulatorias), entre otras, no siempre es posible modificar estas situaciones. La presente investigación permitió observar el daño que se puede producir en el cerebro de este grupo de pacientes.
Respecto a las alteraciones morfológicas de sistema nervioso central, tres pacientes con patología del arco presentaron disminución de las células de Purkinje y de las neuronas en el asta de Amón y en otro solo se observó disminución de las células de Purkinje. En cuatro de este grupo encontramos desorganización en la distribución radiada de las células de la corteza occipital. En los dos casos con ventrículo derecho hipoplásico se identificaron cambios crónicos como microcalcificaciones, a pesar de tener tan solo tres y cuatro días de vida extrauterina, por lo que se deduce que la hipoxia-isquemia ocurrió en la etapa prenatal; además se observó disminución de las células de Purkinje y de las neuronas en el asta de Amón. Lo anterior pudiera ser relevante, ya que Fontes et al.,14 en un estudio de seguimiento a largo plazo, por medio de estudios de imagen demostraron reducción en el tamaño del hipocampo en pacientes con cardiopatía, lo cual se correlaciona con discapacidad en la memoria.
Bozóky et al.11 describieron los hallazgos histopatológicos de los cerebros de 45 recién nacidos y niños hasta cuatro años de edad, quienes fallecieron por defectos cardiacos congénitos. El estudio reveló que el daño en la sustancia blanca se produjo principalmente a los tres meses de edad, mientras que en la sustancia gris se produjo después de esa edad. En nuestro estudio, la mediana de edad de los niños fue de cinco días y las lesiones cerebrales hipóxico-isquémicas incipientes fueron las más frecuentes (71 %), probablemente por los pocos días que sobrevivieron los pacientes. Dos niños (9.5 %) de menos de dos semanas de vida extrauterina tuvieron lesiones hipóxico-isquémicas tardías, de más de dos semanas de evolución, por lo que se deduce que las lesiones se produjeren antes del nacimiento.
Hasta el momento sabemos que los niños que sobreviven presentan 50 % de riesgo de alteraciones en el neurodesarrollo, aunque se han descrito cardiopatías como coartación de la aorta, trasposición de grandes vasos y síndrome de ventrículo izquierdo hipoplásico que pueden asociarse a alteraciones neurológicas incluso desde el tercer trimestre de la gestación.15 Además de la CCC, otros factores genéticos y ambientales de riesgo para lesión cerebral son las fluctuaciones hemodinámicas posnatales, los problemas respiratorios, la cirugía cardiaca mayor con uso de derivación cardiopulmonar y las complicaciones posoperatorias (circulatorias), que contribuyen, en mayor o menor grado, al desarrollo de lesiones cerebrales en el recién nacido vulnerable.16-18 Las lesiones hipóxico-isquémica del cerebro son inespecíficas; de ellas, la más frecuente es la necrosis selectiva de las neuronas maduras, que se presenta entre las 24 y 36 horas de ocurrido el evento hipóxico-isquémico y que se observa como células hipereosinofílicas y picnóticas, acompañadas de activación de la microglia, como se apreció en algunos de los niños analizados.19,20
Los estudios prequirúrgicos de imagen para evaluar el daño cerebral en los recién nacidos con CCC han reportado lesiones que incluyen afección de la sustancia blanca y accidente cerebrovascular, con una prevalencia que varía de 19 a 52 %.21 En esta investigación no se dispuso de estudios de imagen al nacimiento o en sus primeras horas de vida; sin embargo, los seis (100 %) pacientes que no fueron sometidos a ningún procedimiento diagnóstico o terapéutico presentaron alteraciones cerebrales hipóxico-isquémicas, sin evidencia de hemorragia cerebral. En un estudio observacional prospectivo, Kelly et al.,10 previa a procedimiento quirúrgico, realizaron resonancia de cerebro a 70 pacientes con cardiopatía congénita; identificaron lesiones cerebrales en 39 % (n = 27) de los casos y hemorragia cerebelosa en 9 % (n = 6). En la investigación que presentamos encontramos hemorragia cerebelar en 19 %. Marelli et al.,5 en una revisión muy amplia, sugieren que se pueden encontrar accidentes cerebrovasculares o microhemorragias: los primeros se han identificado antes y después de la cirugía cardiovascular y por procedimientos de cateterismo; las microhemorragias se asocian más frecuentemente a mala evolución, apoyo intensivo prolongado y cateterismo cardiaco.
Para contrastar nuestros hallazgos solo se encontraron dos artículos en los que los autores se basaron en autopsias de niños para dar cuenta de hallazgos cerebrales como los que aquí se reportan. Jones17,22 realizó un estudio de las alteraciones macroscópicas del cerebro; las más frecuentes fueron las anomalías focales de las circunvoluciones. En nuestro estudio encontramos solo un paciente portador de conexión anómala total de vasos pulmonares, con hipoplasia bilateral de la tercera circunvolución del temporal. En ninguno de los pacientes se identificaron alteraciones macroscópicas diferentes a hemorragia o necrosis.
Si bien se conocen los factores de riesgo asociados a daño cerebral, no todos son susceptibles de ser controlados. Uno de estos es el tiempo que tardan los pacientes en llegar al hospital, condición favorecedora de daño y que no se puede controlar exhaustivamente a fin de limitar los problemas neurológicos.
Los niños estudiados ejemplifican el daño producido a través de todos los procesos que ocurren en las CCC: factores prenatales, retraso en el diagnóstico y tratamiento, realización de procedimientos diagnósticos o terapéuticos, infecciones nosocomiales, sangrado, uso de anestésicos, entre otros, y, finalmente, la muerte. Esperamos que algunos de estos factores se puedan modificar, aunque no siempre será posible. Es necesario realizar estudios anatomopatológicos para conocer más sobre la influencia de las cardiopatías congénitas en el cerebro neonatal.
Conclusiones
El 100 % de los niños con CCC estudiados presentó algún grado de lesión hipóxico-isquémica y 35 %, algún tipo de hemorragia, de la cual la parenquimatosa fue la más frecuente.
Es necesario aumentar la identificación de causas genéticas en los pacientes con CCC.
Es importante realizar estudios de neuroimagen en los pacientes con CCC para el seguimiento desde el momento del diagnóstico, para, de acuerdo con la evolución subsecuente, correlacionar dichos cambios con los hallazgos de autopsia.
Se requiere ampliar la muestra para conocer con precisión el daño al sistema nervioso central en diversas CCC.
En los casos de CCC se debe tratar de conseguir estudios de autopsia completos para un análisis sistemático del sistema nervioso central.
Limitaciones del estudio
Las limitaciones del estudio son básicamente dos: el reducido número de pacientes por tipo de cardiopatía y no disponer de estudios genéticos amplios, incluidos los de citogenética e hibridación fluorescente in situ, para demostrar que las alteraciones en el cerebro no estuvieron relacionadas con síndromes genéticos asociados.











 text new page (beta)
text new page (beta)


