Introducción
La epidemia de enfermedad por coronavirus 2019 (COVID-19), causada por el coronavirus 2 del síndrome respiratorio agudo grave (SARS-CoV-2), se originó en diciembre de 2019 en Wuhan, China1. El 30 de enero de 2020, la Organización Mundial de la Salud (OMS) declara que el brote de la infección por el coronavirus SARS-CoV-2 (COVID-19) constituye una emergencia de salud pública de importancia internacional. El 11 de marzo de 2020, la OMS declara oficialmente la pandemia, la cual se ha extendido de manera global, con un acumulado de casi 9 millones de casos y 500,000 fallecimientos2.
En el momento actual, no existen opciones terapéuticas específicas o vacuna para la COVID-19. Se encuentran bajo investigación terapias como remdesivir (antiviral que disminuye la producción de ARN viral)3,4, favipiravir (antiviral análogo de nucleósidos que inhibe la síntesis de la cadena de ARN)5,6, hidroxicloroquina/cloroquina (limita la replicación del SARS-CoV-2)7, hidroxicloroquina/azitromicina (favorece la eliminación viral)8, lopinavir/ritonavir (inhibe la actividad proteasa del coronavirus)9, anticuerpos monoclonales (tocilizumab, antagonista del receptor de la interleucina [IL] 6)10 y plasma de donadores convalecientes (inmunoterapia pasiva)11.
La opción con plasma convaleciente resulta atractiva, dados sus precedentes en el contexto de pandemias previas, su rápida disponibilidad en zonas donde la epidemia se encuentre activa y su bien conocido perfil de bioseguridad.
Antecedentes históricos del uso de plasma convaleciente
A inicios del siglo xx, el plasma convaleciente fue utilizado como una intervención de inmunidad pasiva para el tratamiento en brotes epidémicos de infecciones virales como poliomielitis12, varicela13,14, parotiditis15 e influenza16. Durante la pandemia de influenza (1918-1925) se evaluó el uso de componentes sanguíneos en el tratamiento hospitalario de neumonía viral vs. un grupo control. Un metaanálisis realizado casi un siglo después mostró una reducción de la tasa cruda de fatalidad del 37% en los controles a un 16% en los pacientes que recibieron la intervención. El beneficio se vio maximizado si estos recibían el tratamiento en los primeros cinco días de la aparición de las complicaciones por neumonía17. A pesar de las limitaciones de dicho estudio (no cegado, no aleatorizado, sin control con placebo), se destacó el potencial beneficio del plasma convaleciente en la era moderna, por lo que cobró nuevo interés con el surgimiento de nuevas pandemias. El uso de plasma convaleciente fue recomendado como tratamiento empírico de SARS-CoV, coronavirus causante del síndrome respiratorio de Oriente Medio (MERS-CoV), influenza aviar H5N1 e influenza H1N1 y durante el brote por el virus del Ébola en el año 201418-21. En un estudio en el que se incluyeron 99 pacientes con influenza pandémica A-H1N1 en 2009, se observó que en los 20 pacientes en estado crítico que recibieron plasma convaleciente existió una reducción en la mortalidad (odds ratio [OR]: 0.20; intervalo de confianza del 95% [IC 95%]: 0.06-0.69; p = 0.011) e incluso disminución de la carga viral y respuesta sérica de citocinas (IL-6, IL19, factor de necrosis tumoral α)22. Estudios descriptivos sugieren permite reducir la estancia hospitalaria y la mortalidad (sobre todo cuando se administra de manera temprana) y es suficientemente segura23,24. En el caso del MERS los hallazgos previos han sugerido el uso de plasma convaleciente ante situaciones clínicas en las que no existen vacunas o medicamentos específicos25,26.
Uso de plasma convaleciente que la administración de plasma convaleciente en pacientes con SARS en COVID-19: evidencia disponible (experiencia internacional)
De acuerdo con una revisión sistemática que evaluó la experiencia clínica de China con la administración de plasma convaleciente, hasta el 5 de mayo de 2020 en ese país se habían recogido 2,000 muestras de plasma convaleciente, administrándose a un total de al menos 700 pacientes con COVID-1927,28. Según los datos reportados en esta revisión, se recolectaron entre 200-400 ml de plasma en cada donación, con títulos de anticuerpos > 1:160. Al revisar toda la evidencia clínica generada hasta ese momento, fueron identificados y analizados tres estudios clínicos que evaluaban a 19 pacientes que recibieron terapia con plasma convaleciente29-31.
Los detalles de estos tres estudios (un estudio piloto, una serie de casos y un informe de caso) se presentan en la tabla 1. En los tres, la mediana de edad fue de 55 años (rango intercuartílico [IQR]: 46-67 años) la edad de los pacientes fue de 30 a 78 años. La mediana del tiempo desde el inicio de los síntomas hasta la admisión y la transfusión de plasma convaleciente fue de 4 días (IQR: 2-8 días) y 19 días (IQR: 14-20 días), respectivamente. Siete pacientes tenían enfermedades crónicas (enfermedades cardiovasculares y/o cerebrovasculares, insuficiencia renal crónica, enfermedad pulmonar obstructiva crónica e hipertensión). Antes de la terapia con plasma convaleciente, 12 pacientes recibieron esteroides (metilprednisolona) y todos los pacientes recibieron algún antiviral, como terapia convencional, 12 pacientes se encontraban con ventilación mecánica, seis con oxígeno por cánula nasal de alto flujo y dos recibieron oxigenación convencional con cánula nasal de bajo flujo.
Tabla 1 Experiencia internacional en el uso de plasma convaleciente en COVID19
| País | Estudio/autor | Tipo de estudio | Grupo de pacientes (n) PC | Grupo control sin PC (n) | Otros medicamentos | Resultados clínicos | Valores | Valor de p | |
|---|---|---|---|---|---|---|---|---|---|
| China | Shen, et al., 202029
Duan, et al., 202030 Zhang, et al.,31,34 |
Estudio piloto Serie de casos Informe de caso |
19 pacientes entre los 3 estudios | 10 | Arbidol, ribavirina, remdesivir, IFN-a, lopinavir/ritonavir, IFN-a1b, favipiravir, darunavir, oseltamivir | Respuesta | Grupo pacientes PC | Grupo control sin PC | < 0.001 |
| Muerte | 0 (0) | 3 (30) | |||||||
| Estable | 2 (10) | 6 (60) | |||||||
| Mejoría | 8 (42) | 1 (10) | |||||||
| Egresado | 9 (48) | 0 (0) | |||||||
| China | Ling, et al., 202032 | Ensayo clínico multicéntrico, aleatorizado, abierto | 52 pacientes | 51 | Tratamiento estándar | Mejoría clínica a 28 días | Grupo pacientes PC | Grupo control son PC | p=0.26 Diferencia 8.8% (IC 95%: –10.4 a 28.0%; HR: 1.40 (IC 95%: 0.79-2.49) |
| 51.9% (27/52) | 43.1% (22/51) | ||||||||
| EE.UU. | Joyner, et al.,33 | EAP abierto, multicéntrico, nacional | 20,000 pacientes | - | - | Mortalidad a los 7 días | 5,000 pacientes | 20,000 pacientes | - |
| 12.04% (IC 95%: 11.17-12.97%) | 8.56% (IC 95%: 8.18-8.95%) | ||||||||
PC: plasma convaleciente; IC 95%: intervalo de confianza del 95%; HR: cociente de riesgo; EAP: Programa de Acceso Extendido.
Se formó un grupo de control histórico mediante una selección aleatoria de 10 pacientes, de la cohorte del estudio de Duan, et al.30, que coincidían con la edad, el sexo y la gravedad de la enfermedad. Las características basales de los pacientes entre el grupo de tratamiento con plasma convaleciente y el grupo control se mostraron sin diferencias significativas (p > 0.05). La linfopenia, un índice importante en el pronóstico en COVID-19, tendió a mejorar después de transfusión de plasma convaleciente (mediana: 0.65 × 109/l vs. 0.76 × 109/l). Este análisis mostró una mejora estadísticamente significativa en los resultados clínicos de los pacientes que recibieron plasma en comparación con los casos no tratados (p < 0.001). No se informaron efectos adversos graves (Tabla 1).
Ling, et al. publicaron los resultados de su ensayo clínico aleatorizado, que incluyó a 103 pacientes con COVID-19 grave o potencialmente mortal, y reportaron que la terapia de plasma convaleciente agregada al tratamiento estándar no mejoró significativamente el tiempo de mejoría clínica dentro de los 28 días, aunque el ensayo se terminó temprano y puede haber tenido poca potencia para detectar una diferencia clínicamente importante. La razón de riesgo de tiempo para la mejoría clínica dentro de los 28 días en el grupo de pacientes que recibió plasma convaleciente vs. el grupo de tratamiento estándar fue de 1.40 y no fue estadísticamente significativa32.
Recientemente, se reportó la actualización de los resultados de seguridad del Programa de Acceso Extendido (EAP), iniciativa de la Food and Drug Administration (FDA)33, en colaboración con la Clínica Mayo y la comunidad nacional de bancos de sangre. Este ensayo, abierto, multicéntrico y nacional (EE.UU.), incluyó la administración de plasma convaleciente a 20,000 pacientes hospitalizados con COVID-19, habiendo demostrado previamente la seguridad en 5,000 pacientes hospitalizados. La tasa general de mortalidad a los siete días fue del 8.56% (IC 95%: 8.18-8.95%), siendo mayor entre los pacientes críticos, incluidos los pacientes ingresados en la unidad de terapia intensiva vs. los no admitidos en la unidad de terapia intensiva (10.5 vs. 6.0%), ventilado mecánicamente vs. no ventilado mecánicamente (12.1 vs. 6.2%) y aquellos con shock séptico o disfunción/falla de múltiples órganos vs. shock séptico o disfunción/falla de múltiples órganos (14.0 vs. 7.6%). La intención a priori era crear un grupo de control de comparación para determinar la eficacia potencial usando pacientes hospitalizados con infecciones por COVID-19 durante el mismo periodo de tiempo. Esta decisión se tomó después de la colaboración con la FDA, por lo cual este informe es solo sobre la seguridad del plasma convaleciente para los 20,000 sujetos iniciales. Una publicación futura discutirá la eficacia potencial. Estos datos actualizados proporcionan evidencia sólida de que la transfusión de plasma convaleciente es segura en pacientes hospitalizados con COVID-19, y respaldan la noción de que la administración temprana de plasma dentro del curso clínico de COVID-19 es más probable que reduzca la mortalidad.
Principios biológicos y mecanismo de acción del plasma convaleciente
El uso de plasma convaleciente en un paciente con COVID-19 puede tener distintos efectos benéficos34, siendo el más importante la supresión de la viremia. En la infección por SARS-CoV-2 se espera el pico de la viremia en la primera semana de la infección y el desarrollo de la respuesta inmunitaria primaria hacia el día 10 a 14, que da paso al aclaramiento viral. Por lo anterior, se infiere que la utilidad de la administración de plasma convaleciente es mayor durante las fases tempranas de la enfermedad. Además de la neutralización se han descrito otros potenciales mecanismos de acción (Fig. 1).

Figura 1 Mecanismos de acción propuestos del plasma convaleciente en enfermedad por coronavirus 2019 (COVID-19). Ac: anticuerpos; IgIV: inmunoglobulina intravenosa.
Neutralización viral mediada por anticuerpos
Dado que el SARS-CoV-2 utiliza el receptor de la enzima convertidora de angiotensina 2 (ACE2) en la superficie de la célula huésped para unirse y entrar a ella mediante su proteína Spike (S), este resulta una diana atractiva para prevenir la captación viral. Entre las opciones terapéuticas posibles está el uso de anticuerpos neutralizantes de suero convaleciente o el uso de anticuerpos diseñados por ingeniería molecular. Estos pueden tener diversos mecanismos de acción según su diseño u origen, como el dominio de unión al receptor soluble (basado en la proteína SAR-S) que ocuparía el receptor de la ACE2 o su forma soluble evitando el acceso al SARS-CoV-2 o bien secuestrando de manera competitiva al receptor de la ACE2 unido a la superficie celular en las células huésped, evitando de la misma manera la captación viral35.
Citotoxicidad celular mediada por anticuerpos, activación del complemento y fagocitosis
La presencia de anticuerpos contra el virus en cuestión puede suprimir la viremia mediante mecanismos neutralizadores, proporcionando una inmunidad inmediata, aunque transitoria, al huésped susceptible, permitiendo además el desarrollo de inmunidad activa posterior a la unión de la porción Fc (presente en anticuerpos de ocurrencia natural y los diseñados por ingeniería molecular), facilitando la presentación de antígenos por células dendríticas y linfocitos T helper (citotoxicidad mediada por anticuerpos), la activación del complemento y la fagocitosis; estudios in vitro sugieren también un efecto benéfico planteando que la inmunidad pasiva favorece el aclaramiento de células infectadas35,36.
Inmunomodulación
La presencia de anticuerpos no neutralizantes con capacidad de unión viral puede jugar un papel importante. Se ha propuesto que además de los mecanismos descritos esta variedad de anticuerpos tengan un efecto inmunomodulador, el cual podría limitar el daño tisular mediado por la respuesta inflamatoria sistémica del huésped en la fase temprana de la infección36-38.
La mayoría de los estudios describen su uso terapéutico en una dosis única de plasma convaleciente obtenido de 1 o 2 donadores (esto último, de forma teórica, podría incrementar la eficacia de la intervención al obtener anticuerpos de calidad y capacidad neutralizante distintos y eventualmente dirigidos a distintos epítopos)38. Se ha propuesto el uso de profilaxis en el contexto de individuos susceptibles y personal de salud que se encuentre en exposición constante a la infección, aunque no se tiene aprobación local ni internacional.
Eventos adversos a la transfusión de plasma convaleciente
El uso terapéutico de plasma convaleciente como modalidad de inmunidad pasiva puede provocar eventos adversos los cuales pueden ser clasificados en dos grupos: conocidos y teóricos.
Riesgos conocidos
TRANSMISIÓN DE INFECCIONES
Los riesgos conocidos asociados a la transfusión de cualquier hemocomponente son aquellos inherentes a la transmisión de agentes infecciosos (virus de la inmunodeficiencia humana, virus de la hepatitis B y C, sífilis y enfermedad de Chagas, entre otros). Con el advenimiento de técnicas de detección de agentes transmitidos por transfusión (serología y técnicas de amplificación de ácidos nucleicos) el riesgo de la transmisión inadvertida de patógenos o agentes infecciosos susceptibles de generar una reacción adversa a la transfusión es muy bajo.
REACCIONES SECUNDARIAS A LOS CONSTITUYENTES DEL PLASMA
Lesión pulmonar aguda asociada a la transfusión
Es importante recalcar que el uso de suero convaleciente se realizará en pacientes con condiciones predisponentes, particularmente afectación pulmonar secundaria a COVID-19 lo cual aumentará su susceptibilidad a eventos adversos por lesión pulmonar aguda (LPA) asociada a transfusión (TRALI, por sus siglas en inglés)39. Tomando en cuenta la teoría de los dos eventos para explicar la fisiopatología de la LPA asociada a transfusión partiremos de una fase de preactivación de polimorfonucleares (primer evento) en respuesta a la patología pulmonar predisponente (COVID-19) con lo cual moléculas de adhesión como el ligando glucoproteico-1 de la selectina P y la molécula de adhesión intercelular-1 en neutrófilos, selectina P y b2-integrina en células endoteliales y selectina P en las plaquetas se sobreexpresarán y promoverán interacciones celulares, induciendo la migración de neutrófilos al espacio alveolar. El denominado segundo evento constituye la transfusión de componentes que contengan factores como anticuerpos y modificadores de la respuesta biológica (tal es el caso del plasma convaleciente), con lo cual se acentuará la leucostasis pulmonar, la activación de neutrófilos y la formación de NETosis. Todo ello se traducirá en una dificultad respiratoria aguda y edema pulmonar rico en proteínas característico de la TRALI. Para minimizar dicho riesgo es fundamental que en el reclutamiento de donadores se realice cribado para la detección de anticuerpos anti-HLA (antígeno leucocitario humano) en mujeres con antecedente gestacional o bien, de no contar con dicha herramienta, descartar mujeres con antecedente gestacional de la donación33.
Sobrecarga de volumen asociada a transfusión
Es una complicación que debe tomarse en cuenta, debido a que puede coexistir con TRALI y los pacientes candidatos a uso de plasma convaleciente generalmente se encuentran en estado crítico, con comorbilidades predisponentes y mal manejo de fluidos, lo que condicionará per se sobrecarga a ventrículo derecho aumentando el riesgo de dicho evento. Podrá prevenirse la sobrecarga de volumen con un manejo juicioso de la velocidad de infusión y uso de diuréticos.
Riesgos teóricos
EFECTO POTENCIADOR VIRAL DEPENDIENTE DE ANTICUERPOS Y ANERGIA SECUNDARIA
Existe el riesgo teórico de un efecto potenciador viral dependiente de anticuerpos, lo cual se ha explicado como complicación en otras infecciones virales o en el uso de anticuerpos monoclonales (palivizumab). Este efecto se explica debido a que al haber una infección primaria que culmina con la producción de anticuerpos subneutralizantes o no neutralizantes estos no serán capaces de proteger al huésped de una infección ulterior, pero sí facilitarán la unión de partículas virales a la célula a través de su receptor Fc. Así pues, el riesgo de infundir anticuerpos no neutralizantes o subneutralizantes se traduciría en un aumento en la captación viral y la gravedad de la infección, sin embargo, este efecto no se espera que sea de relevancia clínica en el contexto de anticuerpos policlonales (como los existentes en el plasma convaleciente) y la evidencia disponible sugiere la seguridad de esta intervención terapéutica40. Otro riesgo teórico propuesto es la atenuación que podría tener sobre el sistema inmunitario del receptor el administrar una carga de anticuerpos de manera pasiva, por lo que se sugeriría la inmunización sistemática de estos individuos al contar con una vacuna disponible para SARS-CoV-235.
AUMENTO DEL RIESGO TROMBÓTICO
Las alteraciones hematológicas, específicamente en lo que respecta a la coagulación, han sido descritas en otro apartado de este suplemento, sin embargo vale la pena recalcar que el paciente con infección por SARS-CoV-2 manifestará datos clínicos de una coagulopatía intravascular pulmonar mediada principalmente por mecanismos inmunotrombóticos, la cual se traduce en elevación del fibrinógeno y dímero D y una activación importante del sistema del plasminógeno-plasmina41, como reflejo de un daño alveolar difuso e inflamación endotelial, con un efecto dominó potenciado por una desregulación de la respuesta endotelial pulmonar y posteriormente una coagulación intravascular diseminada, teniendo como desenlace trombosis (raramente hemorragia)42. Indudablemente un paciente con factores de riesgo y dichas alteraciones en la coagulación tendrá que someterse a un esquema de tromboprofilaxis como parte integral del manejo. Actualmente no existe evidencia de que el uso de plasma convaleciente aumente el riesgo tromboembólico del paciente, probablemente el uso de este componente (que contiene factores procoagulantes) se vea atenuado por el efecto inmunomodulador de los elementos que contiene (anticuerpos no neutralizantes, citocinas antiinflamatorias, factores anticoagulantes [proteína C y S]).
Existe evidencia disponible plasmada en la experiencia del EAP (Joyner, et al., Mayo Clinic, previamente mencionado), quienes reportan una incidencia baja de eventos adversos graves. De un universo de 20,000 pacientes, solo 89 tuvieron reacciones transfusionales (< 1%), 87 eventos tromboembólicos o trombóticos (< 1%), 680 eventos cardiovasculares (~ 3%). En estos dos últimos rubros la mayor parte de los eventos no fueron atribuidos a la transfusión per se (55 y 562 eventos no relacionados a la transfusión respectivamente)38.
Selección del potencial donador de plasma convaleciente
La obtención de plasma convaleciente debe realizarse solo en individuos que cumplan de manera estricta con la normativa local vigente. Las guías internacionales, destacando la emitida por FDA, destacan cuatro puntos clave: evidencia documentada por laboratorio de infección por SARS-CoV-2, resolución completa de los síntomas, sexo del donador y presencia de anticuerpos neutralizantes (si se cuenta con ella). En las figuras 2 y 3 se muestra un algoritmo propuesto para la selección del donador recuperado de la infección por SARS-CoV-2 para la donación de plasma convaleciente.
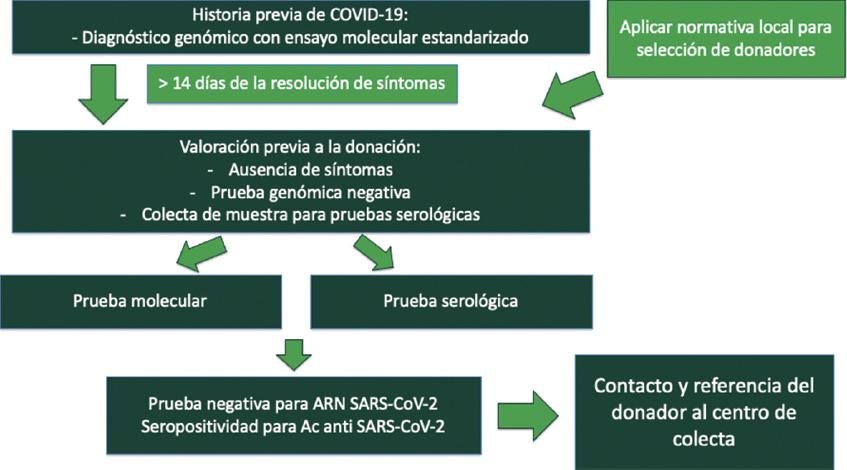
Figura 2 Algoritmo sugerido para la preselección de donadores de plasma convaleciente en enfermedad por coronavirus 2019 (COVID-19). Ac: anticuerpos; SARS-CoV-2: coronavirus 2 del síndrome respiratorio agudo grave.

Figura 3 Algoritmo sugerido para el proceso de obtención y administración de plasma convaleciente en enfermedad por coronavirus 2019 (COVID-19). Ac: anticuerpos; HLA: antígeno leucocitario humano.
Prueba confirmatoria
Se debe tener evidencia laboratorial que confirme la enfermedad: reacción en cadena de la polimerasa por exudado nasofaríngeo u orofaríngeo o una prueba serológica positiva en caso de no contar con prueba confirmatoria cuando se sospechó de COVID-19.
Resolución completa de la sintomatología
A pesar de que la respuesta inmunológica en la infección por SARS-CoV-2 no es conocida del todo y los valores clínicos representativos para el escrutinio de anticuerpos no han sido establecidos, se cuenta con estudios pivotales que nos dan un panorama general del comportamiento serológico de la enfermedad. Un estudio en China que enroló a 173 pacientes demostró una tasa de seroconversión para anticuerpos totales, inmunoglobulina (Ig) M e IgG del 93, 82.7 y 64.7% en una media de 11, 12 y 14 días, respectivamente. La tasa de producción de anticuerpos incrementa rápidamente de < 40% antes del día 7 del inicio de la enfermedad hasta el 100, 94.3 y 79.8% para anticuerpos totales, IgM e IgG respectivamente hacia el día 15 de la enfermedad. A la par se espera una tasa de aclaramiento de ARN del 66.7% antes del día 7 hasta un 45.5% después del día 15. No se encontraron diferencias en la tasa de formación de anticuerpos haciendo el comparativo entre pacientes con infección clínicamente leve e infección grave43. En un estudio italiano el 67% de un total 60 donadores voluntarios de sangre total provenientes de la provincia de Castiglione d’Adda tuvieron una conversión serológica a pesar de haber cursado asintomáticos desde el diagnóstico genómico de la enfermedad44. Es por ello que las guías implementadas de manera internacional (AABB [antiguamente American Association of Blood Banks], FDA, EBA [European Blood Alliance]) recomiendan el reclutamiento de donadores hacia el día 14 del fin de la sintomatología. De manera deseable los donadores deben contar con una prueba de reacción en cadena de la polimerasa negativa para garantizar la seguridad del personal involucrado en el proceso de selección del donador y obtención de plasma convaleciente.
Sexo del donador
Se consideran candidatos donadores masculinos o femeninos sin antecedentes gestacionales. Si se desea incluir donadoras con antecedente gestacional es necesario un escrutinio negativo para anticuerpos anti-HLA (riesgo de TRALI, ver apartado de eventos adversos a la transfusión de plasma convaleciente)33.
Titulación de anticuerpos neutralizantes
Respecto a la titulación de anticuerpos totales, título de IgG o IgM previos a la colecta de plasma, no existe evidencia que correlacione con la capacidad de neutralización; si se cuenta con la capacidad para medir anticuerpos neutralizantes es recomendable que el predonador tenga un título óptimo de anticuerpos anti-SARC-CoV-2 (> 160), un título de 1:80 se considera aceptable si un se cuenta con otra unidad compatible45. Se propone adicionalmente la realización de ensayos de neutralización, los cuales involucran el uso de cultivos celulares, siendo óptima una cifra > 40, cabe destacar que la complejidad de estos ensayos y la necesidad de contar con un laboratorio con nivel de bioseguridad III limita mucho su aplicación en la práctica diaria, por lo que su uso no se considera obligatorio. En caso de no contar con la capacidad de realizar ninguno de estos estudios se recomienda la integración de una seroteca para su determinación ulterior.
Selección de pacientes candidatos a recibir plasma convaleciente
De acuerdo con lineamientos emitidos por FDA38,43, se sugiere el uso de plasma convaleciente en los siguientes contextos:
- Enfermedad grave: disnea, frecuencia respiratoria ≥ 30 respiraciones por minuto, saturación de oxígeno en sangre ≤ 93%, relación de presión parcial de oxígeno arterial/fracción de oxígeno inspirado < 300 o infiltrados pulmonares > 50% dentro de 24 a 48 horas al ingreso.
- Enfermedad potencialmente mortal: insuficiencia respiratoria, choque séptico o disfunción o falla de múltiples órganos.
Adicional a esto se sugiere el uso en pacientes con comorbilidades o factores de riesgo; el uso de plasma convaleciente deberá estar respaldado por un ensayo clínico, apegándose a la normativa local, contando con aprobación del comité de ética y un consentimiento informado del paciente o familiar responsable.
Obtención de plasma convaleciente: fraccionamiento de sangre total y plasmaféresis
La plasmaféresis es un procedimiento de separación celular que permite la obtención de plasma de un donador y el retorno del componente celular a la circulación corporal, lo que permite la colecta de una mayor cantidad del componente deseado (plasma), una mayor calidad de este, una colecta de un mayor volumen de plasma convaleciente, una menor incidencia de eventos adversos a la donación y transfusión y la posibilidad de contar con donantes de repetición. Es posible también obtener este componente mediante fraccionamiento de sangre total, con la desventaja de limitar el número de eventos transfusionales, mayor incidencia de eventos adversos a la donación y mayor contenido celular residual en el componente, lo que pudiera asociarse a una mayor tasa de eventos adversos a la transfusión.
Administración de plasma convaleciente
Se sugiere la administración se realice en una infusión lenta, en un periodo no mayor a 6 horas, sin embargo, dado que la viabilidad de los anticuerpos contenidos en el producto no se compromete tanto como los factores de coagulación (termolábiles), en situaciones especiales (pacientes con sobrecarga de volumen, insuficiencia ventricular derecha) podrá extenderse el periodo de administración. No se sugiere el uso sistemático de premedicación, especialmente esteroides, los cuales pudieran atenuar la respuesta inmunitaria. Deberá realizarse un reporte de eventos adversos siguiendo la normativa y considerando estos una variable principal en el análisis de los resultados del protocolo en cuestión.
Normatividad nacional
El Lineamiento técnico para protocolos de investigación relacionados con el uso terapéutico de plasma proveniente de donadores convalecientes de COVID-19 secundaria a infección por SARS-COV-2 es un documento emitido por el Centro Nacional de la Transfusión Sanguínea, con fundamento en lo establecido por el artículo 42 del Reglamento Interior de la Secretaría de Salud, con el fin de ordenar y alinear a los diferentes bancos de sangre y centros de investigación en México que han mostrado interés en el uso con fines de investigación de plasma convaleciente de donadores recuperados de infección por SARS-CoV-2 en pacientes hospitalizados con COVID-19.
En este documento se encuentran concentrados los lineamientos para poder realizar un protocolo de investigación clínica con plasma convaleciente de donadores recuperados de SARS-CoV-2 y se encuentra disponible en: https://www.gob.mx/cnts/documentos/recome ndaciones-de-abordaje-para-atender-la-pandemia-de-virus-covid-19-en-los-servicios-de-sangre?idiom=es.
Para el desarrollo del protocolo se deben observar adicionalmente las consideraciones del documento La Bioética ante la Pandemia del COVID-19, publicado por la Comisión Nacional de Bioética, el cual se puede consultar en: https://www.gob.mx/cms/uploads/attachment/file/544215/Pronunciamiento_Bioetica_ante_la_pandemia_del_COVID_19.pdf.
Conclusiones
El SARS-CoV-2 ha provocado una crisis de salud global. En ausencia de una vacuna u opciones específicas de tratamiento farmacológico para la COVID-19, el mundo ha dirigido la atención al posible uso terapéutico del plasma convaleciente.
La evidencia científica mundial actual demuestra que desde los primeros ensayos clínicos realizados, la inmunoterapia pasiva con plasma derivado de pacientes convalecientes de COVID-19 es segura33. En cuanto a la eficacia, existen varios estudios que mostraron una estancia hospitalaria más corta y una mortalidad más baja en pacientes tratados con plasma convaleciente que en aquellos que no fueron tratados con plasma convaleciente27-32, sin embargo, existe una clara necesidad de realizar estudios clínicos aleatorizados, más rigurosos, que permitan evaluar de forma objetiva la eficacia del plasma convaleciente, ya que dentro de las limitaciones de la evidencia de la mayoría de los estudios publicados se encuentra que esta es de muy baja certeza por alto riesgo de sesgo (estudios abiertos), inconsistencia, imprecisión y evidencia indirecta. Los datos de ensayos clínicos rigurosamente controlados de plasma convaleciente son pocos, lo que subraya la necesidad de evaluar su uso de manera objetiva para un rango de indicaciones y poblaciones de pacientes específicos, que puedan ser beneficiados en mayor grado de esta intervención terapéutica.
A nivel mundial y nacional, los bancos de sangre cuentan con una infraestructura robusta para realizar recolecciones y construir inventarios de plasma convaleciente para satisfacer la creciente demanda. No obstante, existen desafíos matizados, tanto regulatorios como logísticos, que abarcan la elegibilidad de los donantes, el reclutamiento de donantes, las colecciones y la transfusión misma.
Con el fin de proporcionar a los diferentes centros de investigación que han mostrado interés en el uso con fines de investigación plasma convaleciente de donadores recuperados de infección por SARS-CoV-2 en pacientes hospitalizados con COVID-19, es importante que los establecimientos de sangre estén listos para satisfacer las solicitudes de plasma inmune definiendo los requisitos aplicables a los donantes de plasma y los estándares para la preparación, calificación, almacenamiento, distribución y control del uso del producto. Este documento de posición tiene como objetivo dar recomendaciones sobre las características biológicas de una preparación de plasma de donantes convalecientes y apoyar la evaluación de este enfoque terapéutico en investigaciones más rigurosas.











 text new page (beta)
text new page (beta)


