Posibles intervenciones terapéuticas para la infección por SARS-CoV-2
En la lucha por contrarrestar la enfermedad emergente de COVID-19 se ha utilizado una gran variedad de fármacos; sin embargo, aún no se cuenta un tratamiento estándar.
Las propuestas de tratamiento abordan diferentes aspectos:
– Entrada del virus a las células.
– Replicación del virus.
– Reforzamiento de la inmunidad y prevención de la inflamación exacerbada.
– Control de las complicaciones.
Se han realizado numerosos ensayos en busca de tratamientos o combinación de fármacos para lograr la recuperación o aminorar el progreso hacia las formas graves de la enfermedad. En esta revisión se describen algunas de las propuestas más importantes.
Remdesivir
El remdesivir es un análogo de la adenosina, por lo que disminuye la producción de ARN viral.1 Su uso para el tratamiento de COVID-19 aún no se encuentra aprobado, aunque continúan desarrollándose diversos estudios experimentales. En estudios in vitro se observó efectividad del remdesivir contra SARS-CoV-2. En animales de experimentación, remdesivir redujo la hemorragia pulmonar y el número de copias de ARN viral. Estudios preliminares en humanos sugieren que el 70 % de los pacientes tratados con este antiviral lograron mejoría, incluyendo aquellos con ventilación asistida. En un análisis multicéntrico no controlado se empleó remdesivir, 200 mg el primer día y posteriormente 100 mg/día durante nueve días; de 53 pacientes que recibieron el fármaco, 36 mostraron mejoría clínica (68 %).2 En otro estudio multicéntrico aleatorizado doble ciego controlado con placebo se incluyeron 237 pacientes; el uso del remdesivir no se asoció a mejoría clínica en comparación con el grupo control. Además, se reportaron más efectos adversos en el grupo que recibió el fármaco.3 Los resultados de estas investigaciones sugieren que se requieren protocolos con mayor número de pacientes a fin de evaluar los beneficios que podría ofrecer el fármaco en cuanto al tiempo en la mejoría clínica.
Rivabirina, lopinavir y ritonavir
La ribavirina es un nucleósido sintético de la guanosina que interfiere con la síntesis del ARNm. Por su parte, el lopinavir es un inhibidor de proteasas, que al coadministrarse con una dosis baja del ritonavir mejora significativamente sus propiedades farmacocinéticas y potencia su actividad contra la proteasa de VIH-1.4,5
En un estudio realizado en 75 pacientes con síndrome respiratorio agudo grave, se observó una reducción en las tasas de mortalidad (2.3 %) e intubación (0 %) en los pacientes inicialmente tratados con 400/100 mg de lopinavir/ritonavir cada 12 horas por 14 días.6 En otra investigación de 199 pacientes con SARS-CoV-2, a 99 pacientes se les administró lopinavir/ritonavir y terapia estándar y fueron comparados con un grupo control que recibió solo terapia estándar; los resultados no mostraron diferencia entre grupos en el tiempo de mejoría de los pacientes.7
En otro análisis de pacientes con COVID-19 se administró 400/100 mg de lopinavir/ritonavir cada 12 horas a un grupo, mientras que otro recibió adicionalmente 400 mg de ribavirina cada 12 horas y tres dosis de 8 ×106 UI de interferón en días alternados. Los resultados indicaron que la triple terapia antiviral fue segura y superior a la monoterapia con lopinavir/ritonavir en lo que respecta a la duración de la enfermedad y días de estancia hospitalaria.8 Actualmente se están llevando a cabo estudios para determinar la eficacia de diferentes dosis de rivavirina, en monoterapia o en combinación con otros fármacos, en el manejo de COVID-19.9
Azitromicina
Azitromicina es un antibiótico macrólido cuyo mecanismo de acción se basa en su unión reversible a la subunidad 50s del ribosoma bacteriano, impidiendo la translocación.10 Este fármaco también ha mostrado propiedades antiinflamatorias e inmunomodulatorias, lo cual ha llevado al interés por su uso en infecciones virales. Los reportes muestran disminución del número de neutrófilos y de la concentración de las interleucinas (IL) 8, 6, 1b, del factor de necrosis tumoral a, proteína catiónica eosinofílica y metaloproteinasa 9.11 Estos datos sugieren que la azitromicina podría disminuir la cascada de citocinas inflamatorias característica de COVID-19. La azitromicina también crea un medio poco propicio para la replicación viral.12 La administración de azitromicina se inicia con 500 mg vía oral el primer día, seguidos de 250 mg/día durante dos a cinco días, según el criterio médico y enfermedades preexistentes del paciente.13 Otros autores evaluaron las cargas virales en los pacientes con COVID-19 tras recibir hidroxicloroquina y azitromicina; concluyeron que esta combinación de fármacos produce eliminación viral con mayor eficacia.14 Actualmente, el Instituto Nacional de Alergias y Enfermedades Infecciosas de Estados Unidos se encuentra patrocinando un estudio clínico para evaluar este fármaco en terapia combinada con hidroxicloroquina.15
Cloroquina e hidroxicloroquina
Se considera que estos fármacos son capaces de cambiar el pH de los lisosomas y, por lo tanto, de modificar la actividad de las proteasas e interferir con el ingreso del virus a las células. La cloroquina y la hidroxicloroquina también se caracterizan por disminuir las interleucinas proinflamatorias, en particular IL-6, por lo que su acción también podría ser benéfica en la “tormenta de citocinas”.16 Además, se observó que ambos fármacos en concentraciones bajas son capaces de inhibir la replicación del virus y reducir la carga viral, en estudios in vitro y en humanos, respectivamente. Sin embargo, como desventaja se identificó que el uso de la cloroquina e hidroxicloroquina provoca efectos cardiotóxicos, efecto muy importante que es necesario considerar.17
Ivermectina
Estudios in vitro de células Vero/hSLAM infectadas con SARS-CoV-2 y tratadas con ivermectina en una concentración de 5 mM mostraron una reducción casi total del ARN viral; además, no se observó toxicidad de la ivermectina en la concentración evaluada.18
El mecanismo de acción de la ivermectina aún se desconoce, sin embargo, se piensa que inhibe la importina a/b1 y proteínas nucleares del virus y del hospedero.12 La dosis varía según algunos criterios, pudiendo ser de 12 mg en dosis única por vía oral o 12 mg vía oral durante dos días. Varios países están empleando la ivermectina en los tratamientos de primera elección para combatir la enfermedad, tal es el caso de República Dominicana, Bolivia y Perú. Sin embargo, se considera apropiado realizar más estudios para evaluar a fondo su efectividad como antiviral.19
Tocilizumab
Este fármaco es un anticuerpo monoclonal humanizado antagonista del receptor de IL-6.20,21 Actualmente se están llevando a cabo numerosos estudios clínicos para evaluar el uso del tocilizumab en el tratamiento de la infección por SARS-CoV-2.22 Una investigación realizada en China con 21 pacientes reportó que la adición de 4 a 8 mg/kg de tocilizumab a la terapia estándar produjo mejoría clínica, las opacidades en patrón de vidrio esmerilado en las tomografías computarizadas disminuyeron después de la administración del fármaco, 15 de 20 pacientes requirieron menos oxígeno suplementario y un paciente no lo requirió.23 Sin embargo, este estudio no fue controlado y la cantidad de pacientes analizados no es suficiente para formular mayores inferencias, por lo que se requieren más investigaciones para evaluar la eficacia de tocilizumab.
Vitamina C
La vitamina C posee capacidad antioxidante mediante la donación de un electrón al radical lipídico, lo cual detiene la reacción autoperpetuada de la peroxidación lipídica; posteriormente, la vitamina C se transforma en dos moléculas, el radical ascorbato y el dehidroascorbato; este último se transforma nuevamente en ascorbato por la acción de una oxidorreductasa.24 La dosis diaria de vitamina C recomendada es de 90 y 75 mg/día en varones y mujeres sin requerimientos especiales. Se sabe que las infecciones virales generan grandes cantidades de radicales libres de oxígeno; la vitamina C se utiliza para neutralizar ese estrés oxidativo.25,26 Además, la vitamina C reduce la inflamación mediante la estimulación de la producción de citocinas antiinflamatorias e interferón, por lo que se le atribuye un efecto antiviral directo,27-29 de ahí que se considere su probable utilidad terapéutica en COVID-19.30
Recientemente se realizó un estudio clínico aleatorizado controlado: CITRIS-ALI, en pacientes hospitalizados a quienes se administró una dosis alta de vitamina C por infusión (50 mg/kg cada seis horas por 96 horas). Si bien no se identificaron diferencias significativas en la puntuación de la escala de falla orgánica secuencial (SOFA) ni mejoría en los biomarcadores de inflamación o daño vascular (proteína C reactiva y trombomodulina, respectivamente), se encontró que los pacientes tratados con vitamina C requirieron menos días de terapia intensiva y, en general, de hospitalización.31,32 Las dosis altas de vitamina C se comportan como prooxidantes, por lo que en algunos estudios se sugieren que pequeñas dosis pueden tener mayor beneficio.33 En COVID-19, el papel de la vitamina C como tratamiento coadyuvante es aún incierto.
Vitamina D
La vitamina D es fotosintetizada en la piel a partir del 7-dehidrocolesterol.34 Además de otras funciones, la forma activa de la vitamina D (calcitriol) desempeña un papel como inmunomodulador, incrementando la respuesta inmunitaria innata e inhibiendo la respuesta inmunitaria adaptativa.35 En un estudio multicéntrico retrospectivo de 212 casos se encontraron niveles bajos de vitamina D en pacientes con COVID-19 en estado crítico, reportándose una asociación con el desenlace clínico.36 La mayor causa de deficiencia de vitamina D es la exposición inadecuada a la luz solar,37,38 lo que se ha sugerido como una causa de la severidad de las respuestas a la infección y la mortalidad debida a SARS-CoV-2 en Europa, junto con la ingesta inadecuada de la vitamina.39,40 Estos datos sugieren que la suplementación con vitamina D puede formar parte de la intervención terapéutica y profiláctica en COVID-19.41
Tratamientos relacionados con el sistema renina-angiotensina
La participación de los fármacos que inhiben el sistema renina-angiotensina, tales como los inhibidores de la enzima convertidora de angiotensina (IECA) y los antagonistas de los receptores de angiotensina II (ARA) son objeto de controversia en el contexto de la pandemia de COVID-19. Por un lado, existe información que muestra que la continuidad del tratamiento con IECA o ARA disminuye la morbilidad y mortalidad en pacientes con COVID-19.42 En una revisión sistemática que incluyó 12 artículos con más de 19 000 casos de COVID-19 se reportó que la exposición a IECA o ARA no estuvo asociada a mayor riesgo de infección por COVID-19 ni a mayor riesgo de una infección grave o mortalidad; por el contrario, la exposición a IECA o ARA se asoció a menor riesgo de mortalidad al comparar los resultados con los obtenidos en pacientes medicados con otros antihipertensivos.43 Mehta et al. concluyeron que no existe una asociación significativa entre el uso de IECA o ARA y la positividad de la prueba de COVID-19. Todos estos datos en conjunto respaldan la noción de no interrumpir los IECA o ARA en el contexto de la pandemia de COVID-19.44 Además, actualmente están en curso varios protocolos para evaluar el efecto de la administración de dichos antagonistas para el tratamiento de pacientes con COVID-19.42
En contraposición, estudios recientes de cohortes de Wuhan, China, sugieren que los peores resultados parecen ser más frecuentes en pacientes con hipertensión y diabetes, posiblemente debido a la sobreexpresión de la enzima convertidora de angiotensina tipo 2 (ECA2) en las células epiteliales alveolares debido al tratamiento con IECA o ARA. En investigaciones con animales, ARA y IECA aumentaron la expresión de ECA2, sitio de acceso de SARS-CoV-2, por lo surge la inquietud de si estos fármacos aumentan la morbilidad y mortalidad por COVID-19.45 Es importante señalar que la búsqueda minuciosa de los datos en la literatura no apoya esta asociación.46
ECA2 soluble, no asociada con la membrana, es enzimáticamente activa e inhibe parcialmente la entrada del virus hacia las células blanco. Recientemente en Europa se reportó un estudio clínico en fase II, en el que se está probando la ECA2 humana soluble de grado clínico para bloquear la infección por SARS-CoV-2.42 De hecho, se han descrito algunas variaciones estructurales de la ECA2 humana, la cual se caracteriza por su baja afinidad a la proteína viral en espiga. Los datos anteriores abren un potencial de implicaciones protectoras de la ECA2 sobre la entrada del virus47 (Figura 1).
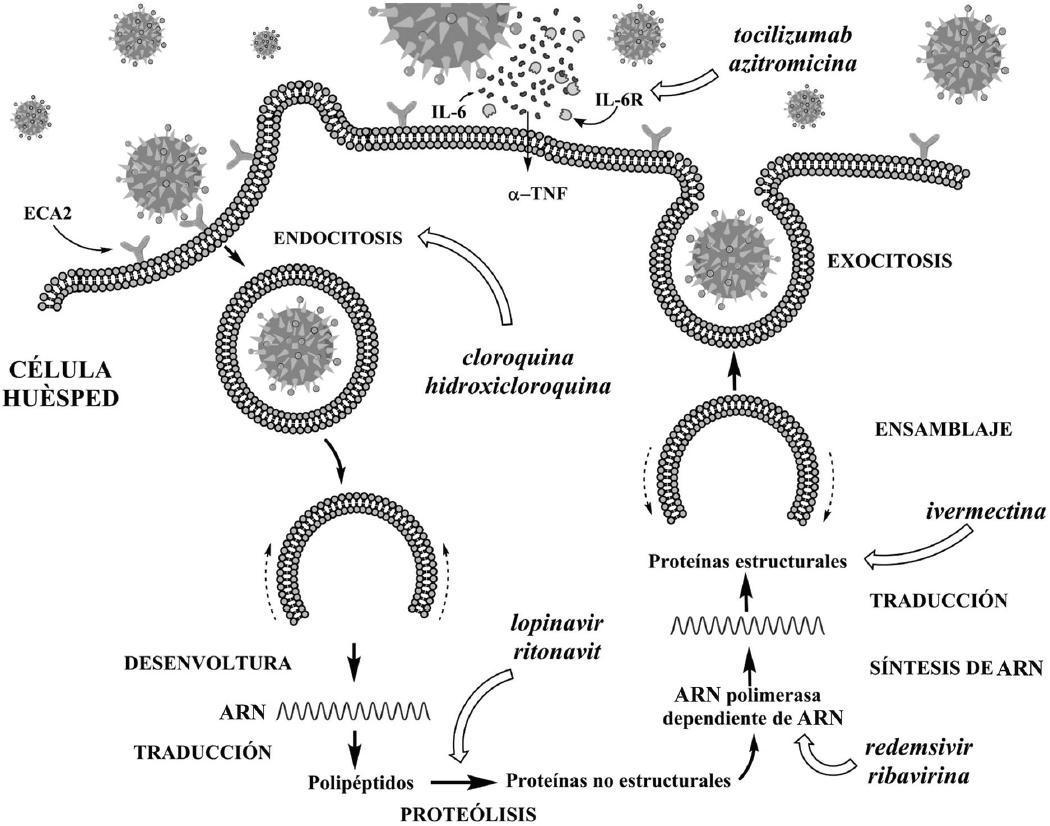
Figura 1 Tratamientos propuestos para COVID-19. Se muestran los sitios de acción probables de algunos fármacos utilizados en forma experimental y clínica contra SARS-CoV-2. Cloroquina e hidroxicloroquina inhiben la interiorización viral y la endocitosis; además, tienen efecto inmunomodulador en el huésped. Azitromicina y tocilizumab inhiben la activación de los receptores de IL-6 y sus vías de señalización, disminuyendo la quimioatracción de macrófagos y neutrófilos. Lopinavir y ritonavir inhiben la formación de proteínas no estructurales mediante el proceso de replicación viral en la proteasa similar a la 3-quimotripsina. Remdesivir y ribavirina inhiben la síntesis de ARN polimerasa dependiente de ARN (RdRp). En estudios experimentales, ivermectina inhibe la síntesis de proteínas estructurales necesarias para el ensamblaje de la cápside viral.
Conclusiones
La infección por el coronavirus SARS-CoV-2 se extendió por todo el mundo en muy pocos meses. A la fecha de publicación de este manuscrito aún no se contaba con un fármaco recomendado mundialmente para tratar la enfermedad. Sin duda, los avances científicos han llevado a proponer varios medicamentos y vacunas para combatir al virus. La transmisión del SARS-CoV-2 en humanos trae consigo una reflexión sobre nuestra convivencia con la fauna silvestre, nuestros hábitos alimenticios y el cuidado de nuestra salud en general.











 text new page (beta)
text new page (beta)


