ANTECEDENTES
El cáncer de mama superó en 2020 al cáncer de pulmón como principal causa de incidencia mundial de cáncer, con un estimado de 2,261,419 millones de nuevos casos, que representan el 11.7% de todos los casos de cáncer en la mayor parte de los países (159 de 185 países) y la quinta causa de mortalidad con 684,996 muertes en 110 países. En las mujeres del continente americano se registran cada año más de 462,000 nuevos casos y casi 100,000 muertes por cáncer de mama.1
La afectación de los ganglios linfáticos axilares es un factor pronóstico importante en la etapa temprana del cáncer de mama. La linfadenectomía axilar tradicionalmente se ha considerado el método más preciso para evaluar la diseminación tumoral regional; entre algunos inconvenientes puede provocar linfedema, lesión nerviosa y disfunción del hombro.2
En 1977, el ensayo NSABP B04, con asignación al azar, demostró que la supervivencia al cáncer de mama se asoció, de forma independiente, con tratamientos locorregionales con o sin linfadenectomía axilar en pacientes sin afectación ganglionar.3
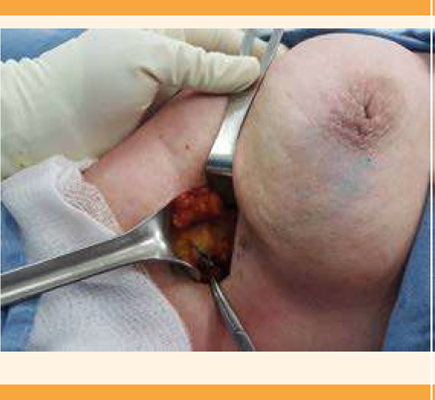
La biopsia de ganglio centinela, introducida en 1990, es un método menos invasivo para evaluar la afectación ganglionar. Su concepto se fundamenta en que los tumores drenan de manera ordenada a través del sistema linfático; por lo tanto, el ganglio centinela es el primero en verse afectado por metástasis. Si no está afectado es poco probable que otros ganglios lo puedan estar.4 Figura 1
Varios ensayos controlados, aleatorios, que comparan la biopsia de ganglio centinela con la linfadenectomía axilar, han aportado evidencia de que la biopsia de ganglio centinela proporciona información precisa, sin aumentar el riesgo de recurrencia regional o disminución de la supervivencia. En la actualidad es el procedimiento convencional para la estadificación ganglionar en pacientes con ganglios clínicamente negativos y ha reemplazado a la linfadenectomía axilar, con disminución de su morbilidad.5-9
El objetivo de este estudio fue: describir las características sociodemográficas, clínicas, técnica quirúrgica y factores pronósticos de la técnica del ganglio centinela en cáncer de mama en un centro de referencia.
MATERIALES Y MÉTODOS
Estudio retrospectivo, analítico, con fuentes secundarias de información de mujeres con cáncer de mama sin afectación clínica axilar, llevadas a cirugía con biopsia de ganglio centinela, en el registro personal de un cirujano del 1 de mayo de 2018 al 31 de octubre de 2020, en un centro de referencia en Medellín, Colombia.
Criterios de inclusión: biopsia de mama con aguja gruesa, con malignidad in situ o invasor y confirmación en espécimen. El carcinoma ductal in situ debía tener alguna de las siguientes indicaciones: lesión de alto grado o tipo comedo. En el trascurso de una mastectomía, masa palpable y sospecha de microinvasión. Estadio clínico 0-III. Axila clínica e imagenológica negativa. Criterios se exclusión: registros con pérdida relevante de información. Axila clínicamente afectada y confirmada con biopsia con aguja fina. Estadio metastásico (IV).
Se realizó muestreo secuencial consecutivo y se obtuvieron 362 registros de los que se retiraron 9; en un caso por estadio metastásico, dos por histología de tumor de comportamiento incierto, otro por no confirmación de lesión en espécimen, y cinco casos por pérdida relevante de información; quedaron 353 registros con utilidad para el estudio.
Después de la estandarización del protocolo de investigación se recolectó, tabuló y verificó la información en una base de datos de Excel®. Variables evaluadas: edad, aseguramiento, ocupación, residencia, tipo y grado histológico, clasificación TNM, receptores de estrógeno, progesterona, HER, KI67, tipo de cirugía mamaria, técnica de ganglio centinela, cantidad de ganglios centinelas resecados y afectados, lateralidad, nivel axilar y vaciamiento axilar.
Técnica quirúrgica
La técnica de marcación del ganglio centinela se efectuó el mismo día (por lo menos 6 horas antes de la intervención quirúrgica), mediante la inyección de un trazador radioactivo (albúmina marcada con TC 99m). La inyección del radio coloide fue periareolar (0.5-1.0 mci) y se tomaron imágenes estáticas (linfogamagrafía) de 30 a 60 minutos después, para garantizar la migración del radio coloide; durante el procedimiento quirúrgico se empleó una gamma sonda. La segunda técnica aplicada fue por tinción, mediante la inyección de 2 cc de azul de metileno periareolar intraquirúrgica y se esperaron 15 minutos para permitir la migración axilar. El ganglio con tinción azul o detectado por la gama sonda se envió a patología. En los casos con axila clínica e imagenológica sin afectación se difirió el estudio histológico. En las pacientes con sospecha de afectación sin confirmación histológica prequirúrgica se hizo la congelación del ganglio centinela. Después de la evaluación intraoperatoria, por el patólogo, se procedió al vaciamiento axilar de los casos reportados con congelaciones positivas.
Se efectuó el análisis descriptivo de las variables sociodemográficas y clínicas. Se calcularon las frecuencias absolutas y porcentajes, promedio y desviación estándar, según la naturaleza y distribución de las variables. Se validó la distribución normal con la prueba de bondad de ajuste Shapiro Wilk. Para establecer la asociación entre la afectación del ganglio centinela y las variables independientes con interés clínico se realizó el análisis bivariado con la prueba de χ2. Para las pruebas de hipótesis se fijó un intervalo de confianza de 95% y nivel de significación de 5%. Se utilizó el programa SPSS v23.
El proyecto fue aprobado por el Comité de Ética de la Clínica Medellín. Se trata de un estudio sin riesgo, conforme a la clasificación planteada en el Artículo 11 de la Resolución Nº 008430 de 1993 (expedida por el Ministerio de Salud de Colombia) y se ajusta a la normatividad internacional, declaración de Helsinki, y a las pautas éticas para la investigación biomédica preparadas por el Consejo de Organizaciones Internacionales de las Ciencias Médicas (CIOMS).
RESULTADOS
Se encontraron 353 casos con media de edad de 60.2 años (DE ± 12,6), el 73.9 % (n = 261) pertenecientes al régimen contributivo y, en su mayoría, residentes de Medellín (45. 6 %, n = 161). Las características sociodemográficas se muestran en la Cuadro 1.
Cuadro 1 Características sociodemográficas y antecedentes personales
| Variable | (n=353) Frecuencia (%) |
|---|---|
|
Edad (años) Media Desviación estándar Mínimo - Máximo |
60,2 12,6 26 - 90 |
|
Régimen seguridad social
Contributivo Subsidiado Particular |
261 (73,9) 87 (24,6) 5 (1,4) |
|
Ocupación
Estudiante Empleada Hogar Independiente Pensionada |
23 (6,5) 43 (12,2) 216 (61,2) 17 (4,8) 54 (15,3) |
|
Residencia
Medellín Área metropolitana Antioquia Otros departamentos |
161 (45,6) 70 (19,8) 114 (32,3) 8 (2,3) |
El tipo histológico más frecuente fue el ductal (80.7%, n = 285), según la clasificación TNM el 50.1 % (n = 177) correspondió a T1, que fue el más frecuente, seguido por el T2 (30.9%, n = 109). La mayoría expresaron receptores hormonales (83.9%) para estrógenos y 72.5% para progesterona. El índice de proliferación Ki67 medio fue de 28.2% (DS ± 21.3). El 58.9% (n = 189) tenían un Ki67 mayor al 20%. El subtipo intrínseco luminal B HER (-) con el 43.4% (n = 139) fue el más frecuente, mientras que el HER enriched fue el menos frecuente en 4.4% (n = 14). Cuadro 2
Cuadro 2 Histología, clasificación TNM e inmunohistoquímica
| Variable | (n=353) Frecuencia (%) |
|---|---|
|
Tipo histológico
Ductal Lobular Otros tipos In situ |
(n= 535) 285 (80,7) 24 (6,8) 25 (7,1) 19 (5,4) |
|
Grado histológico
I II III |
63 (17,8) 174 (49,3) 116 (32,9) |
|
Tamaño tumoral (TNM) T0 T1T2 T3T4 |
(n= 353) 18 (5,1) 177 (50,1)109 (30,9) 36 (10,2)13 (3,7) |
|
Tamaño tumor en patología (cm) Media Desviación estándar Mínimo - Máximo |
2,6 2,8 0,1 - 25 |
|
Receptores estrógenos Negativos Positivos |
(n= 353) 57 (16,1) 296 (83,9) |
|
Receptores Progesterona
Negativos Positivos |
(n= 353) 97 (27,5) 256 (72,5) |
|
Receptor HER2 0 / 1+ 2+ 3+ |
(n= 319) 268 (84) 7 (2) 44 (12,5) |
|
Índice proliferación KI67
Media Desviación estándar Mínimo- Máximo |
(n= 321) 28,2 21,3 1 - 95 |
|
Índice proliferación KI67
Mayor 20 Menor 20 |
(n= 321) 189 (58,9) 132 (41,1) |
|
Subtipo intrínseco St Gallen
21
Luminal A Luminal B HER - Luminal B HER + HER Enriquecido Triple negative |
(n= 320) 108 (33,8) 139 (43,4) 25 (7,8) 14 (4,4) 34 (9,6) |
El tipo de cirugía más frecuente fue la cuadrantectomía en el 57.8% (n = 204). La técnica de ganglio centinela radioguiada se aplicó en el 94.9% (n = 335) y en el 1.7% de los casos (n = 6) no hubo migración, con una tasa de detección del 98.3% (n = 347). El promedio de ganglios centinela resecados fue de 1.9 (DE ± 1.3). De los afectados por metástasis en el 23.1% (n = 80) se aplicó radiocoloide (Tecnecio 99). En 94.9% (n = 335) solo colorante. En el 83.6% (n = 295) se evitó una linfadenectomía innecesaria, por lo que solo se practicó en el 16.4% (n= 58). En 22 casos (6.2%) se omitió la linfadenectomia con base en estudios ACOSOG Z001110,11 y AMAROS12 (Cuadro 3). Se determinó la asociación entre la afectación del ganglio centinela y diferentes variables independientes de interés clínico y se encontraron diferentes asociaciones. Cuadro 4
Cuadro 3 Características quirúrgicas y ganglio centinela
| Variable | (n=353) Frecuencia (%) |
|---|---|
|
Tipo cirugía Cuadrantectomia Mastectomía |
204 (57,8) 149 (42,2) |
|
Lateralidad
Derecho IzquierdoBilateral |
195 (55,2) 155 (43,9) 3 (0,8) |
|
Localización tumoral
Retroareolar Cuadrante supero externoCuadrante infero externo Cuadrante infero medial Cuadrante supero medial |
(n= 353) 35 (9,9) 166 (47)62 (17,6) 19 (5,4) 71 (20,1) |
|
Técnica linfogamagrafía
Tecnecio 99 Azul metileno Mixto |
(n= 353) 335 (94,9) 16 (4,5) 2 (0,6) |
|
Captación Si No |
347 (98,3) 6 (1,7) |
|
Numero ganglios centinela
Media Desviación estándarMínimo- Máximo |
(n= 347) 1,9 1,31 - 9 |
|
Nivel axilar
Nivel 1 Nivel 2 Nivel 3 |
(n= 347) 344 (99,1) 1 (0,3) 2 (0,6) |
|
Afectación de ganglio centinela
No afectado Afectado |
(n= 347) 267 (76,9) 80 (23,1) |
|
Numero de ganglios afectados
Media Desviación estándar Mínimo - Máximo |
3,5 4,8 1 - 32 |
|
Congelación
No Si |
(n= 347) 164 (47,3) 183 (52,7) |
|
Vaciamiento axilar No Si |
(n= 353) 295 (83,6) 58 (16,4) |
|
Neoadyuvancia
Quimioterapia Hormono preoperatoria |
(n= 64) 63 (98,5) 1 (1,5) |
Cuadro 4 Análisis bivariado para asociación entre la afectación ganglionar y las distintas variables independientes
| Variable | OR | IC 95% | p |
|---|---|---|---|
| Edad <50/>50 | 1,05 | 0,57-1,96 | 0,84 |
| EPS subsidiado/contributivo | 1,29 | 0,86-2,47 | 0,21 |
| Congelación Si/No | 1,39 | 1,15-1,7 | 0,003 |
| Mastectomía/cuadrantectomia | 1,45 | 1,13-1,86 | 0,006 |
| Focalidad multifocal/unifocal | 1,52 | 0,97-2,39 | 0,07 |
| Tamaño tumor T3/4 vs T 1/2 | 1,43 | 0,82-2,5 | 0,20 |
| Tipo histológico ductal/lobular | 0,97 | 0,90-1,06 | 0,57 |
| Grado Histológico 3/1-2 | 0,99 | 0,69-1,69 | 0,98 |
| Localización Cuadrantes extremos/internos | 1,1 | 0,97-1,26 | 0,16 |
| Subtipo HER (+) /Luminal A -B | 0,5 | 0,22-1,16 | 0,09 |
| Subtipo luminal A-B/triple negativo | 1,14 | 1,06-1,23 | 0,005 |
| QT neoadyuvante | 0,29 | 0,12-0,70 | 0,002 |
OR: Odds ratio. IC 95%: intervalo confianza 95%. P valor.
DISCUSIÓN
Este estudio reúne el mayor número de casos reportados en la bibliografía latinoamericana de biopsia de ganglio centinela. Por lo tanto, aporta al conocimiento de la técnica de ganglio centinela en cáncer de mama en población hispana y analiza diferentes variables independientes y la afectación del ganglio centinela.
Con base en la actualización de la guía de práctica clínica de la American Society of Clinical Oncology, publicada en 2017,13 a las mujeres sin metástasis en el ganglio linfático centinela no debe practicárseles linfadenectomía, tampoco a quienes tienen una o dos metástasis ganglionares en el curso de una cirugía conservadora, más radioterapia. Otras circunstancias aceptadas para el estudio de ganglio centinela son los tumores multicéntricos, carcinoma ductal in situ cuando se hace una mastectomía y antecedente de cirugía previa de mama o axilar.
La biopsia de ganglio centinela no debe tomarse a pacientes con cáncer de mama invasivo grande o localmente avanzado (tamaño del tumor T3-T4), cáncer inflamatorio, carcinoma ductal in situ cuando se planifica una cirugía conservadora de mama y no hay sospecha de invasión y embarazo.13
El tipo histológico (encontrado en 80.7%) fue ductal infiltrante, lo que coincide con lo reportado en la bibliografía mundial, que informa que es el más frecuente. En este estudio la tasa de positividad de los receptores de estrógeno fue de 83.9% y para progesterona de 72.5%, similar a los hallazgos de los estudios latinoamericanos14 que reportan 83.5% para receptores de estrógenos y para progesterona 73.5%. En nuestro estudio fueron mayores que en los ensayos estadounidenses, con expresión de receptores de estrógenos entre 50 y 80% y progesterona del 40%.15
La identificación intraoperatoria del ganglio centinela la demostraron Krag y colaboradores7 valiéndose de un coloide de azufre marcado con Tc99m, lo mismo que por Giuliano y su grupo16 quienes utilizaron tinte azul, y por Albertini y su equipo,17 que aplicaron una combinación de los anteriores, con tasas de identificación de 82, 66 y 92% respectivamente. En nuestro estudio se encontró una tasa de identificación del 98.3%.
En el 1.7% de los casos no se identificó el ganglio centinela, por eso se optó por la linfadenectomía axilar. El promedio de ganglios centinela resecados fue de 1.9, similar a otros estudios, como el de Perry y colaboradores14 de 1.6 y de 1.8 en el estudio de Corrao y su grupo;18 y un poco menor que el promedio del estudio de Krag y colaboradores7 que fue de 2.9.
El ganglio centinela fue metastásico en el 23.1%, similar a lo encontrado por Perry y coautores14 de 29.4%, y en el metanálisis de Kell y su equipo,19 que fue del 27.6%.
En este estudio el 86.1% correspondió a estadios iniciales (0-I-II). El tamaño tumoral medio fue de 2.6 cm, similar al estudio americano NSABP B-32 donde el 83.7% tenían un tamaño tumoral ≥ 2 cm.7 En Latinoamérica, el estudio de Von Stecher F y colaboradores encontró que el 76.5% tenía un tamaño mayor de 2 cm.20
En este estudio se incluyeron 49 pacientes (13.9%) en estadio T3-T4, sin encontrar afectación en la tasa de detección, y no se encontró mayor daño ganglionar entre T3-T4 vs T1-T2 (p = 0.20). Este mismo hallazgo se encontró en otro estudio14 que reportó en un porcentaje alto de axilas negativas.
Las mayores limitaciones de este estudio fueron su naturaleza retrospectiva y no haber contado con esquemas de quimioterapia, radioterapia y hormonoterapia coadyuvante.
CONCLUSIÓN
En esta muestra, la técnica del ganglio centinela para la estadificación axilar tuvo una alta tasa de detección, se encontró mayor afectación del ganglio centinela en el transcurso de la mastectomía, congelación, subtipos luminal A y B y en menor proporción en la quimioterapia preparatoria.











 nueva página del texto (beta)
nueva página del texto (beta)