Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista bio ciencias
On-line version ISSN 2007-3380
Revista bio ciencias vol.6 Tepic Jan. 2019 Epub Oct 02, 2020
https://doi.org/10.15741/revbio.06.e681
Artículos Originales
Perkinsus sp. en el desempeño de Crassostrea gigas cultivado en el sureste del Golfo de California
1Departamento de Acuacultura, del Centro Interdisciplinario de Investigación para el Desarrollo Integral Regional-Unidad Sinaloa, Instituto Politécnico Nacional, Guasave, Sinaloa, México
2Departamento de Medio Ambiente, Centro Interdisciplinario de Investigación para el Desarrollo Integral Regional-Unidad Sinaloa, Instituto Politécnico Nacional, Guasave, Sinaloa, México
3Departamento de Biotecnología Agrícola, Centro Interdisciplinario de Investigación para el Desarrollo Integral Regional-Unidad Sinaloa, Instituto Politécnico Nacional, Guasave, Sinaloa, México
Se estudió la relación entre la presencia de Perkinsus sp. con el crecimiento (altura de la concha, SH, y peso corporal, BW), índice de condición y composición bioquímica (triglicéridos, proteínas, lípidos y carbohidratos) del ostión Crassostrea gigas cultivado en dos granjas del estado de Sinaloa, México. Se detectó a Perkinsus sp. en ambas granjas durante 13 meses (junio 2013 a junio 2014). El grado de prevalencia en los ostiones fluctuó de 26.7 a 83.3 %. La intensidad de la infección de acuerdo a la escala de Mackin, fue de muy ligera a ligera (0.1 to 1.2) y mostró correlación positiva con la composición bioquímica del ostión. No existieron correlaciones significativas entre la prevalencia y todos los parámetros estudiados. La supervivencia del ostión en ambas granjas no fue afectada por la presencia del protozoario. Se discute la incidencia del parásito en C. gigas por la influencia de los parámetros ambientales. Los resultados sugieren que la presencia de Perkinsus sp. no afectó la salud de los ostiones en cultivo, sin embargo, la incidencia de este patógeno en las granjas debe ser monitoreada de forma periódica.
Palabras clave: Ostión del Pacífico; presencia de parásitos; índice de condición; composición proximal; cultivo
We studied the relation between the presence of Perkinsus sp. with growth performance (shell height - SH, body weight - BW), condition index, and biochemical composition (triglycerids, proteins, lipids, and carbohydrates) of the oyster Crassostrea gigas cultivated in two farms from Sinaloa, Mexico. Perkinsus sp. Was detected in both farms throughout (June 2013 to June 2014). The oysters had diverse degrees of prevalence fluctuating from 26.7 to 83.3 %. According to the Mackin’s scale, the intensity of infection was light to very light (0.1 to 1.2). There were not significant correlations between the prevalence with all studied parameters. Oyster survival at both farms was not affected by the presence of the protozoan. Intensity of Perkinsus infection was positively correlated with the biochemical composition of oyster. The influence of environmental parameters on the incidence the parasite in C. gigas is discussed. The overall results suggest that the presence of Perkinsus sp. in C. gigas from the two farms did not affect the health of the cultivated oysters, however, periodic monitoring of this pathogen in the farms should be continued.
Key words: Parasite occurrence; Pacific oyster; condition index; proximal composition; Farming
Introducción
Se ha reportado ampliamente que el protozoario del género Perkinsus, como muchos parásitos, se transmite horizontalmente en la columna de agua (Andrews, 1996) infectando diferentes especies de ostiones y almejas, y en algunos casos, se le ha asociado con mortalidades drásticas de bivalvos comercialmente importantes alrededor del mundo. Por ejemplo, Goggin & Lester, (1995) identificaron al protozoario Perkinsus olseni como el agente causante de mortalidades severas del abulón de labios verdes Haliotis laevigata en Australia, mientras que Park et al. (2008), confirmaron la presencia de la misma especie de Perkinsus en la almeja Japonesa de cuello corto Ruditapes philippinarum. Park & Choi, (2001) detectaron la existencia de parásitos parecidos a Perkinsus asociados a la mortalidad masiva de la almeja Tapes philippinarum en Korea. También, P. marinus ha infectado poblaciones naturales y cultivadas del ostión del este Crassostrea virginica (Ford, 1996; Soniat, 1996; Aguirre-Macedo et al., 2007) a lo largo de la costa Atlántica de Norte América, desde Canada hasta las lagunas costeras del centro y sur del Golfo de México, mientras que Brandão et al. (2013) encontraron a Perkinsus sp. infectando el ostión de mangle Crassostrea rhizophorae en Brasil. La producción ostrícola en el noroeste del Pacífico Mexicano depende del cultivo de ostión Japonés Crassostrea gigas, en la que el protozoario Perkinsus sp. ha sido reportado en granjas localizadas en el Golfo de California desde hace dos décadas (Chávez-Villalba et al., 2007, 2010; Enríquez-Espinoza et al., 2010; Villanueva-Fonseca & Escobedo-Bonilla, 2013; Chávez-Villalba, 2014). Situaciones similares han ocurrido en la línea de costa al sur de México, con otras especies como el ostión de placer C. corteziensis (Cáceres-Martínez et al., 2008) y el ostión de piedra Saccostrea palmula (Cáceres-Martínez et al., 2012).
El nivel de afectación causada por Perkinsus en bivalvos depende de varios factores, tales como la especie (nativa, no nativa), latitud, parámetros ambientales, sistema immune del huésped, actividad parasitaria y estresores, como contaminantes (Villalba et al., 2004), y comúnmente, es evaluado por medio de la prevalencia e intensidad de la infección (Park et al., 1999; Encomio et al., 2005; da Silva et al., 2016). Por ejemplo, Cáceres-Martínez et al. (2008) observaron una prevalencia baja e infección moderada de P. marinus en una población de C. corteziensis de la costa central del Pacífico Mexicano, y asociaron la presencia de este parásito en bancos naturales del ostión de placer, a la posible introducción de C. virginica infectado, traído de la costa este de los Estados Unidos de América al Golfo de México y diseminado después en el Pacífico Mexicano. También, Villanueva-Fonseca & Escobedo-Bonilla, (2013) evaluaron la presencia de Perkinsus sp. en ostión del Pacífico de una granja de la costa sureste del Golfo de California, registrando una prevalencia moderada y baja intensidad de infección del parásito, los cuales, se incrementaron en los meses más cálidos del cultivo.
El efecto de este parásito en moluscos bivalvos puede variar desde una presencia inócua hasta una severa infección que dañe los tejidos. Cuando esta última sucede, el metabolismo del bivalvo se compromete afectando su flujo de energía y desempeño (Paynter, 1996). La reducción en el crecimiento del tejido suave (y en consecuencia de su índice de condición) y los cambios en la composición bioquímica del huésped, son algunos de los efectos sistémicos provocados por la infección de Perkinsus sp. en ostiones (Dittman et al., 2001; Encomio et al., 2005). De esta forma, la infección de Perkinsus sp. en esos bivalvos pudiera agotar la energía destinada para su crecimiento y reproducción.
La mayoría de los reportes acerca de la presencia de Perkinsus en C. gigas se refieren a la colecta de especímenes juveniles y adultos en granjas comerciales (Kennedy et al., 1995; Samain et al., 2007; Enríquez-Espinoza et al., 2010, 2015). Los estudios específicos que determinan el efecto de Perkinsus sp. en C. gigas, desde la siembra de la semilla hasta la cosecha, representa una herramienta útil para entender mejor esta asociación biológica. Por lo tanto, el objetivo de este estudio fue evaluar la relación entre la presencia de Perkinsus sp., con el crecimiento, índice de condición y composición bioquímica del ostión C. gigas, cultivado en dos localidades del sureste del Golfo de California, durante un ciclo de cultivo sencillo.
Material y métodos
El estudio fue realizado en dos sitios localizados en la ribera norte-central de Sinaloa: Bahía El Colorado (CB), (25°39’-25°47’N, y 109°16’-109°24’W), y Estero Las Aguamitas (AE), (24°20’-24°40’N, y 107°30’-107°58’W) (Figura 1).
Se obtuvo un total de 6,000 semillas del ostión Japonés (3000 para cada sitio, certificadas como “libres de patógenos”) del Centro de Investigaciones Biológicas del Noroeste (CIBNOR), Sonora, Mexico, las cuales, se cultivaron en canastas suspendidas a 0.15 m debajo de la superficie del agua, en un sistema “long-line”. La altura de la concha (SL) y peso inicial (BW) de las semillas fueron 6.8 ± 0.9 mm y 0.02 ± 0.00 g, respectivamente. Las ostrillas fueron aclimatadas (Gallo-García et al., 2004), colocadas en bolsas de malla plástica (2 mm diámetro) y después, dentro de las canastas suspendidas en el sistema “long-line” (n = 500 ostiones canasta-1). Cuando los ostiones alcanzaron 30-40 mm (SL), se colocaron en las canastas (n = 42 ostiones canasta-1), fuera de las mallas plásticas, hasta el final del estudio, el cual, inició en junio de 2013 y finalizó en junio de 2014.
Se recolectaron 30 ostiones cada mes (n = 390) para abrirlos y remover el tejido suave de la concha. Una fracción de 10 g de tejido fue destinado para el diagnóstico de Perkinsus sp., el cual, fue homogenizado en una solución amortiguadora (0.2 M fosfato amortiguador) y colocado en tubos conteniendo Medio Fluido de Tioglicolato de Ray (RFTM) (Karolus et al., 2000). Los tubos se mantuvieron en oscuridad por siete días, a una temperatura de incubación de 28 °C. Después de la incubación, los tejidos fueron macerados en pedazos pequeños y teñidos con lugol (1 ml, 4 %). Finalmente, se determinó la presencia y número de hipnosporas de Perkinsus sp. con un microscopio óptico (100X, Leica®, DM750). La prevalencia de la infección fue calculada como el porcentaje de ostiones infectados en cada muestreo mensual (Thrusfield, 1995), mientras que para la intensidad de la infección, se utilizó la clasificación de la escala de Mackin (Mackin, 1962), modificada por Craig et al. (1989) (Tabla 1).
Tabla 1 Grado de la intensidad de infección en ostiones de acuerdo a la escala de Mackin (Mackin, 1962), modificada por Craig et al. (1989).
| Description of the Scale | Mackin’s scale | # Hypnospores | Tissue covered by hypnospores (%) |
|---|---|---|---|
| Negative/No infection | 0 | 0 | |
| Very light - | 0.3 | 1-10 | |
| Very light + | 0.7 | 11-74 | |
| Ligth - | 1.0 | 75 - 125 | |
| Ligth | 1.3 | > 125 | but < 25 |
| Ligth + | 1.7 | < 25 | |
| Ligth/moderate - | 2.0 | 25 | |
| Ligth/moderate | 2.3 | > 25 but much < 50 | |
| Ligth/moderate + | 2.7 | > 25 but < 50 | |
| Moderate - | 3.0 | 50 | |
| Moderate | 3.3 | > 50 but much < 75 | |
| Moderate + | 3.7 | > 50 but < 75 | |
| Moderately heavy - | 4.0 | 75 | |
| Moderately heavy | 4.3 | > 75 but much less than 100 | |
| Moderately heavy + | 4.7 | ||
| > 75, oyster tissue still visible | |||
| Heavy | 5.0 | 100 oyster tissue covered |
Biometrias y supervivecia
La altura de la concha (SL) y peso corporal (BW) de 60 ostiones fueron obtenidos in situ cada mes, con una regla vernier (0.2 mm) y una balanza portátil (0.00 g), respectivamente. La tasa de crecimiento mensual se reportó como la ganancia en peso corporal (Rodríguez-Quiroz et al., 2016). La supervivencia fue calculada contando los animales muertos en cada muestreo y expresada como el porcentaje del número inicial de ostiones (Góngora-Gómez et al., 2012).
Índice de condición
El índice de condición (CI) mensual fue obtenido de una muestra adicional de 30 ostiones, los cuales, fueron desconchados para remover su tejido. Después, el peso total de las conchas (g, TW) y el peso total del tejido en fresco (g, SW) de cada ostión, se registraron con una balanza portátil (OHAUS, Scout Pro SP 2001). Las conchas y tejidos suaves fueron secados en un horno (100° C, Riossa EC-41) durante 24 horas. El CI fue calculado con la fórmula propuesta por Lucas & Beninger (1985): CI = (SW/TW) x 100.
Composición bioquímica
Para cada sitio de cultivo se recolectaron 30 ostiones por mes, de los cuales, se obtuvo el peso de todos los tejidos en fresco. Después, con los tejidos en fresco de 10 ostiones, se formaron tres grupos, cada uno representando una réplica. De esta forma, se determinaron las concentraciones de triglicéridos, proteínas, lípidos y carbohidratos de cada muestra de los tejidos. Debido al pequeño tamaño de los bivalvos en los primeros tres meses, la composición bioquímica fue obtenida de un grupo de 30 ostiones. Cada muestra de tejidos fue individualmente triturada y colocada en microtubos Eppendorf (2.0 ml), congelada a -70 °C durante 24 h, liofilizada durante 24 h y pulverizada. Finalmente, los tejidos se homogenizaron en 1 ml de solución salina (35 UPS). Los resultados se expresan como mg g-1, peso seco.
Los triglicéridos fueron calculados usando un kit comercial (GEO-PAP, Randox), a una absorbancia de 460 nm. La concentración de proteínas totales se determinó con el procedimiento de Bradford, (1976), a una absorbancia de 595 nm. Los lípidos fueron extraídos del tejido de ostión seco por congelamiento usando el método sulfofosfovanillina (Barnes & Blackstock, 1973) y ensayado a una absorbancia de 540 nm. Los carbohidratos se analizaron usando el método del reactivo antrona (Roe, 1955), a una absorbancia de 630 nm.
Parámetros del agua
Los parámetros del agua fueron muestreados cada mes. La temperatura y el oxígeno disuelto (DO) se obtuvieron con un oxímetro (YSI 55/12FT, Ohio, USA), la salinidad con un refractómetro (ATAGO, S/Mill), el pH usando un pHmetro (HANNA, HI 8314, USA), la profundidad y la transparencia con un disco Secchi, mientras que los sólidos suspendidos totales (TSS) y la material orgánica particulada (POM) mediante el método gravimétrico (APHA, 1995). El análisis de la clorofila a (Cla) fue realizado después de filtrar el agua con filtros Whatman GF/F (0.7 µm tamaño de poro) usando filtración Millipore al vacío, para finalmente, determinar la concentración de Cla mediante los métodos espectrofotométricos estándares (Strickland & Parsons, 1972).
Análisis de datos
Después de probar la normalidad de todos los datos, se eligió el análisis estadístico correspondiente. Para evaluar la presencia mensual de Perkinsus sp., se practicó una comparación de medias con un análisis de varianza (ANOVA) y una prueba de Tukey para cada sitio de cultivo. Se utilizó una prueba t de Student para determinar las diferencias significativas entre las medias de todas las variables comparando los dos sitios de cultivo. Se estudiaron las correlaciones entre la prevalencia e intensidad de Perkinsus sp. con las biometrías de los ostiones, el índice de condición, el contenido bioquímico y los parámetros ambientales de cada lugar. Los análisis estadísticos se realizaron usando el programa Statgraphic Plus 5.0 (Statistical Graphics Corp., Herndon, VA, USA) a un nivel de significancia de p = 0.05.
Resultados y discusión
Perkinsus sp. fue detectado en CB y AE durante todos los meses de cultivo. Los ostiones muestreados en ambos lugares presentaron diversos grados de prevalencia e intensidad de infección (Tabla 2).
Table 2 Prevalencia e intensidad de infección de Perkinsus sp. en el ostión Crassostrea gigas cultivado en la Bahía El Colorado (CB) y el estero Las Aguamitas (AE), Sinaloa, México
| 2013-2104 | Prevalence (%) | Intensity (Mackin’s scale*) | ||
|---|---|---|---|---|
| CB | AE | CB | AE | |
| July | 56.7 | 53.3 | 0.3ª | 0.5a |
| (17)§ | (16) | (0.1) | (0.1) | |
| August | 80 | 63.3 | 0.4a | 0.9b |
| (24) | (19) | (0.1) | (0.1) | |
| September | 60 | 50 | 1.2b | 0.5a |
| (18) | (15) | (0.2) | (0.1) | |
| October | 36.7 | 46.7 | 0.5a | 0.4a |
| (11) | (14) | (0.1) | (0.1) | |
| November | 56.7 | 43.3 | 0.5a | 0.2a |
| (17) | (13) | (0.1) | (0.1) | |
| December | 60 | 80 | 0.4a | 0.6a |
| (18) | (24) | (0.1) | (0.1) | |
| January | 70 | 60 | 0.4a | 0.3a |
| (21) | (18) | (0.1) | (0.1) | |
| February | 43.3 | 46.7 | 0.2a | 0.3a |
| (13) | (14) | (0.04) | (0.1) | |
| March | 43.3 | 56.7 | 0.4a | 0.3a |
| (13) | (17) | (0.1) | (0.1) | |
| April | 26.7 | 46.7 | 0.1a | 0.2a |
| (11) | (14) | (0.04) | (0.1) | |
| May | 83.3 | 73.3 | 0.6a | 0.3a |
| (25) | (22) | (0.1) | (0.1) | |
| June | 46.7 | 40 | 0.2ª | 0.2a |
| (14) | (12) | (0.04) | (0.1) | |
| Mean | 55.3 | 55 | 0.4 | 0.4 |
| (16.58) | (16.5) | (0.1) | (0.1) | |
*Mackin (1962) modificado por Craig et al. (1989). §Media (± error estándar). Diferentes letras entre lugares por mes denotan diferencias significativas (p≤0.05).
La prevalencia del parásito en CB fluctuó desde 26.7 ± 8.0% en abril, hasta 83.3 ± 25.0 % en mayo, mientras que los valores más bajos y altos de prevalencia en AE fueron registrados en junio 2014 (40.0 ± 12.0 %) y diciembre 2013 (80.0 ± 24.0 %), respectivamente. La intensidad de la infección en CB varió desde 0.1 ± 0.04 en abril, hasta 1.2 ± 0.2 en septiembre. En el caso de la granja AE, la intensidad más baja (0.2 ± 0.1) fue obtenida en junio y el valor más alto (0.9 ± 0.1) en agosto. No hubo diferencias significativas comparando la prevalencia (t = 0.07, p = 0.94) e intensidad del parásito (t = 0.32, p = 0.75) entre ambos sitios.
Por el hecho de que organismos parecidos a Perkinsus se han descrito parasitando, y en algunos casos, causando mortalidades masivas en moluscos silvestres (Choi et al., 2002; Casas et al., 2004) y cultivados en el mundo (Aguirre-Macedo et al., 2007; da Silva et al., 2016), y que varios factores (internos y externos) están involucrados en la interacción parásito-huésped, los estudios acerca de la presencia de Perkinsus sp. con relación a la condición fisiológica del huésped y a los parámetros ambientales, representan valiosas contribuciones para evaluar de manera adecuada, los efectos de este parásito en los bivalvos cultivados.
A pesar de que Perkinsus sp. se detectó en ambas granjas, los resultados obtenidos para el crecimiento y fisiología en este estudio sugieren que C. gigas mostró resistencia al patógeno, ya que no se observó una reducción drástica en la supervivencia del ostión, lo cual, coincidió con Villanueva-Fonseca & Escobedo-Bonilla, (2013), quienes trabajaron con C. gigas en el Golfo de California, y con Encomio et al. (2005), al comparar la resistencia a la perkinsosis de varios grupos de ostiones en el Golfo de México. Las poblaciones de ostiones resistentes, no solo presentan alta supervivencia, sino que además, pueden mantener la prevalencia e intensidad de la infección en niveles de bajos a moderados (Villalba et al., 2004), tal como se observó en este estudio. La presencia de Perkinsus sp. desde el primer mes de cultivo indica que los ostiones habrían adquirido el parásito por contacto directo con el agua, donde ya pudieran encontrarse poblaciones de bivalvos silvestres y cultivados previamente infectados. Por ejemplo, Góngora-Gómez et al. (2016) reportaron especímenes silvestres del callo de hacha Atrina maura infectados con Perkinsus sp., cerca de uno de los sitios de cultivo localizado en la costa norte de Sinaloa. También, Villanueva-Fonseca & Escobedo-Bonilla (2013) detectaron el parásito en C. gigas cultivado en uno de los lugares de este estudio. Lo anterior sugiere que a pesar de la garantía “libre de patógenos” certificada por el laboratorio del CIBNOR, Sonora, para las ostrillas usadas en este trabajo, los resultados obtenidos para la prevalencia indican que el parásito ya está presente en los sitios de cultivo.
El intervalo de prevalencia encontrado en CB (26.6-83.3 %) y AE (40-73.3 %) fue más elevado que el reportado por Villanueva-Fonseca & Escobedo-Bonilla (2013) y Enríquez-Ezpinoza et al. (2015) en C. gigas (3-40 % y 3-60 %, respectivamente), al igual que para C. corteziensis (1-6 %, Cáceres-Martínez et al., 2008) y Sacosstrea palmula (7-20 %, Cáceres-Martínez et al., 2012). Sin embargo, nuestros valores son comparables con los obtenidos por Luz & Boehs, (2016) para C. rhizophorae (50-88 %), pero más bajos que los encontrados por Huicab-Pech et al. (2012) en C. virginica (70-100 %). En el caso de la intensidad de la infección, el intervalo obtenido (0.2-1.2, muy ligero a ligero) fue más bajo que el reportado para los estudios anteriormente mencionados.
Presencia de Perkinsus sp. con biometrías, supervivencia y CI
La altura de la concha de los ostiones en los dos sitios se incrementó contínuamente hasta el noveno mes de cultivo, alcanzando en marzo, una talla de 101.6 ± 6.5 mm en CB y 96.1 ± 9.1 mm en AE, sin presentar diferencias significativas (t = 1.25, p = 0.24). No se observó correlación entre la prevalencia y SL de los ostiones cultivados en CB (r = -0.25, p = 0.22) y AE (r = -0.00, p = 0.52) (Fig. 2). El peso corporal de los ostiones (t = 2.55, p = 0.03) y la supervivencia (t = -4.64, p = 0.00) varió significativamente entre los sitios. El peso final de C. gigas fue de 117 y 101 g para CB y AE, respectivamente. Al igual que la SL, la prevalencia de Perkinsus sp. no se correlacionó con el BW (CB r = -0.29, p = 0.28; AE r = -0.05, p = 0.52) (Figura 2).
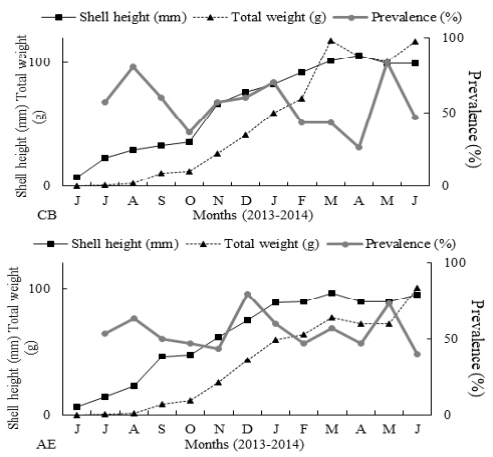
Figura 2 Altura de la concha (mm) y peso total (g) del ostión versus prevalencia (%) de Perkinsus sp. en Crassostrea gigas cultivado en la bahía El Colorado (CB) y el estero Las Aguamitas (AE), Sinaloa, México.
La supervivencia fue superior a 90 % en ambos lugares después de 13 meses de cultivo y no se correlacionó con la prevalencia del parásito (CB: r = -0.06, p = 0.45; AE: r = 0.09, p = 0.42).
El índice de condición de C. gigas en CB y AE mostró dos (septiembre = 72.1 y abril = 60.9) y tres picos (septiembre = 59.5, noviembre = 64.0, y mayo = 54.1), respectivemente. Sin embargo, el CI fue similar en ambos sitios (t=0.19, p=0.85). La prevalencia de Perkinsus no se correlacionó con el CI en las dos granjas (CB r= -0.18, p = 0.58; AE r = -0.11, p = 0.52).
Existen reportes previos en el sureste del Golfo de California (Góngora-Gómez et al., 2012; Rodríguez-Quiroz et al., 2016) indicando que el ostión Japonés alcanza su talla commercial entre 7 y 8 meses de cultivo, lo cual, coincidió con los resultados de este trabajo. Debido al rápido crecimiento mostrado por las semillas provenientes del CIBNOR, podría considerarse que dicha línea de ostión es apropiada, particularmente, para las granjas ostrícolas del sureste del Golfo de California, donde Perkinsus spp. ya ha sido detectado (Villanueva-Fonseca & Escobedo-Bonilla, 2013; Góngora-Gómez et al., 2016). Los valores altos de CI obtenidos durante los primeros meses en ambos sitios pudieran ser atribuidos al incremento continuo registrado para SH y BW (Encomio et al., 2005), los cuales, se relacionaron con el alimento disponible. De hecho, el CI mostró también, correlación con las fuentes de alimento y el contenido de nutrientes de los ostiones indicando que estos últimos fueron utilizados para el crecimiento somático y de la concha. Sin embargo, no existe evidencia clara de que la presencia de Perkinsus sp. tuviera un efecto negativo en el CI, por lo que pudiera ser que el medio ambiente haya tenido mayor influencia que el parásito en el índice de condición de los ostiones, como concluyeron Dittman et al. (2001) y Encomio et al. (2005).
Presencia de Perkinsus sp. y composición bioquímica del ostión
Las concentraciones de triglicéridos, lípidos y proteínas del ostión fueron diferentes significativamente entre los dos sitios (t = -3.12, p = 0.01; t = -2.98, p = 0.01; t = 3.00, p = 0.01, respectively). Los valores más altos en CB se obtuvieron en septiembre (81.7, 288.7 y 540.7 mg g-1, respectivamente), mientras que para los ostiones cultivados en AE, las mayores concentraciones se registraron en diciembre (45.3 mg g-1 para triglicéridos), septiembre (184.8 mg g-1 para lipids) y febrero (564.1 mg g-1 para proteins). Los niveles de carbohidratos fueron similares entre ambas granjas (t = 1.69, p = 0.12).
La prevalencia de Perkinsus sp. no mostró correlación con las concentraciones de triglicéridos (CB r = 0.26, p = 0.61; AE r = 0.32, p = 0.26), lípidos (CB r = 0.26, p = 0.58; AE r = 0.15, p = 0.49), proteínas (CB r = 0.28, p = 0.65; AE r = -0.12, p = 0.70) ni carbohidratos (CB r = -0.10, p = 0.87; AE r = 0.19, p = 0.84) del ostión en ambos sitios (Figura 3).
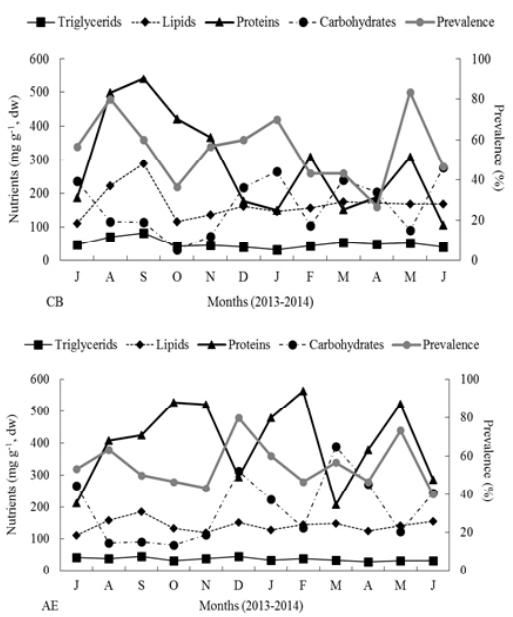
Figura 3 Concentraciones de triglicéridos, lípidos, proteínas y carbohidratos (mg g-1, peso seco) versus prevalencia % de Perkinsus sp. en Crassostrea gigas cultivado en la bahía El Colorado (CB) y el estero Las Aguamitas (AE), Sinaloa, México.
Las correlaciones de Spearman (r) practicadas entre la presencia del parásito y los parámetros ambientales, indicaron que la incidencia de Perkinsus sp. en CB estuvo correlacionada con las concentraciones de proteínas (r = 0.62, p = 0.03), lípidos (r = 0.65, p = 0.02) y triglicéridos (r = 0.67, p = 0.02) del ostión, mientras que en AE, la presencia del parásito se relacionó positivamente con la supervivencia de C. gigas (r = 0.72, p = 0.01) pero negativamente con BW y SH (r = -0.70, p = 0.01 y r = -0.72, p = 0.01, respectivamente).
Los estudios bioquímicos con bivalvos coinciden en que cuando el alimento disponible es abundante, las proteínas, lípidos y carbohidratos que contienen son usados para el crecimiento y almacenamiento para reproducción (Ojea et al., 2004; Dridi et al., 2007). En este trabajo y para ambos sitios, las proteínas fueron el componente nutricional de mayor concentración, como concluyó Berthelin et al. (2000), registrando junto con el CI, un pico durante los meses de verano-otoño. Lo anterior sugiere que las proteínas se mobilizaron para el crecimiento del ostión. Subsequentemente, se obtuvieron dos pequeños picos de este nutriente. Este mismo patrón fue observado para los lípidos, que aumentaron su nivel durante los tres primeros meses para favorecer el desarrollo de las gónadas (Berthelin et al., 2000), aunque a menor concentración. Dridi et al. (2007) concluyó que el contenido de carbohidratos puede ser considerado como un bioindicador ambiental que se refleja en la capacidad del ostión para soportar estrés exógeno, incluyendo como en este estudio, la dinámica infecciosa de Perkinsus sp. Aunque no se encontró una correlación entre la presencia del parásito y el contenido de carbohidratos en el ostión, los datos muestran coincidencias en algunos meses sugiriendo un cierto efecto de este nutriente en Perkinsus sp. Las concentraciones de los nutrientes estudiados indican la disponibilidad de una cantidad de energía suficiente y adecuada para cubrir con los requerimientos metabólicos del ostión, además de los niveles infecciosos de prevalencia e intensidad de Perkinsus sp. obtenidos en este trabajo.
Presencia de Perkinsus sp. y parámetros ambientales
Con excepción de la profundidad y transparencia del agua, el resto de los parámetros ambientales fueron similares entre ambos sitios. La temperatura (t = -1.88, p = 0.09) mostró el mayor gradiente en verano (30.3 °C en junio-julio 2013 para CB, y 30.8 °C en junio 2014 para AE), y el menor en diciembre (CB = 19.7 °C, AE = 22.5 °C). La prevalencia de Perkinsus sp. no se correlacionó con la temperatura (CB r = 0.28, p = 0.68; AE r = -0.34, p = 0.25) en ambas granjas. La concentración de salinidad fue similar entre CB y AE (t = -0.59, p = 0.57), con una fluctuación desde 30 hasta 38.6, y desde 30.3 hasta 35.6 UPS, respectivamente. Tampoco existió correlación entre este parámetro y la prevalencia del parásito en los dos sitios (CB r = 0.25, p = 0.64; AE r = 0.23, p = 0.67).
Las concentraciones de DO en CB y AE fueron estadísticamente iguales (t = 0.40, p = 0.70), y variaron desde 3.1 mg L-1 en otoño, hasta 8.1 mg L-1 registrado en primavera. La prevalencia del parásito en CB (r = 0.16, p = 0.83) y AE (r = -0.04, p = 0.90) no fueron influenciadas por el nivel de OD. La tendencia del pH mostró comportamientos similares entre ambas granjas (t = 0.14, P = 0.89), desde 6.5 hasta 8.2 para CB, y desde 7.5 hasta 8.1 para AE. No se encontraron correlaciones significativas entre la prevalencia de Perkinsus sp. y el pH en ambos sitios (CB r = 0.08, p = 0.59; AE r = 0.19, p = 0.43).
La profundidad y la transparencia del agua en las granjas mostraron diferencias (CB t = -11.58, p = 0.00; AE t = -3.69, p = 0.00, respectivamente); AE obtuvo los valores más altos (3.9 m de profundidad y 1.9 m de transparencia). Al igual que para los parámetros físicos y químicos antes mencionados, la prevalencia del parásito no mostró correlacionarse con la profundidad (CB r = 0.46, p = 0.15; AE r = 0.21, p = 0.39) ni con la transparencia (CB r = 0.45, p = 0.12; AE r = 0.47, p = 0.19) en ambos lugares.
No se obtuvieron diferencias significativas entre la concentración de Cla (t = 0.59, p = 0.56), TSS (t = -1.50, p = 0.16) y POM (t = -0.77, p = 0.46) en las granjas; los valores más altos de estos nutrientes se presentaron en invierno. La prevalencia de Perkinsus sp. no se correlacionó con Cla (CB r = 0.09, p = 0.79; AE r = -0.23, p = 0.82), TSS (CB r = -0.22, p = 0.44; AE r = 0.51, p = 0.19) y POM (CB r = -0.21, p = 0.36; AE r = 0.69, p = 0.05) en las dos granjas.
La presencia del género Perkinsus está asociada a temperaturas superficiales del agua por encima de 25 °C (Guo & Ford, 2017) pudiendo alcanzar hasta 30- 32 °C en verano, el cual, es un gradiente característico en las granjas localizadas en el sureste del Golfo de California (Rodríguez-Quiroz et al., 2016; Villanueva-Fonseca et al., 2017). De hecho, pueden registrarse fluctuaciones moderadas de temperatura y salinidad durante ciclos anuales en dicha región (Góngora-Gómez et al., 2015, 2016), como es confirmado por los resultados de los parámetros en este trabajo. El registro de altas temperaturas de los tres primeros meses (29.7-30.7 °C) pudieron haber promovido la rápida presencia de Perkinsus sp. en ambos sitios, que se reflejó en los valores de prevalencia (60-80 %) obtenidos entre julio y agosto 2013. Lo anterior coincide con lo reportado por Ragone Calvo et al. (2003) y Villanueva-Fonseca & Escobedo-Bonilla, (2013), quienes registraron la proliferación del parásito en C. virginica y C. gigas, respectivamente, durante los meses más cálidos. La presencia de Perkinsus sp. en ostiones está asociada también, a concentraciones de salinidad por encima de 12 UPS (Ragone & Burreson, 1993). La Peyre et al. (2006) concluyeron que salinidades mayores de 15 UPS promueven la actividad metabólica de Perkinsus sp., coincidiendo con los resultados obtenidos en ambos sitios del presente estudio. La temperatura y salinidad del agua son considerados factores clave que controlan la incidencia de este protozoario (Choi & Park, 2010), sin embargo, no existe información precisa que sirva para comparar adecuadamente la relación de este patógeno con ambos factores (Fernández-Robledo et al., 2014).
Los niveles de nutrientes encontrados en C. gigas de ambos sitios, sugieren que su contenido energético fue suficiente para completar los requerimientos fisiológicos del ostión, aún con la presencia del parásito, a la prevalencia e intensidad infecciosa registrados. Lucas & Beninger (1985) y Oliver et al. (1998) mencionan que la cantidad de alimento puede mejorar la condición fisiológica del ostión reforzando su sistema inmunológico. No obstante, existen otros aspectos derivados de su nutrición (calidad y cantidad) que deben ser estudiados con relación a la presencia de Perkinsus en poblaciones silvestres y de cultivo de bivalvos.
Conclusiones
El ostión del Pacífico cultivado en la línea de costa norte-central de Sinaloa, mostró poca susceptibilidad a Perkinsus sp. Los resultados generales sugieren que la presencia de Perkinsus sp. en C. gigas fue debido a la previa existencia del parásito en las granjas. De forma similar, la baja incidencia de Perkinsus sp. en el ostión para ambos sitios, indica que la presencia del patógeno no representa una amenaza para la ostricultura en la región. Finalmente, se recomienda integrar otras técnicas de diagnóstico tales como PCR e histología en la detección y confirmación del parásito, para evaluar adecuadamente el efecto de este patógeno en el desempeño del ostión, así como continuar con su monitoreo.
Agradecimientos
Los autores desean expresar su gratitud al Instituto Politécnico Nacional (IPN), a la Secretaría de Investigación y Posgrado (SIP-IPN), a la Comisión de Operaciones y Fomento de Actividades Académicas (COFFA-IPN) y al Programa de Estímulo para el Desempeño de los Investigadores (EDI-IPN) por apoyar económica y logísticamente este proyecto (SIP-IPN 20160455 and 20160456).
REFERENCIAS
Aguirre-Macedo, M. L., Simá-Álvarez, R. A., Román-Magaña, M. K. and Güemez-Ricalde, J. I. (2007). Parasite survey of the Eastern oyster Crassostrea virginica in coastal lagoons of the southern Gulf of Mexico. Journal of Aquatic Animal Health, 19: 270-279. https://doi.org/10.1577/H06-050.1 [ Links ]
Andrews, J. D. (1996). History of Perkinsus marinus, a pathogen of oysters in Chesapeake Bay 1950-1984. Journal of Shell-fish Research, 15: 13-16. https://www.cabdirect.org/cabdirect/abstract/19970801928 [ Links ]
APHA. (Organización Panamericana de la Salud/Organización Mundial de la Salud) (1995). Standard Methods for the examination of water and wastewater. 19 th Edition. Washington, D. C., USA. American Public Health Association. [ Links ]
Barnes, H. and Blackstock, J. (1973). Estimation of lipids in marine animals and tissues: detailed investigation of the sul-phophosphovanillin method for total lipids. Journal of Experimental Marine Biology and Ecology, 12(1): 103-118. https://doi.org/10.1016/0022-0981(73)90040-3 [ Links ]
Berthelin, C., Kellner, K. and Mathieu, M. (2000). Storage metabolism in the Pacific oyster (Crassostrea gigas) in relation to summer mortalities and reproductive cycle (West Coast of France). Comparative Biochemistry and Physiology, 125B: 359-369. https://doi.org/10.1016/S0305-0491(99)00187-X [ Links ]
Bradford, M. M. (1976). A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-Dye binding. Analytical Biochemistry, 72(1): 248-254. https://doi.org/10.1016/0003-2697(76)90527-3 [ Links ]
Brandão, R. P., Boehs, G., Costa Sabry, R., Oliveira Ceuta, L., Aguiar Luz, M. S., Ramos Queiroga, F. and da Silva, P. M. (2013). Perkinsus sp. infecting oyster Crassostrea rhizophorae (Guilding, 1828) on the coast of Bahía, Brazil. Journal of Invertebrate Pathology, 112: 138-141. https://doi.org/10.1016/j.jip.2012.11.003 [ Links ]
Cáceres-Martínez, J., Vásquez-Yeomans, R., Padilla-Lardizábal, G. and del Río Portilla, M. A. (2008). Perkinsus marinus in pleasure oyster Crassostrea corteziensis from Nayarit, Pacific coast of México. Journal Invertebrate Pathology, 99: 66-73. https://doi.org/10.1016/j.jip.2008.03.005 [ Links ]
Cáceres-Martínez, J., García-Ortega, M., Vázquez-Yeomans, R., Pineda-García, T. J., Stokes, N. A. and Carnegie, R. B. (2012). Natural and cultured populations of the mangrove oyster Saccostrea palmula from Sinaloa, Mexico, infected by Perkinsus marinus. Journal of Invertebrate Pathology , 110: 321-325. https://doi.org/10.1016/j. jip.2012.03.019 [ Links ]
Casas, S. M., Grau, A., Reece, K. S., Apakupakul, K., Azevedo, C. and Villalba, A. (2004). Perkinsus mediterraeus sp. a protistan parasite of the European flat oyster Ostrea edulis (L.) from the Coast of Balearic Islands, Mediterranean Sea. Diseases of Aquatic Organisms, 58: 231-244. https://www.int-res.com/articles/dao2004/58/d058p231.pdf [ Links ]
Chávez-Villalba, J. (2014). Cultivo de ostión Crassostrea gigas: Análisis de 40 años de actividades en México. Hidrobiológica, 24(3): 175-190. https://hidrobiologica.izt.uam.mx/index.php/revHidro/article/view/577/168 [ Links ]
Chávez-Villalba, J., Villelas-Ávila, F. and Cáceres-Martínez, C. (2007). Reproduction, condition and mortality of the Pacific oyster Crassostrea gigas (Thunberg) along coastal Sonora, Mexico. Aquaculture Research, 38: 268-278. https://doi.org/10.1111/j.1365-2109.2007.01662.x [ Links ]
Chávez-Villalba, J., Arreola-Lizárraga, A., Burrola-Sánchez, S. and Hoyos-Chairez, F. (2010). Growth, condition, and survival of the Pacific oyster Crassostrea gigas cultivated within and outside a subtropical lagoon. Aquaculture, 300: 128-136. https://doi.org/10.1016/j.aquaculture.2010.01.012 [ Links ]
Choi, K.-S. & Park, K.-II. (2010). Review on the protozoan parasite Perkinsus olseni (Lester and Davies 1981) infection in Asian waters. In: Coastal Environmental Ecosystems. Ishimatsu, A. and Lie, H. J. Eds. 269-281 pp. Issues of the East China Sea. TERRAPUB and Nagasaki University. https://pdfs.semanticscholar.org/4c68/44a2f95551c a700c1daf2ad2c92ce035f539.pdf [ Links ]
Choi, K.-S., Park, K.-O., Lee, K. W. and Matsuoka, K. (2002). Infection intensity, prevalence and histopathology of Perkinsus sp. in the Manila clam, Ruditapes philippinarum, in Isahaya Bay, Japan. Journal of Shellfish Research, 21: 119-125 https://archive.org/stream/cbarchive_37453_infectionintensityprevalencean2002/infectionintensitypreva-lencean2002_djvu.txt [ Links ]
Craig, A., Powell, E. N. and Fay, R. R. (1989). Distribution of Perkinsus marinus in gulf coast oyster populations. Estuaries, 12: 89-91. https://doi.org/10.2307/1351499 [ Links ]
da Silva, P. M., Pereira Costa, M., Bragante de Araújo, J. P., Ramos Queiroga, F. and Alter Weinberg, A. (2016). Epizootiology of Perkinsus sp. in Crassostrea gasar oysters in polyculture with shrimps in northeastern Brazil. Brazilian Journal of Veterinary and Parasitology, Jaboticabal, 25(1): 37-45. https://doi.org/10.1590/S1984-29612016011 [ Links ]
Dittman, D. E., Ford, S. E. and Padilla, D. K. (2001). Effects of Perkinsus marinus on reproduction and condition of the eastern oyster, Crassostrea virginica, depending on time. Journal of Shellfish Research , 20(3): 1025-1034. http://www.academia.edu/23761327/Effects_of_Perkinsus_marinus_on_reproduction_and_condition_of_the_eastern_oyster_Crassostrea_virginica_depend_on_timing [ Links ]
Dridi, S., Romdhane, M. S. and Elcafsi, M. (2007). Seasonal variation in weight and biochemical composition of the Pacific oyster, Crassostrea gigas in relation to the gametogenic cycle and environmental conditions of the Bizert lagoon, Tunisia. Aquaculture , 263: 238-248. https://doi.org/10.1007/s11802-016-2855-6 [ Links ]
Encomio, V. G., Stickler, S. M., Allen, S. K. Jr. and Chu, F.-L. (2005). Performance of “natural Dermo-resistant” oyster stocks- survival, disease, growth, condition, and energy reserves. Journal of Shellfish Research , 24: 143-155. https://doi.org/10.2983/0730-8000(2005)24[143:PONDOS◆2.0.CO;2 [ Links ]
Enríquez-Espinoza, T. L., Grijalva-Chon, J. M., Castro-Longoria, R. and Ramos-Paredes, J. (2010). Perkinsus marinus in Crassostrea gigas in the Gulf of California. Diseases of Aquatic Organisms , 89: 269-273. https:doi.org/10.3354/ dao02199 [ Links ]
Enríquez-Espinoza, T. L., Castro-Logoria, R., Mendoza-Cano, F. and Grijalva-Chon, J. M. (2015). Perkinsus marinus in Crassostrea gigas and Chione fructifraga from Kino Bay, Sonora, Mexico. Revista de Ciencias Biologicas y de la salud, 27(1): 10-13. https://cibnor.repositorioinstitucional.mx/jspui/bitstream/1001/1192/1/PUB-ARTICULO-2804.PDF [ Links ]
Fernández-Robledo, J. A., Vasta, G. R. and Record, N. R. (2014). Protozoan parasites of bivalve molluscs: literature follows culture. PLoS One, 9 (6): 1-9, e100872. https://doi.org/10.1371/journal.pone.0100872 [ Links ]
Ford, S. E. (1996). Range extension by the oyster parasite Perkinsus marinus into the North Eastern United States: response to climate change? Journal of Shellfish Research , 15: 45-56. https://www.biodiversitylibrary.org/ item/22068#page/51/mode/1up [ Links ]
Gallo-García, M. C., García-Ulloa, M. and Godínez-Siordia, D. E. (2004). Evaluación de dos tratamientos en la intensidad de gusanos poliquetos asociados a las valvas del ostión Crassostrea gigas (Thunberg, 1873). Ciencias Marinas, 30: 455-464. https://doi.org/10.7773/cm.v30i3.283 [ Links ]
Goggin, C. L. and Lester, R. L. G. (1995). Perkinsus, a protistan parasite of abalone in Australia: a review. Marine Freshwater Research, 46: 639-646. https://doi.org/10.1071/MF9950639 [ Links ]
Góngora-Gómez, A. M., García-Ulloa, M., Hernández-Sepúlveda, J. A. and Domínguez-Orozco, A. L. (2012). Crecimiento del ostión Crassostrea gigas (Thunberg, 1795) cultivado en el estero La Piedra, Sinaloa, México. Avances en Investigación Agropecuaria, 16(2): 91-104. https://www.redalyc.org/pdf/837/83723532006.pdf [ Links ]
Góngora-Gómez, A. M., Hernández-Sepúlveda, J. A., Domínguez-Orozco, A. L., Villanueva-Fonseca, B. P. and García-Ulloa, M. (2015). Crecimiento, supervivencia y condición del callo de hacha Atrina maura (Sowerby, 1835) (Bivalvia: Pinnidae) en el estero La Piedra, Sinaloa, México. Avances en Investigación Agropecuaria , 19(3): 73-86. https://www.redalyc.org/jatsRepo/837/83743886007/movil/index.html [ Links ]
Góngora-Gómez, A. M., Rubio-Zepeda, F., Villanueva-Fonseca, L. C., Álvarez-Dagnino, E., Muñoz-Sevilla, N. P., Hernández-Sepúlveda, J. A. and García-Ulloa, M. (2016). Primer registro de Perkinsus sp. (Protozoa, Apicomplexa) en el callo de hacha Atrina maura en Sinaloa, México. Revista de Biología Marina y Oceanografía, 51(3): 689-694. https://doi.org/10.4067/S0718-19572016000300020 [ Links ]
Guo, X. and Ford, S. E. (2017). Infectious diseases of marine mollusks and host responses as revealed by genomic tools. Philosophical Transactions of The Royal Society B Biological Sciences, 371: 20150206. https://doi.org/10.1098/ rstb.2015.0206 [ Links ]
Huicab-Pech, Z. G., Curiel-Ramírez, S., Castañeda-Chávez, M., Lango-Reynoso, F. and Carrillo-Alejandro, P. (2012). Variación estacional de Perkinsus marinus en el ostión americano Crassostrea virginica del Sistema Lagunar Carmen-Machona-Pajonal en Tabasco, México. Tropical and Subtropical Agroecosystems, 15 (SUP 2): S40-S50. https://www.redalyc.org/pdf/939/93924626006.pdf [ Links ]
Karolus, J., Sunila, L., Spacer, S. and Volk, J. (2000). Prevalence of Perkinsus marinus (Dermo) in Crassostrea virginica along the Connecticut shoreline. Aquaculture , 183: 215-221. https://doi.org/10.1016/S0044-8486(99)00306-3 [ Links ]
Kennedy, V. S., Newell, R. I. E., Krantz, G. E. and Otto, S. (1995). Reproductive capacity of the eastern oyster Crassostrea virginica infected with the parasite Perkinsus marinus. Diseases of Aquatic Organisms , 23: 135-144. https://doi.org/10.3354/dao023135 [ Links ]
La Peyre, M. K., Casas, S. and La Peyre, J. (2006). Salinity effects on viability, metabolic activity and proliferation of three Perkinsus species. Diseases of Aquatic Organisms , 71: 59-74. https://doi.org/10.3354/dao071059 [ Links ]
Lucas, A. and Beninger, P. (1985). The use of physiological condition indices in marine bivalves. Aquaculture , 44: 187-200. https://doi.org/10.1016/0044-8486(85)90243-1 [ Links ]
Luz, M. dos S. A. and Boehs, G. (2016). Perkinsus beihaiensis infecting the oyster Crassostrea rhizophorae under cultivation and in natural stock in Camamu Bay, Bahia, Brazil. Brazilian Journal of Veterinary and Animal Sciences, 53(2): 191-198. https://pdfs.semanticscholar.org/b1fb/1e662ebe5c2709646a997256bdde60c561c6.pdf [ Links ]
Mackin, J. G. (1962). Oyster disease caused by Dermocystidium marinum and other organisms in Louisiana. Publication of the Institute for Marine Science, University of Texas, Texas, USA, 7: 132-229. [ Links ]
Ojea, J., Pazos, A. J., Martínez, D., Novoa, S., Sánchez, J. L. and Abad, M. (2004). Seasonal variation in weight and biochemical composition of the tissues of Ruditapes decussatus in relation to the gametogenic cycle. Aquaculture , 238: 451-468. https://doi.org/10.1016/j.aquaculture.2004.05.022 [ Links ]
Oliver, L. M., Fisher, W. S, Ford, S. E., Ragone Calvo, L. M., Burreson, E. M., Sutton E. B. and Gandy, J. (1998). Perkinsus marinus tissue distribution and seasonal variation in oysters Crassostrea virginica from Florida, Virginica and New York. Diseases of Aquatic Organisms , 34: 51-61. https://doi.org/10.3354/dao034051 [ Links ]
Park, K. I. and Choi, K.-S. (2001). Spatial distribution of the protozoan parasite Perkinsus sp. found in the Manila clams, Ruditapes philippinarum, in Korea. Aquaculture , 203, 9-22. https://doi.org/10.1016/S0044-8486(01)00619-6 [ Links ]
Park, K. I., Choi, K.-S. and Choi, J.-W. (1999). Epizootiology of Perkinsus sp. found in the Manila clam, Ruditapes philippinarum, in Komsoe Bay, Korea. Journal of the Korean Fisheries Society, 32(3): 303-309. http://www.ndsl.kr/ndsl/commons/util/ndslOriginalView.do?dbt=JAKO&cn=JAKO199923607615868&oCn=JAKO199923607615868&pageCode=PG14&journal=NJOU00010626 [ Links ]
Park, K. I., Tsutsumi, H., Hong, J.-S. and Choi, K.-S. (2008). Pathology survey of the short-neck clam Ruditapes philippinarum occurring on Sandy tidal flats along the coast of Ariake Bay, Kyushu, Japan. Journal of Invertebrate Pathology , 99: 212-219. https://doi.org/10.1016/j.jip.2008.06.004 [ Links ]
Paynter, K. (1996). The effects of Perkinsus marinus infection on physiological processes in the eastern oyster, Crassostrea virginica. Journal of Shellfish Research , 15(1): 119-125. http://www.clfs.umd.edu/biology/paynterlab/labpub/PerkinsusMarinusInfection.pdf [ Links ]
Ragone, L. M. and Burreson, E. M. (1993). Effect of salinity on infection progression and pathogenicity of Perkinsus marinus in the eastern oyster, Crassostrea virginica (Gmelin). Journal of Shellfish Research , 12: 1-7. [ Links ]
Ragone Calvo, L. M. , Dungan, C. F., Roberson, B. S. and Burreson, E. M. (2003). Systematic evaluation of factors controlling Perkinsus marinus transmission dynamics in lower Chesapeake Bay. Diseases of Aquatic Organisms , 56: 75-86 https://doi.org/10.3354/dao056075 [ Links ]
Rodríguez-Quiroz, G., García-Ulloa, M., Domínguez-Orozco, A. L., Valenzuela-Hernández, T. N, Nava-Pérez, E. and Góngora-Gómez, A. M. (2016). Relación del crecimiento, condición y supervivencia del ostión del Pacífico Crassostrea gigas y las variables ambientales, cultivado en suspensión en el sistema lagunar Navachiste-Macapule, Sinaloa, México. Revista de Biología Marina y Oceanografía , 51(3): 541-551. https://doi.org/10.4067/S0718-19572016000300006 [ Links ]
Roe, J. H. (1955). The determination of sugar in blood and spinal fluid with anthrone reagent. Journal of Biology and Chemistry, 212(1): 335-343. https://www.semanticscholar.org/paper/The-determination-of-sugar-in-blood-and-spinal-with-Roe/8f85bc4f17d79bdfc07b579c6917c89de4f92fa3 [ Links ]
Samain, J. F., Dégremont, L., Sotetchnik, P., Haure, H., Bedrer, E., Ropert, M., Moal, J., Huver, A., Bacca, H., Van Wormhoudt, A., Delaporte, M., Costil, K., Pouvreau, S., Lambert, Ch., Boulo, V., Soudant, Ph., Nicolas, J. L., Leroux, F., Renault, T., Gagnaire, B., Geret, F., Boutet, I., Burgeoy, T., and Broudy, P. (2007). Genetically based resistance to summer mortality in the Pacific oyster (Crassostrea gigas) and relationship with physiological, immunological characteristics and infection processes. Aquaculture , 268: 227-243. https://doi.org/10.1016/j. aquaculture.2007.04.044 [ Links ]
Soniat, T. M. (1996). Epizootiology of Perkinsus marinus disease of Eastern oysters in the Gulf of Mexico. Journal of Shellfish Research , 15: 35-43. https://www.infona.pl/resource/bwmeta1.element.elsevier-6cd05af0-3de6-3be5-9ebf-446eb102b17f [ Links ]
Strickland, J. D. and T. R. Parsons. (1972). A practical handbook of the seawater analysis. Second edition. Ottawa, Canada. Fisheries Research Board of Canada. [ Links ]
Thrusfield, M. (1995). Diagnostic testing. Veterinary epidemiology. Second Edition. Cambridge, UK. The University Press. [ Links ]
Villalba, A., Reece, K. S., Camino Ordás, M., Casas, S. M. and Figueras, A. (2004). Perkinsosis in molluscs: A review. Aquatic Living Resources, 17: 411-432. https://doi.org/10.1051/alr:2004050 [ Links ]
Villanueva-Fonseca, L. C. and Escobedo-Bonilla, C. M. (2013). Prevalencia del protozoario Perkinsus sp. en un cultivo de ostión japonés Crassostrea gigas en Sinaloa, México. Latin American Journal of Aquatic Research, 4(15): 996-1002. http://dx.doi.org/103856/vol41-issue5-fulltext-19 [ Links ]
Villanueva-Fonseca, B. P., Góngora-Gómez, A. M., Muñoz-Sevilla, N. P., Domínguez-Orozco, A. L., Hernández-Sepúlveda, J. A., García-Ulloa, M. and Ponce-Palafox, J. T. (2017). Growth and economic performance of diploid and triploid Pacific oysters Crassostrea gigas cultivated in three lagoons of the Gulf of California. Latin American Journal of Aquatic Research , 45(2): 466-480. https://doi.org/10.3856/vol45-issue2-fulltext-21 [ Links ]
1Como citar este artículo: Góngora-Gómez, A. M., Rubio-Zepeda, F., SantamaríaMiranda, A., Villanueva-Fonseca, B. P., Domínguez-Orozco, A. L., Villanueva-Fonseca, L.C., HernándezSepúlveda, J. A., Rodríguez-González, H., Espinosa-Alonso, L. G., García-Ulloa, M. (2019). Perkinsus sp. on Crassostrea gigas performance cultivated in the southeastern Gulf of California. Revista Bio Ciencias 6, e681. doi: https://doi.org/10.15741/revbio.06.e681
Recibido: 07 de Febrero de 2019; Aprobado: 05 de Mayo de 2019











 text in
text in 




