Introducción
La castaña de Brasil (Bertholletia excelsa H.B.K) es una especie abundante en la región amazónica y sus frutos se cosechan casi exclusivamente en bosques naturales, donde varias comunidades se benefician con su producción (Tonini et al., 2008). Esta especie es clave para la conservación y el desarrollo de la región amazónica, debido a su uso múltiple por las comunidades que la usufructúan, es una fuente de empleo e ingresos para trabajadores rurales y urbanos de esta región y por el uso de su madera (Tonini, 2011). En el norte de Brasil, B. excelsa es una especie nativa con gran potencial para la reforestación (Tonini y Arco-Verde, 2005) y tiene una combinación de aspectos favorables, como madera de excelente calidad, rápido crecimiento, abundante fructificación, y la recolección de frutos causa un impacto ambiental bajo (Tonini et al., 2008).
La propagación por semilla de B. excelsa es limitada por una pérdida rápida de su viabilidad, causada por su comportamiento recalcitrante, la germinación lenta e irregular de hasta seis meses y dificultades en el enraizamiento. Además sus frutos son susceptibles a los ataques por predadores antes de su maduración (Figueiredo y Carvalho, 2002). Para obtener germinación rápida es necesario retirar el tegumento, y en la mayoría de las veces se producen daños mecánicos en la semilla. Dadas estas limitaciones, la propagación vegetativa por estacas y la aplicación de reguladores de crecimiento, en especial la auxina sintética ácido indolbutírico (AIB) es una técnica prometedora para la mayoría de las especies. El AIB es una sustancia fotoestable, no tóxica, de acción localizada y menos sensible a la degradación biológica (Husen, 2012). El uso es recomendado para estimular el enraizamiento de numerosas plantas (Bortoline, 2008) y se usan concentraciones bajas y altas como los tipos y tamaños de estacas (Vernier e Cardoso, 2013). Según Xavier et al. (2009), el grado de éxito de la propagación vegetativa también depende de la temporada, las condiciones fisiológicas de la planta, la concentración de los reguladores de crecimiento, las condiciones meteorológicas, la ubicación, el tamaño y el tipo de propágulo, los medios de enraizamiento, los fungicidas y la influencia del sustrato sobre el enraizamiento.
Para algunos árboles como Eucalyptus, la técnica de propagación por estacas está bien establecida, con dominio en la producción de plántulas de alta calidad y bajo costo. En Schizolobium amazonicum (Rosa y Pinheiro, 2001), Calophyllum brasiliensis (Silva et al., 2010) e Ilex paraguariensis (Brondani et al., 2008) existen protocolos de propagación, pero no para la mayoría de las especies forestales. Los estudios de Pinheiro (1967) y Moraes et al. (2008) son los únicos con estacas con B. excelsa y los resultados no fueron eficientes para el desarrollo de protocolos, por lo cual la información es insuficiente para la aplicación de esta técnica.
Por lo tanto, el objetivo de este estudio fue evaluar el enraizamiento de estacas juveniles de B. excelsa asociadas a la aplicación de AIB en propagadores de subirrigación.
Materiales y métodos
El estudio se realizó en el vivero forestal de Embrapa Amazonia Oriental, en la ciudad de Belém, capital del Estado de Pará, Brasil, usando semillas compradas a productores. Para la producción de las plantas, las semillas de B. excelsa se sumergieron en agua 24 h y se sembraron en bolsas de plástico de 17 cm x 28 cm, las cuales contenían una mezcla de sustrato de 60 % de tierra negra, 30 % de estiércol de pollo y 10 % de arena, y se colocaron en un invernadero bajo riego artificial intermitente.
Cuando las plántulas alcanzaron 45 cm de altura, se seccionaron en estacas de 10 cm de largo, cortadas en forma oblicua en la base, conteniendo al menos dos yemas y dos pares de hojas reducidas a la mitad de su tamaño original, con el fin de evitar la transpiración excesiva. Los cortes se separaron en tres grupos: posición apical, media y basal. Con el fin de mantener el vigor y la turgencia del material vegetal, inmediatamente después de la recolección, las estacas se lavaron con agua y se colocaron en una caja térmica con agua.
Para el enraizamiento las estacas se colocaron seis meses en un propagador tipo cámara de subirrigación, con estructura metálica envuelta con plástico de polietileno que lo tornaba impermeable. La base estaba forrada con cuatro camadas: 1) arena (6-10 cm); 2) grava (10-15 cm); 3) piedras (5 cm); y 4) sustrato (5 cm), compuesto por arena estéril, según el modelo de Leakey et al. (1990) y adaptado por Longman (1993). El propagador estaba dentro de un invernadero con luminosidad interna reducida a 50 % de la luz natural por una media sombra ubicada en la parte superior externa de la estructura, con una humedad relativa de 90 % y una temperatura promedio de 27 °C. Durante el período de estancia de las estacas, en el propagador se realizó el control fitosanitario mediante un rociado cada 15 d con Benomyl (1 g L-1).
El diseño experimental fue completamente al azar con un arreglo factorial (3x3x2) de tratamientos: AIB (0, 1000 y 3000 mg L-1), tipos de estacas (apical, media y basal) y tiempos de inmersión (1 s y 1 min). El AIB se disolvió en hidróxido de sodio (NaOH) 1 N, se diluyó en agua destilada (50:50 % en v/v) y la base de las estacas fue inmersa en la solución. Cada tratamiento tuvo tres unidades experimentales de 12 estacas.
Las mediciones se realizaron en intervalos de 30 d durante 180 d, y las variables fueron porcentaje de estacas enraizadas, número y longitud de raíces, presencia de callosidades y porcentaje de mortalidad. Los valores medios del porcentaje de enraizamiento se transformaron con la función raíz cuadrada de arcoseno para cada observación y el número promedio de raíces transformadas en
Las estacas con raíces se transfirieron a bandejas de plástico de 24 celdas, las cuales contenían suelo negro y vermiculita en la proporción de 1:1 (v/v) y se colocaron en un invernadero con riego intermitente para el crecimiento de la parte aérea. Las plántulas formadas se transfirieron a bolsas de plástico de polietileno negro de 14 cm x 20 cm con tierra negra y estiércol vacuno en la proporción de 1:1 (v/v), para evaluación de la adaptación en vivero y futura plantación en campo.
Análisis estadístico
Con los datos se realizó un ANDEVA, regresión, y las medias se compararon con la prueba SNKα (p≤0.05), usando SISVAR 5.3 (Ferreira, 2010), porque usa la distribución de la prueba de Tukey. El método Keuls es relativamente fácil de aplicar y considera el número total de tratamientos utilizados en el experimento, y es una prueba de amplitud múltiple que evalúa la significancia de un conjunto de diferencias, haciendo un balance entre los Errores de Tipo I y II.
Resultados y discusión
Estacas enraizadas, presencia de callos y mortalidad
Los porcentajes de enraizamiento (de 8 % a 58 %) fueron relativamente bajos, pero los tipos de estacas (Pr>F 0.002), las concentraciones de AIB (Pr>F 0.002), el tiempo de inmersión (Pr>F 0.026) y las interacciones entre estos factores (Pr>F 0.000) mostraron diferencias significativas (p≤0.05) (Cuadros 1 y 2). La interacción positiva con los mismos factores fue verificada por Dias et al. (2012a) con propagación vegetativa por mini estacas de Anadenanther amacrocarpa y diferentes concentraciones de AIB.

Los valores con diferente letra en una columna son estadísticamente diferentes (p≤0.05)
Cuadro 1 Efecto de la concentración y el tiempo de inmersión de ácido indolbutírico (AIB) y la posición de la estaca con el porcentaje de las estacas enraizadas (EE), formación de callo (C), mortalidad (M) y los valores medios de número de raíz (NR) y longitud de raíz (LR) en Bertholletia excelsa.
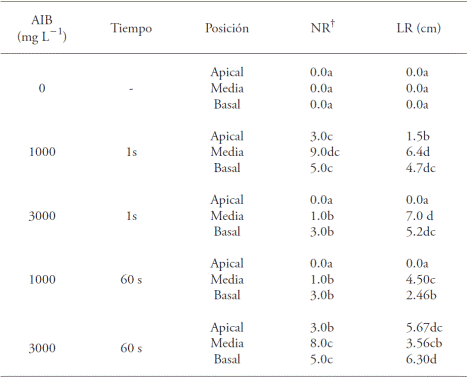
Los valores medios con letra diferente en una columna son diferentes (test de SNK; p≤0.05); † Datos trasformados a
Cuadro 2 Efecto de la concentración y tiempo de inmersión en ácido indolbutírico (AIB) y la posición de la estaca, en los valores medios de número de raíz (NR) y longitud de raíz (LR) en estacas juveniles de Bertholletia excelsa.
Wendling y Xavier (2005) obtuvieron 80 a 100 % de enraizamiento al usar concentraciones de 500 a 1000 mg L-1 de AIB en estacas de clones de Eucalyptus. Según Santos et al. (2011), además del efecto del regulador de crecimiento, las características propias de cada especie también afectan el enraizamiento de las estacas, como observó en su estudio con 20 especies forestales. Estos resultados destacan que el enraizamiento de las estacas presentó un comportamiento diferenciado y que en la iniciación de las raíces influyeron factores intrínsecos relacionados con la propia planta y extrínsecos vinculados con las condiciones ambientales (Hartmann et al., 2002; Pio et al., 2003).
El porcentaje bajo de formación de raíces se explica porque las estacas respondieron de forma diferente a la acción de la hormona; unas necesitan permanecer por más tiempo en contacto con la solución reguladora de crecimiento y otras enraízan esporádicamente o no enraízan. Esta diferencia se debe a las variaciones fisiológicas entre las estacas de la misma planta, aunque estas sean juveniles; además, el proceso se puede inhibir según la concentración del regulador de crecimiento. Estos resultados sugieren que un material vegetal juvenil no siempre es propicio para el proceso de enraizamiento de especies leñosas provenientes de semillas, como lo comprobado con estacas de B. excelsa. Fachinello et al. (2005) señalan que a pesar de la capacidad de enraizamiento de especies leñosas, el potencial de una estaca para formar raíces varía con la especie y el tipo de cultivo debido a la interacción de factores como la manipulación de la planta, el buen estado nutricional, el periodo de recolección y la edad de la planta, el largo y el diámetro de las estacas, la presencia de hojas y yemas, el tratamiento hormonal, la iluminación, la temperatura y la humedad relativa.
El uso de AIB aumentó el número de raíces por estaca, y promueve un mayor porcentaje de enraizamiento según Endres et al. (2007). Lo mismo observaron Gratieri-Sossella et al. (2008), en estudios con palo del brasil (Caesalpinia echinata) y ceibo (Erythrina crista-galli), respectivamente.
En ausencia de AIB la formación de callos varió de 66 a 100 %, en especial en la posición apical (Cuadro 1; Figura 1). La presencia de callos en las secciones de cortes ocurrió independientemente de la presencia del regulador de crecimiento o posición de corte. Hernández et al. (2013), respecto a la propagación vegetativa por estacas de Cariniana estrellensis, reportan que la presencia de callo se produce con o sin la presencia de AIB, tanto en estacas apicales como intermedias.
Fachinello et al. (2005) señalan que el callo se forma desde una masa de células parenquimatosas y desorganizadas, como resultado de las lesiones de los tejidos del xilema y el floema durante la preparación de la estaca. La auxina natural producida en las hojas y en los brotes se mueve hacia la parte inferior de las estacas estimulando la actividad de enraizamiento, acumulándose en la base de corte, junto con azúcares y otros nutrientes (Janick, 1996), actúan como sustancias inhibidoras en la iniciación de las raíces adventicias preformadas y potencializan la formación de callos en la base de las estacas (Hartmann y Kester, 2011).
Iritani et al. (1986) y Caldwell et al. (1988) afirman que las raíces pueden aparecer directamente desde el tejido caulinar o sólo a través del callo. La formación de callos se debe a la presencia del equilibrio de la auxina aplicada (AIB) en presencia de una citocinina endógena y, según Hartmann y Kester (2011), ese equilibrio también puede ocurrir cuando se aplica citocinina con la auxina endógena. Así, la presencia de callos en estacas de B. excelsa indicaría que si las estacas permanecen un período más largo en el entorno de enraizamiento, habrá un aumento en el porcentaje de estacas enraizadas. Sin embargo, las raíces que surgen por diferenciación de las células del callo raramente poseen conexiones vasculares con las estacas, por lo cual no se recomienda la propagación a partir de estos (George et al., 2008).
Respecto a la mortalidad, las estacas en la posición basal, inmersas 1 s con 3000 mg L-1 de AIB, presentaron mayor porcentaje (83.3 %) comparado con otros tipos de posición y tiempo de inmersión, lo cual sugiere que hubo fitotoxicidad a esa concentración. Entre los tratamientos, sólo las estacas apicales en ausencia de AIB no presentaron mortalidad (Cuadro 1). Bastos et al. (2004) estudiaron el enraizamiento de las estacas de la fruta de estrella (Averrhoa carambola) y sugieren que hubo fitotoxicidad con concentraciones diferentes de AIB e inmersas 10 s, y que la capacidad de supervivencia de las estacas apicales en ausencia de regulador del crecimiento fue mayor que las expuestas a AIB.
Número y longitud de las raíces
Las estacas presentaron, en promedio, la formación de una sola raíz (Figura 2). El tratamiento que causó un número mayor de raíces fue aquel con una concentración de 3000 mg L-1 de AIB (Cuadro 1).
Las estacas medias sumergidas 1 s a 1000 mg L-1 de AIB mostraron un porcentaje más alto de enraizamiento (58.3 %), seguida por las estacas basales en el mismo tiempo de inmersión y misma concentración (41.7 %) (Cuadro 1). Sin embargo, estas últimas no difirieron de las estacas medias y basales, inmersas 1 min en 3000 mg L-1 de AIB. En ausencia de AIB, para los tres tipos de estacas usadas, no hubo formación de raíces, así como en los cortes apicales sumergidos 1 s en una concentración de 3000 mg L-1 de AIB e inmersas 1 min a 1000 mg L-1 de AIB (Cuadro 1).
En la ecuación de regresión, el número total de raíces obtenidas por morfogénesis directa tendieron a un aumento lineal en el número de raíces producidas por estacas, al incrementar la concentración del regulador de crecimiento (Figura 3).

Figura 3 Efecto de ocho concentraciones (mg L-1) de AIB sobre en número de raíces producidas en estacas de Bertholletia excelsa. r=0.864.
Dentro de cada concentración de AIB, las estacas en la posición apical tenían el menor porcentaje de enraizamiento (Cuadro 1). En este sentido, Dias et al. (2012b) señalaron que las menores tasas de enraizamiento ocurren en las estacas apicales, ya que contienen el meristemo, que es uno de los lugares principales de síntesis natural de auxina y, por tanto, no se necesita la aplicación exógena de los reguladores sintéticos de crecimiento en la base; si esta ocurre, causa un desequilibrio hormonal e inhibe la aparición de raíces (Hartmann et al., 2002, Lopes et al., 2011). Las longitudes medias mayores de raíz se obtuvieron en los tratamientos con estacas en la posición media, sumergidas 1 s a 3000 mg L-1 de AIB (7.0 cm) y en 1000 mg L-1 de AIB (6.4 cm) sin diferencias significativas entre sí. La longitud media menor de raíz (1.5 cm), se observó en el tratamiento con las estacas en la posición apical, inmersas 1 s en la concentración de 1000 mg L-1 de AIB (Cuadro 2).
La regresión lineal mostró una tendencia creciente con un aumento de la concentración de AIB, indicando que eventualmente en concentraciones mayores proporcionaría mejores resultados. Sin embargo, por estaca existió una amplia variación en la longitud de la raíz. Este hecho pudo deberse a factores genéticos, ya que cada estaca presentó características únicas y por ende, los requisitos para la propagación también tendieron a ser únicas (Figura 4).
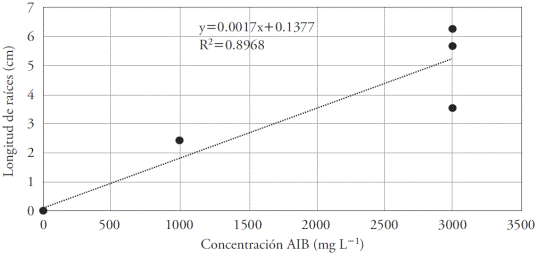
Figura 4 Efecto de ocho concentraciones de AIB (mg L1) en la longitud de la raíz en estacas de Bertholletia excelsa. R0.947. 1
Estos resultados son similares a los reportados por Xavier et al. (2003), quienes encontraron diferencias significativas en el enraizamiento de estacas de Cedrela fissilis. Hernández et al. (2012) en un estudio con Piptadenia gonoacantha obtuvieron valores promedios mayores en las estacas intermedias y basales al aplicar AIB (6000 mg L-1), y los tres tipos de estacas respondieron a la aplicación de la AIB.
De acuerdo con las observaciones realizadas, al cabo de seis meses, las estacas supervivientes estaban verdes y fortalecidas, sugiriendo iniciación y elongación posterior de raíces adventicias. Sin embargo, el éxito de esta técnica depende del tipo de material vegetal, de la especie y sus condiciones nutricionales, del tipo de regulador de crecimiento, las concentraciones utilizadas y el tiempo de inmersión. Debido al porcentaje bajo de enraizamiento y tiempo para enraizar, es necesario realizar ajustes para que la técnica sea viable y convertirse en una alternativa para la producción de plántulas a lo largo del año, especialmente en situaciones en que la semilla es un insumo limitante.
Conclusiones
El uso de AIB estimuló el crecimiento de raíces en estacas de diferentes tipos de Bertholletia excelsa, destacó la concentración de 1000 mg L-1, sumergiendo la base de la estaca en la solución de AIB por un segundo y usando el segmento medio para obtener estacas, como lo más indicado para aumentar el porcentaje de enraizamiento.
La técnica de estacas para la propagación vegetativa en masa de la especie. Sin embargo, el enraizamiento bajo sugiere que este proceso depende de factores múltiples, que se deben considerar para estimular y optimizar la producción posterior de plántulas.











 text in
text in 




