Introducción
Resulta paradójico que las soluciones de futuro para el mundo, en lo que se refiere a la producción de los nuevos materiales que servirán de base a las infraestructuras tecnológicas y que regirán la vida de las generaciones venideras, no sean visibles para el ojo humano. En los materiales aparecen nuevas propiedades cuando llegan a la nanoescala, y son generalmente sorprendentes (EcuRed, 2015). Según Carchi (2014), los materiales nanométricos han despertado la curiosidad entre los científicos, debido a las magníficas propiedades mecánicas, térmicas, eléctricas, entre otras, que poseen.
Dentro de esta relativamente nueva clase de materiales, la nanocelulosa ha sido un tema de gran interés debido a la variedad de características físicas y químicas que ofrece para estudio. Conocida como una nanofibra que puede obtenerse a partir de fibras de celulosa, aparece como un novedoso compuesto de relevancia potencial. Se encuentra formando parte de las paredes celulares en vegetales y de los subproductos agroindustriales (Beltramino, 2016). Se presenta en dos formas, cristalina o aleatoria.
La nanocelulosa llegó hace poco al grupo de los materiales de origen natural y es candidata a revolucionar la industria en las próximas décadas. Si hubiese que hacer un pódium de los materiales postulados para revolucionar la industria en los próximos años, seguramente este estaría ocupado por el grafeno, los nanotubos de carbono (que es en esencia lo mismo que el grafeno, es decir, átomos de carbono, pero organizados en cilindros en vez de en láminas) y la nanocelulosa. Las características únicas y los potenciales usos de la nanocelulosa maravillan a los científicos y los ingenieros, y los responsables de los procesos productivos están a la espera de que se logren producir con fiabilidad y eficiencia en cantidades industriales. Es un nanomaterial que posee una resistencia ocho veces mayor a la del acero, además de ser un material flexible, ligero, y un buen conductor de electricidad; presenta una gran estabilidad con respecto a los cambios de temperatura, es transparente y respetuosa con el medio ambiente (Prieto, 2013); se aplica como refuerzo y/o barrera de distintos polímeros, nanopapel, nanofiltros, implantes médicos, y en aplicaciones que necesiten de alta transparencia, baja expansión térmica y alta resistencia, asimismo, en cosméticos y productos farmacéuticos, películas y recubrimientos de barrera, tratamiento de aguas, electrónicos y más (Valencia Payán, 2015).
Este material libre y sostenible, posee características importantes: dimensionamiento a nano escala, características rígidas y estabilidad en medios ofensivos, temperaturas elevadas, superficialidad, cristalinidad y resistencia específica alta, esparcimiento térmico renovable bajo, patrón y bajo costo. Su complejidad dependerá de las características que presente la materia prima y las prácticas que se ejecuten para su obtención (Kaur et al., 2018).
Durante un estudio realizado por el grupo de científicos de Malcom Brown, de la Universidad de Texas, se logró obtener volúmenes pequeños de nanocelulosa por medio de un alga que lo origina de forma natural, donde los nutrientes no son necesarios (Prieto, 2013). Esto se consiguió mediante la inserción de genes en el alga provenientes de la bacteria Acetobacter xylinum (bacteria típica utilizada en la obtención de vinagre) donde se reveló que por medio de este proceso se lograría la generación de volúmenes colosales de nanocelulosa con bajos precios de operación, debido a que en el ecosistema se puede encontrar fácilmente esta materia prima, abriendo la puerta a hallazgos de procesos en donde se utiliza la nanocelulosa como un ecológico y eficiente biocombustible, aparte de los procesos indicados anteriormente.
Se han conseguido también adelantos en la creación de nanocelulosa bacteriana mediante el uso de Gluconacetobacter xylinus (actualmente llamada Komagateibacter xylinus). En la investigación realizada indican que la bacteria utilizada en la obtención de la nanocelulosa presenta una gran capacidad de producción de la misma. Además, mencionan que este material se puede aplicar en muchas áreas como, elaboración de películas comestibles para packaging, papeles de resistencias altas y en membranas acústicas (Cerrutti y Foresti, 2016).
Subproductos agrícolas
Los residuos agrícolas son aquellas partes derivadas del cultivo de diferentes especies vegetales, particularmente durante la cosecha, que no son destinadas al consumo. Se incluyen en esta categoría materiales como tallos, hojas, cáscaras, cortezas, vainas, semillas, rastrojos, entre otros, provenienentes de cereales (arroz, maíz, trigo, cebada), café, cacao, té, frutas (banano, mango, coco, piña), legumbres (tomate, soya, frijol), algodón, y palma aceitera entre otros. (Singh et al., 2012). Estos remanentes son producidos en millones de toneladas alrededor del mundo y representan una fuente de biomasa lignocelulósica abundante, barata y de fácil acceso. De estas enormes cantidades de residuos agrícolas, solamente una pequeña cantidad es empleada como alimento animal o combustible para hogares y una mayor porción es quemada en los campos creando un problema de contaminación ambiental (Kalia et al., 2011).
Origen de los residuos agroindustriales
Los residuos agroindustriales son materiales que se pueden encontrar en estado sólido o líquido y que se derivan de un proceso de industrialización de un producto primario o del consumo directo del mismo, estos materiales ya no tienen utilidad alguna para el proceso que los genera, pero se han constituido en una fuente de estudio para el desarrollo de energías renovables por lo cual ganan valor económico y se crea conciencia social. El principal problema enfrentado por la generación de residuos agroindustriales es la falta de conciencia ambiental de las empresas que los generan, a esto se suman los pocos recursos destinados a la I+D, a la falta de tecnología y las pobres políticas del gobierno en cuanto al manejo de dichos residuos (Vargas y Pérez, 2018).
Las características de los desechos agroindustriales son a menudo variadas y en gran medida dependen de los productos de donde se desprenden y de los procesos industriales de los cuales son generados, sin embargo, la mayoría de residuos agroindustriales comparten la misma composición de materia orgánica, aunque puede diferir en los porcentajes. La materia orgánica de estos residuos está constituida principalmente por celulosa, lignina, hemicelulosa y pectina. A menudo se los denomina “residuos orgánicos” por estar constituidos principalmente de materia orgánica (Mejías et al., 2016).
Para concebir una idea sobre la cantidad de desechos agroindustriales que se derivan de los procesos de varias industrias a nivel mundial se muestran los siguientes valores: la industria cervecera utiliza en su proceso apenas un 8% del grano de cebada, el 92% sobrante es desechado como residuo; la industria que elabora aceite de palma solo utiliza el 9% de la pepa, el 91% restante es desechado; la industria del café solo utiliza el 9.5% y el 90.5% sobrante corresponde a residuo, en la industria papelera se utiliza menos del 30% y lo que resta corresponde a residuos (Cury et al., 2017)
La quema de residuos agrícolas es una práctica tradicional muy común en México para eliminar residuos no deseados de cosechas de maíz, frijol, trigo, arroz entre otros cultivos. También se queman ramas y malezas en huertos de árboles frutales, nogales y viñedos. Desafortunadamente, en ese proceso también puede producirse la quema de costales y plásticos usados en invernaderos y zanjas, costales de insecticida y fertilizantes, papel y plásticos para protección (utilizados, por ejemplo, en los cultivos de plátanos y dátiles) y bandejas de secado, entre otros, mezclados con residuos de cultivos, lo que contribuye aún más a la contaminación (Galeana, 2017).
Se estima que la quema de biomasa, como madera, hojas, árboles y pastos incluidos los residuos agrícolas, produce 40% del dióxido de carbono (CO2), 32% del monóxido de carbono (CO), 20% de materia particulada o partículas de materia suspendidas (PS) y 50% de los hidrocarburos aromáticos policíclicos (HAP) emitidos al ambiente a escala mundial. Las quemas de residuos agrícolas son muy utilizadas a pesar de no tratarse de un manejo ambientalmente aceptable (Lemieux, 2004).
Además, desde el punto de vista de la salud pública, resultan preocupantes por una serie de razones:
El humo de las quemas agrícolas se libera a nivel o muy cerca del suelo en áreas generalmente pobladas, lo cual conlleva una exposición a los contaminantes directa y elevada de la población aledaña.
Estas quemas se realizan generalmente por etapas, en temporadas específicas del año, y pueden dar lugar a concentraciones muy elevadas de contaminantes.
Son fuentes no puntuales de contaminantes atmosféricos y se realizan en áreas muy extensas, por lo que resulta difícil medir y regular este tipo de emisiones. Las condiciones de la combustión y los combustibles varían e incluyen la posible presencia de plaguicidas.
Contribuyen al cambio climático, pues entre los compuestos emitidos se encuentran gases de efecto invernadero y contaminantes climáticos de vida corta, como el carbono negro.
Afecta la visibilidad en zonas y carreteras aledañas.
Además, en estos procesos de combustión incompletos se producen dioxinas, contaminantes altamente tóxicos y cancerígenos (Galeana, 2017).
Como se muestra en la Tabla 1, cada fibra proveniente de una fuente o materia prima de residuos postcosecha, tiene un porcentaje diferente de celulosa, hemicelulosa, lignina y cera, que evidentemente constituyen la base de los trabajos posteriores de obtención de nanocelulosa, independientemente del procedimiento que sea usado (Sánchez, 2015). Este mismo autor planteó que, de las cinco biomasas estudiadas, la cascarilla de soya, el residuo de cartón y la cáscara de cacahuate son las que presentaron una mayor viabilidad para la producción de nanopartículas de celulosa, al contener 49.59, 44.52 y 32.80% de celulosa, respectivamente; mientras que las muestras de residuo de maíz y salvado de trigo contienen 12.68 y 12.01% de celulosa, respectivamente. El análisis de fibra muestra que la biomasa de mayor porcentaje es la cascarilla de soya con un 49.52% de celulosa, coincidiendo con lo reportado por Flauzino et al. (2013).
Tabla 1 Comparación del porcentaje de celulosa, lignina, hemicelulosa y sílice en diferentes tipos de fibras utilizadas en ensayos de laboratorio.
| Tipo de fibra | Celulosa (%) |
Lignina (%) |
Hemicelulosas (%) |
Sílice (%) |
Referencia* |
|---|---|---|---|---|---|
| Fibras de paja | |||||
| Cascarilla de arroz | 28-36 | 12-16 | 31.6 | 9-14 | Santos y Silva (2019), Peñaranda et al. (2017) |
| Paja de arroz | 35.62 | 15.38 | 11.96 | Carroll y Somerville (2009) | |
| Paja de trigo | 29-39.04 | 5.71-21 | 20.9-32 | 3-7 | Araya (2016), Carroll y Somerville (2009), Liu et al. (2017) |
| Salvado de trigo | 12.01 | 2.20 | 12.84 | - | Sánchez (2015) |
| Fibras de caña | |||||
| Caña de azúcar | 32-44 | 19-24 | 27-32 | 0.7-3.5 | Araya (2016) |
| Bagazo | 39.01-55.2 | 23.0-25.3 | 27.08-16.8 | - | Araya (2016), Carroll y Somerville (2009) |
| Fibras de musa | |||||
| Banana | 63-64 | 5 | 19 | 0 | Maurat (2014) |
| Fibra textil | |||||
| Algodón | 85-90 | 0 | 5.7 | - | Wang et ai. (2017), Soni et al. (2015) |
| Fique | 61-73 | 5-14 | - | - | Ramírez y Muños (2106) |
| Fibras de madera | |||||
| Coníferas | 40-45 | 26-34 | - | - | Peñaranda et al. (2017) |
| Frondosas | 38-49 | 23-30 | - | - | Peñaranda et al. (2017) |
| Bambú | 40-55 | 15-32.2 | 18-20.8 | - | Zakikhani et al. (2014), Nechyporchuk et al. (2016), Wang et al. (2008) |
| Otras sp.veg | |||||
| Esparto | 35.4 | 14.9 | 28.5 | - | Valadez-Gonzalez et al. (1999), Hattallia et al. (2002), Hoareau et al. (2004) |
| Palma de aceite | 65 | 29 | - | - | Haafiz et al. (2013) |
| Piña | 81 | 12.7 | - | - | Valadez-Gonzalez et al. (1999), Hattallia et al. (2002), Hoareau et al. (2004) |
| Cáñamo | 68 | 10 | 15 | - | Valadez-Gonzalez et al. (1999), Hattallia et al. (2002), Hoareau et al. (2004) |
| Lino | 71 | 2.2 | 18.6-20.6 | Valadez-Gonzalez et al. (1999), Hattallia et al. (2002), Hoareau et al. (2004) | |
| Fibras de coco | 28.72 | 40.25 | 10.56 | An et al. (2020) | |
| Eucalipto | 48.07 | 26.9 | 16.76 | Carroll y Somerville (2009) | |
| Álamo | 48.9 | 27.7 | 17.3 | Carroll y Somerville (2009) | |
| Biomasas en base seca | |||||
| Cáscara de cacahuate | 32.8 | 38.93 | 5.07 | - | Sánchez (2015) |
| Cascarilla de soya | 49.52 | 4.97 | 13.76 | - | Sánchez (2015) |
| Residuo de cartón | 44.52 | 23.36 | 2.46 | - | Sánchez (2015) |
| Residuo de maíz | 37.6-12.68 | 18.5-1.31 | 22.6-9.09 | - | Sánchez (2015), Carroll y Somerville (2009) |
Fuente: Elaboración de los autores a partir de las referencias señaladas.
En teoría, según fuentes bibliográficas como Santos y Silva (2019), casi cualquier planta o residuo con características fibrosas pueden ser utilizadas para la producción de fibras de origen no maderero, pero son tres los tipos de fibras mayormente utilizadas; fibras originarias de plantas anuales: lino, yute y abacá; residuos agrícolas: cascarilla de arroz, paja de trigo, maíz, bagazo de caña y sisal; residuos procedentes de hierba silvestre como pastos. Pero según Cury et al. (2017), la mayor disponibilidad de fibras naturales se encuentra en residuos agroindustriales como paja de cereales, tallos de maíz, sorgo y caña de azúcar.
Por lo anterior, resulta evidente que la celulosa es el principal componente de las paredes celulares de los árboles y las plantas. Es una fibra vegetal similar a un cabello humano, cuya longitud y espesor varía según el tipo de árbol o planta, como el algodón, el lino, el sisal y las hojas de piña, entre muchos otros. También es conocida como un polímero natural, generado por el proceso de fotosíntesis. Un método no convencional (ASAM) para su obtención consiste en la aplicación de un pretratamiento mecánico (desmedulado), prehidrólisis ácida H2SO4 al 0.5%, seguido de la solución ASAM (sosa-antraquinona-metanol, 0.1%:20%:20%) y finalmente blanqueamiento. Diámetros promedio (2.83 ± 0.78 μm), para celulosa a partir de coronas de piña, según Ramírez et al. (2018).
Tipos de nanocelulosas
La nanocelulosa se puede describir como un material de celulosa, que tiene al menos una de sus dimensiones en un rango nano (10-9m = 1nm) (Ramírez et al. 2018; Asim, 2018) y se conoce comúnmente en varias terminologías como cristalitos, nanocristales, whiskers de celulosa, nanofibrillas y nanofibras (Charreau et al., 2013).
La celulosa se clasifica en cuatro tipos diferentes de polimorfos, celulosa I, II, III y IV (Mishra et al., 2018). Es un polímero sostenible, renovable, no tóxico, biocompatible, rentable y biodegradable (Ghanbarian et al., 2017). En su forma de tamaño nanométrico, posee propiedades químicas y físicas únicas, tales como una gran superficie, alta resistencia, grupos hidroxilo ricos para modificación, rigidez y estabilidad (Li et al., 2017).
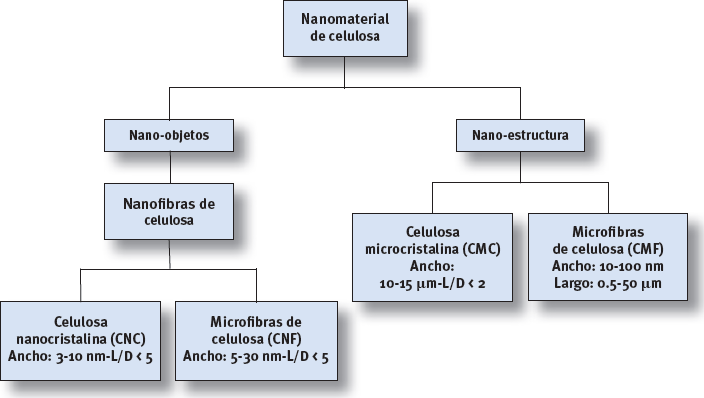
Diferentes terminologías se han ido utilizando a lo largo del tiempo para los diferentes tipos de NC, pero en el año 2011 la Asociación Técnica de la Pulpa y de la Industria del Papel (TAPPI) propuso unos términos estándares y sus respectivas definiciones para celulosa nanométrica. Se puede observar la clasificación efectuada por la TAPPI en la Figura 1.
Celulosa tipo I. Se conoce como celulosa nativa pues se la localiza en la naturaleza, esta celulosa es una especie de mezcla entre celulosas que se encuentran en algas y bacterias y de las celulosas encontradas en plantas (Sun, 2010).
Celulosa tipo II. Se obtiene por medio del sometimiento de la celulosa de primer tipo a un tratamiento con hidróxido de sodio acuoso. La diferencia entre el primer y segundo tipo de celulosa radica en la manera como están organizados sus átomos ya que el segundo tipo de celulosa posee sus átomos dispuestos en forma antiparalela contrario al primer tipo de celulosa en la cual los átomos se encuentran dispuestos en forma paralela (Aulin et al., 2009).
Celulosa tipo III. Nace del sometimiento de la celulosa ya sea del primer o segundo tipo a la acción del amoniaco líquido o de algún tipo de amina.
Celulosa tipo IV. Para la obtención del cuarto tipo de celulosa se debe tratar la celulosa con glicerol a elevadas temperaturas (O’Sullivan, 1997).
La nanocelulosa se obtiene a partir de fuentes renovables como son los residuos agroindustriales es un material que por el aspecto y rigidez que posee ha sido objeto de estudio para la elaboración de nanocompuestos cuyas propiedades mecánicas han mejorado con respecto al material original. Esta nanocelulosa se obtiene principalmente por dos medios el primero es mediante hidrólisis ácida de la celulosa para lo cual, en general se utiliza un tipo de ácido fuerte como el ácido sulfúrico (H2SO4), el segundo medio de obtención es a través de la utilización de bacterias, para este último método se utilizan enzimas para realizar hidrólisis enzimáticas (Nascimento et al, 2018).
La nanocelulosa se ha utilizado para elaborar materiales de singulares características, este nanocompuesto puede ser utilizado como refuerzo mecánico, y también como espesante, actúa como estabilizador en emulsiones, se presenta en forma de hidrogel y aerogel, en la industria farmacéutica y automotriz (Abitbol et al., 2016).
Descomposición de celulosa a nanocelulosa
La microfibra de celulosa está constituida de una parte amorfa y otra cristalina estas están distribuidas de forma aleatoria en la estructura de la microfibra, la región amorfa de la microfibra se encuentra en desorden dentro de la estructura por esta razón es de fácil rompimiento ante un ataque con ácido o enzimas, la región cristalina se encuentra muy cohesionada por enlaces de puentes de hidrógeno, por lo que su separación se torna más compleja. Uno de los mecanismos más utilizados para la obtención de la nanocelulosa es la oxidación de la celulosa mediante hidrólisis ácida que consiste básicamente en romper los enlaces glicosídicos de la misma. A menudo la hidrólisis ácida se lleva a cabo empleando ácido mineral, el más común el H2SO4 (50-72%). La pureza de la nanocelulosa obtenida depende en gran medida del tipo de ácido empleado para su obtención, del tiempo de reacción, la procedencia de la celulosa empleada para realizar la reacción y de la temperatura que se emplee para llevar a cabo la hidrólisis ácida (Lee et al., 2014).
Cuando se lleva a cabo la hidrólisis ácida de la celulosa, además del rompimiento de las regiones amorfas y cristalinas se genera un proceso de esterificación por parte de los grupos hidroxilos con el ácido sulfúrico (H2SO4) lo cual conlleva a la producción de sulfato de celulosa causando una sobrecarga negativa en la superficie de los nanocristales. El control omniótico de las fuerzas interpelantes de las capas electrónicas es el medio por el cual las suspensiones coloides de los cristales llegan a estabilizarse. No obstante, la nanocelulosa obtenida puede sufrir modificaciones químicas por el grupo de ésteres de sulfato con lo que su funcionalidad podría sufrir alteraciones (Brinchi et al., 2013).
Morfológicamente, la nanocelulosa muestra una gran diversidad desde estructuras en forma de varilla hasta estructuras en forma de cinta con un ancho que varía de 3 a 50 nm y una longitud que varía de 50 a 1000 nm (10-9m = 1nm). Esta diversidad morfológica de la nanocelulosa se debe a la diferencia en sus fuentes celulósicas y métodos de preparación (Nechyporchuk et al., 2016; Kaushik y Moores, 2016; Habibi, 2014; Deepa et al., 2011). Hay métodos que se utilizan con frecuencia para la preparación de nanocelulosa a partir de biomasa celulósica. Hay los que realizan la simplificación de los materiales celulósicos complejos, mediante pretratamientos químicos seguidos del tratamiento mecánico se conocen como “enfoque de arriba hacia abajo” (top down approach). Estos han sido los más importantes métodos de preparación de nanocelulosa a partir de complejos lignocelulósicos y han sido muy explotados (Malucelli et al., 2017; Bettaieb et al., 2015; Chirayil et al., 2014).
En la Figura 2 se muestran las imágenes tomadas al microscopio electrónico, con diferentes tamaños y formas de nanocelulosa, obtenidos después de haber procesados muestras de cáscara de arroz y paja de arroz, mediante procesos químicos y mecánicos.

Fuente: Muñoz (2018).
Figura 2 Imágenes al microscopio electrónico que muestran las diferencias estructurales de tipos de nanocelulosa obtenidas, con tratamientos químico-mecánicos. Distribución de tamaño de la nanocelulosa producida a partir de cáscara de arroz y paja de arroz, con promedio entre 30-35 nm.
Obtención de nanopartículas de celulosa
Según Li et al. (2013), la obtención de nanopartículas de celulosa se clasifica en dos categorías generales: top-botton y botton-up. La primera se obtiene de diferentes fuentes e incluye métodos mecánicos y/o métodos químicos y bioquímicos. En la segunda se ensamblan las nanoestructuras de celulosa desde las moléculas de celulosa y utiliza procesos de biosíntesis. Los procesos y métodos de producción de nanopartículas de celulosa que son utilizados hoy en día son mecánicos, biológicos y químicos, así como una combinación de estos (Kim et al., 2013).
Procedimientos mecánicos
Los procesos mecánicos para la producción de nanopartículas de celulosa se pueden dividir en refinación y homogeneización a alta presión, molienda, trituración a bajas temperaturas (cryocrushing) y ultrasonido (Abdul et al., 2012).
a) Proceso de obtención de la celulosa por refinación. En la refinación, la suspensión de fibras diluidas se hace pasar por un hueco entre el extractor y un motor de discos equipados con ranuras y barras, en la cual la pulpa se expone a tensiones cíclicas secuenciales. Este proceso mecánico puede causar alteraciones irreversibles en las fibras celulósicas e incrementar sus potenciales de unión (Nakagaito y Yano, 2004).
b) La homogeneización a alta presión. Este proceso se basa en pasar la suspensión de celulosa a alta presión en un recipiente a través de una pequeña boquilla; la alta velocidad, la presión, así como el impacto y las fuerzas de cizallamiento en el fluido disminuyen el tamaño de las fibras a tamaño nanométrico (Frone et al., 2011). Este proceso se considera eficiente para la refinación de fibras celulósicas y simple, por el hecho de no utilizar disolventes orgánicos (Keerati y Corredig, 2009). Cuando la suspensión de fibras de las pulpas celulósicas es homogeneizada, el procedimiento se repite varias veces para incrementar el grado de fibrilación aumentando la demanda de energía, pudiendo alcanzar 30,000 kWh/t (Siró y Plackett, 2010).
c) Producción de nanocelulosa por molienda. Otra forma de producción de celulosa en tamaño nanométrico es por molienda. En equipos de molienda, existe una piedra estática y otra afilada rotando (~1500 rpm) y la pasta de pulpa pasa entre estas dos piedras. Este procedimiento rompe los enlaces de hidrógeno por la fuerza de corte e individualiza las fibras a escala nanométrica. La molienda utiliza mucha energía y la relación entre consumo de energía y tiempo de fibrilación es una función de la cristalinidad (Abdul et al., 2012).
d) Trituración a bajas temperaturas (cryocrushing). Este método (ultracongelación) consiste en que las fibras celulósicas hinchadas se sumergen en nitrógeno líquido y posteriormente se trituran con mortero y navaja (Frone et al., 2011). Al aplicar fuerzas de alto impacto a la fibra celulósica congelada se rompe la pared celular por la presión ejercida por los cristales de hielo, liberando las microfibrillas (Wang y Sain, 2007). Es un método raramente usado (Lavoine et al., 2012), ya que las fibras trituradas a bajas temperaturas se dispersan en agua usando un desintegrador (Janardhnan y Sain, 2007). Durante el proceso de ultrasonido las moléculas absorben energía ultrasónica y se produce una fuerte oscilación mecánica con olas de alta intensidad que consisten en la formación, expansión e implosión de burbujas microscópicas de gas que aísla las fibras de celulosa (Abdul et al., 2012). Este procedimiento induce cambios estructurales en la biomasa dependiendo de la energía del ultrasonido y la duración del mismo, además de ser un proceso intensivo de energía (Rehman et al., 2013), ya que el ultrasonido puede ejercer presión extrema y variaciones de temperatura (Wang et al., 2012).
Según Henriksson et al., (2007), los métodos mecánicos tienden a dañar la estructura de la celulosa al reducir la masa molar y el grado de cristalinidad, además de desintegrar parcialmente la fibra siendo un método no efectivo al no alcanzar la escala nanométrica. El mayor obstáculo de estos procedimientos de obtención de nanopartículas de celulosa es el alto consumo de energía, que normalmente implica valores entre 20,000 y 30,000 kWh/ton (Siró y Plackett, 2010), además de disminur el rendimiento y longitud de las nanopartículas de celulosa (Abdul et al., 2012).
Procedimientos biológicos
La hidrólisis enzimática se ha utilizado para la producción de nanopartículas de celulosa con un bajo consumo de energía (Paakko et al., 2007). Este procedimiento tiene como resultado nanofibras cristalinas enlazadas con la fase amorfa (De Campos et al., 2013). Muchos estudios se realizan en pulpas blanqueadas y se hidrolizan con enzimas; siendo las celulasas las más utilizadas. Normalmente los procedimientos biológicos se combinan con procedimientos mecánicos para incrementar la accesibilidad de las fibras (Rebouillat y Pla, 2013). Los cambios estructurales a escala nanométrica que tienen lugar en la biomasa durante la hidrólisis enzimática tienen un fuerte impacto en la accesibilidad y, por consiguiente, en la digestibilidad de la celulosa por la enzima, ya que el tamaño y la forma en las fibrillas, así como el área de superficie disponible se altera continuamente por la acción de las enzimas (Penttilä et al., 2013).
La Figura 3 muestra, de forma simplificada, los principales procedimientos que permiten la producción de nanocelulosa mediante hidrolisis con enzimas (Ribeiro et al., 2019).
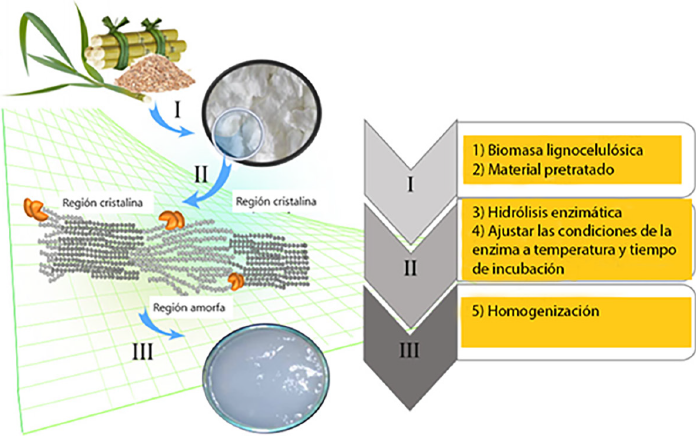
Fuente: Muñoz (2018).
Figura 3 Diagrama de producción de nanocelulosa mediante hidrólisis enzimática.
La primera etapa (I), consiste en el pretratamiento de biomasa lignocelulósica. El objetivo de este pretratamiento aplicado en lignocelulosa es romper la interconexión estructural de su composición. Esta exposición eleva la superficie área de los polímeros y facilita la eficacia del tratamiento enzimático (Kumar et al., 2009). Las principales técnicas aplicadas como pretratamiento son los procesos mecánicos combinados con un proceso de lavado (Henriksson et al. 2007; Teixeira et al. 2015; Camargo et al. 2016).
El segundo paso (II) consiste en la hidrólisis enzimática controlada de muestras de fibra y es el paso principal para la producción de nanocelulosa. En esta fase, el material pretratado se solubiliza en la solución tampón con un cóctel enzimático. El cóctel enzimático tiene la función de romper el polímero de la celulosa en polímeros más pequeños. Las endoglucanasas tienen una relativa actividad moderada, que es adecuada para la hidrólisis de regiones de celulosa amorfa sin hidrólisis completa para la glucosa, pero conservando el dominio de celulosa cristalina en consecuencia (Bhat et al. 1997; Barcelos et al, 2015). El búfer agregado asegura una más constante actividad enzimática. El rango de pH que se utiliza varía de 4 a 7, según la literatura (Song et al, 2104; Henriksson et al. 2007; Tsukamoto et al. 2013; Filson et al. 2009; Camargo et al. 2016; Martelli et al. 2016). Los reactivos se mezclan de forma constante, generalmente a temperatura constante: rango de 45 a 50 ºC. El tiempo de mezcla, puede oscilar entre 1 a 72 h. Esta discrepancia de tiempo probablemente se deba a los diferentes tipos y condiciones de los materiales lignocelulósicos, la mezcla velocidad, los distintos cócteles enzimáticos y el pH, que son presentados en la literatura. Todas estas variaciones dan como resultado diferentes tiempos que permiten hidrolizar el material para obtener nanocelulosa (Lee et al., 2014; Song et al., 2104; Tsukamoto et al., 2013; Filson et al., 2009; Camargo et al., 2016; Martelli et al., 2016).
Finalmente, el tercer paso (III) es el proceso de homogeneización del material tratado enzimáticamente mediante un simple lavado, suspensión, u homogeneización mecánica. Estos procedimientos finales permitir la producción de nanocelulosa con homogeneidad y consistencia (Lee et al., 2014; Henriksson et al., 2007; Tsukamoto et al., 2013; Filson et al., 2009); Martelli et al., 2016).
Procedimientos químicos
El método más ampliamente utilizado y más conocido es la hidrólisis ácida. Este proceso rompe las partes desordenadas y amorfas de la celulosa, liberando solamente cristales bien definidos (Flauzino et al., 2013). Rånby (1951) es considerado el pionero en la producción de suspensiones coloidales de celulosa cristalina mediante hidrólisis ácida controlada con ácido sulfúrico en fibras de celulosa. Las nanopartículas de celulosa producidas con hidrólisis ácida son estructuras de celulosa que se obtienen bajo condiciones controladas de temperatura, agitación y tiempo (Lavoine et al., 2012). Dependiendo de la fuente, las nanopartículas de celulosa tienen una variedad de aspecto (L/d, siendo L la longitud y d el diámetro), y van de 1 a 100 nm (Azizi y Alloin, 2005). Los pasos generales para obtener nanopartículas de celulosa mediante hidrólisis ácida según Brinchi et al. (2013) son los siguientes: 1. Hidrólisis con ácido fuerte al material puro de celulosa controlando estrictamente la temperatura, tiempo, agitación y otras condiciones (naturaleza y concentración del ácido). 2. Dilución con agua para detener la reacción y repetir el lavado con centrifugación. 3. Diálisis con agua destilada para remover todas las moléculas de ácido. 4. Tratamiento mecánico, usualmente sonicación para dispersar las nanopartículas de celulosa como una suspensión estable. 5. Secado de la suspensión para producir nanopartículas de celulosa sólidas.
Dong et al. (1998) fueron de los primeros investigadores en estudiar el efecto de las condiciones de la hidrólisis en las propiedades de las nanopartículas obtenidas, probando que con tiempos muy grandes se obtienen monocristales pequeños y se incrementa la carga superficial. Beck-Candanedo et al. (2005) explican que el tiempo de reacción es el parámetro más importante a considerar en la hidrólisis ácida, se indicó que los tiempos de reacción demasiado largos pueden digerir completamente la celulosa produciendo moléculas de azúcar; por el contrario, lo tiempos de reacción cortos producen grandes fibras no dispersadas y agregados. La hidrólisis ácida puede llevarse a cabo con ácidos fuertes, como H2SO4 y HCl, a temperaturas no tan elevadas; obteniendo nanopartículas de celulosa con una baja capacidad de resistir temperaturas muy altas (Rosa et al., 2010). En 1998, Araki et al. (1998) compararon el efecto de usar ácido sulfúrico o ácido clorhídrico para producir suspensiones estables de nanocristales de celulosa. Explicaron que el ácido sulfúrico proporciona suspensiones acuosas más estables que el ácido clorhídrico. Angellier et al. (2005) informaron que el ácido sulfúrico no solo reduce la posibilidad de aglomeración de nanocristales, sino también limita su floculación en medio acuoso. En 2006, Bondeson et al. (2006) estudiaron las condiciones óptimas de la hidrólisis ácida y determinaron que con una concentración de 63.5% (w/w) de ácido sulfúrico y un tiempo de reacción de 130 min, se produce celulosa microcristalina con una longitud de 200 a 400 nm, un ancho no mayor a 10 nm y un rendimiento mayor al 30% del peso inicial. Wang et al. (2012) mencionan que el utilizar ácido sulfúrico fuerte, aproximadamente 64% (w/w) produce suspensiones estables de nanopartículas de celulosa, reduce el tiempo de reacción a un par de horas a temperaturas entre 45-50 ºC, teniendo un rendimiento mayor a 47%. Utilizar ácido concentrado fuerte como el sulfúrico tiene grandes inconvenientes como ser extremadamente corrosivo y oxidante, y peligroso para el personal que lo maneja y el medio ambiente (Brinchi et al. 2013). Durante la hidrólisis ácida hay un grado de injerto del grupo sulfato sobre la superficie de las nanopartículas de celulosa (Revol et al. 1992), que compromete la termoestabilidad de las mismas (Roman y Winter, 2004), Brinchi et al. 2013), señalaron que es necesario una procedimiento fiable para la producción de nanopartículas de celulosa con tamaño uniforme mediante hidrólisis ácida; además, se ha reportado el uso de pasos adicionales (filtración, centrifugación diferencial o ultracentrifugación) para reducir la polidispersión de las nanopartículas. Abraham et al., (2011) encontraron evidencia de que la hidrólisis ácida genera residuos tóxicos, al contener azúcares en forma monomérica y oligomérica con ácido sulfúrico residual; asimismo, el costo del proceso es elevado debido a que el equipo utilizado debe ser resistente a la corrosión.
Se ha propuesto un nuevo proceso para obtener nanopartículas de celulosa basado en la reacción TEMPO (Siqueira et al., 2010). Saito et al. (2006) introdujeron la oxidación de celulosa aplicando 2,2,6,6-tetrametilpiperidina-1-oxyl (TEMPO). Este método explica que los materiales celulósicos crudos se procesan mediante unas tijeras químicas nanométricas para obtener celulosa microfibrilada (Brichi et al., 2013). El principio básico de este método consiste en la oxidación de las fibras de celulosa por NaClO en presencia del catalizador TEMPO y NaBr a pH 10 - 11 a temperatura ambiente (Lavoine et al., 2012). Este método deja accesibles los hidroxilos primarios en la superficie de las fibras y se oxidan a grupos aldehídos que se oxidan a grupos carboxilos con carga negativa (Abdul et al., 2014); como resultado, las nanofibrillas dentro de las fibras se desenrollan por la agitación mecánica y por las fuerzas repulsivas entre los carboxilatos ionizados y los puentes de hidrógeno (Eichhorn et al., 2010). Entre mayor cantidad de NaClO, mayor cantidad de grupos carboxilados se forman en la superficie, por lo tanto, el tiempo de oxidación aumenta y decrece la longitud de las nanofibrillas obtenidas (Kalia et al., 2014). Normalmente, el procedimiento de oxidación TEMPO es seguido por tratamiento mecánico para eliminar la celulosa microfibrillada incompleta (Kalia et al., 2014). Se ha encontrado que este sistema de oxidación permite tener una distribución uniforme de nanofibrillas (≈5 nm de ancho) y materiales libres de grupos aldehídos (Siró y Plackett, 2010). Los rendimientos no han sido reportados para la oxidación de las regiones amorfas que se hidrolizan para formar suspensiones dispersas acuosas, además se debe considerar que TEMPO es una sustancia cara y tóxica (Brinchi et al., 2013). Se considera que al utilizar TEMPO baja drásticamente la acción mecánica para producir nanopartículas de celulosa, sin embargo, el utilizar el TEMPO aumenta el costo del proceso (Moon et al., 2011).
Procedimientos combinados
En la explosión de vapor (steam explosion), se lleva a alta presión la muestra para después seguir una rápida descompresión. Para Sonia y Dasan (2013), la explosión de vapor es una alternativa para la producción de nanopartículas de celulosa. Según Cherian et al. (2010) este proceso combina las acciones mecánicas y químicas causando cambios físicos y químicos en el material lignocelulósico, que incluye la formación de fibras individuales y una despolimerización parcial de la hemicelulosa y lignina. La explosión de vapor es un método eficiente para separar las nanofibras de la biomasa lingocelulósica (Cherian et al. 2010; Naik et al. 2010) y producir nanopartículas de celulosa con alta pureza y cristalinidad. La explosión de vapor fue introducida por Mason en 1927 para desfibrilar la madera en la producción de cartón (Vignon et al., 1995). Marchessault et al. (1991) mencionan que la explosión de vapor es un proceso de autohidrólisis; los efectos de este proceso en la biomasa son: 1) la separación de enlaces glicosídicos accesibles. 2) la separación de los vínculos β-éter de la lignina. 3) la separación de enlaces complejos de lignina en carbohidratos. 4. Modificación química de lignina y los carbohidratos (Deepa et al., 2011). En este proceso la biomasa se corta y se lleva a alta presión por un corto tiempo (20’’ s a 20’ min) a una temperatura de 200-270 ºC y presiones de 14-16 bar. La presión cae rápidamente, hasta llegar a la presión atmosférica que causa la explosión y rompe la estructura lignocelulósica (Brinchi et al., 2013). Se ha encontrado que acoplar ácido a la explosión de vapor ayuda a desintegrar más las fibras (Cherian et al. 2010). Las ventajas de este procedimiento incluyen un impacto ambiental menor, baja energía, bajo costo de inversión y el uso de sustancias menos peligrosas.
Este proceso debe repetirse varias veces hasta que se libere la celulosa microfibrillada (Kalia et al., 2014). Keijsers et al. (2013) mencionan que la principal desventaja de la explosión de vapor es que no ha sido posible llevarlo a gran escala y los residuos generados (biomasa comprimida) ocupan un volumen considerable en los desechos. El método de irradiación por microondas para la producción de nanopartículas ha ganado popularidad en los últimos años debido a su velocidad o rapidez, porque no es necesario aplicar alta presión ni utilizar soluciones tóxicas (Hou et al., 2008) y permite repetir las condiciones del proceso (Kos et al., 2014). La técnica de irradiación con microondas produce nanopartículas con una muy baja dispersión de tamaño, aunque no siempre se logre un control preciso en la morfología; asimismo, utilizar muestras líquidas permite la disminución de las fluctuaciones de temperatura en el medio de reacción, proporcionando, así, un entorno más homogéneo (Zanella, 2012). El uso de este método permite repetir las condiciones del proceso. Los métodos de calentamiento por microondas pueden proporcionar una plataforma escalable a nivel industrial (Gerbec et al., 2005).
Se ha encontrado que los productos de celulosa obtenidos por microondas son similares a los obtenidos térmicamente (Allan et al., 1980). Como ejemplos recientes: Lu et al. (2013) obtuvieron nanopartículas de celulosa de papel filtro con un ancho menor a 100 nm mediante hidrólisis ácida y la aplicación simultánea de ultrasonido y microondas (SUMAT) encontrando que el efecto sinérgico del ultrasonido y las microondas intensifica la hidrólisis ácida y mejora la producción de fragmentos de celulosa nanométrica provenientes del papel filtro; Kos et al. (2014) produjeron a partir de microcelulosa cristalina comercial nanopartículas de celulosa con diámetros de 126 a 1310 nm mediante hidrólisis ácida asistida por microondas en 10 minutos observando que al aumentar la temperatura disminuye el rendimiento de producción y es repetible. Utilizar irradiación por microondas para la obtención de nanopartículas es atractivo al ofrecer una mayor eficiencia de calentamiento en comparación con las anteriores técnicas (Wan et al., 2011). Guiotoku et al. (2009) mencionan que la ventaja principal de las microondas es que producen un calor selectivo, rápido y homogéneo que reduce el tiempo de procesamiento y los costos; las microondas inducen calor a nivel molecular mediante la conversión directa de energía electromagnética (Lu et al., 2013). Este tipo de calentamiento uniforme en la solución permite un control del tamaño de nanopartículas en la síntesis (Yin et al., 2004). La energía de microondas es una forma de energía electromagnética con un rango de frecuencia de 300 MHz a 300 GHz (Oghbaei et al., 2010), siendo el rango más efectivo para el calentamiento de la materia prima de 0.915 a 2.45 GHz (Leonelli et al., 2010). El calor por microondas es el resultado de la absorción de la energía de microondas por el material expuesto al campo electromagnético (Clark et al., 2000). La eficiencia de los procesos de irradiación de microondas depende de la naturaleza del material, en términos de su forma física. El método de irradiación de microondas involucra al residuo agroindustrial en un ambiente acuoso (Kappe et al., 2004).
Tabil y Kashaninejad (2011) indicaron que el rango de trabajo para una hidrólisis asistida por microondas va de 250 hasta 1000 W con 2450 MHz de potencia. Igualmente, Wu et al. (2010) mencionan que la irradiación de microondas para acelerar reacciones orgánicas ha ganado interés debido a ser un proceso benigno para el medio ambiente. Se ha reportado el efecto benéfico y sinérgico de las microondas en la hidrólisis de celulosa en presencia de ácidos (Fan et al., 2013), así como líquidos iónicos (Ha et al., 2011) y con ultrasonido (Leonelli et al., 2010). Budarin et al. (2010) encontraron que la irradiación por microondas tiene un efecto dramático en la descomposición de celulosa, al observar que después de 180 ºC se produjeron cenizas con una fracción líquida aceitosa; además Fan et al. (2013), señalaron que la temperatura máxima en un método asistido por microondas no debe ser 180 ºC debido a la generación de gases, como CO2, y al aumento de celulosa amorfa inducida por la despolimerización de la celulosa cristalina. Wang et al. (2012) indicaron que la cantidad de nanopartículas generadas disminuye al aumentar el tiempo de irradiación; esto se debe a que las moléculas dipolares como el agua rotan vigorosamente haciendo colisionar las nanopartículas favoreciendo la formación de micropartículas. En 2011, Singh et al. (2012) advirtieron que el tiempo de procesamiento de celulosa utilizando un calentamiento térmico en baño de agua es de 10 h, siendo mucho mayor a los 8 min requeridos por un método de irradiación por microondas con potencia de 360 W. Utilizando la pulpa de yuca, Hermiati et al. (2012) realizaron hidrólisis ácida asistida por microondas tomándole solo unos pocos minutos (5-10 min), mientras que los procesos convencionales como hidrólisis ácida duraron 90’ min y entre 48 a 72 h para hidrólisis enzimática.
Se han señalado algunas ventajas y desventajas cuando se aplican los diferentes métodos para obtener nanocelulosa los cuales pueden ser resumidos en la Tabla 2:
Tabla 2 Resumen de las ventajas y desventajas de algunos métodos aplicados para la obtención de la nanocelulosa según Tshikovhi et al. (2020).
| Método | Ventajas | Desventajas | Referencias* |
|---|---|---|---|
| Hidrólisis ácida | Alta cristalinidad. | Durante el lavado se derrochan grandes cantidades de aguas ácidas. | Nechyporchuk y Belgacem (2016) |
|
Desintegración mecánica |
Alta pureza. | Alto consumo energético, bajo grado de polimerización y cristalinidad. | Mondal (2017) |
| Bacterias aerobias | Gran pureza y alta cristalinidad. | Bajo rendimiento y lento. | Sharma et al. (2019) |
| Hidrólisis enzimática | Es un proceso respetuoso con el medio ambiente, menor consumo energético, no utiliza productos químicos tóxicos. | Lleva un mayor tiempo de preparación. | Khalil et al. (2104) |
| Electro hilado | Es versátil y sencillo. | Tiende a aglomerarse y con solubilidad limitada. | Nechyporchuk y Belgacem (2016) |
| Homogeneización | Tiene alta eficiencia, sencillez y sin disolventes orgánicos. | Pero produce obstrucción del sistema, disminuye la estabilidad térmica y cristalinidad, daños mecánicos y alto consumo de energía. | Kargarzadeh et al. (2017) |
| Molienda | No se necesitan tratamientos previos adicionales, es rápido. | Debe tenerse en cuenta el mantenimiento y reemplazo de piedra de disco. | Nechyporchuk y Belgacem (2016) |
| Refinado | Aumenta la superficie y el volumen de las fibras. | Disminuye la longitud y cristalinidad de las fibras. | Khalil et al. (2104) Kalia et al. (2014) |
| Ultrasonidos | Produce alta cristalinidad. Equipos económicos. |
Hay agregación, y alto consumo energético. | Phanthong et al. (2018) Rahimi et al. (2016) |
Fuente: Elaboración de los autores a partir de las referencias señaladas.
Los métodos aplicados, como la hidrólisis ácida, tienen como ventajas una alta cristalinidad, al romper la estructura rígida de un componente lignocelulósico. Pero en los procesos de lavados se derrochan grandes cantidades de aguas ácidas que contaminan el medio. Cuando se aplica la desintegración mecánica, se logra una alta pureza, pero con un alto consumo energético, bajo grado de polimerización y cristalinidad. Cuando usamos bacterias aerobias, se logra gran pureza y alta cristalinidad, pero con bajo rendimiento y lento. El empleo de hidrólisis enzimática, se considerada un proceso respetuoso con el medio ambiente y con menor consumo energético, además de que no utiliza productos químicos tóxicos. Sin embrago, debe tenerse en cuenta que lleva un mayor tiempo de preparación. El proceso mediante electro hilado es versátil y sencillo, pero tiende a aglomerarse y con solubilidad limitada. La homogeneización tiene alta eficiencia, sencillez y sin disolventes orgánicos. Pero producen obstrucción del sistema, disminuye la estabilidad térmica y cristalinidad, daños mecánicos y alto consumo de energía. Cuando se usa el proceso de molienda, no se necesitan tratamientos previos adicionales, es un método más rápido, sin embargo, debe tenerse en cuenta el mantenimiento y reemplazo de piedra de disco. El refinado, aumenta la superficie y el volumen de las fibras, pero disminuye la longitud y cristalinidad de las fibras. El procedimiento de ultrasonidos produce alta cristalinidad, pero hay agregación, y alto consumo energético. En el proceso de molienda de bolas, se presentan equipos económicos, temperatura y presión, pero se tiene un consumo energético alto, con disminución de la cristalinidad, tamaño y morfología.
Delignificación de las fuentes de celulosa o purificación de la celulosa
Antes de realizar la hidrólisis ácida de la celulosa para obtener la nanocelulosa, se procede con un pretratamiento a las fuentes de celulosa para la eliminación de la lignina principalmente. Este se realiza mediante los siguientes métodos.
Método Kraft
Los métodos más utilizados para la obtención de celulosa consisten en procesos químicos, comúnmente se realizan por medio de la separación de las fibras celulósicas mediante la disolución de la lignina. Cuando el reactivo usado es un álcali, se denomina proceso alcalino y cuando además del álcali se agrega Na2S para aumentar la velocidad de delignificación, se denomina proceso Kraft (Rodríguez, 2016). En este proceso, la delignificación se lleva hasta el punto de liberación de la fibra, en donde estas son separadas con muy poca energía mecánica. La delignificación se produce en fase heterogénea: la lignina presente en la materia celulósica (fase sólida) reacciona con el álcali disuelto (fase líquida), se rompe y pasa a la fase líquida. La materia prima celulósica delignificada origina la celulosa. La velocidad de delignificación varía con la temperatura (Singh et al., 1980).
Hidrólisis básica
De la hidrólisis básica o alcalina, no se tienen tantos estudios como de la hidrólisis ácida. La hidrólisis básica se aplica con éxito a la celulosa antes del tratamiento previo. Las principales soluciones alcalinas utilizadas son: hidróxido de sodio (NaOH), hidróxido de potasio (KOH) e hidróxido de calcio (CaOH), y se observa una deslignificación con alteraciónes químicas de la lignina, originándose compuestos fenólicos como la valina o siringaldehido (Thaherzadeh y Karimi, 2008). Por lo general se utilizan proporciones a una concentración que varía entre 0 y 5% para poder remover la lignina que cubre la celulosa y la hemicelulosa a 45 ºC durante un tiempo de 24 h y agitación constante (Meléndez et al., 2017). Se basa en la saponificación de los enlaces esteres intramoleculares que hay entre los xilanos de la hemicelulosa y otros compuestos, como las ligninas (Sun et al., 2002).
Hidrólisis ácida
La hidrólisis ácida es el proceso principal que se usa para producir celulosa nanocristalina, en el que se utilizan generalmente ácido sulfúrico (H2SO4) y después el ácido clorhídrico (HCl) pero también se ha empleado ácido fosfórico (H3PO4) y bromhídrico (HBr). Las regiones amorfas en las cadenas de celulosa son más susceptibles a la hidrólisis ácida, en estas secciones se facilita la ruptura de los enlaces glucosídicos, liberando los cristales individuales. Cuando la hidrólisis se realiza con H2SO4, los grupos sulfato cargados negativamente son introducidos en la superficie de los cristales evitando la aglomeración, lo que resulta en una suspensión más estable de nanocelulosa cristalina (NCC). La purificación de las suspensiones se consigue por ciclos de separación por centrifugación y redispersando el precipitado en agua (Carchi, 2014; Urena, 2011).
Las condiciones de hidrólisis afectan el tamaño y la distribución de las partículas de manera que a mayor tiempo de hidrólisis y temperatura se obtienen menores tamaños. Se ha reportado que las partículas de celulosa en forma de varilla adquiridas de diferentes fuentes a través de la hidrólisis ácida son, básicamente, con un diámetro de 5 a 20 nm, y una longitud de 100 nm, pero si las condiciones son muy severas los dominios cristalinos pueden ser completamente descompuestos (Xu et al., 2013). Aunque el tratamiento químico no cambie la morfología o cristalinidad de la celulosa, puede reducir la capacidad de refuerzo debido a una disminución en los enlaces de hidrógeno resultado de la inserción de los grupos químicos.
Oxidación TEMPO
La oxidación catalítica utilizando TEMPO ha abierto un nuevo campo de la química por su conversión eficiente y selectiva de grupos hidroxilo alcohólicos a aldehídos, cetonas y grupos carboxilo en condiciones suaves. En esta experimentación cantidades catalíticas de TEMPO y NaBr se disolvieron en soluciones a pH 10-11, y la oxidación se inició mediante la adición de solución de NaClO como un oxidante primario. Anteriormente, cuando la oxidación TEMPO / NaBr / NaClO se aplicó a celulosas nativas como algodón, pulpas Kraft blanqueadas y celulosa bacteriana, incluso bajo condiciones de oxidación fuertes o para tiempos de reacción prolongados, no se obtuvieron casi ninguna o solo pequeñas cantidades de productos solubles en agua. Tampoco presentaba cambios en su cristalinidad (Akira et al., 2011). Cuando la oxidación TEMPO / NaBr / NaClO a pH 10 y la temperatura ambiente se aplica a las celulosas nativas con la estructura cristalina de la celulosa I, celulosas de madera, pulpa termomecánica de madera blanda, celulosa bacteriana y fibra de ramio, las morfologías fibrosas se mantienen intactas incluso después de la oxidación con cantidades suficientes de reactivos (Tabla 3).
Tabla 3 Morfología, rendimiento, índice de cristalinidad (CI), estabilidad térmica (TG) y aplicaciones de la nanocelulosa producida a partir de diferentes materias primas.
| Residuos | Método de obtención | Morfología | Yield (%) | CI (%) | TG (C) | Aplicaciones actuales sugeridas |
Costo estimado |
Referencias |
|---|---|---|---|---|---|---|---|---|
| Paja de trigo | Químico-mecánica. | Diámetro: 8 a 76 nm | 55.6 | 77.8 | 296 | Fabricación de papel, termoplástico a base de almidón, polímero | 2.55 €/kg | Espinosa et al. (2016), Alemdar y Sain (2008) |
| Paja de arroz | Tratamiento alcalino, blanqueo sin cloro e hidrolisis ácida. | Diámetro de 5 a 80 nm y algunos µm de largo | 78.7 | 78 | 345-364 | Materiales avanzados | NG | Jiang et al. (2016), Lu y Hsieh (2012a, 2012b) |
| Cáscara de arroz | Deslignificación alcalina a baja presión (LPAD). | Diámetro de 10 a 50 nm, 550 nm de largo | 32 (aprox.) | 61.6 | NG | NG | NG | Islam et al., (2017ª); Islam et al., (2017b) |
| Paja de maíz | Tratamiento alcalino, blanqueo sin cloro e hidrolisis ácida. | Diámetro de 19 nm | 20 | 75.5 | 360 | NG | NG | Rehman et al. (2014) |
| Cebada | Tratamiento alcalino, blanqueado e hidrólisis ácida. | Diámetro de 10 a 50 nm, 329 ± 123 nm de largo | NG | 66 | 281-357 | Nanocomposites, estructuras nemáticas quirales y películas de barrera | NG | Espino et al. (2014) |
| Paja de centeno | Microfluidización, oxidación TEMPO. | Diámetro de 3 -9.1 nm | 3 | 59-70 | 349-361 | Compuestos de alcohol polivinílico | NG | Sharma et al. (2012) |
| Cáscara de nuez | Químico-Mecánico, hidrólisis ácida y fibrilación. | Diámetro de 3-5 nm | 22-26 | 73 | 361 | NG | NG | Chandra et al. (2016) |
| Paja de soja | Tratamiento enzimático-mecánico. | Diámetro de 15 nm | 6.3-7.5 nm | 68 | 250 | NG | NG | Martelli-Tosi et al. (2016) |
| Bagazo de caña | Pretratamiento con agua caliente líquida e hidrólisis enzimática. | Diámetro de 14-18 nm y largo 193-246 nm | NG | 77-81.7 | 227-279 | NG | NG | Camargo et al. (2016) |
| Bagazo de yuca | Pretratamiento alcalino, tratamiento, blanqueo e hidrólisis ácida. | Diámetro de 2.3-5.4 nm | 29 | 62.1-100 | NG | NG | NG | Leite et al. (2017) |
| Algodón | Química (hidrólisis ácida). | Diámetro de 12 nm y largo 177 nm | NG | 91 | 219 | Nanocompuestos hidróficos | NG | Morais et al. (2013) |
| Cáscara de coco | Química (hidrólisis con ácido sulfúrico). | Diámetro de 5 nm y largo de 177 ± 80-218 ± 99 nm | NG | 62.2-65.9 | 120-330 | Nanocompuestos de agentes reforzantes | NG | Rosa et al. (2010) |
|
Pseudotallo de banano |
Oxidación mediada por TEMPO (2,2,6,6-tetrame- tilpiperidina 1-oxilo). | Diámetro: 7-35 nm, largo algunos mm | NG | 57-69 | 220 | NG | NG | Faradilla et al. (2016) |
| Hojas de piña | Mecánico con (explosión de vapor). | Diámetro: 5-60 nm | NG | 73.62 | NG | Aplicaciones biomédicas y biotecnológicas | NG | Cherian et al. (2010) |
|
Semilla de mango |
Química (hidrólisis ácida con ácido sulfúrico). | Diámetro: 4-59 nm | 22.8 | 90.6 | 248 | NG | NG | Henrique et al. (2013) |
| Cáscara de ajo | Química (hidrólisis ácida con ácido sulfúrico). | Diámetro: 6 nm | 19.6 | 68.8 | 200 | Nanocompuestos | NG | Kallel et al. (2016) |
|
Hojas de Mengkuang (Pandanus tectorius) |
Química (hidrólisis ácida con ácido sulfúrico.) | Diámetro: 5-25 nm, largo 110-300 nm | 28 | 69.5 | 250 | NG | NG | Sheltami et al. (2012) |
|
Residuos de biomasa de palma aceitera |
Químico de hinchamiento. | Diámetro: 20 nm, largo 300 nm | NG | 88 | 329-418 | Compuestos poliméricos | NG | Haafiz et al. (2013) |
|
Corteza de morera |
Tratamiento alcalino e hidrólisis ácida con ácido sulfúrico. | Diámetro: 20-40 nm, largo: 400-500 nm | NG | 73.4 | 228-335 | Compuestos farmacéutica y óptica industrias | NG | Li et al. (2009) |
|
Pecíolos de palma de coco |
Pretratamiento químico y mecánico. | Diámetro: 25-40 nm | NG | 67.2-71.2 | 333-341 | Compuestos | NG | Xu et al. (2015) |
| Cactus | Químico. | Diámetro: 10-15 nm | NG | 50 | 312.5 | Compuestos de alcohol polivinílico | NG | Ramezani Kakroodi et al. (2015) |
|
Fibras de hojas de sisal |
Química (hidrólisis ácida con ácido sulfúrico) | Diámetro: 1.85-9.45 nm, largo: 128.55 ± 20.51-156.75 ± 21.46 nm | NG | 46-73 | 163-295 | NG | NG | Mariano et al. (2016) |
|
La estopa de cáñamo |
Química (radical 2,2,6,6-tetrametilpiperidina-1-oxilo (TEMPO). | Diámetro: 2 nm, largo: algunos nm | 58-65 | NG | 200 | NG | NG | Puangsin et al. (2017) |
| Linaza | Química (hidrólisis ácida). | Diámetro: 85 ± 39 nm, largo: 158 ± 89 nm | NG | NG | NG | Como adhesivo para poros protectores del calor cerámica y un relleno de refuerzo anisotrópico de películas de polímero | NG | Istomin et al. (2016) |
| Kenaf | Químico y mecánico. | Diámetro: 12-34 nm | 58-62.5 | 79.4-81.5 | 357.9-361 | Termoplásticos biodegradables | NG | Karimi et al. (2014) |
| Jute | Químico. | Diámetro: 50 nm, largo: few mm | NG | 62.54-82.22 | 250-400 | Nanocompuesto with natural rubber | NG | Thomas et al. (2015) |
| Ramina | Químico-ultrasónico. | Diámetro: 19 nm, largo: 1 mm | 89.39 | 73.65 | 350 | Biocompuestos | NG | Syafri et al. (2018) |
| Bambú | Mecánico-químico con acción de ácido fosfórico. | Diámetro: 15-30 nm, largo: 100-200 nm | 77.37 | 59.62-66.44 | 240-350 | Compuestos | NG | Lu et al. (2013) |
| Algas rojas | Química (hidrólisis utilizando ácidos orgánicos concentrados. | Diámetro: 21.8± 11.1 nm, largo: 547.3 ± 23.7 nm | 52.1 | 73 | 334 | Nanocompuestos | NG | Chen et al. (2016a, 2016b, 2016c) |
NG: No generados.
Fuente: Kumar et al. (2020).
Comparación de métodos de obtención de nanocelulosa de algunos residuos postcosecha
Nanocelulosa obtenida de estopa de fique (Furcraea macrophylla Baker)
Se realizó un pretratamiento de la estopa de fique para la eliminación de carbonatos y oxalatos de calcio, así como algunos restos del jugo de fique, según lo reportado por (Ovalle et al., 2018). Posteriormente, se deslignificó y blanqueó la estopa utilizando el método del peróxido de hidrógeno alcalino. Para su delignificación, se tomaron 24 g de estopa de fique y se sumergieron en una solución de H2O2 al 10% p/p ajustando el pH a 11.5 mediante la adición de una solución de NaOH. La mezcla se colocó en baño de ultrasonido durante 120 minutos a 70 ºC. Luego, se filtró el producto y se colocó nuevamente en el baño de ultrasonido durante 15 minutos con agua desionizada. Finalmente, se sacó del ultrasonido, se lavó con abundante agua desionizada, se secó a 60 ºC durante 24 h y se almacenó para posteriores ensayos y análisis. Luego, mediante oxidación TEMPO y desintegración mecánica, se realizó la extracción de nanofibras de celulosa.
Nanocelulosa obtenida de residuos de plátano macho (Musa paradisiaca L.)
Se utilizó un proceso adaptado por Abraham, et al. (2011) y Cherian, et al. (2008), consistente en un tratamiento alcalino de fragmentos del pseudotallo, con 2% de hidróxido de sodio por 6 h a una temperatura de 30 ºC. Posteriormente la fibra mercerizada se procesó en una autoclave a una presión de 150 Pa por 1.5 h, a una temperatura de 125 ºC. Más adelante la fibra se blanqueó con clorito de sodio al 1% a 75 ºC por 2 h, a un pH de 4. Para terminar, la celulosa se sometió a una hidrólisis parcial ácida utilizando ácido oxálico al 5% y seguido de un segundo paso en autoclave a 150 Pa por 1.5 h a una temperatura de 125 ºC. Una vez concluido el tratamiento se lavó con agua destilada y se centrifugó a 2500 rpm por 20 min.
Otros como Bolio-López et al. (2011) obtuvieron whiskers a partir de residuos agroindustriales de plátano (Musa cavendish). Este fue secado al sol y tratado con una solución acuosa de NaOH al 10%, con el objetivo de eliminar ceras, pectinas y resinas. Utilizaron fragmentos de una longitud de 30 cm, para que la solución de NaOH al 10% penetrara perfectamente en las muestras y permanecieron en esta solución durante 20 minutos después de alcanzar la temperatura de ebullición. Al ser retirados de la solución, se dejaron enfriar y se lavaron con agua corriente, para después desfibrarlas manualmente. Se cortaron las fibras a 2 cm de largo y se secaron en una estufa a una temperatura de 60 ºC durante 12 h.
La obtención de la celulosa se realizó usando la técnica de pulpeo (Cazaurang et al., 1990), que consta de cuatros pasos.
(1) una hidrólisis ácida suave con H2SO4 al 0.4% por una hora, y un lavado posterior; (2) una cloración con NaClO al 3.5%, con agitación continua de la solución en un baño de agua a 30 ºC hasta alcanzar un pH de 9.2, lavado con agua destilada hasta la neutralidad; (3) una extracción alcalina con NaOH al 20% en agitación por 1 h, seguido por un proceso de lavado; (4) un blanqueo con una solución de NaClO al 0.5%, agitando continuamente por 1 hora y un lavado final hasta pH neutro. Seguidamente, el material se desmenuzó y se colocó en una charola de aluminio durante 1 día a temperatura ambiente y luego en una estufa durante 24 h a 60 ºC. El material se pesó, para determinar el rendimiento y por último, la celulosa se pulverizó por medio de un molino Brabender, con una malla de 0.67 mm.
La obtención de whiskers de celulosa se logró a partir de 10 g de celulosa, se añadieron 350 ml de una solución de HCl 4N, agitando continuamente durante 225 min a una temperatura de 80 ºC. Acto seguido se sometió a lavados repetidos con centrifugación (3800 rpm a 4 ºC por 5 min), hasta alcanzar un pH 4 necesario para obtener un sobrenadante turbio (Araki et al., 1998), el sobrenadante fue colectado para darle un proceso posterior para la obtención de los CW. Después a 150 g de la suspensión obtenida en el paso anterior (0.8 % w/w) se le añadieron lentamente 500 ml de ácido sulfúrico al 64%, en un proceso de sonificación de 5 ciclos de 3 min para hacer un total de 15 min en sonificación y en baño de hielo, para evitar que la temperatura se elevara a más de 50 ºC. Al término de este proceso la suspensión fue diluida en una proporción 1:10, con la finalidad de detener la reacción. La suspensión fue lavada repetidamente con agua destilada y des ionizada, y separada por centrifugación (12,500 rpm por 5 min a 4 ºC), hasta obtener un sobrenadante turbio blanquecino, que fue almacenado para así ser concentrado en un rotavapor, hasta alcanzar una suspensión coloidal. La suspensión fue almacenada en una cama de resina de intercambio iónico por 48 h y filtrada a través de papel filtro (Whatman 541) con tamaño de poro de 0.45 µm y almacenada a 4 ºC (Edgar y Gray, 2003).
Nanocelulosa obtenida a partir de tule (Typha domingensis Pers)
Pulido-Barragán et al. (2016) describieron el proceso de obtención de nanocelulosa a partir de tule (Typha domingensis) en tres partes principales: a) extracción de celulosa de la planta; b) blanqueamiento de celulosa, y, c) hidrólisis ácida.
a) La extracción de la planta tiene como objetivo separar la celulosa de todos los demás componentes del tejido vegetal. Este primer paso se lleva a cabo en un reactor tipo Batch, en el que se debe tener cuidado en el proceso de montaje, purgado de presión y desmontaje del reactor, antes y después de la reacción.
b) El blanqueamiento tiene como objetivo eliminar el color residual que tiene la celulosa, proveniente principalmente de la lignina. Previo al blanqueamiento se realiza un tratamiento en equipo soxhlet con una mezcla tolueno/etanol 2:1 durante 6 h para remover ceras, colorantes e impurezas. Se prepara una solución de NaClO al 1% se somete a agitación continua con una temperatura de 70 ºC durante una hora. Terminado este tiempo se lava y filtra con agua destilada hasta obtener un pH neutro. Al final se seca a 80 ºC. Después se realiza un tratamiento con una solución diluida de HCl 0.5% para remover las hemicelulosas.
c) Este proceso rompe las partes amorfas de las moléculas de celulosa; las partes cristalinas, al tener una mayor resistencia a los ataques ácidos, se mantienen intactas. Se prepara una solución de H2SO4 al 64% en 700 ml. Se toman la celulosa blanqueada y se depositan en la solución de H2SO4 a una temperatura de 45 ºC bajo agitación continua durante 45 minutos. Para detener la reacción, se diluye en 5 L de agua desionizada durante 2 h. Para remover el exceso de agua y ácido, la suspensión se centrifugo a 6000 rpm por 10 min (Kloser et al., 2010). La suspensión se somete a un baño ultrasónico para obtener una completa separación de las fibras.
Nanocelulosa obtenida a partir de coco (Cocos nucifera L.)
En otros estudios se ha empleado la fibra de coco para la producción de nanomateriales, un ejemplo es el estudio realizado por Rosa et al. (2010), en el que se obtuvo celulosa nanocristalina a partir de la fibra de coco, para lo cual dicha fibra fue pretratada con una solución alcalina para eliminar impurezas, y posteriormente cortada y tamizada con una malla del 40, obteniéndose así 100 g de material para disolver en agua destilada con la ayuda de una licuadora. La suspensión de la fibra obtenida se agitó durante 2h a 50 ºC y se filtró, para luego dispersar el residuo en NaOH al 2% con agitación constante, seguido de esto los residuos fueron secados para llevar a cabo la deligininación parcial o blanqueamiento para facilitar la extracción de los nanocristales.
Posteriormente, los nanocristales son obtenidos por hidrólisis ácida al tratar las fibras blanqueadas con una solución de ácido sulfúrico. Después del tratamiento la celulosa hidrolizada fue lavada para separar los cristales de la solución por centrifugación y separada por diálisis hasta obtener un pH constante, con lo cual el precipitado fue dispersado en agua para obtener una suspensión que se caracterizó mediante microscopía electrónica, difracción de rayos X y análisis termogravimétrico, con lo cual los autores concluyeron que para la obtención de nanocristales a partir de fibras de coco, el blanqueamiento menos agresivo es el más recomendable y que la lignina residual puede ayudar con la compatibilidad de este material y las matrices poliméricas hidrofóbicas. De Figueirêdo et al. (2012), conociendo la problemática existente en Brasil en relación con los residuos de coco, analizaron la producción de celulosa nanocristalina a partir de fibras de coco inmaduras, así como de algodón para identificar el impacto ambiental del proceso. En este caso se utilizó la metodología propuesta por Rosa et al. (2010).
Nanocelulosa obtenida a partir de cascarilla de arroz (Oryza sativa L.)
Santos y Silva (2019) han descrito la reducción de tamaño de la cascarilla mediante un secado de la misma en dos tandas, a temperatura de 65 ºC en estufa, 1 h y 15 minutos cada tanda. Una vez seca la cascarilla fue molida y se tamizó para obtener diferentes tamaños de partículas. Primero se purificó la celulosa mediante hidrólisis básica, con soluciones de hidróxido de sodio al 5, 15 y 20%, a partir de 20 gramos de cascarilla con un tiempo de cocción de 90 minutos a 45 ºC. Se realizó el blanqueamiento de la celulosa aplicando una solución de hipoclorito de sodio al 1% (p/p) y se removió hemicelulosas con solución de ácido clorhídrico al 0.65% (p/p). La obtención de nanocelulosa se llevó a cabo mediante la hidrólisis ácida de la celulosa purificada, aplicando ácido sulfúrico al 64% (p/p) de concentración con un tiempo de reacción de 45 minutos y 45 ºC de temperatura, ácido sulfúrico al 60% (p/p) de concentración y tiempo de reacción de 45 minutos y 45 ºC de temperatura, con agitación constante. Una vez transcurrido el tiempo de reacción, se procede a agregar 650 ml de agua destilada a la mezcla para detener la reacción, se dejará sedimentar y se realizará una decantación del líquido sobrenadante, este proceso se repetirá hasta que el tiempo de sedimentación de la mezcla sea mayor, entonces se traslada la mezcla hasta un matraz y se le realizará un baño de ultrasonido a 28 KHz de amplitud para que se logre separar la parte cristalina de la amorfa por completo, observándose en recipiente un sedimento (microfibras) y el sobrenadante (nanocristales de celulosa). Mediante este proceso se confirmó la obtención de nanocristales de celulosa con tamaños que van desde 10 × 5 nm hasta 500 × 100 nm. Además, se llevó a cabo el escalamiento industrial del proceso de obtención de nanocristales de celulosa y se determinaron los indicadores financieros, valorándose una tasa interna de retorno del 13%, lo cual indica que se trata de un proyecto económicamente rentable (Santos y Silva, 2019).
Según An et al. (2020), otro procedimiento fue realizado a partir de celulosa obtenida de biomasa (fibras secas de residuos de arroz), en donde cincuenta gramos de polvo de biomasa , se colocaron en 1000 ml de agua destilada a 100 ºC durante 2 h para eliminar impurezas y sustancias solubles en agua, luego se enfrió a temperatura ambiente y se filtró con papel de filtro, esta etapa se realizó dos veces, y las celulosas finales en masa, se secaron en un horno de aire a 70 ºC durante 8 h. Veinte gramos del polvo de biomasa pretratado, se dispersó en HCOOH 90% (1:10 p/v) a 100 ºC durante 2 h con agitación magnética en sistema de circulación. Luego fue filtrado con papel y lavado el residuo con ácido HCOOH puro y agua destilada tibia para romper los enlaces -O - 4 de la hemicelulosa con la finalidad de eliminarla, así como también, disolver los restos de impurezas. Posteriormente, las muestras pretratadas con ácido fueron disueltas en PFA (mezcla de disolventes de ácido fórmico, peróxido de hidrógeno y agua destilada con una proporción de 90: 4: 6% p/p, respectivamente), se agitaron a 80 ºC durante 2 h, luego se filtró y lavó con ácido fórmico (80%) y agua destilada, respectivamente. La fibra se blanqueó a pH 11, agregando la cantidad requerida de NaOH y H2O2 con fibra a proporción de 1:1 p/p. Los experimentos se llevaron a cabo bajo circulación con agitación magnética a 80 ºC durante 1 h, luego se filtró y enjuagó varias veces para deshacerse de la lignina y las hemicelulosas para finalmente obtener celulosa blanca en suspensión. El blanqueo se realizó dos veces para asegurar que los contenidos adicionales de la cascarilla de arroz fueran eliminados completamente de las fibras de celulosa. La celulosa blanca se hidrolizó utilizando una solución de ácido sulfúrico (64%) con una relación de 1:15 a 45 ºC durante 30 min con fuerte agitación en el sistema de circulación. Para evitar la agregación y sedimentación de partículas debido a la fuerza de unión de Van Der Waals, la suspensión se sonicó, utilizando un procesador ultrasónico de alta intensidad (UP200St, Hielscher) durante 10 min para obtener celulosa cristalina a nanoescala.
De acuerdo con An et al. (2020), se aislaron con éxito nanocristales de celulosa (CNC) de subproductos de cáscara de arroz (RH), con alta cristalinidad (82.8%) y un rendimiento mediano de la síntesis (35-37%). Imágenes en microscopía electrónica de transmisión (TEM) confirmaron que el diámetro de las fibras de nanocelulosa sintetizadas estaba en el rango de 10 a 15 nm. La estabilidad térmica mejorada de las fibras de nanocelulosa las hace adecuados en la fabricación de bionanocompositos para diversas aplicaciones como funcional papel, soporte versátil para la preparación de metal/óxido de metal nanopartículas, filtro de membrana (Islam et al., 2018). Este estudio demuestra que con las dimensiones a nanoescala, las fibras de celulosa aisladas por hidrólisis ácida prometen recursos potenciales para el material nano-natural adecuado para otras aplicaciones de alto valor agregado (optoelectrónica, empaque, compuestos poliméricos reforzados mecánicamente, andamios de tejido, remediación ambiental, entre otros) de desechos agrícolas/subproductos y también contribuyen a prevenir la contaminación ambiental por estas fuentes de biomasa.
Nanocelulosa obtenida a partir de paja de trigo (Triticum aestivum L.)
La producción de nanocelulosa se realizó utilizando tres métodos diferentes; el tratamiento tradicional con ácido sulfúrico, y dos enfoques alternativos que son un tratamiento con ácido clorhídrico y un enzimático. Los tratamientos alternativos tenían como objetivo producir nanopartículas de celulosa y comparar su rendimiento y características entre sí, así como las nanocelulosas producidas tradicionalmente utilizando los residuos ricos en celulosa deslignificados (Regan, 2019).
Hidrólisis con ácido sulfúrico de fibras ricas en celulosa. Las fibras ricas en celulosa obtenidas después del tratamiento de deslignificación alcalina se trataron en una solución de ácido sulfúrico al 64%. El tratamiento se realizó según el procedimiento informado por Liu et al. (2017). Las fibras ricas en celulosa se mezclaron en una proporción de fibra a solución ácida de 1:20 en un matraz de tres bocas a 45 ºC durante 60 min.
La mezcla resultante después del tratamiento se diluyó con 10 partes de agua destilada y se centrifugó a 3000 xg durante 10 minutos. El precipitado producido se dializó con agua destilada durante 3 días. La solución resultante se neutralizó luego con NaOH 0.1 M a pH 5, se dializó durante un día y luego se centrifugó y se secó para obtener las nanopartículas de celulosa.
Hidrólisis con ácido clorhídrico de fibras ricas en celulosa. El tratamiento con ácido clorhídrico se realizó de manera similar a lo realizado por Cheng et al. (2017) con algunos cambios. Se realizó un cribado para determinar la temperatura y el tiempo para usar HCl 4 M. Las fibras ricas en celulosa del tratamiento de deslignificación alcalina se trataron con HCl 4 M en una proporción de fibra a ácido de 1:20 (Cheng et al., 2017) a distintos tiempos y temperaturas con agitación. La mezcla resultante se lavó hasta un pH superior a 5 con agua destilada centrifugando a 3000 xg durante 10 minutos. El precipitado producido se resuspendió en agua destilada y neutralizada con NaOH 0,1 M. La nanopartícula tratada producida se diluyó luego para producir una suspensión de fibra al 2-3%, que se sometió a un homogeneizador de alta velocidad durante 20 minutos. A continuación, la mezcla resultante se liofilizó para obtener la nanopartícula de celulosa.
Tratamiento enzimático de fibras ricas en celulosa. También se realizó un tratamiento enzimático como alternativo al tratamiento con ácido sulfúrico. Las fibras ricas en celulosa obtenidas del tratamiento de deslignificación alcalina se sometieron a una hidrólisis enzimática como ilustra Bester (2018). Primero se determinaron las dosis de enzima, así como el tiempo para producir nanopartículas con la formación mínima de glucosa. Las muestras se trataron a 50 ºC usando una incubadora (MRC Orbital shaker TS600) en diferentes tiempos de tratamiento y dosis de enzima a pH 5. La optimización de la hidrólisis enzimática se realizó usando dosis variables de FiberCare R y Viscozyme L solución de Novozyme así como en tiempo variable.
Nanocelulosa obtenida a partir de caña de azúcar (Saccharum spp)
Cataño (2009) realizó un pretratamiento donde el bagazo se cortó en fibras de 7-10 cm de longitud. Seguidamente las fibras se lavaron con abundante agua destilada y se secaron en un horno a 50 °C hasta obtener un peso constante de estas. Con el objetivo de extraer su contenido graso, se pesaron 2,960 gramos de la fibra seca y se sometieron a un proceso de extracción Soxhlet durante 6 h empleando 240 ml de una solución tolueno-etanol (2:1, v/v) como disolvente. Una vez culminada la extracción, las fibras se lavaron con etanol (para retirar el tolueno remanente) y posteriormente con abundante agua destilada. Finalmente, las fibras fueron filtradas al vacío y posteriormente secadas en un horno a 50 ºC hasta obtener un peso constante.
Tratamiento con ácido acético-ácido nítrico (Sun et al., 2004). Después de llevada a cabo la extracción soxhlet, la fibra se trató con 400 ml de una solución 80% ácido acético-65% ácido nítrico (10:1, v/v) dentro de un beaker con agitación magnética a 300 rpm a 120 ºC durante una hora. Acto seguido, con el propósito de neutralizar las fibras estas se separaron del ácido por decantación y por medio de lavados sucesivos con agua destilada. Seguidamente, se adicionó NaOH hasta lograr un pH neutro, haciéndose necesario un lavado final con agua destilada para retirar la sal formada después de la neutralización con la base. Por último, las fibras fueron filtradas al vacío, secadas y pesadas (hasta obtener un peso constante).
Tratamiento con hidróxido de sodio (Cataño, 2009). Después de efectuado el procedimiento anterior, las fibras se trataron con 200 ml de una solución de NaOH al 17.5 % dentro de un beaker a 300 rpm y a temperatura ambiente durante seis horas. Por último, se llevó a cabo una filtración al vacío y el secado de las fibras que fueron finalmente pesadas en una balanza analítica.
Tratamiento mecánico (Cataño, 2009). Con el propósito de individualizar las microfibras de celulosa, la muestra tratada químicamente se congela en nitrógeno líquido y se somete a impacto mecánico en un molino planetario a 300 rpm por 2 h. Cataño (2009) concluyó en su estudio que el tratamiento químico empleado separo eficientemente las fibras de celulosa, por lo que se aprecia una disminución significativa de lignina a partir del análisis de espectroscopía infrarroja; no obstante, el análisis termogravimétrico realizado revela una muestra que se degrada a partir de los 180 ºC, que según el análisis propuesto, corresponde a la presencia de hemicelulosa residual en la muestra. A partir del análisis de cristalografía de rayos X se aprecia claramente una región cristalina en las fibras de celulosa obtenidas, lo que representa un resultado valioso en una eventual aplicación de dichas fibras en el reforzamiento de compuestos termoplásticos.
Nanocelulosa obtenida a partir de algodón (Gossypium ssp.)
El uso de desechos de algodón como materia prima para la generación de nanocelulosa podría ser una solución prometedora para reciclar materiales derivados del algodón. Varios estudios han informado de la extracción de nanocelulosa de tallos de algodón, astillas de algodón, fibras, linters y tejidos (Morais et al., 2013; Shamskar, 2016; Soni y Mahmoud, 2015; De Morais et al., 2016; Wang et al., 2017).
La producción de nanocristales de celulosa mediante método de hidrólisis con ácido sulfúrico (Zhong et al., 2020). Se mezclaron fibras de algodón molidas (4 g) con ácido sulfúrico (70 ml) a una concentración del 64% en peso para la hidrólisis ácida a 45 ºC durante 1h. A continuación, se detuvo la reacción añadiendo agua destilada a la mezcla. La celulosa hidrolizada se lavó mediante centrifugación y luego se dializó contra agua durante ~ 5 días. Finalmente, las fibras se desintegraron mediante ultrasonidos intensos (Branson Ultrasonics, EUA.) durante 10 minutos para obtener suspensiones nanocristales de nanocelulosa (CNC) bien dispersas. Los nanocristales de celulosa resultantes de la tela de algodón blanqueada y la mezclilla teñida con índigo se codificaron como CNC (algodón blanqueado) y CNC (mezclilla teñida con índigo), respectivamente. Las suspensiones CNC se almacenaron a 4 ºC antes de su uso y caracterización. También se aplicó la hidrólisis ácida a la pulpa de madera triturada para obtener CNC a partir de pulpa de madera.
Producción de nanofibras de celulosa mediante un enfoque de oxidación mediado por TEMPO (Zhong et al., 2020). Se suspendieron fibras de algodón molidas (4 g) en agua (400 ml) para que se hincharan durante la noche. A continuación, se añadieron TEMPO (0.064 g) y bromuro de sodio (0.4 g) a la suspensión. La oxidación del algodón se inició añadiendo la solución de NaClO (23 g) a la mezcla. El pH de la mezcla de reacción se mantuvo a 10.0 ~ 10,5 añadiendo una solución de NaOH 0,5 M. La reacción continuó a temperatura ambiente durante 6.5 h. Tras el tiempo de reacción definido, se añadió etanol (8 ml) para detener la reacción. A continuación, se ajustó el pH a 7.0 con HCl 0,5 M. La celulosa oxidada con TEMPO (TOC, por sus siglas en inglés) se lavó mediante centrifugación y luego se dializó con agua durante aproximadamente 5 días. La desintegración mecánica del TOC se llevó a cabo con un microfluidizador (LM20, microfluidics, EUA). Las suspensiones de TOC se pasaron a través de las cámaras de interacción cinco veces bajo la presión de 30.000 psi para generar una dispersión de nanofibras de celulosa oxidadas con TEMPO (TOCN, por sus siglas en inglés). Las nanofibras de celulosa resultantes se codificaron como TOCN (algodón blanqueado) y TOCN (mezclilla teñida con índigo) de la tela de algodón blanqueada y la mezclilla teñida con índigo, respectivamente. Las suspensiones de TOCN se almacenaron a 4 ºC antes de su uso y caracterización. Se aplicó la misma condición de oxidación TEMPO a la pulpa de madera triturada y el TOCN obtenido se etiquetó como TOCN (pulpa de madera).
Nanocelulosa obtenida a partir de piña (Ananas comosus L. Merril, variedad piña cabezona)
Las hojas de piña se dejaron reposar en agua por un periodo de 12 h con la finalidad de hidratarlas y así facilitar el trabajo mecánico con ayuda del refinador de discos. En función del peso seco, se calculó la cantidad de agua a partir de la Ec. 1. Utilizando 2.5g de material en 100 mL de solución (consistencia de 2.5%) (Ramírez et al., 2018). Se realizó un pretratamiento de hidrólisis ácida 0.5%. con el objeto de remover algunos componentes no celulósicos para obtener una celulosa de alta calidad. Se usó un equipo cocedor-desfibrador, aplicando 0.5 % de H2SO4 y posteriormente aplicando agua en proporción de 5:1 (agua: material), temperatura de 160 ºC, por 60 min (Rivera, 2013). Luego, se pulpeo las hojas de piña pretratadas, con una solución de sulfito de sodio, sosa, antraquinona y metanol para disolver y extraer la lignina (Rivera, 2013) con una carga de reactivo del 20%, una relación de Na2SO3/NaOH 70:30, metanol al 20 % v/v, y antraquinona 0.1%, con una temperatura de 170 ºC y un tiempo de reacción de 120 min.
La celulosa obtenida fue molida utilizando un molino Kika MF 10 Basic a 4,000 rpm, posteriormente se le realizó una hidrólisis ácida con H2SO4 al 64%, a una temperatura de 45 ºC, con agitación constante (360 rpm), en un tiempo de 60 min y para detener la reacción se utilizó 10:1 (agua: solución). Se procedió a realizar lavados sucesivos con agua desionizada hasta alcanzar un pH de 6, a partir de este valor se almacenó la solución sobrenadante, una vez concluida la etapa de centrifugación, la solución fue colocada en la membrana para la diálisis que se efectuó durante 5 días , posteriormente se procedió a un proceso de ultrasonificación por un tiempo de 10 min a 40 ºC y en baño de hielo para evitar que la temperatura se elevara a más de 50 ºC y, por último, se filtró utilizando papel filtro Alhstrom con tamaño de poro de 1.6 µm. Finalmente se obtuvieron cristales de diámetros de 8.6 nm a 9.2 nm y longitudes de 4 a 600 nm, son mayormente rectos, de superficies lisas, tipo agujas.
Nanocelulosa obtenida a partir de agave (Agave salmiana)
Se efectuó la limpieza y corte de la materia fibrosa natural, proceso de molienda y se liofilizó el material. Posteriormente, se llevó a cabo la síntesis de la matriz, se preparó NaOH al 5%: se analizaron 25.07 g de NaOH y se depositan en 500 ml de agua desionizada para después ser dispersado colocándolo en una plancha de agitación por mínimo 15 minutos con ayuda de un magneto o agitador. Se procedió a pesar 3.02 g de matriz de agave, la cual se deposita en un matraz bola de 500 ml con 200 ml de agua desionizada y al igual que la solución 5wt % de NaOH se le coloca un agitador magnético para llevar a cabo la dispersión durante 30 minutos. Se empieza a percibir un importante cambio de color en la solución, ya que de ser blanca cristalina pasa a un color verdoso (Rodríguez, 2016).
Hidrólisis básica de la matriz. El procedimiento consistió en llevar la matriz al baño de aceite a una temperatura de 50 ºC, esperando que la solución llegara a la temperatura deseada para añadir 22 ml de H2O2 (peróxido de hidrogeno) y 48 ml de agua desionizada y dejar la reacción durante 90 minutos. Todo el procedimiento se realizó en agitación constante. Los resultados mostraron que la extracción de nanocelulosa laminar con diámetro de 60-90 nm fue fácilmente procesable como dispersión coloidal con una cristalinidad mayor al 50% (Rodríguez, 2016).
Otro método ha sido aplicado a otras variedades de agave Vidales (2019). En este caso se aplicó un tratamiento de etanol-agua (70:30 v/v) de Organosolv (OT) para extraer la lignina de las fibras. La temperatura se fijó a 200 ºC y la presión se estabilizó a ~ 30 bar y la agitación se ajustó a 150 rpm, la reacción duró 90 minutos. La fracción líquida se separó por filtración y la fracción sólida se lavó varias veces hasta que se eliminó el licor negro restante.
Blanqueo total sin cloro. Un tipo de blanqueo total sin cloro en las fibras pretratadas se realizó de la siguiente manera: 1) etapa de oxígeno alcalino, realizada dos veces, con agua a un pH 11, estabilizado con 0.2% en peso, bajo una atmosfera de oxígeno a 6 bar a 98 ºC durante 60 minutos. 2) etapa de peróxido con una reacción de quelación secundaria (PQ) usando a 3 M, a pH 11 con 1: 5 (p / v) de ácido pentético (DTPA) como quelante, la reacción se realiza durante 120 minutos a 105 ºC y (3) etapa de peróxido alcalino (PO) usando una solución 3 M de a pH 11 y 0.2% en peso de a 98 ºC durante 150 min bajo una atmósfera de oxígeno de 6 bar. La pasta blanqueada se lavó varias veces hasta pH neutro después de cada etapa y luego se secó en horno a 50 ºC durante 24 h. Antes de elaborar nanofibras de celulosa o nanocristales de celulosa, las fibras blanqueadas se muelen con un molino Retsch utilizando un tamiz de 1 mm y luego se mantuvo dentro de una cámara de acondicionamiento sin humedad a 25 ºC.
Hidrólisis ácida mejorada con sonicación . Se realizó utilizando una solución de a 10.2 M (1:15 p/v) a 45 ºC durante 60 min en el interior de un baño de sonicación. En este proceso se indujo cavitaciones a 37 kHz. La nanocelulosa se dializó con agua destilada, hasta que se alcanzó un pH neutro. La suspensión CNC se ajustó a una solución al 3% en peso por sonicación directa durante 10 minutos a 20 ºC y se almacenó a 5 ºC.
Conclusiones
Se han desarrollado varias técnicas para la extracción de nanocelulosa de materiales celulósicos. Los diferentes métodos de extracción dieron como resultado diferencias en los tipos y propiedades de la nanocelulosa obtenida. Tres técnicas fueron exitosas: hidrólisis ácida, enzimática y mecánica.
La hidrólisis ácida con ácido sulfúrico fue la más común en la hidrólisis. No solo puede aislar fuertemente la celulosa nanocristalina, sino que también puede hacer que la nanocelulosa se disperse como un sistema coloidal debido a la esterificación del grupo hidroxilo por los iones sulfato. Algunos factores deben ser controlados para evitar afectar las propiedades de la nanocelulosa: el tiempo de reacción, la temperatura y la concentración de ácido. Como inconveniente de esta hidrólisis, son las aguas residuales ácidas que se generan en el proceso de lavado para neutralizar el valor de pH de la suspensión de nanocelulosa.
En la hidrólisis enzimática, se necesita un tiempo de obtención prolongado. Para solucionar este problema, la hidrólisis enzimática se puede combinar siempre con otros métodos.
Tomando en cuenta las principales barreras económicas de la extracción de nanocelulosa actual, que incluyen: el alto costo de los productos químicos, el costo de producción y mantenimiento de los equipos operados en ambientes ácidos, el difícil tratamiento de aguas residuales ácidas y el alto consumo de energía para el tratamiento mecánico; la mejor opción para la extracción en un escalado masivo sería el proceso en un solo paso, donde se pueda extraer directamente la nanocelulosa de los residuos de biomasa, problema aún por resolver por la comunidad científica. Es por esto que, la extracción de la celulosa es un campo poco explorado, que atrae el interés de los investigadores y/o tecnólogos para lograr un proceso económico, con seguridad ambiental y un buen rendimiento, y que se produzca industrialmente bajo un desarrollo sustentable.











 text new page (beta)
text new page (beta)