Introducción
Las especies vegetales se enfrentan a diferentes tipos de presiones selectivas de naturaleza biótica y abiótica durante su crecimiento y desarrollo. Del primer tipo destaca el daño causado por fitófagos y patógenos; entre los factores abióticos, las deficiencias en la calidad nutricional del suelo, el agua, las condiciones microclimáticas, el pH y la luz (Azcon, 1993), lo que conduce al deterioro mecánico o fisiológico de los árboles, como deformaciones, disminución de crecimiento, debilitamiento o incluso la muerte, con el consecuente impacto ecológico, económico y social (Semarnat, 2002).
De los cinco grandes órdenes de insectos derivan la mayoría de los que se alimentan de plantas (Coleoptera, Lepidoptera, Himenoptera, Diptera y Hemiptera). Estos artrópodos son considerados los primeros y los más importantes consumidores de vegetales en los sistemas terrestres, y junto con los ácaros superan en número a los vertebrados herbívoros (Daly et al., 1998).
Cualquier población fitófaga, constituya plaga o no, está influenciada por el ambiente abiótico (físico y químico) y biológico que la rodea: el clima, el agua, el suelo, las plantas, otras plagas, los enemigos naturales y las alteraciones que producen las prácticas culturales, así como las aplicaciones de pesticidas. Las alteraciones que se produzcan en tales componentes suelen repercutir en los niveles que alcanzan las poblaciones de plagas (Cisneros, 2010).
El follaje es la parte fotosintética predominante de las plantas, por lo que su ausencia por efecto de las plagas, por ejemplo, redunda en la pérdida del área fotosintética y en una reducción en la producción de hidratos de carbono (Resh y Cardé, 2003). En el caso de las áreas verdes urbanas, este comportamiento es particularmente importante por las funciones vitales que dicha vegetación ejerce: regulación del microclima, equilibrio y control de problemas ambientales, arquitectura del paisaje, hábitat de diferentes especies de fauna, recreación y esparcimiento (González y García, 2007). Por lo tanto, es trascendental conocer la entomofauna que afecta el arbolado urbano, debido a los beneficios que aporta. En dicho contexto, el objetivo de este estudio consistió en identificar los insectos y ácaros fitófagos, así como su efecto en el estado físico de los árboles del Parque Cultural y Recreativo Tezozómoc (PCyRT), Azcapotzalco, Cd. de México.
Materiales y Métodos
Localización y descripción del área de estudio
El Parque Cultural y Recreativo Tezozómoc (PCyRT) fue diseñado en 1978 por el arquitecto Mario Schjetman de Garduño, e inaugurado el 21 de marzo de 1982 como un espacio cultural-recreativo, en una zona densamente poblada del noroeste de la Ciudad de México, donde existen pocas áreas verdes. El propósito de ese proyecto fue recrear la topografía-orografía del Valle de México y sus cinco lagos de finales del siglo XV, para ofrecer a través de un recorrido cultural una visión histórica y ecológica de manera fácil y atractiva (Reséndiz et al., 2015).
El PCyRT se ubica al noroeste de la alcaldía Azcapotzalco en la Ciudad de México; sus coordenadas son 19°29’05” N y 99°12’38” O, a 2 250 msnm (Figura 1). Abarca una superficie de 270 000 m2 (González y Moctezuma, 1999-2000); colinda al norte con el municipio Tlalnepantla, al oeste con el municipio Naucalpan, al sur con las alcaldías Cuauhtémoc y Miguel Hidalgo y al oriente con la de Gustavo A. Madero.
De acuerdo con la estación meteorológica de Azcapotzalco, el clima corresponde al tipo C (w0), templado subhúmedo con lluvias en verano, de humedad media, según la clasificación de Köeppen modificado por García (Cuaderno Estadístico Delegacional, 2000).
En la actualidad los suelos que existen en el Parque Tezozómoc son rellenos sanitarios compuestos principalmente por escombro y diversas basuras, por lo que dada su influencia antrópica este tipo de suelo se le conoce como Androsol.
La flora del parque está representada por las siguientes especies, algunas de las cuales están presentes en otros parques urbanos como San Juan de Aragón (González et al., 2014): eucalipto (Eucalytus globulus Labill.; E. camaldulensis Dehnh), fresno [Fraxinus uhdei (Wenz.) Lingelsh], álamo blanco (Populus alba L.), jacaranda (Jacaranda mimosifolia D. Don), durazno [Prunus persica (L.) Stokes], tejocote (Crataegus mexicana DC.), aguacate (Persea americana Mill.), clavo ornamental [Pittosporum tobira (Thunb.) A. T. Aiton], rosa laurel (Nerium oleander L.), piracanto (Pyracantha coccinea M. Roem.), árbol orquídea (Bauhinia variegata L.), ahuehuete (Taxodium mucronatum Ten.), ahuejote (Salix bonplandiana Kunth), níspero [Eriobotrya japonica (Thunb.) Lindl.], ficus (Ficus microcarpa L. F.; Ficus benjamina L.), casuarina (Casuarina equisetifolia L.), sauce llorón (Salix babylonica L.), colorín (Erythrina coralloides DC.), trueno (Ligustrum lucidum A. T. Aiton; Ligustrum japonicum Thunb.), cedro (Cupressus sempervirens L.), ciprés (Cupressus lusitanica Mill.), pirul (Schinus molle L.), pino radiata (Pinus radiata D. Don), pino insigne [Pinus radiata var. binata (Engelm.) Lemmon], pino piñonero (Pinus cembroides Zucc.), palmera (Phoenix canariensis Hort ex Chabaud.), yuca (Yucca guatemalensis Baker.), hule (Ficus elastica Roxb. ex Hornem.), álamo temblón (Populus tremuloides Michx.), acacia lateada (Acacia retinodes Schltdl.), capulín [Prunus serótina Ehrh. ssp capuli (Cav.) Mc Vaugh], encino (Quercus acutifolia Née) y yuca (Yucca elephantipes Regel ex Trel.).
Trabajo de campo
Para conocer el estado general del área de estudio, inicialmente, se realizó un recorrido preliminar en el parque Tezozómoc con ayuda de un mapa proporcionado por la administración del mismo. Se reconocieron las diferentes zonas, así como su distribución y el tipo de agregación del arbolado; posteriormente, se hizo un censo, de agosto de 2009-2010. A partir de las muestras botánicas recolectadas, los árboles fueron identificados con base en los trabajos de Rodríguez y Cohen (2003) y de Martínez y Tenorio (2008). Las muestras de pinos se llevaron al Laboratorio de Entomología y Fitopatología Forestal del Centro Nacional de Investigación Disciplinaria en Conservación y Mejoramiento de Ecosistemas Forestales (Cenid Comef) del Instituto Nacional de Investigaciones Forestales Agrícolas y Pecuarias (INIFAP).
Colecta de material entomológico. La evaluación del estado sanitario consideró 10 % de las especies más frecuentes a partir del censo realizado; de los taxoness de menor frecuencia, se incluyó a la totalidad de los individuos. Se tomaron muestras de hojas, ramas, frutos y corteza; se aplicó la técnica de golpeo y colecta directa, así como una charola con alcohol al 70 %. El material vegetal se colocó en bolsas de plástico para evitar su desecación y los insectos colectados se guardaron en tubos tipo vial con alcohol al 70 %; las formas inmaduras, tales como ninfas, larvas o pupas se mantuvieron en cámaras (cajas) de cría con parte de material vegetal en el caso de ninfas y larvas, a fin de obtener las fases adultas; dicho procedimiento se llevó a cabo en el laboratorio de control de plagas de la Facultad de Estudios Superiores Iztacala, donde finalmente se hizo su identificación.
Trabajo de laboratorio
Determinación de los pinos. Se tomaron muestras de conos, cortezas y acículas. De estas últimas, se realizaron cortes transversales y se colocaron en portaobjetos para observar la disposición y número de los canales, en un microscopio óptico Carl Zeiss Axiostar Plus, y contrastarlas con las claves de Farjon et al. (1997) y Martínez (1948).
Determinación entomológica. Los insectos colectados se observaron en microscopio estereoscópico Carl Zeiss Stemi 2000-C y se tomaron fotografías con una cámara Canon Power Shot A640®. La determinación taxonómica se efectuó a nivel de familia, género y especie mediante el apoyo de las claves taxonómicas de Ferris (1938), Peterson (1973), Stehr (1987), Blackman y Easton (1994, 2006), Halbert (2001), Triplehorn et al. (2005), Bautista (2006), y Unruh y Gullan (2008).
Los montajes se efectuaron de acuerdo con las características y tamaño de los organismos: el montaje seco se realizó utilizando alfileres entomológicos (chinches y escarabajos), así como mediante técnicas especializadas en portaobjetos con bálsamo de Canadá (áfidos y escamas). En el caso de los ácaros se llevó a cabo un montaje directo con líquido de Hoyer (Remaudière, 1992; Solís, 1993; Triplehorn et al., 2005).
Análisis estadístico
Para procesar los datos de las muestras de ácaros e insectos, se aplicó la frecuencia relativa (F), la cual se considera como el número de veces en las que una especie se registró cuando menos una vez y se expresó en porcentaje (Dix, 1961):
Donde:
mi= Número de muestras en que aparece una especie en el total de las muestras (M).
Para determinar si existe independencia entre la condición sanitaria (insectos y ácaros) y el estado físico de la copa y el tronco del arbolado, se utilizó una prueba de X2:
Donde:
Σi=1…r (sumatoria del número de poblaciones o renglones de la tabla de contingencia)
Σj=1…c (sumatoria de categorías o columnas de la tabla de contingencia)
Oij = Frecuencia observada por celda
Eij= Frecuencia esperada por celda
Los criterios que se usaron para determinar el porcentaje de daño se basan en las siguientes categorías: mínimo (0 a 25 %), significativo (26 a 50 %), severo (51 a 75 %) y muy severo (76 a 100 %) (Benavides, 1996).
Las hipótesis planteadas fueron las siguientes:
Hipótesis nula (Ho): la presencia de insectos o ácaros son independiente de la condición física del arbolado.
Hipótesis alterna (Ha): la presencia de insectos o ácaros si es dependiente de la condición física del arbolado.
De acuerdo a Durán et al. (2005), se aplicó la regla de decisión para rechazar la hipótesis nula (Ho): χ20 >χ2α, (r-1) (c-1).
Resultados y Discusión
Composición arbórea
De acuerdo al censo realizado en el Parque Tezozómoc existen 3 758 árboles pertenecientes a 30 especies, que se agrupan en 16 familias botánicas, de las cuales 15 son nativas. Respecto a la permanencia del follaje, se observó que 67 % (20) son perennifolias y 33 % (10) son caducifolias (Cuadro 1).
Cuadro 1 Listado de especies arbóreas en las que se ubicaron fitopatógenos en el parque Tezozomoc.
| Especies | Familia | Número de árboles |
|---|---|---|
| Eucalyptus camaldulensis Dehnh. | Myrtaceae | 1 142 |
| Populus tremuloides Michx. | Salicaceae | 680 |
| Schinus molle L. | Anarcardiaceae | 380 |
| Pinus radiata var. binata (Engelm.) | Lemmon Pinaceae | 370 |
| Cupressus lusitanica Mill. | Cupresaceae | 214 |
| Erythrina coralloides DC. | Fabaceae | 175 |
| Fraxinus uhdei (Wenz.) Lingelsh. | Oleaceae | 150 |
| Total | 3 111 |
Determinación de insectos y ácaros
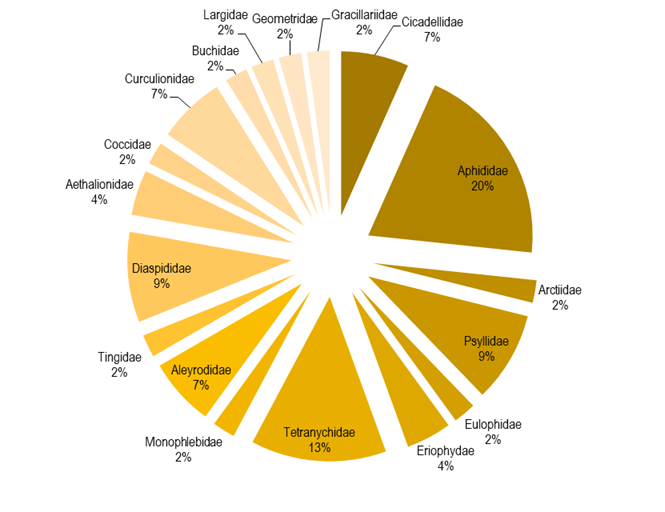
La entomofauna y acarofauna fitófaga se agruparon en 45 especies, incluidas en 34 géneros, 18 familias y seis órdenes (Cuadro 2). El principal habito alimentario fue el chupadore (76 %) (Figura 2), lo que puede ser consecuencia de que las familias más abundantes fueron Aphididae (20 %), seguida por Tetranychidae (13 %) (Figura 3); respecto a los hospederos, el que presentó más especies fitófagas fue Salix bonplandiana (11), seguido de Populus tremuloides (6) y Acacia retinodes (5) (Figura 4).
Cuadro 2 Entomofauna y acarofauna fitófaga recolectada en cada una de las especies arbóreas.
| Entomofauna | |||||||
|---|---|---|---|---|---|---|---|
| Especie forestal | Orden | Familia | Especie | Nombre común | Estructura dañada | Tipo de daño | Frecuencia (%) |
| Cupressus lusitanica Mill. | Coleoptera | Curculionidae | Phloeosinus baumanni Hopkins | Descortezador | Tronco | Descortezador | 10.15 |
| Hemiptera | Aphididae | Cinara Curtis | Pulgón | Chupador | |||
| Pinus cembroides Zucc. | Hemiptera | Diaspididae | Chionaspis Signoret | Escama del pino | Follaje | Chupador | 29.63 |
| Pinus radiata D.Don | Hemiptera | Diaspididae | Escama del pino | Follaje | Chupador | 100 | |
| Hemiptera | Aphididae | Eulachnus rileyi Williams | Pulgón | ||||
| Pinus radiata var. binata (Engelm.) Lemmon | Hemiptera | Diaspididae | Escama del pino | Follaje | Chupador | 41.34 | |
| Coleoptera | Curculionidae | Descortezador | Tronco | Descortezador | 6.61 | ||
| Populus tremuloides Michx. | Hemiptera | Cicadellidae | Empoasca Walsh | Chicharrita | Follaje | Chupador | 45.00 |
| Alebra Fieber | Chicharrita | Follaje | Chupador | 45.45 | |||
| Tingidae | Corythucha salicata Gibson | Chinche de encaje | Follaje | Chupador | 20 | ||
| Aphididae | Pemphigus populitransversus Riley | Pulgón | Peciolo | Formador de agalla | 1.51 | ||
| Chaitophorus Koch | Pulgón | Follaje | Chupador | 3.8 | |||
| Diptera | Minador | Follaje | Minador (masticador) | 13.64 | |||
| Salix bonplandiana Kunth | Hemiptera | Cicadellidae | Alebra Fieber | Chicharrita | Follaje | Chupador | 95 |
| Tingidae | Corythucha salicata Gibson | Chinche de encaje | Follaje | Chupador | 20 | ||
| Aphididae | Macrosiphum californicus Baker | Pulgón | Follaje (brotes nuevos) | Chupador | 25 | ||
| Cavariella pustula Essig | Pulgón | Follaje | Chupador | 25 | |||
| Pterocomma smithiae Monell | Pulgón rojo | Ramas | Chupador | 35 | |||
| Hymenoptera | Eulophidae o Aphelinidae | Avispa | Follaje | Formador de agallas | 65 | ||
| Lepidoptera | Gracillariidae | Phyllocnistis Zeller | Minador | Follaje | Minador (masticador) | 75 | |
| Geometridae | Oruga | Follaje | Defoliador | 5 | |||
| Hemiptera | Largidae | Stenomacra marginella Herrich-schaeffer | Chinche roja | Follaje | Chupador | 15 | |
| Prostigmata | Eriophydae | Aculops tetanothrix Nalepa | Eriófido | Follaje | Formador de agallas | 95 | |
| Tetranychidae | Tetraníquido | Follaje | Chupador | 40 | |||
| Salix babylonica L. | Prostigmata | Tetranychidae | Eotetranychus lewisi McGregor | Tetraníquido | Follaje | Chupador | 26.31 |
| Hemiptera | Aphididae | Pterocomma smithiae Monell | Pulgón | Ramas | Chupador | 15.8 | |
| Chaitophorus pusilus Hottes and Frison | Pulgón | Follaje | Chupador | 10.53 | |||
| Largidae | Stenomacra marginella Herrich-schaeffer | Chinche roja | Follaje | Chupador | 10.53 | ||
| Schinus molle L. | Lepidoptera | Arctiidae | Lophocampa Harris | Azotador | Follaje | Defoliador | 2.41 |
| Hemiptera | Psyllidae | Calophya rubra Blanchard | Psílido | Follaje | Formador de agallas | 100 | |
| Eucalyptus globulus Labill. | Hemiptera | Psyllidae | Ctenarytaina eucalypti Maskell | Psílido | Follaje (brotes nuevos) | Chupador | 100 |
| Eucalyptus camaldulensis Dehnh. | Hemiptera | Largidae | Stenomacra marginella Herrich-schaeffer | Chinche roja | Follaje | Chupador | 4.2 |
| Psyllidae | Blastopsylla occidentalis Taylor | Psílido | Follaje | Chupador | 34.45 | ||
| Glycaspis brimblecombei Moore | Psílido del escudo | Follaje | Chupador | 100 | |||
| Acacia retinodes Schltdl. | Prostigmata | Tetranychidae | Ácaro | Follaje | Chupador | 83.67 | |
| Hemiptera | Aleyrodidae | Mosquita blanca | Follaje | Chupador | 14.29 | ||
| Monophlebidae | Icerya Douglas | Escama | Ramas | Chupador | 2.04 | ||
| Aphididae | Macrosiphum Linnaeus | Pulgón | Fruto (vainas) | Chupador | 2.04 | ||
| Diaspididae | Aspidiotus Bouche | Escama | Follaje | Chupador | 83.67 | ||
| Erythrina coralloides DC. | Coleoptera | Bruchidae | Specularius impressithorax Pic | Gorgojo del frijol | Fruto (vaina) | Carpófago (barrenador) | 5 |
| Prostigmata | Tetranychidae | Ácaro | Follaje | Chupador | 20 | ||
| Hemíptera | Coccidae | Toumeyella erythrinae Kondo and Williams | Escama | Ramas (hembras), Follaje (machos). | Chupador | 100 | |
| Ligustrum japonicum Thunb. | Hemiptera | Largidae | Stenomacra marginella Herrich-schaeffer | Chinche roja | Follaje | Chupador | 100 |
| Ficus benjamina L. | Hemiptera | Cicadellidae | Empoasca Walsh | Chicharrita | Follaje | Chupador | 23.3 |
| Alebra Fieber | Chicharrita | Follaje | Chupador | 23.3 | |||
| Aphididae | Greenidea ficicola Takahashi | Pulgón | Follaje | Chupador | 3.3 | ||
| Fraxinus uhdei (Wenz.) Lingelsh. | Hemiptera | Miridae | Tropidosteptes chapingoensis Carvalho | Chinche del fresno | Follaje | Chupador | 100 |
| Prostigmata | Tetranychidae | Olygonichus punicae Hirst | Ácaro | Follaje | Chupador | 34.28 | |
| Eriophydae | Aceria fraxiniflora Felt | Eriófido | Flx|x||or | Formador de agallas | 7.14 | ||
| Prunus serotina subsp. Capulli (Cav. ex Sreng.) McVaugh | Lepidoptera | Arctiidae | Lophocampa Harris | Azotador | Follaje | Defoliador | |
| Persea americana Mill. | Hemiptera | Aleyrodidae | Mosquita blanca | Follaje | Chupador | ||
| Aethalionidae | Aethalion subquadratum Saussure | Mosca verde del aguacate | Ramas | Chupador | |||
| Hoplophorion monograma Germar | Periquito del aguacate | Ramas | Chupador | ||||
| Prostigmata | Tetranychidae | Olygonychus persea Tuttle, Baker and Abbatiello | Ácaro | Follaje | Chupador | ||
| Quercus acutifolia Née | Prostigmata | Tetranychidae | Ácaro | Follaje | Chupador | ||
| Hemiptera | Aleyrodidae | Mosquita blanca | Follaje | Chupador | |||

Sb = Salix bonplandiana; Sba = Salix babylonia; Sm = Schinus molle; Eg = Eucalyptus globulus; Ec = Eucalyptus camaldulensis; Ar = Acacia retinodes; Eco = Erythrina coralloides; Lj = Ligustrum japonicum; Fb = Ficus benjamina; Fu = Fraxinus uhdei; Pp = Pinus patula; Pa = Persea Americana; Qa = Quercus acutifolia; Cl = Cupressus lusitanica; Pc = Pinus cembroides; Pr = Pinus radiate; Prb = Pinus radiata var. binate; Pt = Populus tremuloides.
Figura 4 Porcentaje de hospederos afectados por insectos y ácaros.
Los síntomas más frecuentes en los hospederos fue la clorosis o puntos cloróticos en el follaje, puesto que los patógenos se alimentan del tejido vascular, principalmente del floema, con lo que provocan que las células se colapsen y bloquen el paso de nutrientes; en infestaciones severas causan la caída prematura del follaje; además de, que la mayoría de estas especies producen mielecilla (Cibrián et al., 1995), a excepción de los ácaros, sobre la que se desarrollan fumaginas, hongos no parásitos que viven de las mielecillas producidas por estos insectos, forman una capa obscura y densa que reduce la cantidad de luz que llega a la superficie de la planta (Agrios, 2008). La fumagina fue más evidente en Erythrina coralloides, causada por Toumeyella erythrinae Kondo and Williams en todos los árboles (100 %).
A pesar de que Aspidiotus sp. se presentó con frecuencia (83.67 %) en Acacia retinodes, no se determinó el porcentaje de daño, debido a que el hospedero evidenció otro tipo de problemas como la existencia de un micromiceto, y factores abióticos, por lo que no fue posible definir qué incidió en su estado de salud. Sin embargo, el daño provocado por Icerya sp. fue mínimo (0-25 %), pues succiona la savia en las ramas y su frecuencia fue baja (2.04 %)
A pesar de que Stenomacra marginella, Alebra sp. y Empoasca sp. fueron frecuentes, no tuvieron efectos significativos (0-25 %) en sus hospederos (Ligustrum japonicum (100 %), Ficus benjamina (23 %) y Populus tremuloides (45 %); lo anterior puede explicarse porque son polífagos; es decir, se alimentan de diferentes especies de plantas. Lo contrario ocurrió en Salix bonplandiana, en la que el daño fue severo (51-75 %) ya que presentó puntos cloróticos en la hoja ocasionados por un conjunto de especies de Tetraníquido: S. marginella (95 %), Alebra sp. (95 %), Empoasca sp. (95 %) y Corythucha salicata (20 %); este último también se observó en Populus tremuloides (20 %), con un daño mínimo (0-25 %).
Por otro lado, la incidencia de diaspididos (posiblemente del género Chinaseis sp.) en Pinus radiata (100 %), P. cembroides (29.6%), P. radiata var. binata (41.3 %) fue baja (0-25 %), lo que puede relacionarse con el hecho de que en todas estas especies registró poca densidad. La presencia de Tropidosteptes chapingoensis Carvalho (100 %) fue importante (26-50 %) en los árboles adultos y el daño, severo (51 a 75 %) se observó en individuos juveniles con un amarillamiento foliar, y punteado clorótico, síntoma característico de esta especie, y caída del follaje en 50 %. Sin embargo, tales manifestaciones pueden estar asociadas a diferentes factores bióticos como otros insectos fitófagos e incluso a factores abióticos como contaminantes atmosféricos o del suelo.
El daño producido por los áfidos fue muy bajo (0-25 %) en Cupressus lusitanica (1 %), Pinus radiata (1 %), Acacia retinodes (2.04 %), Populus tremuloides (3.8 %), Ficus benjamina (3.3 %). En Salix bonplandiana (25 % y 35 %) fue significativa (26-50 %), debido a que presentó tres especies diferentes de la familia Aphididae.
Las afectaciones asociadas con Tetranychidae en Erythrina coralloides (20 %), Fraxinus uhdei (34.28 %) y Salix babylonica (26.3 %) fueron mínimas (0-25 %), al igual que los provocados por Blastopsylla occidentalis Taylor (34.45 %) colectados en Eucalyptus camaldulensis, pues en ambos casos no se obsevaron muchos organismos por hospedero.
En relación a los ácaros e insectos formadores de agallas o cecidias, se consignó a Aculops tetanothrix Nalepa, 1889, el cual ocasiona que las hojas formen una estructura dura de color rojo que rodea a los ácaros; las agallas propician que las hojas se doblen y queden más cortas que las no infestadas, lo que favorece su caída prematura (Cibrián et al., 1995). Dicho comportamiento concuerda con lo observado en Salix bonplandiana con una frecuencia de 100 %; de igual manera, se reconocieron agallas de color diferente. Los mismos síntomas se identificaron en Schinus molle (100 %), pero fueron provocados por el psílido Calophya rubra Blanchard, 1852 (100 %), con daño de 51 a 75 %, pero sin una infestación severa.
En algunas agallas se encontraron organismos pertenecientes a Eulophidae o Aphelinidae (65 %), ya que según Triplehorn et al. (2005), no hay gran diferencia anatómica entre estas familias por lo que fue difícil definir a cuál pertenece la avispa observada; ambas han sido citadas como parasitoides, y no hay registros sobre avispas de estos grupos que formen agallas en Salix bonplandiana. Sin embargo, existen datos de avispas pertenecientes a la familia Eulophidae, que forman de agallas en Ophelimus eucalypti Gahan, 1922 (especie originaria de Australia) y en Chile sobre Eucalyptus spp. (Gómez et al., 2006). El daño provocado por estos dos fitófagos en Salix bonplandiana fue muy severo (76-100 %). Otra especie perteneciente a esta familia es Quadrastichus erythrinae Kim, 2004, consignada en diferentes especies de Eritrina en Taiwán (Yang et al., 2004).
Entre los ácaros e insectos que elaboran agallas, el pulgón se caracteriza por formarlas en el peciolo; por lo tanto, se interrumpe parcialmente el paso del agua y de nutrientes a las hojas, lo que conduce a un amarillamiento y la caída prematura del follaje. En Populus tremuloides el daño por este organismo fue mínimo (0-25 %), ya que su frecuencia fue poca (1.51 %). Pero, por ser es una especie caducifolia, le ocasionó la perdida anticipada del follaje a consecuencia de las agallas presentes en las hojas.
El eriófido, Acerya fraxinoflora (7.14 %) es un ácaro citado para Fraxinus uhdei (Otero et al., 1999), al que le provocó un daño significativo (26-50 %), ya que afecta a los brotes florales y se manifiesta con deformación de la inflorescencia en forma de agallas y aborto de las flores. García (1981) describió que las agallas o cecidias resultaron en el estímulo continuo del organismo invasor, que las utiliza como un medio para desarrollarse.
También, se identificó un género de lepidópteros entre los insectos defoliadores: Lophocampa sp. sobre Schinus molle (2.41 %) y Prunus serotina subsp. capulli. Este lepidóptero causó daños mínimos (0-25 %) en sus hospederos, probablemente, porque son más especificos y parásitos primarios que atacan árboles vigorosos, y no individuos en estado de deficiencia fisiológica (Dajoz, 2001). Aunque esa no es la principal causa de que los defoliadores tengan menor frecuencia en el Parque, ya que desempeñan un papel importante en las cadenas alimentarias, pues transforman la biomasa vegetal a la animal, además constituyen el alimento de numerosos depredadores tales como las aves, que en el Parque son abundantes (Martínez y Leyva, 2014).
Otro tipo de daño común es el producido por insectos minadores, los cuales se caracterizan por formar una mina, camino, canales o serpentinas en el foliolo, ya que se alimentan principalmente del mesófilo de la hoja y le provocan un amarillamiento (Méndez et al., 2008).
En el Parque se registraron dos minadores, un díptero no determinado en Populus tremuloides (13.64 %) y un lepidóptero de la familia Gracillariidae, posiblemente, del género Phyllocnistis sp., en Salix bonplandiana (75 %). Se contabilizaron a razón de tres dípteros por folíolo, mientras que los microlepidopteros solo uno por foliolo. El daño provocado por estos insectos fue de 26 a 50 %. Los dípteros colectados estaban muertos dentro de la mina sin rastros de parasitoides, posiblemente debido a la planta misma o a hongos endófitos (Cornell y Hawkins, 1995), lo que puede explicarse porque las sustancias químicas de defensa se concentran en la cutícula y en la epidermis de las hojas.
En relación al tronco, los insectos descortezadores fueron menos frecuentes, pues solo se presentan cuando el arbolado está debilitado por otros factores, lo cual, en casos extremos, deriva en la muerte de los árboles (Wood, 1982). Se identificaron dos especies, perteneciente a la familia Curculionidae: Dentrictonus adjuntus Blanford, 1897 sobre Pinus radiata var. binata (6.61 %) y Phloeosinus baumanni Hopkins, 1905 en Cupressus lusitanica (10.15 %); en ambas especies provocaron un daño severo (51 a 75 %). Estos descortezadores se caracterizan por alimentarse de los tejidos del cambium vascular y de la corteza interna de los árboles.
Cibrián et al. (1995) indicaron que Phloeosinus baumanni no es una plaga primaria para el arbolado urbano, pero llega a infestarlo cuando está debilitado o en decadencia; además de que en el Valle de México es frecuente observarlo sobre árboles viejos de Cupressus benthamii Endl. y C. lindleyi Klotzsch ex Endl.; sin embargo, no precisan la localización de las áreas plagadas, ni el porcentaje de daño.
En la NOM-019-SEMARNAT-2006 se establece que en México existen insectos descortezadores de los géneros Dendroctonus, Ips, Phloesinus y Scolytus, entre otros. Varias de sus especies tienen repercusión económica, al grado de que se les reconoce como las plagas forestales más dañinas del país (Semarnat, 2012). De los géneros citados en la Norma, en este estudio se detectó a Phloesinus spp. sobre individuos de Cupressus lusitanica.
Otro tipo de daño que fue poco frecuente y menos representativo, en cuanto a número de especies correspondió a insectos carpófagos de Specularius impressithorax (Pic), que incidieron solo en 5 % de los individuos de Erythrina coralloides. Dicho bruquido se alimenta de las semillas del colorín; se desconoce su distribución en México y la severidad de sus daños, ya que es una especie con pocos registros (Romero et al., 2009).
En los Cuadros 3 y 4 se muestran los resultados obtenidos de la X2 y la significancia observada de la comparación sanitaria y física de la copa y tronco.
Cuadro 3 Resultados de X2 y significancia observada en la comparación del estado sanitario y físico de la copa.
| Especies | χ2 | Significancia observada |
|---|---|---|
| Cupressus lusitánica Mill. | 21.387 | 8.747E-05 |
| Pinus cembroides Zucc. | 12.5 | 0.019 |
| Pinus radiata D.Don | 22 | 2.727E-06 |
| Pinus radiata var. binata (Engelm.) Lemmon | 93.472 | 5.043E-21 |
| Pinus patula Schiede ex Schltdl. & Cham. | 30 | 4.320E-08 |
| Populus tremuloides Michx. | 142.216 | 1.258E-30 |
| Salix babylonica L. | 10.363 | 0.0012 |
| Salix bonplandiana Kunth | 31.544 | 1.414E-07 |
| Acacia retinodes Schltdl. | 0.196 | 0.658 |
| Erythrina coralloides DC. | 3.243 | 0.072 |
| Eucalyptus camaldulensis Dehnh. | 15.827 | 0.0004 |
| Eucalyptus globulus Labill. | 10 | 0.0015 |
| Schinus molle L. | 6.666 | 0.0098 |
| Fraxinus uhdei (Wenz.) Lingelsh | 92 | 1.053E-20 |
| Prunus pérsica (L.) Stokes | 12 | 0.00053 |
| Ligustrum japonicum Thunb. | 8 | 0.0046 |
| Ficus benjamina L. | 60 | 9.485E-15 |
| Yucca elephantipes Regel ex Trel. | 56 | 7.247E-14 |
Cuadro 4 Resultados de X2 y significancia observada en la comparación del estado sanitario y físico del tronco.
| Especies | X2 | Significancia observada |
|---|---|---|
| Cupressus lusitánica Mill. | 74.746 | 5.700E-17 |
| Pinus radiata var. binata (Engelm.) Lemmon | 19.599 | 2.050E-04 |
| Schinus molle L. | 58.032 | 2.578E-14 |
| Populus tremuloides Michx. | 240.711 | 6.679E-52 |
| Salix babylonica L. | 22.166 | 1.537E-05 |
| Salix bonplandiana Kunth | 3.243 | 0.071 |
| Acacia retinodes Schtdl. | 67.618 | 1.381E-14 |
| Erythrina coralloides DC. | 40 | 2.539E-10 |
| Eucalyptus camaldulensis Dehnh. | 238 | 2.084E-52 |
| Ficus benjamina L. | 3.158 | 0.075 |
El valor de
El dosel de Cupressus lusitanica, Pinus cembroides, P. radiata var. binata, P. radiata, P. patula, Populus tremuloides, Salix babylonica, S. bonplandiana, Eucalyptus camaldulensis, E. globulus, Fraxinus uhdei, Prunus persica, Ligustrum japonicum, Schinus molle, Ficus benjamina y Yucca elephantipes sí fue afectado por la presencia de dichos agentes entomológicos.
En P. radiata var. binata, C. lusitanica, E. camaldulensis, S. molle, P. tremuloides, S. babylonica, S. bonplandiana, A. retinodes y E. coralloides se verificó dependencia entre la presencia de los insectos descortezadores y la condición física del tronco.
Los descortezadores de P. radiata var. binata y C. lusitanica causaron daños mecánicos en el tronco; en S. molle, P. tremuloides, S. babylonica, S. bonplandiana, A. retinodes, E. coralloides y E. camaldulensis no se encontraron descortezadores.
Conclusiones
Los árboles y arbustos determinadas en el Parque Tezozomoc comprendieron 30 especies, de las cuales la mitad fueron nativas y la otra mitad exóticas. Las más utilizadas para reforestar fueron cuatro Eucalyptus camaldulensis, Populus tremuloides, Schinus molle y Pinus radiata var. binata; lo que sugiere poca diversidad de arbolado.
Al evaluar la relación de la condición sanitaria y el estado físico de la copa y tronco, se determinó que en la mayoría de los hospederos los daños se debieron a la acción de insectos y ácaros fitófagos, mientras que la especie arbórea más susceptible a plagas fue Salix bonplandiana con 10 taxones de insectos y ácaros, que representaron 19 % del total de entomofauna fitófaga observada en el Parque.
Se hacen nuevos registros para la avispa Eulophidae o Aphelinidae formadora de agallas en S. bonplandiana y la existencia en el Parque del bruquido Specularius impressithorax, barrenador de semilla en Erythrina coralloides.




![Identification of the causal agent of antracnosis in the cultivation of the rubber tree [Hevea brasiliensis (Willd. ex A. Juss.) Müll. Arg.]](/img/en/prev.gif)






 text in
text in