Introducción
Los ecosistemas costeros son fundamentales en los ciclos de las especies marinas, ya que representan áreas propicias para la reproducción, protección y alimentación, desde la fase de larva hasta adultos, de un buen número de organismos marinos, incluyendo algunos considerados como recursos pesqueros (Lara-Lara et al., 2008). Uno de los componentes clave de la red alimentaria pelágica es el zooplancton, grupo heterogéneo de organismos fagotróficos (Harris et al., 2000) encargado de transferir la energía y el carbono desde los productores primarios hacia los organismos de la parte alta de la red trófica (Lavaniegos-Espejo, 2007).
Entre los trabajos que han descrito algunos aspectos del zooplancton en el Golfo de California, destaca la extensa revisión realizada por Brinton et al. (1986). Farfán y Álvarez-Borrego (1992) determinaron las fluctuaciones de biomasa del zooplancton en el Alto Golfo, y encontraron que los copépodos calanoideos y los ctenóforos eran los grupos más abundantes. Respecto a investigaciones en bahías y zonas costeras, sobresalen los trabajos de Lavaniegos-Espejo y González-Navarro (1999), quienes reportan 27 grupos zooplanctónicos colectados con dos redes de diferente abertura en la Bahía de la Paz. De Silva-Dávila et al. (2006) determinaron 45 taxa en Bahía San Ignacio-Navachiste, de los cuales copépodos, decápodos, quetognatos y cladóceros fueron los más abundantes. Lavaniegos-Espejo et al. (2012) encontraron 15 grupos de zoopláncteres en Bahía de los Ángeles, mientras que Hernández-Nava y Álvarez-Borrego (2013), identificaron 21 grupos taxonómicos en la misma zona. Sin embargo, a pesar de estas importantes contribuciones, la comunidad zooplanctónica de los ecosistemas costeros del Golfo de California sigue siendo poco conocida, ya que varios de los 24 cuerpos de agua costeros registrados, aún no han sido estudiados (Lara-Lara et al., 2008).
Las Guásimas es una laguna costera típica del estado de Sonora. Presenta una superficie de 37 km2, una profundidad media de 0.7 m y se caracteriza por tener comunicación permanente con el mar abierto, circulación influida por las mareas y el patrón estacional de vientos (Arreola-Lizárraga, 2003). La importancia ecológica de este cuerpo de agua radica en su complejidad faunística y su abundancia de especies de importancia pesquera, destacando diversas especies de peces (Sardinops sagax caerulea Girard, 1854), crustáceos (camarones peneidos y jaibas), moluscos y la medusa comestible Stomolophus meleagris Agassiz, 1862 (Padilla-Serrato, 2011). La información publicada acerca de la biota relacionada con este ecosistema incluye trabajos sobre la taxocenosis fitoplanctónica de López-Martínez y Salinas-Zavala (1996) y Castillo-Durán (2007). Sin embargo, más allá de estos registros, la comunidad zooplanctónica de Las Guásimas sigue siendo casi desconocida. Esta necesidad de investigación cobra aún más relevancia si se considera que, aparte de servicios ambientales, este sitio proporciona refugio y alimento para aves, además de otras especies de importancia ecológica, aspectos que han sido tomados en cuenta para catalogar a Las Guásimas como un ecosistema estratégico y de gran importancia para la conservación de la biodiversidad y el bienestar de las comunidades humanas en 2008, bajo los criterios de la Convención Ramsar.
Por lo tanto, considerando la información previa y las necesidades de investigación actuales, el objetivo de este trabajo fue determinar por primera vez la abundancia, composición y estructura mensual del zooplancton a partir de dos sitios representativos del ecosistema y su relación con las principales variables hidrológicas durante un ciclo anual, como punto de partida para investigaciones futuras que requieran del conocimiento de la comunidad microfaunística de este cuerpo de agua costero.
Materiales y métodos
La laguna costera Las Guásimas está ubicada en la región centro-sur del Golfo de California. Para su estudio se establecieron dos sitios representativos elegidos arbitrariamente en función de investigaciones previas, uno en el ambiente interno (27° 52.120' N, 110° 36.992' O) y otro en la zona nerítica contigua a la boca (27° 52.725' N, 110° 39.085' O) (Fig. 1).
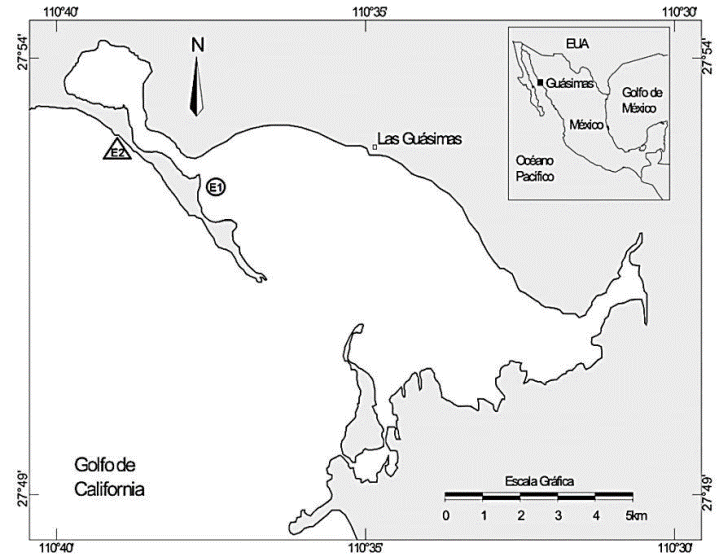
Figura 1 Ubicación de la laguna costera Las Guásimas y posición de las zonas de muestreo, en el interior de la laguna (E1) y en la zona nerítica contigua (E2).
Los muestreos se realizaron mensualmente de enero a diciembre de 2010, con excepción de julio, septiembre y octubre, meses en los que no fueron posibles las salidas de campo por diversas razones técnicas. En cada estación se realizaron arrastres lineales superficiales por 5 minutos para la colecta de muestras de zooplancton (Harris et al., 2000) y se registró la posición inicial y final del arrastre mediante un GPS Garmin (Mod. 72H). Para la toma de muestra se utilizó una red cónica con diámetro de 50 cm y tamaño de malla de 300 μm. Las muestras colectadas se fijaron en formol al 4% neutralizado con borato de sodio.
Se midió la temperatura superficial del mar (TS), La salinidad (SAL) y el oxígeno disuelto (OD) mediante un equipo multisensores YSI (Mod. Pro Plus).
En laboratorio, las muestras se concentraron y aforaron a un volumen de 100 ml, del cual se extrajeron alícuotas sucesivas de 10 ml para el conteo e identificación de organismos mediante una pipeta Stempel-Hansen, hasta alcanzar al menos 1000 organismos por muestra (Harris et al., 2000). La identificación de los grupos del zooplancton se realizó hasta el taxón más bajo posible, utilizando las guías de identificación de Smith y Johnson (1996), Boltovskoy (1999), Harris et al. (2000) y Conway (2012). Para la identificación de copépodos a nivel de especies y géneros se utilizó el catálogo de Palomares-García et al. (1998) y la guía en línea de Razouls et al. (2012). Con el fin de obtener un estimado grueso de densidad (DZ) y biomasa de zooplancton (VZ) por unidad de volumen, se utilizaron los datos de distancia recorrida y área de entrada de la red para calcular el volumen de agua filtrado, asumiendo un barrido óptimo de la red, aunque esto implica una sobreestimación ya que el filtrado no es 100% eficiente. Los valores de DZ se expresaron en org. 100 m-3 y los de VZ se estandarizaron a ml 100 m-3 (Smith & Richardson, 1979).
Las diferencias en los valores de DZ y variables hidrológicas entre estaciones de muestreo fueron evaluadas utilizando la prueba Mann-Whitney. La diversidad fue evaluada mediante el índice H' de ShannonWienner, siguiendo a Raybaud et al. (2008). Para evaluar la asociación entre variables fisicoquímicas y DZ se aplicó un análisis de correlación de Spearman (McDonald, 2014). Todos los cálculos fueron realizados a través del programa PAST 3.0 (Hammer et al., 2001).
Resultados
La temperatura superficial (TS) presentó un claro patrón estacional, con mínimos en diciembre (18.4°C) y máximos en agosto (33.6°C) en ambas estaciones (Fig. 2). Entre localidades de muestreo no se encontraron diferencias significativas (U=40.5, p=0.96). La salinidad (SAL) presentó valores de 35.3 a 38.5 en E1 y de 34.9 a 37.6 en E2, en ambos casos los valores mínimos ocurrieron en enero y los máximos en diciembre, con algunas fluctuaciones en los meses de primavera. Las diferencias entre estaciones no fueron significativas por un margen estrecho (U=18, p=0.05). El oxígeno disuelto (OD) fue muy variable, con mínimos de 2.9 mg l-1 durante la fase cálida del año y máximos de 12.4 mg l-1 durante el periodo más frío en E1, mientras que en E2 la fluctuación fue de 3.2 a 12.4 mg l-1 en los mismos periodos. El OD fue ligeramente mayor en E2 aunque estas diferencias no fueron significativas (U=27.5, p=0.27).
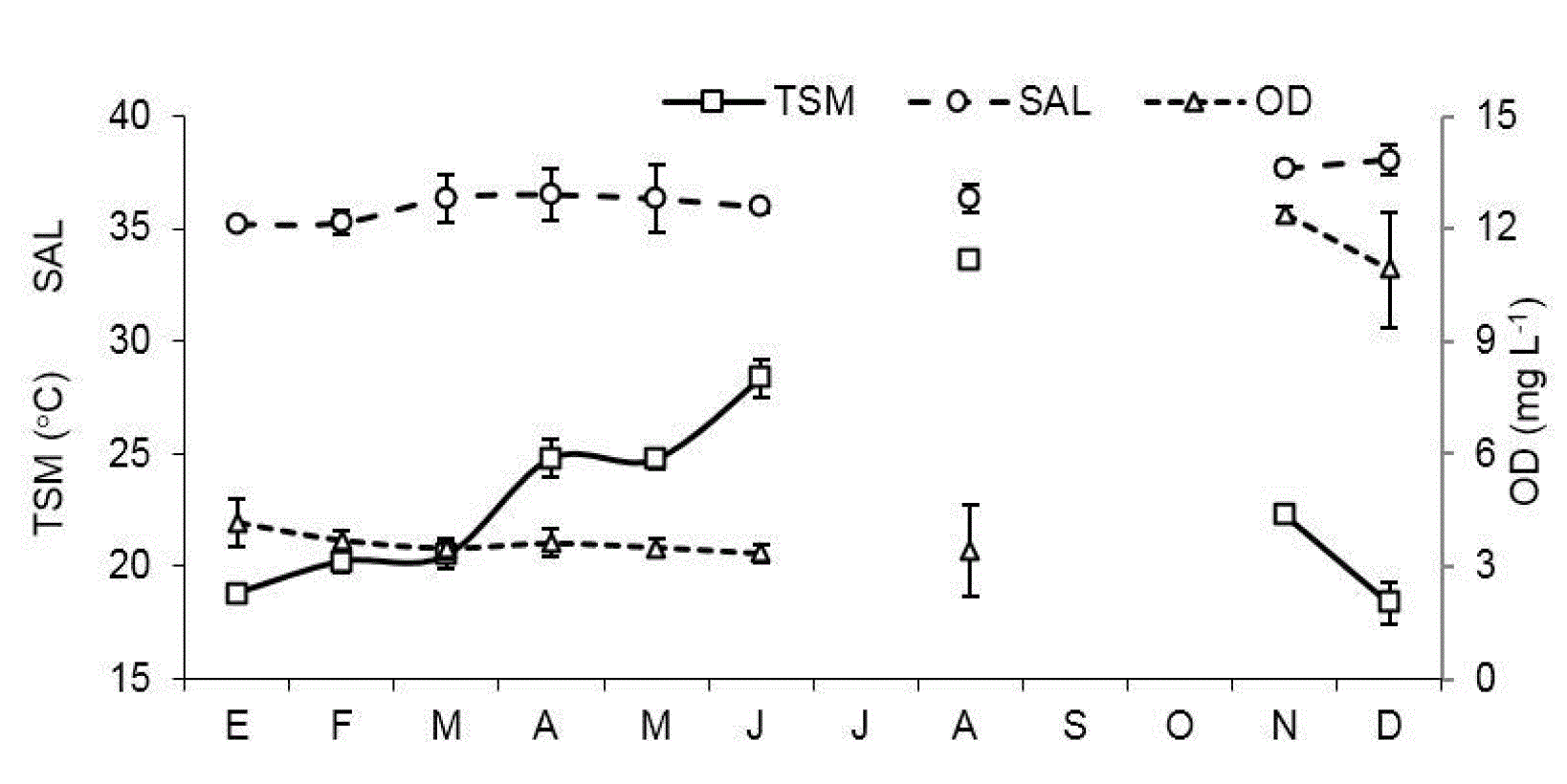
Figura 2 Patrón mensual promedio de las variables hidrológicas: temperatura superficial (TS), salinidad (SAL) y oxígeno disuelto (OD) en la laguna Las Guásimas, Sonora, México, durante 2010.
El zooplancton se caracterizó por su alta variabilidad mensual tanto en biomasa (VZ) como en densidad de organismos (DZ) (Fig. 3). En E1 la DZ fluctuó en más de 2 órdenes de magnitud (5.7 x103 org.100 m-3 a 1.0 x105 org.100 m-3) con mínimos en enero y máximo en marzo, mientras que en E2 el mínimo se presentó en diciembre y el máximo en noviembre (9.6 x103 org.100 m-3 a 9.4 x104 org.100 m-3). No se encontraron diferencias significativas entre estaciones (U=35, p>0.66). De manera similar, VZ mostró marcados cambios episódicos mensualmente, con fluctuaciones de 29.6 a 164.0 ml 100 m-3 en E1 y de 14.5 hasta 183.0 ml 100 m-3 en E2, sin que se observaran diferencias entre las localidades (U=33, p=0.54).
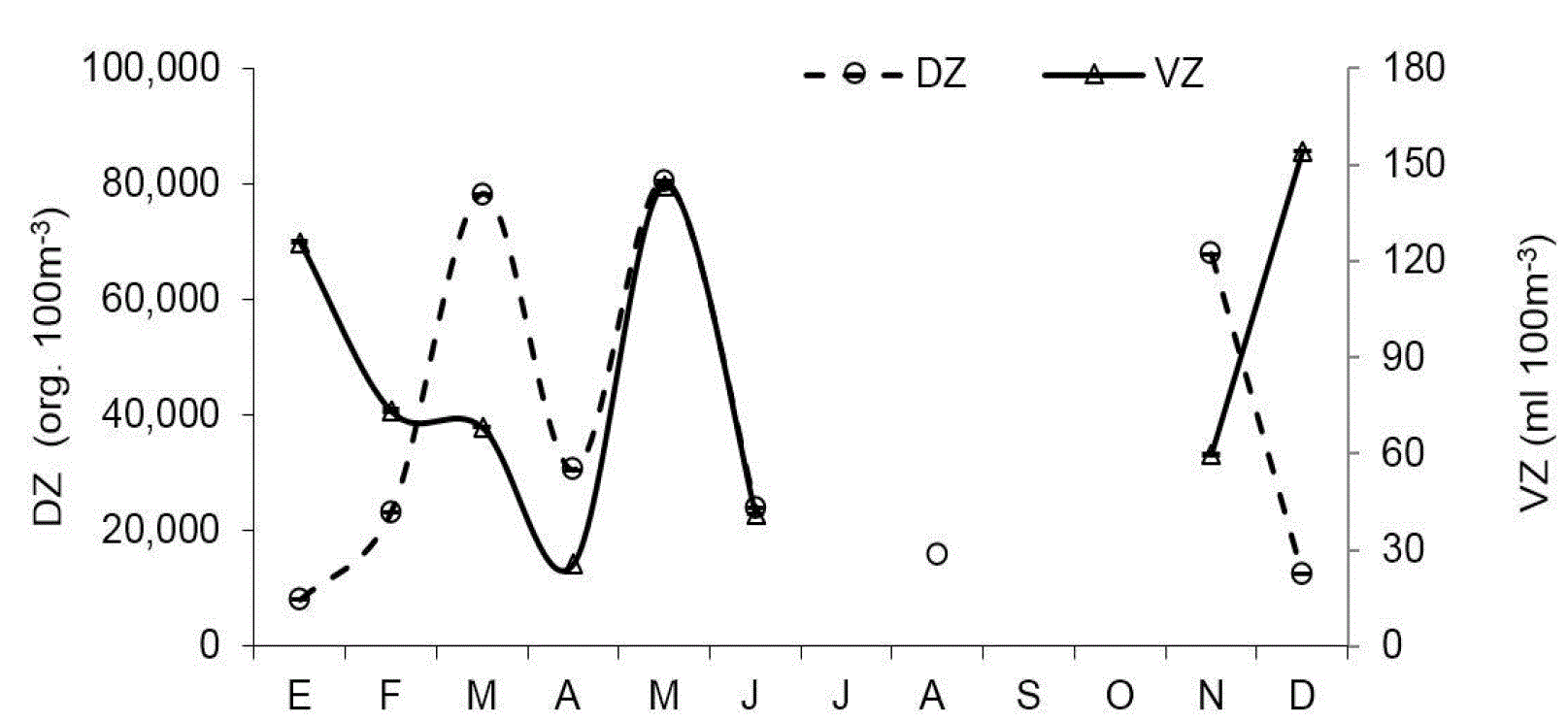
Figura 3 Patrón mensual de indicadores de abundancia de zooplancton en Las Guásimas, Sonora, México, durante 2010. DZ representa el volumen sedimentado de zooplancton y DZ la densidad de zoopláncteres.
Se identificaron 78 taxones, los cuales fueron clasificados en 29 grupos taxonómicos mayores (Tabla 1). En general las especies más abundantes fueron el copépodo Acartia tonsa y el cladócero Penilia avirostris (Dana 1849), quienes contribuyeron con más del 75% de los conteos en toda la zona.
Tabla 1 Composición del mesozooplancton por especies, taxones en cada estación interior (E1) y zona nerítica contigua (E2) de la laguna costera Las Guásimas, Sonora, México, durante 2010. DZ= Densidad de zooplancton
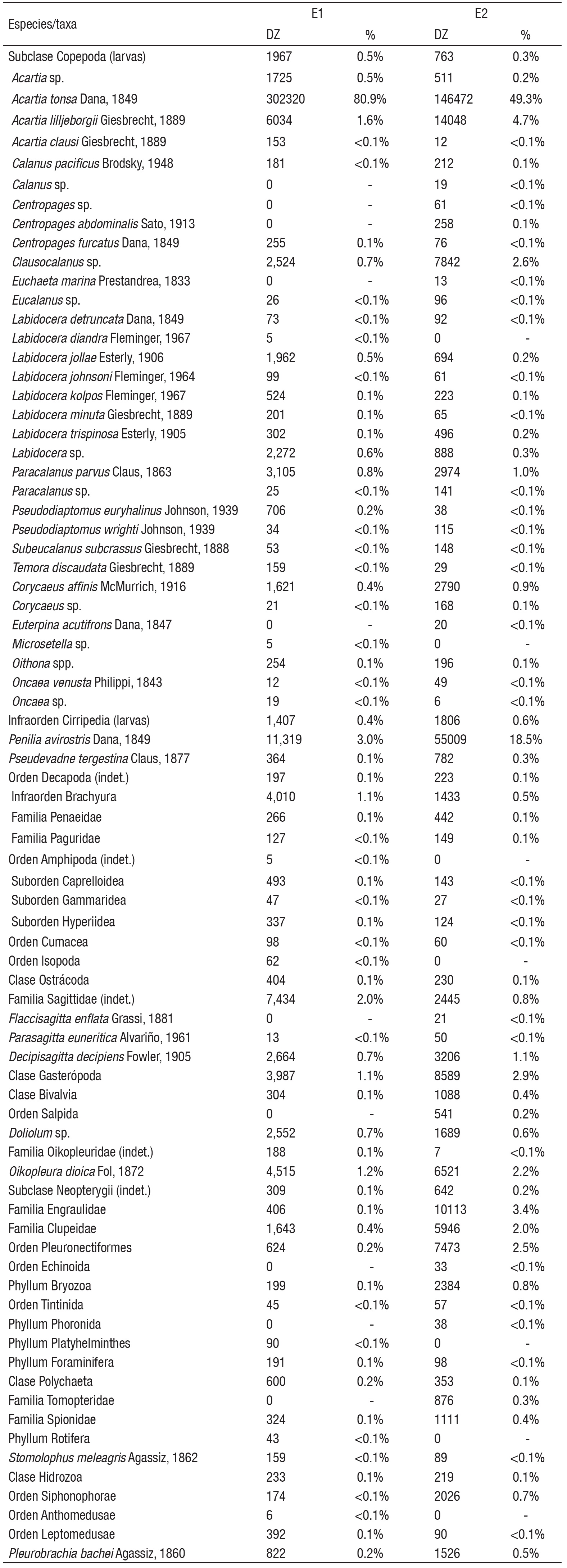
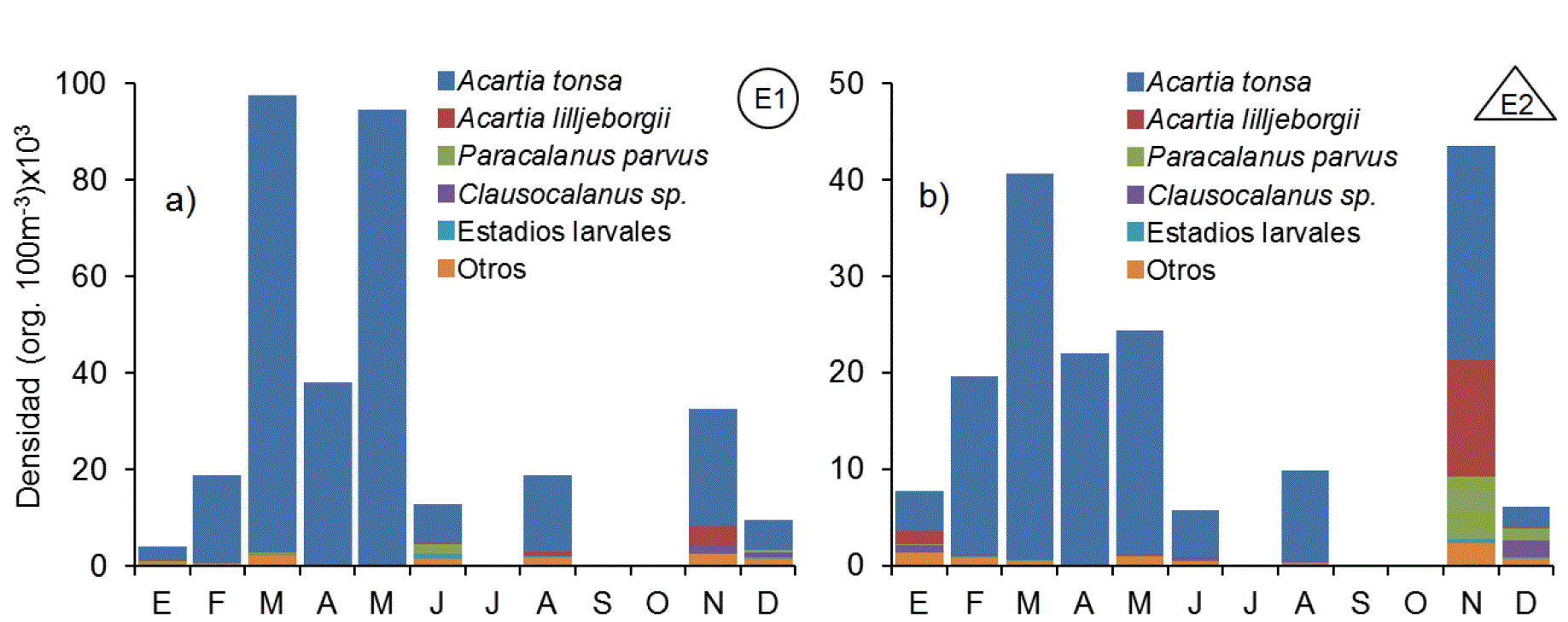
Los copépodos fueron el grupo proporcionalmente más numeroso, tanto en E1 con el 87.4% del conteo total, como en E2 con el 60.4% (Fig. 4). Así mismo también fue el grupo más complejo con 22 especies y 11 géneros identificados, de los cuales 26 pertenecieron al orden Calanoida, tres al orden Cyclopoida y dos a los órdenes Poecilostomatoida y Harpacticoida. Los cladóceros ocurrieron en mayor número en junio en E1 y en noviembre en E2, superando 6 veces la abundancia de E1 (Fig. 5). El cladócero predominante fue Penilia avirostris. El ictioplancton estuvo compuesto en más del 90% por huevos de peces de las familias Engraulidae, Clupeidae y del orden Pleuronectiformes (Fig. 5). Los huevos de peces fueron abundantes durante febrero, mayo, junio y noviembre, con máximos durante mayo en la estación costera superando en más de un orden de magnitud las abundancias de la parte interna. Los Urocordados, que incluyeron Apendicularios y Thaliáceos, se capturaron durante casi todo el ciclo, a excepción del mes de abril, con densidades máximas durante noviembre en ambas estaciones (Fig. 5). El grupo estuvo formado por 4 taxones, de los que Oikopleura dioica (Fol, 1872) fue el más abundante, seguido por Doliolum sp. registrándose máxima abundancia en noviembre en ambas estaciones. Los Quetognatos fueron otro grupo de organismos que manifestó un patrón de alta frecuencia de aparición y baja abundancia numérica. Estuvo compuesto por Decipisagitta decipiens (Fowler, 1905), Parasagitta euneritica (Alvariño, 1962) y Flaccisagitta enflata (Grassi, 1881), además de una elevada proporción de especies de la familia Sagittidae no determinados. Los moluscos fueron un grupo relativamente escaso pero constante en todo el año, con valores máximos de abundancia durante mayo y conformado casi en su totalidad por larvas de gasterópodos (90.0%) y bivalvos (10.0%). Los decápodos estuvieron representados por larvas zoea, y megalopa del infraorden brachyura (84.5%) y en menor proporción por larvas de peneidos (Dendobranchiata) y pagúridos (Anomura). Las mayores densidades de este grupo se registraron en E1, duplicando las registradas en E2 (Fig. 5). Los poliquetos fueron representados por larvas tempranas de la familia Spionidae y Tomopteridae durante todo el ciclo, alcanzando valores máximos en mayo (Fig. 5). Las concentraciones de poliquetos de la estación E2 casi triplicaron la máxima abundancia registrada en la estación interna. El conjunto de organismos pertenecientes a los peracáridos estuvo compuesto por tres familias de anfípodos (Hyperidae, Gammaridae y Caprelidae), cumáceos e isópodos, siendo los primeros los más abundantes en ambos ambientes con más del 60% dentro de este conjunto. Estos organismos registraron un pulso en enero de anfípodos caprélidos y otro en mayo de hypéridos. Los peracáridos fueron más abundantes dentro de la laguna.
Figuras 4a-b Patrón mensual de densidad de copépodos en la zona interna (a) y externa (b) de la laguna Las Guásimas, Sonora, México durante 2010.
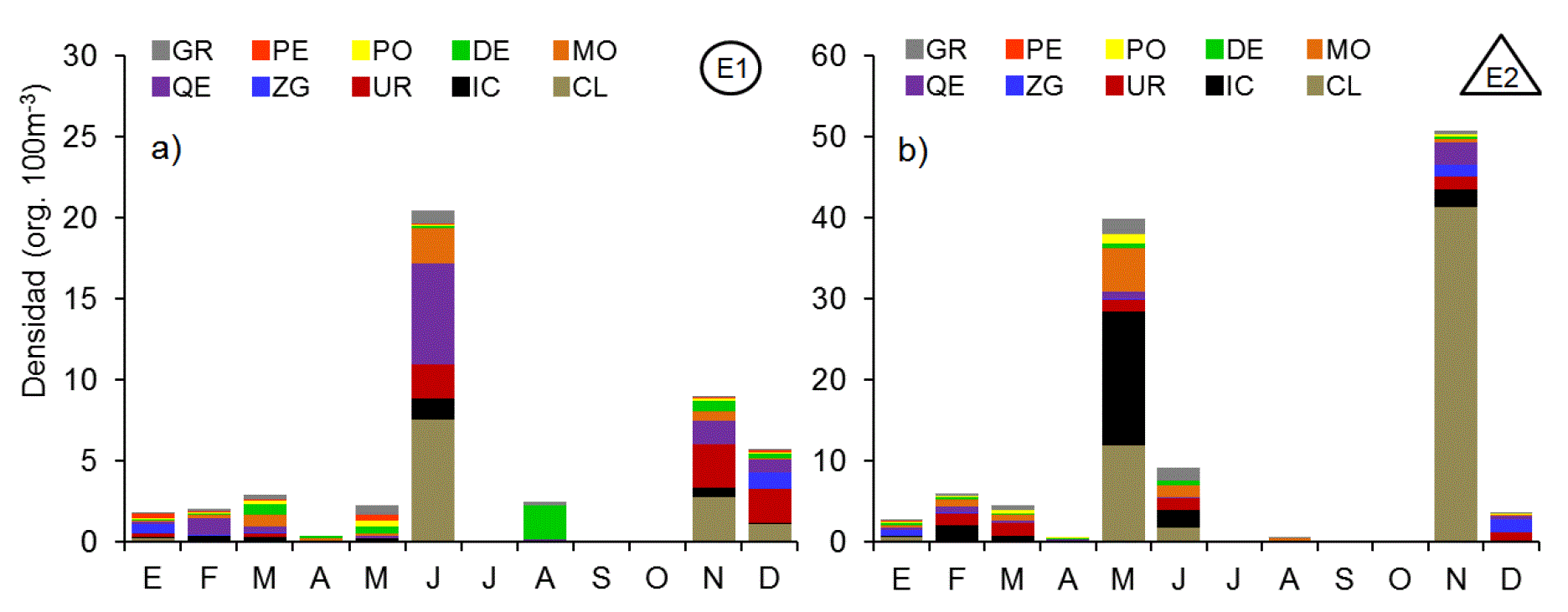
Figuras 5a-b Patrón mensual de densidad de las fracciones de mesozooplancton en la zona interna (a) y externa (b) de la laguna Las Guásimas, Sonora, México, durante 2010 (GR= grupos raros, PE= peracáridos, PO= poliquetos, DE=decápodos, MO= moluscos, QE=quetognatos, ZG=zooplancton gelatinoso, UR= urocordados, IC=ictioplancton y CL=Cladóceros).
Los organismos agrupados como zooplancton gelatinoso se caracterizaron por ser más numerosos en los meses fríos, con máximos en enero y diciembre en ambas estaciones (Fig. 5). Los taxones principales dentro de este grupo fueron ctenóforos de la especie Pleurobrachia bachei (40.9%), hidrozoarios de los órdenes Siphonophorae (38.4%) y Leptomedusae (16.3%), así como larvas éfiras y juveniles tempranos de la escifomedusa Stomolophus meleagris (4.3%). Los taxones con menor presencia fueron larvas meroplanctónicas de cirrípedos, bryozoarios, equinoideos, forónidos y platelmintos, así como ostrácodos, tintínidos, foraminíferos y rotíferos.
La diversidad biológica de la fracción mesozooplanctónica presentó una alta variabilidad a lo largo de todo el ciclo anual (Fig. 6). Valores moderados de diversidad ocurrieron en enero, marzo, y junio en E1, mientras que en E2 ocurrieron en enero, junio y diciembre, sucedidos por registros bajos (H'<2). El mínimo de diversidad en E1 se presentó en mayo (H'= 1.453), en tanto que en E2 el valor de diversidad más bajo del año se registró en agosto (H'= 0.343).
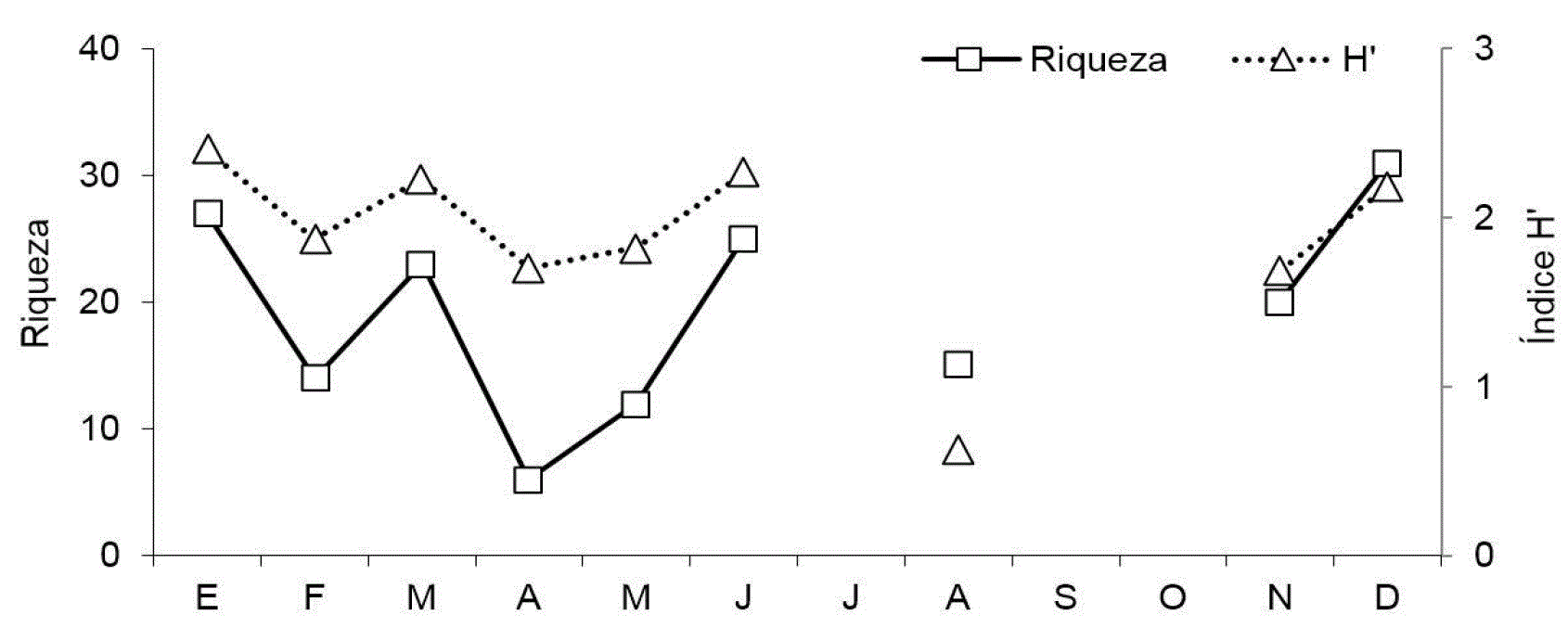
Figura 6: Patrón mensual de diversidad (H') en las estaciones E1 y E2, en Las Guásimas, Sonora, México, durante 2010.
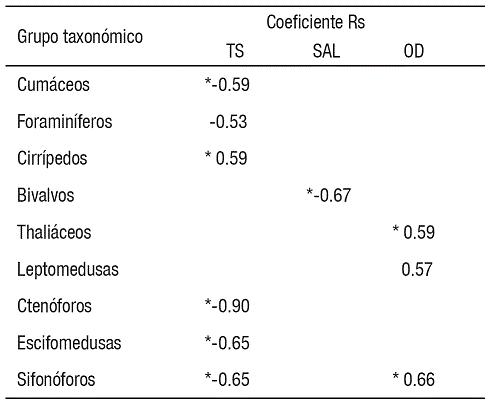
La TS fue la variable con el mayor número de asociaciones con grupos del zooplancton, las cuales consistieron en relaciones negativas altamente significativas con depredadores planctónicos gelatinosos (sifonóforos, ctenóforos y escifomedusas), cumáceos y foraminíferos, además de correlación positiva con larvas de cirrípedos. Asimismo, el OD se correlacionó positivamente con leptomedusas, thaliáceos y sifonóforos. La variable SAL solo se relacionó negativamente con larvas de bivalvos (Tabla 2).
Discusión
El rango de temperatura registrado a lo largo del año, de más de 15°C, indica que las especies que habitan este sitio están sometidas a variaciones térmicas extremas. Entre los efectos biológicos que inducen estas condiciones ambientales adversas está la presencia de una gran cantidad de organismos de afinidad tropical (Jiménez-Pérez & LaraLara, 1988), además de especies eurihalinas y euritérmicas (Márquez-Rojas et al., 2011).
Valores máximos de VZ y DZ se presentaron en marzo y mayo, mientras que en enero y diciembre los datos de DZ fueron bajos y contrastaron con altos valores de VZ debido a la presencia de zooplancton gelatinoso y quetognatos, cuyos organismos son de un tamaño mayor que el resto del zooplancton.
Las grandes fluctuaciones mensuales observadas en la densidad de zooplancton, sugieren la combinación de diferentes factores poblacionales (p.e. ciclos de vida) e interacciones biológicas (depredación y competencia) en adición a la influencia de mareas, como potenciales fuentes de variabilidad que probablemente afectaron la comunidad zooplanctónica, lo cual se reflejó en el patrón de fluctuaciones de abundancia observado y que son consistentes con lo registrado en otras regiones de la costa mexicana del Océano Pacífico, como Bahía Magdalena (Hernández-Trujillo et al., 2010) y Punta Farallón-Cuyutlán (Franco-Gordo et al., 2001), en donde se reporta la ocurrencia de dos máximos de DZ, uno asociado al invierno y otro a la primavera, además de valores mínimos en verano-otoño. En esta investigación, dos pulsos de DZ fueron registrados, uno en primavera (marzo y mayo) y otro en otoño (noviembre).
Los copépodos dominaron el mesozooplancton en Las Guásimas, lo cual coincide con lo encontrado en una gran cantidad de cuerpos de agua costeros alrededor del mundo, incluyendo los de ambas costas mexicanas (Jiménez-Pérez & Lara-Lara, 1988; Farfán & Álvarez-Borrego, 1992; De Silva-Dávila et al., 2006; Álvarez-Cadena et al., 2007). De esta subclase de crustáceos, Acartia fue el género dominante, representado por A. tonsa (Dana 1849), A. lilljeborgii (Giesbrecht 1889) y A. clausi (Giesbrecht 1889). Acartia tonsa fue altamente dominante en el interior de la laguna la mayor parte del año, gracias a su capacidad para reproducirse y reclutarse en aguas con severas condiciones eutróficas y salinas (Cervetto et al., 1999; Marques et al., 2006). En E2 sus abundancias disminuyeron en noviembre y diciembre hasta ser superada por A. lilljeborgii, Clausocalanus sp. y Paracalanus parvus (Claus 1863). Debido a que estos crustáceos son presas de una gran cantidad de organismos, incluyendo sifonóforos, medusas y larvas de peces (Azeiteiro et al., 1999), tienden a variar inversamente con los incrementos de estos depredadores, lo que explica sus bajas abundancias en enero, noviembre y diciembre, en sincronía con el incremento en número del zooplancton gelatinoso. Los cladóceros se caracterizaron por sus abundancias masivas, seguidas de periodos de escasa o nula presencia, comportamiento que concuerdan con lo descrito por Onbé e Ikeda (1995). Su abundancia en diversos cuerpos de agua costeros ha sido registrada por autores como De Silva-Dávila et al. (2006) y Márquez-Rojas et al. (2011), quienes los clasifican como parte de los grupos dominantes e incluso sucesores de los copépodos en algunos meses, durante los cuales prevalecen condiciones oligotróficas que son ideales para que estos organismos puedan prosperar (Atienza et al., 2006).
La ocurrencia de larvas de decápodos estuvo limitada principalmente a los meses de verano. Este patrón bien definido se relaciona con la liberación de larvas en la columna de agua durante los meses cálidos, cuando las condiciones ambientales son favorables para estos organismos (De Silva-Dávila, et al., 2006). Muchas larvas meroplanctónicas muestran una clara tendencia estacional relacionada con la temperatura (Gilabert, 2000), en este estudio, los huevos y larvas de peces, moluscos, decápodos, poliquetos y cirrípedos exhibieron un máximo en la transición de la primavera hacia el verano, lo cual probablemente se relaciona con los ciclos reproductivos de dichos organismos, aunque debido a su corta duración no presentaron una correlación significativa con la temperatura del agua.
Uno de los grupos más contrastantes fue el zooplancton gelatinoso. Aunque la abundancia numérica absoluta de este grupo fue muy baja (0.04%), es probable que su contribución a la producción zooplanctónica no haya sido debidamente ponderada, considerando su aporte de biomasa por individuo con respecto al resto de los taxones. El caso más representativo fue la escifomedusa Stomolophus meleagris, la cual parece desarrollar todo su ciclo de vida en la zona y alcanza niveles de biomasa tan elevados en fase adulta que han permitido la existencia de una pesquería en la zona desde 2001 (López-Martínez & Álvarez-Tello, 2013). Este grupo de animales mostró una correlación negativa altamente significativa con la temperatura superficial (p<0.01), lo que explica parcialmente su incremento durante el invierno y su abrupta disminución en el verano, posiblemente debido a la existencia de un límite letal de temperatura para estos organismos gelatinosos, como en el caso de la medusa Aurelia aurita (Olesen, 1995). Otros organismos que se correlacionaron negativamente con la temperatura fueron cumáceos y foraminíferos, en tanto que cirrípedos se relacionaron de manera directa, lo que muestra que la temperatura fue la variable ambiental más determinante en las Guásimas, seguida por el oxígeno disuelto y la salinidad.
Resulta interesante que a pesar de la fuerte influencia ambiental en varios grupos planctónicos, la VZ y DZ no reflejaran esta correlación, lo cual se debe a que los copépodos no se asociaron con las variables evaluadas, probablemente debido a que estos organismos tienden a variar inversamente con la presencia de grandes depredadores, incluyendo sifonóforos, hidromedusas y larvas de peces (Azeiteiro et al., 1999). La inexistencia de un patrón estacional también se reflejó en los valores de diversidad, lo que sugiere que en algunos periodos el control de la comunidad zooplanctónica podría ser biológico más que fisicoquímico. Comparado con las aguas oceánicas, donde la comunidad pelágica podría responder sólo a variaciones climáticas, las aguas costeras son influenciadas por múltiples factores que pueden alterar la comunidad del plancton de diferentes maneras (Eloire et al., 2010).
En conclusión, la información presentada indica que Las Guásimas es un ecosistema muy dinámico debido a que presenta características ambientales y biológicas cambiantes mensualmente, tanto a nivel de abundancia como de estructura de la comunidad zooplanctónica, la cual se caracterizó por el predominio de copépodos, especialmente A. tonsa, la ocurrencia de múltiples pulsos de densidad de organismos y la aparición de grandes biomasas de plancton gelatinoso asociadas al periodo frío. El conjunto de datos ambientales y biológicos descritos permiten un conocimiento detallado de la composición y estructura del mesozooplancton de esta laguna costera y una primera aproximación al conocimiento de sus variaciones, lo cual debe ser complementado con series más largas de datos, ya que la serie utilizada es demasiado limitada como para definir tendencias de largo plazo. Además del gran valor ecológico que representa el conocimiento de la dinámica del zooplancton en un humedal RAMSAR como Las Guásimas, esta investigación también podría ayudar a una mejor comprensión de la variabilidad de la comunidad biológica en otros humedales estratégicos del Golfo de California con características ambientales similares y cuya riqueza biológica sigue siendo desconocida.











 text new page (beta)
text new page (beta)