Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Hidrobiológica
Print version ISSN 0188-8897
Hidrobiológica vol.13 n.4 Ciudad de México Dec. 2003
Artículo
Inventario del macrofitobentos en los fondos blandos al norte de Matanzas, Cuba
Soft bottom macrophytobenthos from northern coast of Matanzas, Cuba
Beatriz Martínez-Daranas, Macario Esquivel, Jhoana Díaz, Miguel Hernández, Mercedes Cano, Dulce M. Pérez y Arsenio J. Areces
Instituto de Oceanología. Departamento de Ecosistemas Marinos. Ave 1ra No. 18406. Playa. Ciudad de la Habana. C. P. 11600. Cuba. E-mail: beatriz@cesigma.com.cu
Recibido: 16 de abril de 2003.
Aceptado: 8 de octubre de 2003.
Resumen
Se presenta el inventario del macrofitobentos de los fondos blandos de la costa norte de la provincia Matanzas, Cuba. Se obtuvo un total de 163 especies: 77 fueron algas rojas (Rhodophyta), 12 algas pardas (Phaeophyta), 70 algas verdes (Chlorophyta) y 4 fanerógamas marinas (Magnoliophyta). En comparación con una prospección ficológica realizada en 1989, 114 especies representan registros nuevos para la zona estudiada. El mayor número de especies se registró en los sitios con mayor intercambio con aguas oceánicas, mientras que en los sitios afectados por el desarrollo industrial y urbano, o con un intercambio limitado con el océano, presentaron los valores menores.
Palabras Clave: Algas marinas, angiospermas marinas, Cuba, fitobentos, inventario, Norte de Matanzas.
Abstract
An inventory of the macrophytobenthos from soft bottoms of the northern coast of the Matanzas province, Cuba, is presented. A total of 163 species was obtained: 77 red algae (Rhodophyta), 12 brown algae (Phaeophyta), 70 green algae (Chlorophyta) and 4 seagrasses (Magnoliophyta). In comparison with a phycological survey carried out in 1989, 114 species are new records for the studied area. The largest number of species was registered in sites with more exchange of oceanic waters, while sites affected by the industrial and urban development, or with a limited exchange with the ocean, presented the smallest values.
Key words: Cuba, Northern Matanzas, Inventory, phytobenthos, seaweeds, seagrasses.
Introducción
El archipiélago Sabana-Camagüey es el mayor grupo insular que rodea la isla de Cuba y se extiende a lo largo de aproximadamente 460 km en el centro-norte de la isla, sobre una plataforma somera relativamente amplia (cerca de 40 km en su porción más ancha), y una larga cadena de cayos e islotes bordeados por manglares y playas arenosas. Estos cayos e islotes ocupan 3414 km2 de superficie y al sur existe un largo sistema de cuerpos de agua poco profundos (3-4 m como promedio) e interconectados, denominada aquí, una macrolaguna, que configuran sistemas con poco intercambio con el océano y tendencia a la hipersalinización, la cual alcanza unos 8311 km2 de superficie (Alcolado y Espinosa, 1999). Esta macrolaguna está formada por diferentes bahías donde predominan fondos con sedimentos fangosos hasta arenosos, algunas rocas y restos de moluscos, con praderas marinas donde la angiosperma más abundante es Thalassia testudinum Banks ex König (Martínez-Daranas et al., 1996).
Todo el archipiélago posee un gran interés para el desarrollo sustentable del país; son territorios que dependen económicamente de la explotación de sus recursos, desde la pesca hasta el desarrollo turístico, donde el principal exponente son sus playas.
Entre los años 1989 y 1990 se llevaron a cabo varias prospecciones en la época climática de secas para inventariar las especies de la mayor parte del archipiélago (Martínez-Daranas et al., 1996). Para completar y actualizar el conocimiento sobre las especies de los fondos blandos de dicho archipiélago, así como conocer cuáles áreas presentan mayor riqueza de especies, se realizaron dos expediciones en épocas de lluvias y de secas en el año 2001, al norte de la provincia Matanzas. Se incluyó la zona Varahicacos-Galindo que está propuesta como Reserva Ecológica por el Sistema Nacional de Áreas Protegidas de Cuba (WWF/CITMA/CNAP, 2000).
Las recolectas se realizaron en zonas con diferente grado de influencia antropogénica, incluyendo la Bahía de Cárdenas con una mayor afectación por el desarrollo urbano e industrial, hasta lagunas pre-arrecifales con un mayor intercambio con el océano.
Materiales y métodos
Las expediciones se realizaron en marzo (época de secas) y en septiembre del 2001 (época de lluvias), desde la Bahía de Cárdenas y la península de Hicacos hasta la zona occidental de la Bahía de Santa Clara, incluyendo lagunas pre-arrecifales en la parte exterior (Norte) de algunos cayos (Fig. 1).
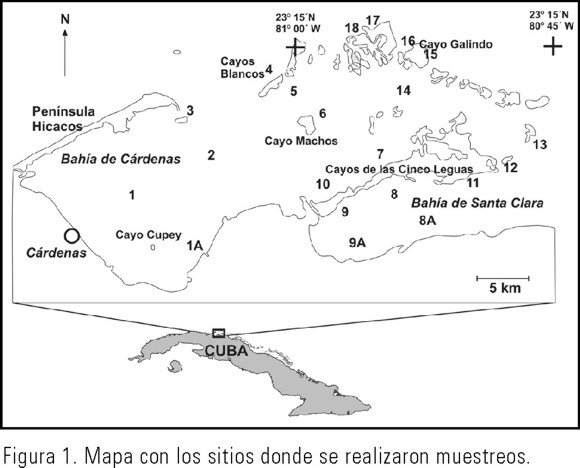
El muestreo se realizó en veintiún sitios mediante una rastra con un copo de malla de 4 mm y con buceo en apnea, con lo cual se recolectaron especímenes para completar la lista de especies de la zona.
La vegetación recolectada en cada muestreo fue lavada para eliminar el sedimento, fijada con una solución de formaldehído al 5% en agua de mar previamente neutralizada con tetraborato de sodio y guardada en bolsas de plástico debidamente etiquetadas para su posterior procesamiento en el laboratorio. Se identificó, hasta la mínima categoría taxonómica posible, toda entidad que fuera visible a simple vista o aproximadamente hasta 1 cm de tamaño, mediante el empleo de microscopios.
Para la identificación y clasificación de las especies se utilizaron las obras de Børgesen (1915-1920); Guiry y Nic Dhonncha (2002); Hartog (1970); Littler y Littler (2000); Silva (2001); Taylor (1960); Wynne (1998); Wynne y Ballantine (1986) entre otras. Para la determinación de los registros nuevos para Cuba se tuvo en cuenta la literatura sobre las especies de algas y fanerógamas marinas cubanas (Cirujano et al., 1998; Cruz, 1982; Díaz-Piferrer, 1964; Farlow, 1871; Howe, 1909, 1918; Humm & Jackson, 1955; Jiménez, 1989, 1990; Montagne, 1842; Suárez, 1973; datos sin publicar).
Con el objeto de conocer si el muestreo fue representativo de la región, se realizó una curva acumulativa de especies por sitios acumulados en ambas épocas climáticas (Boudouresque, 1974).
Para analizar la composición de las especies como posible indicador de afectación en los sitios, se realizó un análisis de clasificación entre éstos según las especies encontradas en ambas épocas (secas y lluvias). Se elaboraron las matrices de similitud de presencia-ausencia con el coeficiente de Sørensen, para lo cual se eliminaron las especies que aparecieron sólo en una ocasión. Para la clasificación se empleó la estrategia de medias no ponderadas (UPGMA) (Field et al., 1982). El análisis de clasificación y la curva acumulativa área-especies se realizaron con el programa Primer v5 (Clarke y Gorley, 2001).
Resultados
El número total de especies de macroalgas y fanerógamas marinas por sitio osciló entre 0 (sitios 1, 1A y 9A en secas) y 48 (sitio 6 en lluvias). Se destacaron los sitios que tuvieron un número de especies mayor de 30 (6, 17 y 18 en secas, y la 3, 6, 7, 14 y 15 en lluvias) (Tabla 1). De éstos, 3, 17 y 18 se encuentran ubicados en la zona exterior (norte) de los cayos y de la península Hicacos, con un alto intercambio con aguas oceánicas, mientras que los sitios 6, 7 y 14 están en la porción norte de la Bahía de Cárdenas (Fig. 1).
Para la zona de estudio, se acumuló un total de 163 taxa: 77 Rhodophyta, 12 Phaeophyta, 70 Chlorophyta y 4 Magnoliophyta marinas. En comparación con la prospección realizada en 1989, 114 son registros nuevos para la zona y 11 registros nuevos para Cuba (Martínez-Daranas et al., 2001, 2002). De las especies presentes, 30 se hallaron solamente en el periodo de secas, 48 solamente en lluvias y 85 en ambos periodos (Tabla 2).
La curva acumulada de especies por número acumulado de sitios, incluyendo el muestreo de 1989, no llega a ser asintótica, por lo que se considera que aún queda un potencial de especies por conocer en la zona (Fig. 2).

El análisis de agrupamiento dio lugar a seis grupos de sitios, con excepción del sitio 5 en secas que quedó fuera de algún grupo (Fig. 3). Las especies también formaron grupos mediante el análisis de la matriz inversa, los que resultaron más difíciles de separar por la cantidad de especies presentes, y por los bajos valores de similitud encontrados.

Los sitios aparecieron generalmente en el mismo grupo en los muestreos de secas y lluvias, con excepción de los sitios 2, 5, 11 y 13.
Las especies que aparecieron en el 40 % o más de los muestreos o la mayoría de los grupos de sitios fueron: Chondrophycus gemmiferus (Harvey) Garbary et Harper, Laurencia intricata Lamouroux, Caulerpa paspaloides (Bory) Greville, Dictyosphaeria cavernosa (Forsskål) Børgesen, Halimeda incrassata (Ellis) Lamouroux, H. monile (Ellis) Lamouroux, H. simulans Howe, Penicillus capitatus Lamarck, Udotea caribaea D. S. Littler et M. M. Littler, Halodule wrightii Ascherson y Thalassia testudinum.
Grupos de sitios:
Grupo 1: Sitios exteriores (3, 15, 16, 17, 18): En este grupo se presentaron valores medios a altos en el número de especies (14-42). El sedimento es arenoso con un pasto medio a denso, conformado principalmente por T. testudinum, y se destacaron algunas especies de macroalgas que no se encontraron en otros grupos: Centroceras sp., Dasya crouaniana, Dictyota bartayresiana, D. pulchella, Lobophora variegata, varias especies del género Avrainvillea, Halimeda discoidea y varias coralinas no geniculadas. En este grupo no se encontró Halodule wrightii. Estos sitios quedan al norte de la cayería y presentan un mayor intercambio con el océano.
Grupo 2: Sitios 2 en secas y 4 en secas y lluvias: El pasto en el sitio 4 estaba muy denso (Díaz, datos sin publicar) y el sedimento es arenoso, a diferencia del sitio 2 donde el pasto no estaba tan desarrollado y el fondo es fangoso. No obstante, en ambas se presentaron valores bajos en el número de especies (6-9), y se encontraron las especies Hypnea spinella, Halimeda incrassata, H. monile, Thalassia testudinum y Gracilaria sp. Estos sitios, a pesar de tener características diferentes entre sí, se encuentran en una zona en la que se produce el paso de las corrientes de marea desde y hacia la Bahía de Cárdenas, por donde puede darse un intercambio de propágulos.
Grupo 3: En este grupo se encuentran los sitios 6, 7, 9, 9A, 10, 12, 11 en lluvias y 13 en secas, todas de la macrolaguna interior. Esta zona incluye parte de la Bahía de Santa Clara y la parte superior de la Bahía de Cárdenas, donde el sedimento oscila entre fangoso-arenoso y arenoso-fangoso (datos del Departamento de Oceanografía del Instituto de Oceanología), posee un intercambio medio con las aguas oceánicas y está influenciada por aportes de materia orgánica y de nutrientes procedentes de tierra firme y de los cayos de mangle. Se presentaron valores medios a altos del número de especies (12-48). Por estar en una zona intermedia entre los sitios exteriores y los interiores, aparecieron especies que también estuvieron en otros grupos de sitios: Ceramium nitens, Dasya corymbifera, Dictyota cervicornis, Cladophoropsis membranacea, Dictyosphaeria cavernosa, Halimeda lacrimosa, Penicillus dumetosus, P. pyriformis, Rhipocephalus phoenix var. brevifolius, Udotea flabellum, U. occidentales, Valonia macrophysa, Ventricaria ventricosa y Syringodium filiforme se comparten con los sitios exteriores (grupo 1); Con el grupo 4 comparte las especies Jania capillacea, Spyridia filamentosa, Anadyomene saldanhae, Caulerpa paspaloides var. wurdemanni, Acetabularia crenulata, Batophora occidentalis y B. oerstedii.
Grupo 4: Este grupo incluyó los sitios con menor intercambio de agua en la Bahía de Santa Clara (8, 8A, 9, 9A, y 11 en secas), que poseen un número de especies medio a bajo (6-13); el sedimento es fangoso con poca circulación (Alcolado & Espinosa, 1999) y los pastos son muy pobres (Díaz, datos sin publicar). Las especies presentes también se encuentran en los demás grupos.
Grupo 5: En este grupo se reunieron los sitios de la parte inferior de la Bahía de Cárdenas en lluvias (1, 1A, 2, todos en lluvias). Estos sitios tienen las condiciones más desfavorables para el desarrollo de la vegetación, con un fondo fangoso y mucha resuspensión de sedimentos que dificulta el paso de la luz hasta el fondo. No se encontró Thalassia testudinum y el número de especies fue bajo (6-9). Se localizaron varias especies de algas rojas filamentosas y carnosas, destacándose: Chondria atropurpurea, Gracilaria blodgetti, Hypnea spinella y Spyridia filamentosa.
Grupo 6: En este grupo se incluyen los sitios 5 y 13 en lluvias, con número bajo de especies (5 y 7 respectivamente). El sitio 5 tuvo una densidad alta de Thalassia, no así el sitio 13 (Díaz, datos sin publicar). En ambas coincidieron sólo cuatro especies: Laurencia intricata, Batophora oerstedii, Halodule wrightii y Thalassia testudinum.
El sitio 5 en secas sólo tuvo tres especies y el análisis de agrupamiento lo dejó fuera de los grupos formados.
Discusión
El número de especies encontradas en esta zona excede al hallado para todo el archipiélago en la prospección realizada en 1989 (88 especies en 109 sitios) (Martínez-Daranas et al. 1996) y la curva acumulativa de especies contra sitios apunta hacia un potencial aún mayor. Todo ello sugiere que esta zona posee una riqueza de especies del macrofitobentos más alta que otras del archipiélago, principalmente en la parte superior de la Bahía de Cárdenas y la zona exterior de los cayos.
En la prospección realizada en 1989, en trece sitios ubicados en el área de estudio, se encontraron 44 especies (Martínez-Daranas et al. 1996), de las cuales 37 fueron halladas en el inventario actual. De los 64 géneros registrados actualmente, 26 coinciden y solamente dos, Bryopsis y Neomeris no aparecieron en el 2001. Este incremento en el número de géneros y especies también puede deberse a que se realizó un mayor esfuerzo de muestreo, y a que se han dilucidado problemas taxonómicos de algunos grupos de macroalgas marinas que han dado lugar a un mayor número de géneros y de especies, como son los casos de los complejos Polysiphonia (Kim & Lee, 1999), Dictyota (Hörnig et al. 1992a, 1992b, 1993), Udotea, Anadyomene, Avrainvillea (Littler & Littler, 1990, 1991, 1992) y Laurencia (Sentíes & Fujii, 2002).
El análisis de agrupamiento sugiere que los sitios de menor estabilidad ambiental son los de la Bahía de Cárdenas (1, 1A, 2), así como los sitios 11 y 13, que aparecieron en grupos diferentes en los muestreos de secas y lluvias. Los demás grupos señalan diferencias relacionadas con las zonas geográficas estudiadas.
Al analizar el número de especies por zonas (Tabla 2), se observaron contrastes causados posiblemente por diferencias en el tipo de sustrato y por el grado de afectación: en la parte inferior de la Bahía de Cárdenas (sitios 1, 1A y 2) se encontraron solamente 36 especies. Esta zona tiene características hidrológicas de una bahía típica con sedimento fangoso, con una alta resuspensión, y ha sido impactada por residuales de diversos tipos (agropecuarios, industriales-agrícolas y domésticos-industriales), así como por dragados frecuentes. Existe en ella la única zona de prospección petrolera y explotación de hidrocarburos en el mar de todo el Archipiélago Sabana-Camagüey, y un creciente desarrollo turístico en la península de Hicacos. En la Bahía de Santa Clara (sitios 8, 8A, 9, 9A, 11, 12 y 13), con poca circulación, fondos de arena y fango y menos impactada por residuales, se registraron 62 especies, aunque en los sitios más cercanos a tierra la riqueza de especies fue menor. En la parte superior de la Bahía de Cárdenas (sitios 5, 6, 7, 10 y 14), que es una zona intermedia entre el océano abierto y las lagunas interiores, aparecieron 100 especies. En los sitios ubicados por la parte exterior de la cayería (sitios 3, 4, 15, 16, 17 y 18), que poseen un intercambio mayor con el océano, se encontraron 106 especies y no se halló Halodule wrightii, especie pionera que aparece en zonas perturbadas (Gallegos, 1995; Hemminga & Duarte, 2000). En los sitios 4 y 5 en particular se inventariaron pocas especies, lo que puede deberse a que la densidad de Thalassia testudinum tuvo valores comparativamente altos (mayores de 1500 vástagos m-2; Díaz, datos sin publicar), y la competitividad de dicha especie por el espacio impidió el asentamiento de muchas especies de algas. Thalassia testudinum es la especie dominante en la comunidad clímax en los pastos marinos del Caribe, cuando las condiciones son favorables (Phillips & Meñez, 1988; Gallegos, 1995; Hemminga & Duarte, 2000).
Los sitios con mayor número de especies están ubicados en zonas con intercambio con el océano, pero además reciben agua del interior de las macrolagunas con las corrientes de marea y a través de los canales entre cayos, como son los sitios 3 y 6, 7, 17 y 18, aunque en periodos de lluvia puede resultar contraproducente el arrastre de sedimento y otras sustancias disueltas o en suspensión.
En general no se presentaron diferencias notables en cuanto al número de especies o la composición genérica o específica entre ambas épocas del año, con excepción de la Bahía de Cárdenas, ya que en la época de secas no se hallaron especies de macroalgas en los sitios 1 y 1A, mientras que en lluvia, se favoreció el desarrollo algal.
Agradecimientos
Los autores expresan su agradecimiento al proyecto GEF-PNUD CUB/98/G32 "Acciones prioritarias para consolidar la protección del Ecosistema Sabana Camagüey". Al Coronel José María Finalé, así como a las tripulaciones de los buques "Delfín", de la Marina Gaviota, y "Proyecto", del Proyecto GEF/PNUD, quienes hicieron posible las expediciones. También agradecemos a Mutue Toyota Fujii, del Instituto de Botânica, São Paulo, Brasil, y a Abel Sentíes Granados, de la Universidad Autónoma Metropolitana - Iztapalapa, México, por su colaboración en el esclarecimiento de la taxonomía de muchas de las especies encontradas. Un agradecimiento especial a Gloria Garduño de la FES Iztacala de la Universidad Autónoma de México y a dos revisores anónimos por las sugerencias realizadas al manuscrito.
Referencias
ALCOLADO, E., E. GARCÍA & N. ESPINOSA. 1999. Protección de la biodiversidad y desarrollo sostenible en el ecosistema Sabana-Camagüey. Proyecto GEF/PNUD Sabana-Camagüey CUB/92/G31. CESYTA S. L., Madrid, 145 p. [ Links ]
BØRGESEN, F. 1915. The marine algae of the Danish West Indies. Part 3: Rhodophyceae (1). Dansk Botanisk Arkiv. 3: 1-130. [ Links ]
BØRGESEN, F. 1918. The marine algae of the Danish West Indies. Part 3: Rhodophyceae (1). Dansk Botanisk Arkiv. 3: 241-304. [ Links ]
BØRGESEN, F. 1920. The marine algae of the Danish West Indies. Part 3: Rhodophyceae (1). Dansk Botanisk Arkiv. 3: 369-498. [ Links ]
BOUDOURESQUE, C. F. 1974. Aire minima et peuplements algaux marins. Bulletin de la Societe Phycologique de France 19: 141-157. [ Links ]
CIRUJANO, S., R. OVIEDO, R. ECHEVARRÍA, G. STÜBING, J. B. PERIS & M. FERNÁNDEZ. 1998. Diversidad de la Flora Acuática de Cuba. Informe de Proyecto, Real Jardín Botánico, Madrid - Instituto de Ecología y Sistemática, La Habana, Programa de Cooperación con Iberoamérica, 12 p., 2 anexos, 5 Tablas. [ Links ]
CLARKE, K. R. & R. N. GORLEY. 2001. Primer v5: User Manual/Tutorial. Primer-E, Ltd., Plymouth. 91 p. [ Links ]
CRUZ, G. DE LA. 1982. Adiciones a la flora marina de Cuba. Revista de Investigaciones Marinas 3(3): 31-37. [ Links ]
DÍAZ-PIFERRER, M. 1964. Adiciones a la flora marina de Cuba. Caribbean Journal of Science 4(2-3): 353-371. [ Links ]
FARLOW, W. G. 1871. Cuban seaweeds. American Naturalist 5: 201-209. [ Links ]
FIELD, J. G., K. R. CLARKE & R. M. WARWICK, 1982. A practical strategy for analysing multispecies distribution patterns. Marine Ecology Progress Series, 8, 37-52. [ Links ]
GALLEGOS, M. E. 1995. Dinámica de poblaciones y crecimiento de los pastos marinos caribeños Thalassia testudinum Bank ex König, Syringodium filiforme Kutzing y Halodule wrightii Ascherson. Tesis para optar el grado de Doctor en Ciencias (Biología), UNAM, México D. F., 17 p. [ Links ]
GUIRY, M. D. & E. NIC DHONNCHA. 2002. AlgaeBase. <http://www.algae-base.org> [20/Junio/2003] [ Links ].
HARTOG, C. 1970. The seagrasses of the World. Amsterdam, North Holland Pub. Co., 275 p. [ Links ]
HEMMINGA, M. A. & C. M. DUARTE. 2000. Seagrass Ecology. Cambridge University Press. 298 p. [ Links ]
HÖRNIG, I., R. SCHNETTER & W. F. PRUD'HOMME VAN REINE. 1992a. The genus Dictyota (Phaeophyceae) in the North America, I: A new generic concept and new species. Nova Hedwigia 54(1-2): 45-62. [ Links ]
HÖRNIG, I., R. SCHNETTER & W. F. PRUD'HOMME VAN REINE. 1992b. The genus Dictyota (Phaeophyceae) in the North America, II: Key to the species. Nova Hedwigia 54(3-4): 397-402. [ Links ]
HÖRNIG, I., R. SCHNETTER & W. F. PRUD'HOMME VAN REINE. 1993. Additional note to "The genus Dictyota (Phaeophyceae) in the North America, I: A new generic concept and new species". Correction and validation of new combinations in the genus Dictyota. Nova Hedwigia 56(1-2): 169-171. [ Links ]
HOWE, M. A. 1909. Report on an expedition to Jamaica, Cuba and the Florida Keys. Journal of the New York Botanical Garden 10: 115-118. [ Links ]
HOWE, M. A. 1918. The marine algae and marine spermatophytes of the Tomas Barrera expedition to Cuba. Smithsonian Miscellaneous Collection 68(11): 1-13. [ Links ]
HUMM, H. J. & C. R. JACKSON, 1955. A collection of marine algae from Guantánamo Bay, Cuba. Bulletin of Marine Science Gulf and Caribbean 5(3): 240-246. [ Links ]
JIMÉNEZ, C. 1989. Corynomorpha clavata (Rhodophyta:Cryptonemiales), un nuevo registro para aguas cubanas. Acta Botánica Cubana 72: 1-4. [ Links ]
JIMÉNEZ, C. 1990. Macroalgas y fanerógamas marinas de la macrolaguna del Golfo de Batabanó. In: P. M. ALCOLADO (Ed.). El bentos de la macrolaguna del Golfo de Batabanó, Editorial Academia, La Habana, pp. 14-17. [ Links ]
KIM, M. S. & I. K. LEE. 1999. Neosiphonia flavimarina gen. et sp. nov., with a taxonomic reassessment of the genus Polysiphonia (Rhodo-melaceae, Rhodophyta). Phycological Research 47: 271-281. [ Links ]
LITTLER, D. S. & M. M. LITTLER. 1990. Systematics of Udotea species (Bryopsidales, Chlorophyta) in the tropical western Atlantic. Phycologia 29(2): 206-252. [ Links ]
LITTLER, D. S. & M. M. LITTLER. 1991. Systematics of Anadyomene species (Anadyomenaceae, Chlorophyta) in the tropical western Atlantic. Journal of Phycology 27: 101-118. [ Links ]
LITTLER, D. S. & M. M. LITTLER, 1992. Systematics of Avrainvillea (Bryopsidales, Chlorophyta) in the tropical western Atlantic. Phycologia 31(5): 375-418. [ Links ]
LITTLER, D. S. & M. S. LITTLER, 2000. Caribbean Reef Plants. An identification guide to the reef plants of the Caribbean, Bahamas, Florida and Gulf of Mexico. Offshore Graphics, Inc., 542 p. [ Links ]
MARTÍNEZ-DARANAS, B., J. DÍAZ & M. ESQUIVEL. 2002. Nuevos registros de algas marinas cubanas (II). Avicennia 15: 147-149. [ Links ]
MARTÍNEZ-DARANAS, B., M. ESQUIVEL & M. HERNÁNDEZ. 2001. Nuevos registros de algas marinas cubanas. Avicennia 14: 135-137. [ Links ]
MARTÍNEZ-DARANAS, B., C. JIMÉNEZ & P. M. ALCOLADO. 1996. Prospección del macrofitobentos de los fondos blandos del Archipiélago Sabana-Camagüey. Avicennia 4/5: 77-88. [ Links ]
MONTAGNE, C. 1842. Criptogamia o Plantas Celulares. In: RAMÓN DE LA SAGRA (Ed.). Historia física, política y natural de la Isla de Cuba. Paris, Vol. 9, pp. 1-54. [ Links ]
PHILLIPS, R. C. & E. G. MEÑEZ. 1988. Seagrasses. Smithsonian Contribution to Marine Sciences 34:1-104. [ Links ]
SENTÍES, A. G. & M. T. FUJII, 2002. El complejo Laurencia (Rhodomelaceae, Rhodophyta) en el Caribe mexicano. In: A. SENTÍES y K. DRECKMANN N. (Eds.). Monografías Ficológicas. Universidad Nacional Autónoma Metropolitana - Iztapalapa, Red Latinoamericana de Botánica, México, D. F., pp. 121-192. [ Links ]
SILVA, P. 2001. Index Nominum Algarum, <http://ucjeps.berkeley.edu/I-NA.html> [20/Junio/2003] [ Links ].
SUÁREZ, A. M. 1973. Catálogo de algas cubanas. Ciencias, Ser. 8, Investigaciones Marinas (Cuba), 2: 107 p., + 10 p. (supl. [ Links ]).
TAYLOR, WM. R. 1960. Marine Algae of the Eastern Tropical and Subtropical Coasts of Americas. The University of Michigan Press, 870 p. [ Links ]
WWF/CITMA/CNAP. 2000. Marco legal. Sistema Nacional de Áreas Protegidas, Cuba. MPH Graphics, Inc., 47 p. [ Links ]
WYNNE, M. J. 1998. A checklist of benthic marine algae of the tropical and subtropical western Atlantic: first revision. Nova Hedwigia 116: 155 p. [ Links ]
WYNNE, M. J. & D. L. BALLANTINE. 1986. The genus Hypoglossum Kützing (Delesseriaceae, Rhodophyta) in the tropical western Atlantic, including H. anomalum sp. nov. Journal of Phycology 22: 185-193. [ Links ]














