Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Ciencias marinas
Print version ISSN 0185-3880
Cienc. mar vol.49 Ensenada Jan./Dec. 2023 Epub Dec 08, 2023
https://doi.org/10.7773/cm.y2023.3344
Artículos
Rasgos de la vida temprana de la dorada común de dos bandas, Diplodus vulgaris (Perciformes: Sparidae), que habita en las aguas poco profundas de la isla de Gökçeada, Turquía
1Çanakkale Onsekiz Mart University, Faculty of Canakkale Applied Sciences, Department of Fisheries Technology, Çanakkale, Turkey. Email: aytacaltin@gmail.com
Se investigó la duración y el crecimiento de las larvas pelágicas de la dorada común de dos bandas,Diplodus vulgaris. Los ejemplares fueron recolectados con un chinchorro playero en aguas poco profundas de la isla de Gökçeada, Turquía. La edad mínima diaria estimada fue de 41 d, y la máxima de 339 d. La tasa media de crecimiento diario de las crías del año deD. vulgarisfue de 0.330 mm·d-1. Los individuos deD. vulgarisexhibieron una marca de asentamiento Tipo Ia con duración larvaria pelágica de 29 d. El periodo de eclosión ocurrió entre noviembre y abril. Las frecuencias máximas de eclosión se observaron en el invierno, cuando la temperatura del agua era relativamente baja. Los datos del logaritmo natural de la abundancia de las crías del año se graficaron contra la edad, y se estimaron los coeficientes de mortalidad. Las relaciones entre la longitud total y las medidas morfométricas de otolitos (longitud [LO], ancho [AO] y radio [RO] de otolitos) se describieron mediante ecuaciones lineales. Además, se observó que esta relación exhibió una relación lineal entre la LO, el AO y el RO y la longitud total y la edad diaria.
Palabras clave: tasa de crecimiento diario; periodo de eclosión; Diplodus vulgaris
Daily growth rates and pelagic larval duration were investigated in the common two-banded seabream (Diplodus vulgaris). Fish were sampled using a beach seine from the shallow waters of Gökçeada Island, Turkey, between June 2013 and June 2014. The minimum and maximum daily age estimates were 41 and 339 d, respectively. The mean daily growth rate of young-of-the-yearD. vulgariswas 0.330 mm·d-1. Our results showed thatD. vulgarisexhibits a Type Ia settlement-mark with a pelagic larval duration of 29 d. The hatching period occurred from November to April. The maximum hatching frequencies were observed in winter, when the water temperature was relatively low. The natural logarithm of young-of-the-year abundance data was plotted against age, and the instant mortality coefficients were estimated. The relationships between total length and otolith morphometric measurements (otolith length [OL], width [OW], and radius [OR]) were defined by linear equations. Furthermore, it was observed that this ratio exhibited a linear relationship with OL, OW, and OR and total length and daily age.
Key words: daily growth rate; hatching period; Diplodus vulgaris
Introducción
Diplodus vulgarises una especie de pez demersal que se encuentra en el mar Mediterráneo y el mar Negro occidental y a lo largo de la costa atlántica oriental (de Francia a Senegal y de Angola a Sudáfrica), incluidos los archipiélagos de Madeira, Azores y Canarias (Bauchot y Hureau 1990). Esta especie se encuentra principalmente en aguas poco profundas (menos de 50.0 m de profundidad) y prefiere fondos rocosos y arenosos, aunque los juveniles deD. vulgarisgeneralmente prefieren las lagunas costeras (Monteiro 1989, Ribeiro et al. 2008, Altin et al. 2015a). Además, se han encontrado individuos deD. vulgarisde menos de 12.0 cm de longitud total (LT) en áreas costeras de pastos marinos donde hay abundantes recursos alimentarios disponibles (Abecasis et al. 2009, Altin et al. 2015b).
A lo largo del noroeste del mar Mediterráneo y las costas de Portugal, la temporada de desove deD. vulgaristiene lugar en octubre y noviembre (Bauchot y Hureau 1986, Jug-Dujaković y Glamuzina 1988, Gonçalves y Erzini 2000, Hadj-Taieb et al. 2012, Mouine et al. 2012). En el Mediterráneo central se ha reportado que la temporada de desove ocurre de diciembre a febrero (Hadj-Taieb et al. 2013). En el momento de la primera reproducción, la longitud corporal deD. vulgarises de aproximadamente 17.4 cm, lo que corresponde a una edad de 4 años (Mouine et al. 2012).
Diplodus vulgarises una especie económicamente importante que es ampliamente capturada por la pesca artesanal y la pesca industrial. A lo largo de las costas de Turquía, las artes de pesca más comunes utilizadas para capturar esta especie son las redes agalleras y los palangres. Los datos de crecimiento deD. vulgarisson cruciales para el desarrollo de estrategias de manejo adecuadas; sin embargo, muchos aspectos biológicos de esta especie aún son desconocidos (Pauly 1983), y la mayoría de los estudios de edad y crecimiento se centran en individuos adultos (Gordoa y Molí 1997, Gonçalves et al. 2003, Pajuelo y Lorenzo 2003, Mouine et al. 2010, Dulčić et al. 2011, Hadj-Taieb et al. 2013). Aunque se han reportado validaciones de depósitos diarios en anillos (Vigliola 1997, Villanueva y Molí 1997), mediciones de LT y otolitos (Altin y Ayyildiz 2018), fechas de desove y duración de larvas pelágicas (DLP; Macpherson y Raventos 2006, Galarza et al. 2009, di Franco et al. 2013), solo se ha realizado un estudio de la tasa de crecimiento diario hasta la fecha (Ayyildiz et al. 2015).
El objetivo principal del presente estudio fue evaluar el periodo de eclosión, la DLP, la tasa de crecimiento diario y la mortalidad de los juveniles del año (JDA) deD. vulgarisde las aguas poco profundas de la isla de Gökçeada, Turquía, usando la microestructura de otolitos.
Materiales y métodos
Este estudio se realizó en aguas poco profundas (0.00-2.00 m) de la isla de Gökçeada, Turquía, entre junio de 2013 y junio de 2014 (Fig. 1). En total, se recolectaron 309 JDA deD. vulgariscon un chinchorro de playa de 32.00 m (LT) (malla elástica de 13.00 mm) con alas de 15.00 m de longitud. El copo medía 2.00 × 2.00 × 0.60 m, con luz de malla de 5.00 mm. Se usó una sobredosis de quinaldina para matar a los peces recolectados y una solución de alcohol al 70.00% para almacenar a los especímenes.
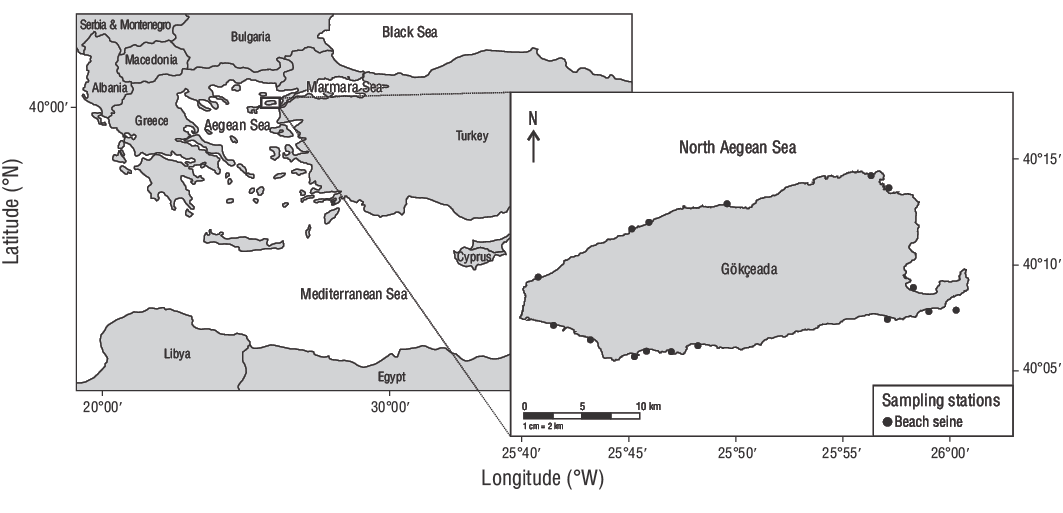
Figura 1. Estaciones de muestreo empleadas en este estudio. Se utilizó un chinchorro playero para recolectar ejemplares de dorada común de dos bandas (Diplodus vulgaris) de las aguas poco profundas de la isla de Gökçeada, Turquía.
Se obtuvo la LT (al 1.00 mm más cercano) y el peso total (P, al 0.01 g más cercano) de los especímenes deD. vulgaris. La relación entrePy LT se determinó utilizando la siguiente función de potencia:
dondeaes la constante de regresión ybes el coeficiente de regresión. Se calcularon los parámetros de regresión (a,b) y el coeficiente de determinación (r 2) para todos los especímenes.
Se extrajeron otolitos sagitales de los especímenes y se almacenaron en tubos Eppendorf. En el examen preliminar, 79 otolitos fueron excluidos del análisis de determinación de la edad debido a fracturas. Por tanto, 230 otolitos sagitales, que cubrían todas las clases de longitud, se incrustaron en cemento termoplástico en portaobjetos de vidrio. Se utilizaron papeles abrasivos (12.00, 9.00 y 3.00 mm) para lijar cada muestra. Posteriormente, cada muestra se pulió con un paño de pulido y pasta de alúmina (0.30 mm) hasta que se reconocieron los anillos de crecimiento diario desde el núcleo del otolito hasta su borde (Secor et al. 1991, Jones 1992). El número de anillos en otolitos para cada muestra se determinó mediante conteos ciegos realizados por 2 lectores independientes que no tenían conocimiento del espécimen. Se utilizó un microscopio óptico para contar los anillos de crecimiento diarios (Fig. 2). Las estimaciones de la precisión de los conteos diarios de anillos de crecimiento de los lectores se detectaron utilizando el coeficiente de variación (CV) de Chang (1982) y el error porcentual promedio de Beamish y Fournier (1981).

Figura 2. Imágenes de los anillos de crecimiento vistos en un otolito sagital pulido (17 mm de longitud total) de un espécimen de los juveniles del año deDiplodus vulgarisde 54 días de edad.
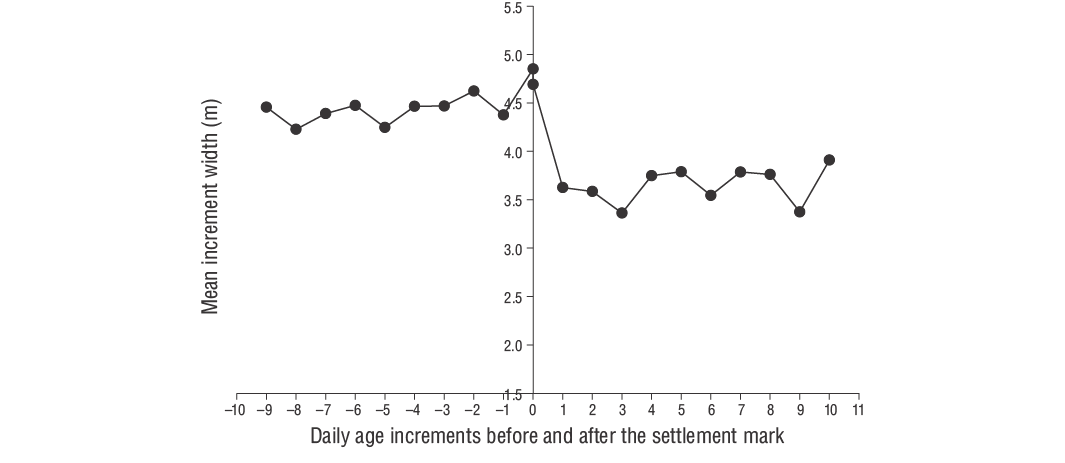
La relación entre la edad (días) y el tamaño (LT) de los peces se evaluó usando una regresión lineal con la tasa de crecimiento promedio (mm·d-1). Las tasas de crecimiento diario de cada individuo se estimaron utilizando la pendiente del análisis de regresión de la edad diaria y la LT. El crecimiento diario de otolitos (ancho de incremento) se midió usando ImageJ (v.1.52a). Según Wilson y McCormick (1999), la marca de asentamiento se puede clasificar en una de 3 categorías (I, II o III) y 2 subcategorías (a, b). El Tipo I se clasifica por la clara disminución del ancho de los incrementos a lo largo de la marca de asentamiento. En el Tipo Ia, la transición del asentamiento concluye dentro de un incremento, mientras que en el Tipo Ib, la transición del asentamiento ocurre en múltiples incrementos (Raventós y Macpherson 2001).
Por medio de la sustracción del número de incrementos de la fecha de captura, se calcularon las distribuciones de las fechas de eclosión (cálculo retroactivo). Utilizando las relaciones longitud-edad, el tamaño de los peces se convirtió a edad (día) para determinar el coeficiente de mortalidad instantánea (Z). La abundancia de peces se agrupó en intervalos de 20 días. Se utilizó el método de Ricker (1975) de la curva de captura basada en edad para estimar el coeficiente de mortalidad. Se realizó un análisis de regresión lineal con el conjunto de datos transformados a logaritmo natural (ln), y las pendientes de las líneas de regresión reflejaron Z. Los porcentajes de mortalidad diaria (MD) se determinaron de la siguiente manera:
Se utilizó elsoftwarede imágenes QCapture (QImaging; Surrey, Columbia Británica, Canadá) para medir la longitud (LO), el ancho (AO) y el radio (RO) de los otolitos con una precisión de 0.001 mm. Las diferencias entre las mediciones de los otolitos izquierdo y derecho se analizaron mediante una pruebatpareada. Se examinaron las relaciones entre la LT y las medidas morfométricas de otolitos.
Resultados
Se capturaron un total de 309 especímenes de JDA deD. vulgaris(14.00 a 102.00 mm LT) entre junio de 2013 y junio de 2014 (Fig. 3). Los parámetros de las relaciones longitud-peso se proporcionan para todas las muestras en la Figura 4. Las estimaciones de la edad diaria se determinaron con éxito a partir de la submuestra que constaba de 209 otolitos sagitales de los JDA deD. vulgaris(14.00 a 102.00 mm LT; Tabla 1). Las estimaciones de la edad diaria mínima y máxima fueron 41 d (14.00 mm LT) y 339 d (102.00 mm LT). No se detectaron diferencias significativas en las estimaciones de la edad diaria entre los otolitos derechos e izquierdos (pruebatpareada:n= 30,P> 0.05). El error porcentual promedio y el CV fueron 5.40% y 6.90%, respectivamente, y solo se excluyeron 21 otolitos debido a que estaban demasiado lijados o agrietados. El porcentaje de error promedio y el CV obtenidos en este estudio son cercanos a sus puntos de referencia aceptados. Los grupos de la edad diaria dominantes fueron 41-59 y 60-79 d (14.00-27.00 mm LT; 47.80%). La tasa media de crecimiento diario deD. vulgarisfue de 0.330 mm·d-1(Fig. 5).
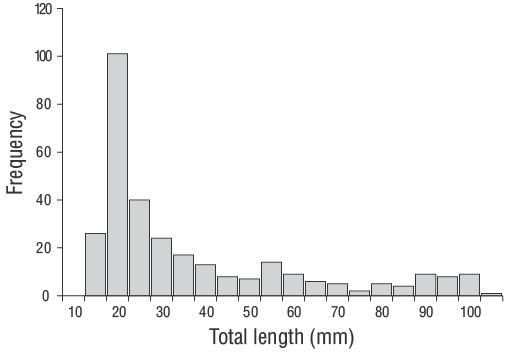
Figura 3. Distribución de la frecuencia-longitud de los juveniles del año deDiplodus vulgarisrecolectados (n= 309) en las aguas poco profundas de la isla de Gökçeada durante todo el periodo de muestreo de este estudio (junio de 2013 a junio de 2014).
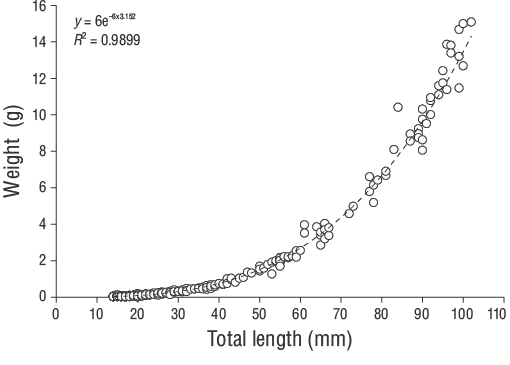
Figura 4. Relaciones longitud-peso de los juveniles del año deDiplodus vulgarisrecolectados en las aguas poco profundas de la isla de Gökçeada.
Tabla 1. Clave de edad-longitud para los juveniles del año deDiplodus vulgaris.N, número total de individuos por longitud/grupo de edad.
| Length groups (mm) | Daily age | N | ||||||||||||||
| 41-59 | 60-79 | 80-99 | 100-119 | 120-139 | 140-159 | 160-179 | 180-199 | 200-219 | 220-239 | 240-259 | 260-279 | 280-299 | 300-319 | 320-339 | ||
| 14-20 | 41 | 34 | 75 | |||||||||||||
| 21-27 | 1 | 23 | 14 | 38 | ||||||||||||
| 28-34 | 1 | 10 | 9 | 3 | 23 | |||||||||||
| 35-41 | 1 | 8 | 9 | 1 | 1 | 20 | ||||||||||
| 42-48 | 1 | 2 | 2 | 5 | ||||||||||||
| 49-55 | 2 | 3 | 3 | 8 | ||||||||||||
| 56-62 | 1 | 2 | 3 | 6 | ||||||||||||
| 63-69 | 2 | 2 | 4 | |||||||||||||
| 70-76 | 1 | 1 | 2 | |||||||||||||
| 77-83 | 3 | 4 | 7 | |||||||||||||
| 84-90 | 6 | 4 | 10 | |||||||||||||
| 91-97 | 1 | 6 | 7 | |||||||||||||
| 98-102 | 3 | 1 | 4 | |||||||||||||
| N | 42 | 58 | 25 | 18 | 16 | 7 | 7 | 5 | 3 | 3 | 4 | 7 | 10 | 3 | 1 | 209 |
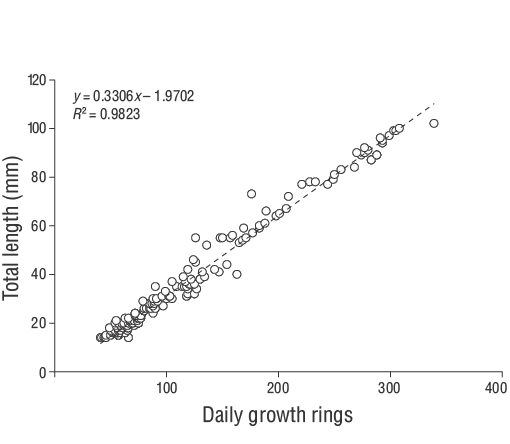
Figura 5. Relaciones edad-longitud estimadas para los juveniles del año deDiplodus vulgarisrecolectados en las aguas poco profundas de la isla de Gökçeada entre junio de 2013 y junio de 2014.
De acuerdo con Wilson y McCormick (1999), los individuos de los JDA deD. vulgarisexhiben marcas de asentamiento Tipo Ia (Fig. 6). La duración de la fase larvaria pelágica de los individuos de los JDA deD. vulgarisfue de 29 d. El periodo de eclosión abarcó de noviembre a abril, aunque se observaron tasas de eclosión más altas en diciembre y enero (Fig. 7). El valor de Z para los JDA deD. vulgarisfue de 0.0195, lo que corresponde a una tasa de mortalidad diaria de aproximadamente 1.95% (Fig. 8). Las medidas morfométricas de LO, AO y RO de los otolitos oscilaron entre 0.514 y 7.331 mm, 0.391-4.349 mm y 0.247-3.551 mm, respectivamente (Tabla 2). Las relaciones entre LT y LO, AO y RO se describieron mediante ecuaciones lineales en la Tabla 3.
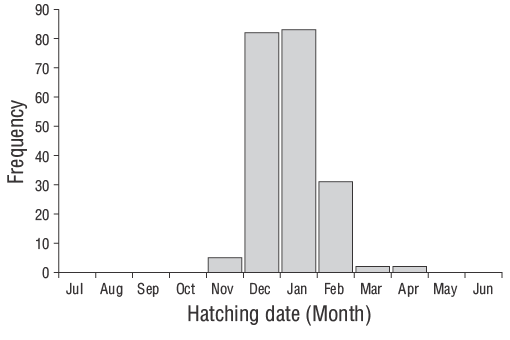
Figura 7. Distribuciones de la frecuencia de las fechas de eclosión retrocalculadas utilizando las estimaciones de la edad diaria y fechas de los muestreos de los juveniles del año deDiplodus vulgarisrecolectados en las aguas poco profundas de la isla de Gökçeada entre junio de 2013 y junio de 2014.
Tabla 2. Medidas morfométricas de otolitos de juveniles del año deDiplodus vulgarissegún los grupos de longitud. Min., valor mínimo; Max., valor máximo; SD, desviación estándar.
| Length group (mm) | Otolith length | Otolith width | Otolith radius | ||||||||||||
| Min. | Max. | Mean | SD | Min. | Max. | Mean | SD | Min. | Max. | Mean | SD | ||||
| 14-20 | 0.515 | 1.244 | 0.812 | 0.130 | 0.392 | 0.849 | 0.584 | 0.093 | 0.247 | 0.599 | 0.386 | 0.076 | |||
| 21-27 | 0.515 | 1.724 | 1.054 | 0.205 | 0.404 | 1.190 | 0.740 | 0.126 | 0.247 | 0.838 | 0.503 | 0.107 | |||
| 28-34 | 1.138 | 1.618 | 1.388 | 0.106 | 0.764 | 1.120 | 0.970 | 0.071 | 0.564 | 1.279 | 0.695 | 0.143 | |||
| 35-41 | 1.205 | 1.838 | 1.623 | 0.152 | 0.884 | 1.481 | 1.136 | 0.118 | 0.566 | 0.945 | 0.798 | 0.090 | |||
| 42-48 | 1.213 | 2.134 | 1.791 | 0.375 | 0.895 | 1.322 | 1.166 | 0.165 | 0.592 | 1.018 | 0.858 | 0.175 | |||
| 49-55 | 2.226 | 2.455 | 2.348 | 0.080 | 1.491 | 1.731 | 1.545 | 0.078 | 1.071 | 1.222 | 1.142 | 0.057 | |||
| 56-62 | 2.382 | 2.938 | 2.565 | 0.197 | 1.575 | 1.865 | 1.673 | 0.104 | 1.146 | 1.272 | 1.190 | 0.044 | |||
| 63-69 | 2.663 | 2.849 | 2.745 | 0.083 | 1.791 | 1.916 | 1.854 | 0.052 | 1.285 | 1.431 | 1.337 | 0.066 | |||
| 70-76 | 3.098 | 3.136 | 3.117 | 0.027 | 1.926 | 2.092 | 2.009 | 0.117 | 1.496 | 1.514 | 1.505 | 0.013 | |||
| 77-83 | 2.976 | 3.402 | 3.185 | 0.163 | 2.057 | 2.241 | 2.144 | 0.076 | 1.437 | 1.635 | 1.548 | 0.074 | |||
| 84-90 | 3.404 | 3.967 | 3.602 | 0.178 | 2.173 | 2.529 | 2.382 | 0.117 | 1.644 | 1.914 | 1.735 | 0.084 | |||
| 91-97 | 3.243 | 4.021 | 3.776 | 0.239 | 1.983 | 2.621 | 2.447 | 0.203 | 1.487 | 1.932 | 1.804 | 0.138 | |||
| 98-104 | 3.860 | 4.206 | 4.033 | 0.141 | 2.518 | 2.789 | 2.643 | 0.112 | 1.778 | 1.950 | 1.902 | 0.083 | |||
Tabla 3. Parámetros de la relación lineal de la longitud, el ancho y el radio de los otolitos con la longitud total para los juveniles del año deDiplodus vulgarisrecolectados en las aguas poco profundas de la isla de Gökçeada. Se muestran el número de individuos (n), el intercepto eny(a), la pendiente de la línea de regresión (b) y el coeficiente de determinación (r 2).
| Otolith morphometry | n | a | b | r 2 | P |
| Otolith length | 209 | -5.8329 | 27.143 | 0.967 | <0.010 |
| Otolith width | 209 | -9.2516 | 43.013 | 0.957 | <0.010 |
| Otolith radius | 209 | -6.3141 | 57.930 | 0.921 | <0.010 |
Discusión
El periodo de eclosión de los juveniles deD. vulgarisen las aguas poco profundas de la isla de Gökçeada ocurrió de noviembre a abril. Las frecuencias máximas de eclosión se observaron en invierno (diciembre y enero) cuando la temperatura del agua era relativamente baja. Las variaciones temporales y espaciales en las condiciones hidrográficas afectan directamente la reproducción, el desove, la disponibilidad de pesces y la distribución de diferentes especies, así como la abundancia de sus larvas (Isari et al. 2008). Wootton (1990) informó que la temperatura es el factor ambiental crucial que controla los eventos de reproducción. De hecho, al evaluar las características reproductivas de las especies de espáridos, Pajuelo et al. (2006) indicaron que la reproducción está asociada con la disponibilidad de nutrientes y la temperatura del agua. Sin embargo, se sabe que los periodos de desove en especies de peces varían de un año a otro dependiendo de los factores ambientales y biológicos (Gonçalves y Erzini 2000, Morato et al. 2003, Pajuelo et al. 2006).
Estudios anteriores reportaron el desove invernal deD. vulgarisa lo largo de la costa de Portugal (Gonçalves y Erzini 2000) y en el mar Mediterráneo central (Jug-Dujaković y Glamuzina 1988, Mouine et al. 2012). Di Franco et al. (2013) también indicaron que el desove ocurrió del 20 de octubre al 14 de febrero en el mar Adriático. En las aguas poco profundas de Çanakkale, Turquía, Ayyildiz et al. (2015) indicaron que las frecuencias de eclosión más altas deD. vulgarisse observaron en enero. Además, se ha reportado que la temporada de desove de esta especie en el golfo de Gabes ocurre en invierno (Hadj-Taieb et al. 2013). Por lo tanto, otros investigadores han reportado resultados similares para regiones distintas.
La DLP, que se define como el periodo de tiempo durante el cual las larvas crecen en la columna de agua como parte del plancton, se puede determinar en los peces con las marcas de incremento diario en los otolitos (Macpherson y Raventos 2006). El número de incrementos desde el núcleo del otolito hasta la marca de asentamiento se puede utilizar para determinar la DLP. En este estudio, todos los especímenes exhibieron marcas de asentamiento, los cuales son marcadores de tiempo esenciales que se necesitan para determinar la DLP y los patrones de reclutamiento (Wilson y McCormick 1999). Las determinaciones de la edad diaria de los JDA deD. vulgarisse realizaron con éxito con los otolitos sagitales mediante el conteo de los incrementos (ver métodos).
Determinamos que el crecimiento de los otolitos (LO, AO y RO) en los JDA deD. vulgarises proporcional a la LT y la edad del pez. De hecho, esta proporción exhibió relaciones lineales entre la LO, el AO y el RO y la LT y la edad diaria. También encontramos que los JDA deD. vulgarispresentan marcas de asentamiento Tipo Ia según los criterios de Wilson y McCormick (1999). Las marcas de asentamiento en los otolitos de las especies de crecimiento lento, como los espáridos, pueden determinarse por una rápida disminución en el ancho de los incrementos de crecimiento diarios (Vigliola et al. 2000, Ayyildiz y Altin 2021). En este estudio, estimamos que la DLP paraD. vulgarises de 29 d.
Macpherson y Raventos (2006) determinaron una relación débil pero notoria y positiva entre la DLP y el rango de distribución. En el Mediterráneo, la DLP deD. vulgarisdifiere entre áreas geográficas. En Marsella, Francia, Vigliola et al. (2000) encontraron queD. vulgarisse había asentado en el ambiente demersal 25 d después de la eclosión. Además, Galarza et al. (2009) reportaron que la DLP deD. vulgarisosciló entre 29 y 58 d en el mar Mediterráneo occidental. Los tiempos de asentamiento de los JDA deD. vulgaristambién pueden diferir según la región del mar Mediterráneo. Por ejemplo, García-Rubies y Macpherson (1995) reportaron 2 picos aparentes para los JDA deD. vulgarisa principios de noviembre y marzo/abril en el noroeste del Mediterráneo que reflejan una estrategia de reclutamiento intermitente. Sin embargo, Vigliola et al. (2000) determinaron queD. vulgarisse asentó en otoño e invierno en Marsella, Francia. Estos hallazgos apoyan aún más la idea de Vigliola et al. (2000) de que las especies deDiploduscon periodos de asentamiento invernal (e.g.,Diplodus puntazzoyD. vulgaris) muestran tiempos de DLP más prolongados que las especies que se asientan en meses más cálidos (e.g.,Diplodus sargus; García-Rubies y Macpherson 1995, Macpherson 1998, Vigliola 1998).
Las tasas de crecimiento de los peces durante las primeras etapas de vida afectan el éxito de la supervivencia, y el crecimiento y la mortalidad de las larvas están estrechamente relacionados (Jones 1986, Vigliola 1997). En general, las tasas de crecimiento larvario más rápidas se asocian con una mayor supervivencia en el plancton, por lo que un crecimiento más rápido puede resultar en un reclutamiento alto (Sim-Smith et al. 2012). Monteiro (1989) encontró que la tasa de crecimiento diario de los JDA deD. vulgarisera de 0.240 mm·d-1en la laguna de Ria Formosa. En otro estudio, Ayyildiz et al. (2015) encontraron que la tasa media de crecimiento somático de los juveniles deD. vulgarisera de 0.273 mm·d-1en las aguas poco profundas de Çanakkale, Turquía. A partir de los resultados de los estudios experimentales de verificación de la edad realizados en el mar Mediterráneo, se encontró que las tasas de crecimiento diario eran de 0.150 y 0.200 mm·d-1(Vigliola 1997). En este estudio, la tasa media del crecimiento diario de los juveniles deD. vulgarisfue de 0.330 mm·d-1, la cual es superior a la reportada en otros estudios. Esto puede deberse a las diferencias en la disponibilidad de nutrientes entre regiones dado que la dieta es un determinante esencial de la tasa de crecimiento de los peces (Jones 1986).
Como se mencionó anteriormente, un crecimiento más rápido se asocia con una mayor supervivencia (Sogard 1997, Ayyildiz et al. 2014, Bouchoucha et al. 2018, Ayyildiz y Altin 2020). De hecho, se ha demostrado que los peces de rápido crecimiento progresan a través de las primeras etapas de la vida en periodos de tiempo relativamente cortos, mientras que muestran bajas tasas de mortalidad (Takahashi y Watanabe 2004). En este estudio, la mortalidad diaria de los JDA de D. vulgarisfue de 1.93%. Cabe destacar que la tasa de mortalidad deD. vulgarisen este estudio fue menor que la de los JDA deDiplodus annularis(23.00%) de la misma región (Altin et al. 2016). Un estudio similar realizado en la costa suroeste de Francia reportó que la tasa de mortalidad promedio de los juveniles deD. vulgarisosciló entre el 71.40% y el 76.50% en los 4 meses posteriores al asentamiento (Planes et al. 2009).
En el norte del mar Egeo, un área rica en nutrientes, observamos que los JDA deD. vulgarisdesovan en invierno. Aunque la DLP no es un indicador fuerte del tamaño del área de distribución (Macpherson y Raventos 2006), se observó una DLP relativamente corta en esta área en comparación con lo que se ha reportado para otras áreas del mar Mediterráneo. Finalmente, se detectó una mortalidad relativamente baja y altas tasas de crecimiento para los juveniles deD. vulgarisen las aguas poco profundas de la isla Gökçeada. En general, estas aguas poco profundas constituyen un hábitat adecuado para los peces juveniles.
Agradecimientos
El Consejo de Investigación Científica y Tecnológica de Turquía financió esta investigación (número de proyecto: 112Y062).
REFERENCIAS
Abecasis D, Bentes L, Erzini K. 2009. Home range, residency and movements ofDiplodus sargusandDiplodus vulgarisin a coastal lagoon: Connectivity between nursery and adult habitats. Estuar Coast Mar Sci. 85(4):525-529. http://dx.doi.org/10.1016/j.ecss.2009.09.001 [ Links ]
Altin A, Ayyildiz H. 2018. Relationships between total length and otolith measurements for 36 fish species from Gökçeada Island, Turkey. J Appl Ichthyol. 34(1):136-141. https://doi.org/10.1111/jai.13509 [ Links ]
Altin A, Ayyildiz H, Kale S, Alver C. 2015a. Length-weight relationships of forty-nine fish species from shallow waters of Gökçeada Island, Northern Aegean Sea Turkey. Turk J Zool. 39(5):971-975. https://doi.org/10.3906/zoo-1412-15 [ Links ]
Altin A, Ayyildiz H, Ozen O, Yuksek A, Acarli D. 2016. Gökçeada sığ sularındaki larva ve genç balıkların biyoçeşitliliği, dağılımı ve populasyon parametreleri [Biodiversity, distribution and population parameters of larvae and young of the year (YOY) fishes in the shallow waters of Gökçeada]. Çanakkale (Turkey): Tubitak. Project Report 112Y062. 262 p. [ Links ]
Altin A, Özen Ö, Ayyildiz H, Ayaz A. 2015b. Feeding habits and diet overlap of juveniles of 2 sparids,Diplodus puntazzo(Walbaum, 1792) andDiplodus vulgaris(Geoffroy Saint-Hilaire, 1817), from the North Aegean Sea of Turkey. Turk J Zool . 39(1):80-87. https://doi.org/10.3906/zoo-1312-2 [ Links ]
Ayyildiz H, Altin A. 2020. Hatching time and early growth ofDiplodus sargus sargusinhabiting a coastal area of Gökçeada Island, Turkey. Thalassas. 36:1-8. https://doi.org/10.1007/s41208-019-00185-9 [ Links ]
Ayyildiz H, Altin A. 2021. Pelagic larval duration and early growth of striped seabream,Lithognathus mormyrusinhabiting the Gökçeada shallow waters, Turkey. Res Mar Sci. 6(1):883-895. [ Links ]
Ayyildiz H, Ozen O, Altin A. 2014. Growth and hatching of annular seabream,Diplodus annularis, from Turkey determined from otolith microstructure. J Mar Biol Assoc UK. 94(5):1047-1051. https://doi.org/10.1017/s002531541400040x [ Links ]
Ayyildiz H, Ozen O, Altin A. 2015. Daily growth rates and hatch date distributions of common two-banded seabream,Diplodus vulgarisinhabiting the Çanakkale shallow waters of Turkey. J Mar Biol Assoc UK . 95(1):185-191. https://doi.org/10.1017/s0025315414001222 [ Links ]
Bauchot ML, Hureau JC. 1986. Sparidae. In: Whitehead PJP, Bauchot ML, Hureau JC, Nielsen J, Tortonese E (eds.), Fishes of the north-eastern Atlantic and the Mediterranean No. II. Paris (France): UNESCO. p. 883-907. [ Links ]
Bauchot ML, Hureau JC. 1990. Sparidae. In: Hureau JC, Karrer C, Post A, Saldanha L (eds.), Check list of the fishes of the eastern tropical atlantic. Paris (France): Clofeta II, UNESCO. p. 790-812. [ Links ]
Beamish RJ, Fournier DA. 1981. A method for comparing the precision of a set of age-determinations. Can J Fish Aquat Sci. 38(8):982-983. https://doi.org/10.1139/f81-132 [ Links ]
Bouchoucha M, Brach-Papa C, Gonzalez JL, Lenfant P, Darnaude AM. 2018. Growth, condition and metal concentration in juveniles of twoDiplodusspecies in ports. Mar Pollut Bull. 126:31-42. https://doi.org/10.1016/j.marpolbul.2017.10.086 [ Links ]
Chang WYB. 1982. A statistical-method for evaluating the reproducibility of age-determination. Can J Fish Aquat Sci. 39(8):1208-1210. https://doi.org/10.1139/f82-158 [ Links ]
Di Franco A, Qian KC, Calo A, Di Lorenzo M, Planes S, Guidetti P. 2013. Patterns of variability in early life traits of a mediterranean coastal fish. Mar Ecol Prog Ser. 476:227-235. https://doi.org/10.3354/meps10117 [ Links ]
Dulčić J, Pallaoro A, Matić-Skoko S, Dragičević B, Tutman P, Grgičević R, Stagličić N, Bukvić V, Pavličević J, Glamuzina B et al. 2011. Age, growth and mortality of common two-banded seabream,Diplodus vulgaris(Geoffroy Saint-Hilaire, 1817), in the eastern Adriatic Sea (Croatian coast). J Appl Ichthyol . 27(5):1254-1258. https://doi.org/10.1111/j.1439-0426.2011.01806.x [ Links ]
Galarza JA, Carreras-Carbonell J, Macpherson E, Pascual M, Roques S, Turner GF, Rico C. 2009. The influence of oceanographic fronts and early-life-history traits on connectivity among littoral fish species. P Natl A Sci. 106(5):1473-1478. https://doi.org/10.1073/pnas.0806804106 [ Links ]
García-Rubies A, Macpherson E. 1995. Substrate use and temporal pattern of recruitment in juvenile fishes of the mediterranean littoral. Mar Biol. 124(1):35-42. [ Links ]
Gonçalves JMS, Bentes L, Coelho R, Correia C, Lino PG, Monteiro CC, Ribeiro J, Erzini K. 2003. Age and growth, maturity, mortality and yield-per-recruit for two banded bream (Diplodus vulgarisGeoffr.) from the south coast of Portugal. Fısh Res. 62(3):349-359. https://doi.org/10.1016/S0165-7836(02)00280-1 [ Links ]
Gonçalves JMS, Erzini K. 2000. The reproductive biology of the two-banded sea bream (Diplodus vulgaris) from the southwest coast of Portugal. J Appl Ichthyol . 16(3):110-116. https://doi.org/10.1046/j.1439-0426.2000.00232.x [ Links ]
Gordoa A, Molí B. 1997. Age and growth of the sparidsDiplodus vulgaris,D. sargusandD. annularisin adult populations and the differences in their juvenile growth patterns in the north-western Mediterranean Sea. Fish Res. 33(1-3):123-129. http://dx.doi.org/10.1016/S0165-7836(97)00074-X [ Links ]
Hadj-Taieb A, Ghorbel M, Ben-Hadj Hamida N, Jarboui O. 2012. Reproductive biology ofDiplodus vulgaris(Teleostei, Sparidae) in the Southern Tunisian waters (Central Mediterranean). Acta Adriat. 53(3):437-446. [ Links ]
Hadj-Taieb A, Ghorbel M, Ben-Hadj-Hamida N, Jarboui O. 2013. Reproductive biology, age and growth of the two-banded seabreamDiplodus vulgaris(Pisces: Sparidae) in the Gulf of Gabes, Tunisia. J Mar Biol Assoc UK. 93(5):1415-1421. https://doi.org/10.1017/S0025315412001737 [ Links ]
Isari S, Fragopoulu N, Somarakis S. 2008. Interranual variability in horizontal patterns of larval fish assemblages in the northeastern Aegean Sea (eastern Mediterranean) during early summer. Estuar Coast Shelf S. 79(4):607-619. https://doi.org/10.1016/j.ecss.2008.06.001 [ Links ]
Jones CM. 1992. Development and application of the otolith increment technique. In: Stevenson DK, Campana SE (eds.), Otolith Microstructure Examination and Analysis No. 117. Virginia (USA): Canadian Special Publication of Fisheries and Aquatic Sciences. p. 1-11. [ Links ]
Jones GP. 1986. Food availability affects growth in a coral reef fish. Oecologia. 70(1):136-139. https://doi.org/10.1007/bf00377123 [ Links ]
Jug-Dujaković J, Glamuzina B. 1988. Preliminary studies of reproduction and early life history ofDiplodus vulgaris(E. Geoffroy Saint-Hilaire 1817) in captivity. Aquaculture. 69(3-4):367-377. http://dx.doi.org/10.1016/0044-8486(88)90343-2 [ Links ]
Macpherson E. 1998. Ontogenetic shifts in habitat use and aggregation in juvenile sparid fishes. J Exp Mar Biol Ecol. 220(1):127-150. https://doi.org/10.1016/S0022-0981(97)00086-5 [ Links ]
Macpherson E, Raventos N. 2006. Relationship between pelagic larval duration and geographic distribution of Mediter-ranean littoral fishes. Mar Ecol Prog Ser . 327:257-265. http://doi.org/10.3354/meps327257 [ Links ]
Monteiro CC. 1989. La faune ichthyologique de la lagune ria formosa (sud Portugal) répartition et organisation spatio-temporelle des communautés application à l'aménagement des ressources. Montpellier (France): Université des Sciences et Techniques du Languedoc. 219 p. [ Links ]
Morato T, Afonso P, Lourinho P, Nash RDM, Santos RS. 2003. Reproductive biology and recruitment of the white sea bream in the Azores. J Fish Biol. 63(1):59-72. https://doi.org/10.1046/j.1095-8649.2003.00129.x [ Links ]
Mouine N, Francour P, Ktari MH, Chakroun-Marzouk N. 2012. Reproductive biology of fourDiplodusspeciesDiplodus vulgaris,D. annularis,D. Sargus sargusandD. Puntazzo(Sparidae) in the gulf of Tunis (central Mediterranean). J Mar Biol Assoc UK . 92(3):623-631. https://doi.org/10.1017/S0025315411000798 [ Links ]
Mouine N, Ktari MH, Chakroun-Marzouk N. 2010. Age and growth ofDiplodus vulgaris(Sparidae) in the gulf of Tunis. Cybium. 34(1):37-45. [ Links ]
Pajuelo JG, Lorenzo JM. 2003. The growth of the common two-banded seabream,Diplodus vulgaris(Teleostei, Sparidae), in Canarian waters, estimated by reading otoliths and by back-calculation. J Appl Ichthyol. 19(2):79-83. https://doi.org/10.1046/j.1439-0426.2003.00359.x [ Links ]
Pajuelo JG, Lorenzo JM, Bilbao A, Ayza O, Ramos AG. 2006. Reproductive characteristics of the benthic coastal fishDiplodus vulgaris(Teleostei: Sparidae) in the Canarian Archipelago, northwest Africa. J Appl Ichthyol. 22(5):414-418. https://doi.org/10.1111/j.1439-0426.2006.00766.x [ Links ]
Pauly D. 1983. Some simple methods for the assessment of tropical fish stocks. Rome (Italy): [FAO] Food and Agriculture Organization of the United Nations. 52 p. [ Links ]
Planes S, Lecchini D, Romans P, Mills SC. 2009. Effects of post-settlement mortality on size and parasite load in juvenileDiplodus vulgarisandD. sargusin the Mediterranean. Aquat Biol. 6(1-3):153-158. http://doi.org/10.3354/ab00178 [ Links ]
Raventós N, Macpherson E. 2001. Planktonic larval duration and settlement marks on the otoliths of Mediterranean littoral fishes. Mar Biol. 138:1115-1120. https://doi.org/10.1007/s002270000535 [ Links ]
Ribeiro J, Monteiro CC, Monteiro P, Bentes L, Coelho R, Gonçalves JMS, Lino PG, Erzini K. 2008. Long-term changes in fish communities of the ria formosa coastal lagoon (Southern Portugal) based on two studies made 20 years apart. Estuar Coast Shelf S. 76(1):57-68. http://dx.doi.org/10.1016/j.ecss.2007.06.001 [ Links ]
Ricker WE. 1975. Computation and interpretation of biological statistics of fish populations. B Fish Res Board Can. 191:382. [ Links ]
Secor DH, Dean JM, Laban EH. 1991. Manual for otolith removal and preparation for microstructural examination. Columbia (SC, USA): Belle W. Baruch Institute for Marine Biology and Coastal Research. University of South Carolina. Technical Publication 1991-01. 84 p. [ Links ]
Sim-Smith CJ, Jeffs AG, Radford CA. 2012. Variation in the growth of larval and juvenile snapper,Chrysophrys auratus(Sparidae). Mar Freshwater Res. 63(12):1231-1243. https://doi.org/10.1071/MF12176 [ Links ]
Sogard SM. 1997. Size-selective mortality in the juvenile stage of teleost fishes: A review. B Mar Sci. 60(3):1129-1157. [ Links ]
Takahashi M, Watanabe Y. 2004. Staging larval and early juvenile japanese anchovy based on the degree of guanine deposition. J Fish Biol . 64(1):262-267. https://doi.org/10.1111/j.1095-8649.2004.00283.x [ Links ]
Vigliola L. 1997. Validation of daily increment formation in otoliths for threeDiplodusspecies in the Mediterranean sea. J Fish Biol . 51(2):349-360. https://doi.org/10.1111/j.1095-8649.1997.tb01671.x [ Links ]
Vigliola L. 1998. Contrôle et régulation du recrutement des Sparidae (poissons, téléostéens) en Méditerranée: Importance des processus pré- et post-installation benthique = Control and regulation of sparid recruitment (pisces, teleostei) from the Mediterranean sea : importance of pre- and post settlement processes [dissertation]. [Marselle (Fance)]: Université Aix-Marseille II. 265 p. [ Links ]
Vigliola L, Harmelin-Vivien M, Meekan MG. 2000. Comparison of techniques of back-calculation of growth and settlement marks from the otoliths of three species ofDiplodusfrom the Mediterranean Sea. Can J Fish Aquat Sci . 57(6):1291-1299. https://doi.org/10.1139/f00-055 [ Links ]
Villanueva R, Molí B. 1997. Validation of the otolith increment deposition ratio using alizarin marks in juveniles of the sparid fishes,Diplodus vulgarisandD. puntazzo. Fish Res . 30(3):257-260. http://dx.doi.org/10.1016/S0165-7836(97)00008-8 [ Links ]
Wilson DT, McCormick MI. 1999. Microstructure of settlement-marks in the otoliths of tropical reef fishes. Mar Biol . 134(1):29-41. https://doi.org/10.1007/s002270050522 [ Links ]
Wootton RJ. 1990. Ecology of teleost fishes. London (UK), New York (NY): Chapman and Hall. 404 p. [ Links ]
Recibido: 12 de Enero de 2022; Aprobado: 25 de Julio de 2022; Publicado: 25 de Abril de 2023











 text in
text in