Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista mexicana de fitopatología
On-line version ISSN 2007-8080Print version ISSN 0185-3309
Rev. mex. fitopatol vol.39 n.spe Texcoco 2021 Epub Nov 30, 2022
https://doi.org/10.18781/r.mex.fit.2021-27
COVID-19: El Virus, Enfermedad y Epidemiología
Un análisis retrospectivo de epidemias en plantas y humanos para comprender COVID-19
2Laboratory of Phytosanitary Epidemiological Risk Analysis (LANREF), Postgraduate College, Montecillo Campus, Texcoco. km 36.5 Road Mexico-Texcoco. Montecillo, Mexico State, C.P. 56230.
El análisis retrospectivo mundial de la epidemiología humana/vegetal exhibe desarrollo cognitivo reactivo influenciado por fenómenos casuísticos. Brotes epidémicos del siglo XXI demuestran involución del enfoque poblacional de prevención de riesgos y erosión del modelo de Salud Pública, exitoso entre 1950-1970. Después de 19 pandemias y 200 brotes históricos, ni la OMS e instituciones públicas o privadas han consolidado modelos preventivos sustentables. La expansión urbana y el colonialismo agrícola durante la Revolución Industrial aceleró procesos pandémicos como la Peste Negra (Yersinia pestis), Cólera (Vibrio cholerae), Tizón de la Papa (Phythopthora infestans) o Roya del Café (Hemileia vastatrix). Éstas coadyuvaron en la concepción y aplicación de los principios contagio y prevención por Snow/1854 o de Bary/1857, en el higienismo de Proust/1873, y la sanitización de Marshall/1882, antes del principio etiológico desarrollado por Pasteur/1862 y Koch/1882. Las revoluciones científicas contemporáneas fortalecieron la visión reduccionista hospitalaria, o parcelaria, con énfasis en la curación como principio, y la privatización de la salud como estrategia de mercado. La población, paradigma central de la epidemiología, está limitada al individuo-paciente o planta-daño. La curva de casos COVID-19 (‘ola epidémica’) no es inherente a la epidemiología preventiva, su ‘aplanamiento’ carece de fundamento infeccioso, la ‘sana distancia’ o ‘confinamiento’ no son estrategias de mitigación sostenibles. El énfasis inmunológico, no generó la protección individual e ‘inmunidad de rebaño’ esperadas. En cambio, exacerbó la ‘carrera’ farmacéutica-mercantilizada de vacunas ante nuevas variantes; el proteccionismo geopolítico; y la inequitativa distribución de inmunológicos. La pandemia SARS-CoV-2/COVID-19 evidenció el deterioro de un marco epidemiológico racional; ausencia de Sistemas de Vigilancia que articulen la detección clínica y de variantes virales con trazabilidad de riesgos comunitarios, potenciados con tecnología genómica y digital; la depauperación del Sistema Público de Salud; y la ausencia de un modelo pansistémico integrador de modelos regionales preventivos. Reducción de letalidad máxima de 15.2% en 2020, a 2.5 promedio mundial en 2021 sugiere un proceso transicional endémico. Tasas de reproducción mundial R t > 1 son congruentes con variantes más transmisibles, como Delta y Ómicron, como aptitud de sobrevivencia subletal del virus. La pandemia no se ha logrado intervenir exitosamente y su momentum está determinado por atributos biológicos inherentes al SARS-CoV-2.
Palabras clave: Pandemia; Enfermedad; Prevención; Cura; SARS-COV-2; Salud; Vacuna.
Global retrospective human/plant epidemiology analysis exhibits a reactive cognitive development influenced by casuistic phenomena. Epidemic outbreaks of XXI century evidenced regression of the population-based approach to risk prevention and erosion of Public Health model, successful between 1950-1970. After 19 pandemics and 200 historical outbreaks, neither WHO nor public or private institutions, have not consolidated sustainable preventive models. Urban expansion and agricultural colonialism during the Industrial Revolution accelerated pandemic processes such as Black Death (Yersinia pestis), Cholera (Vibrio cholerae), Potato Blight (Phythopthora infestans) or Coffee Rust (Hemileia vastatrix). These factors contributed to the conception and application of the contagion and prevention principles by Snow/1854 or de Bary/1857, in the hygienism of Proust/1873, and the sanitation of Marshall/1882, before the etiological principle developed by Pasteur/1862 and Koch/1882. The contemporary scientific revolutions strengthened the reductionist hospital vision, with emphasis on cure as a principle, and on health privatization as a business strategy. The central epidemiology paradigm’s population is limited to the individual-patient or plant-damage. The COVID-19 cases curve (‘epidemic wave’) is not inherent to preventive epidemiology, ‘flattening’ lacks infectious basis, ‘healthy distance’ or ‘confinement’ are not sustainable mitigation strategies. The immunological emphasis did not generate the expected individual protection and ‘herd immunity’. Instead, it exacerbated the pharmaceutical-mercantilized vaccine ‘race’ to new variants; geopolitical protectionism; and unequal distribution of immunologicals. The SARS-CoV-2/COVID-19 pandemic evidenced the rational epidemiological framework deterioration; the absence of Surveillance Systems that articulate clinical detection and viral variants with community risks follow-up, enhanced with genomic and digital technology; the systematic failure of Public Health Systems; and the absence of a pansystemic model to integrate regional preventive models. Maximum case-fatality reduction from 15.2% in 2020 to 2.5 world average 2021, suggests an endemic transitional process. Worldwide reproduction rates R t > 1 are consistent with more transmissible variants, such as Delta and Omicron, as sublethal survival ability of the virus. The pandemic has not been successfully intervened and its momentum is determined by biological attributes inherent to SARS-CoV-2.
Key words: Pandemic; Disease; Prevention; Cure; SARS-COV-2; Health; Vaccine.
Introducción
México detectó el primer caso de SARS-CoV-2, agente causal de la enfermedad denominada COVID-19, en la Ciudad de México el 28 de febrero, 2020 (SSA, 2020;Méndez-Domínguezet al., 2020). Dos meses y once días después del brote epidémico en Wuhan, la Organización Mundial de la Salud (OMS, 2021a) declaró la condición pandémica de COVID-19, es decir, una epidemia de ocurrencia espacial-global temporalmente sincrónica respecto a relaciones funcionales de contagio. Restricciones a las actividades económicas y sociales se establecieron de inmediato en varios países europeos y asiáticos, debido a un total de 126559 casos de COVID-19 con 4566 muertes en 113 países (Donget al., 2020). Cinco meses después del brote, el Sistema Público de Salud en algunas ciudades de Italia, España y otros países estuvo por colapsar. Fue evidente la limitación en infraestructura, recursos humanos especializados, disponibilidad de ‘kits’ comerciales de diagnóstico y pruebas clínicas validadas para enfrentar la enfermedad (OMS, 2021a). Esto fue consecuencia de la gradual adopción mundial del enfoque curativo en detrimento del principio preventivo de enfermedades (Velázquez, 2021; CEPAL y OPS, 2021; Frenk, 2003). En México, se establecieron medidas preventivas con base en recomendaciones de la OMS para la población ambulatoria como el ‘Programa de Sana Distancia’, el ‘Modelo Centinela’ para detección y estimación de casos sospechosos (Hernández-Ávilaet al., 2020), y se adoptó el protocolo de diagnóstico de Reacción de Cadena de la Polimerasa (PCR por siglas en inglés) de la OMS para uso rutinario en laboratorios oficiales y aprobados. Sin embargo, por costo e infraestructura, se cuestionó la viabilidad de pruebas masivas, cuya eficacia se demostró durante el primer trimestre de 2020 en Corea del Sur, Hong Kong y China, para diagnóstico temprano de SARS-CoV-2 y supresión de cadenas de contagio (June-Hoet al., 2021). En Noviembre 2021, a casi dos años del proceso pandémico, México y el resto de países han transitado por varias etapas de gestión y mitigación epidémica en función a su estructura gubernamental de salud, capacidad financiera y operativa para articular recomendaciones de la OMS. Los resultados, contrastantes e inconsistentes, requieren un análisis causa-efecto desde la perspectiva histórica integral y sistémica.
En este contexto, el objetivo de este trabajo fue analizar el proceso pandémico de SARS-CoV-2 desde un enfoque histórico retrospectivo de epidemias en humanos y plantas, con el fin comparar la aplicación de conceptos, principios y estrategias de mitigación bajo la premisa de que la epidemiología es una ciencia transversal unificada por la población y el sistema epidemiológico como marco racional de un Sistema de Salud. Para este fin, se seleccionaron epidemias con un impacto poblacional y regional extensivo pero contrastantes respecto a realidades científicas, tecnológicas y sociales.
1. COVID-19: La gestión pandémica
Pandemia COVID-19. Impacto y enfoque curativo . A 21 meses del brote pandémico (Noviembre 2021), mundialmente se han acumulado más de 239 millones de casos de COVID-19 y 5 millones de muertes en cuatro ‘olas epidémicas’ o eventos cíclicos (Donget al., 2020; OMS, 2021b). Al menos los dos últimos eventos ocurrieron a pesar de la vacunación masiva, insipiente y en número de dosis mal distribuidas geográficamente. No obstante, todavía prevalece el énfasis médico y clínico en la búsqueda de soluciones ante un problema complejo, que requiere la inclusión de enfoques transdisciplinarios. Para ilustrar este enfoque reduccionista centrado en la solución clínica, impulsado por grandes farmacéuticas y centros de investigación, baste recordar que las tres epidemias de este siglo (Influenza A H1N1, SARS-2002, MERS y SARS-CoV-2) son de origen zoonótico, implicando que las actividades antropocéntricas fueron determinantes para transmisión de agentes infecciosos de animales a humanos. Enfoques preventivos efectivos, no solo curativos, enfatizarían el monitoreo epidemiológico de ‘causalidad’ primaria en el microbioma animal para modelos de riesgo.
Primeros enfoques epidemiológicos e investigación. Internacionalmente, la detección del SARS-CoV-2 se utilizó para monitoreo clínico y epidémico, sin diferenciar necesidades y estrategias específicas de un tratamiento médico con respecto a objetivos preventivos comunitarios (Dong et al., 2020; OMS, 2021a). Por otra parte, la investigación científica se ralentizó o paralizó debido al confinamiento voluntario u obligatorio. Esto impidió usar infraestructura instalada y aplicar enfoques interdisciplinarios para enfrentar la complejidad de la pandemia desde una visión holística, sistémica y multidimensional. Adicionalmente, la fuerte especialización científica ha sido detrimental para la conformación de equipos interdisciplinarios. Persistió, y persiste aún, entre investigadores de áreas sociológicas, psicológicas, agrícolas, demográficas, etc., la apreciación que la crisis de salud por COVID-19 es responsabilidad gubernamental y del sistema de investigación biomédico. Desafortunadamente, esta visión también impera dentro del propio sector salud.
Farmacéuticas, inmunización y antivirales. Desde el inicio epidémico, la demanda original de regresar a modelos preventivos integrales mediante fortalecimiento de los Sistemas Públicos de Salud, prácticamente ha desaparecido. Por el contrario, se ha implantado una agenda de visión predominantemente mercantil de la industria farmacéutica. De este modo, el enfoque se centra en la vacunación masiva y la ‘inmunidad de rebaño’, pero la reinfección por SARS-COV-2 en personas con dosis completas sugiere una potencial pérdida de inmunidad después de 16 meses, menor a otros coronavirus como SARS-CoV, MERS o HCoV (Townsendet al., 2021). Más aun, no existe la inmunidad absoluta. Han continuado procesos epidémicos cíclicos con una sucesión de variantes de alta prevalencia (Delta es la actual) y la ocurrencia de cuadros clínicos variables, incluso severos y muerte, en personas inmunizadas. Se tuvo que reconocer la posibilidad de infección, reinfección o coinfección en personas inmunizadas e introducir el argumento que una vacuna elimina el riesgo de mortalidad en más del 90%. La investigación de farmacéuticas fue indudablemente rápida en la generación de inmunizantes pero a costa de vacíos biológicos mecanísticos derivados de limitada comprensión patológica viral (Li et al., 2021). A pesar de ello, ahora se incursiona en otro frente médico que definitivamente eliminará la posibilidad de retornar modelos de salud sustentables y mantendrá la línea curativa altamente rentable en detrimento de la prevención.
Al cierre de este escrito, Merck y Pfizer tenían pruebas clínicas avanzadas, aún no públicas, que sugieren el beneficio de píldoras antivirales (Molnupiravir y Paxlovid) contra SARS-CoV-2 (Ap, 2021; Afp et al., 2021a). En otro frente, la agenda actual inducida por farmacéuticas incluye la vacunación de niños cuando sus factores de riesgo no lo justifican y aún existen poblaciones de adultos con alto riesgo sin vacunas en países con insuficiencia económica e infraestructura para la adquisición de inmunizantes, que pueden representar fuentes de reinfección y nuevas variantes para el resto del mundo. Al 28 de octubre, la OMS reportaba que solo el 0.4% de pruebas y 0.5% de vacunas aplicadas en el mundo fueron efectuados en países de pocos ingresos (Afp et al., 2021b). Nos aproximamos peligrosamente a una cooptación de la salud pública, con fines mercantiles, explotando la vulnerabilidad y miedo a COVID-19 como recurso disuasorio.
2. Prevención y salud pública
La OMS y COVID-19. Desde un contexto histórico, es necesario plantear contundentemente que ni la OMS ni instituciones de salud humana, han podido desarrollar e implementar modelos efectivos de salud pública con énfasis en la prevención de riesgos (Figura 1). Los programas preventivos exitosos, concretados o iniciados en el siglo XX (Cáceres, 2012), han sido subrepticiamente soslayados a pesar de la erradicación de viruela (1971), poliomielitis (1997) y sarampión (2016), esta última derivada de un programa global iniciado en 1980 y que previno, según la OMS, 17.1 millones de muertes mundiales entre 2000 y 2014 (OPS). No obstante, la emergencia de grupos antivacunas en Europa y EUA constata la negligencia de organismos responsables de la salud por revertir una tendencia que atenta al principio de prevención y favorece el modelo curativo económicamente rentable (Velázquez, 2021; CEPAL y OPS, 2021; Frenk, 2003). Así, los fracasos del pasado reciente con la gripe H1N1 (2009) o el Ébola (2014) prueban la ausencia de modelos preventivos. Consecuentemente, el manejo de la pandemia COVID-19 ha sido cuestionado y controvertido a pesar de grandes montos financieros operados por la OMS. Tan solo en 2020-2021 este organismo invirtió US$ 8482 millones para atender tres componentes fundamentales en materia de salud: 1) Cobertura universal de salud; 2) Emergencias sanitarias; y 3) Mejora de la salud y bienestar (OMS, 2021a). No obstante, 239 millones de infecciones desde el paciente cero, el 17 de noviembre de 2019 en Wuhan, China (Dong et al., 2020), evidencian el abandono sistemático mundial de la prevención y de estructuras académicas, investigación y operativas (Velázquez, 2021; CEPAL y OPS, 2021; Frenk, 2003). En este contexto, el ‘nuevo plan’ de la OMS contra la pandemia en países menos desarrollados, requiere US$ 23 mil 400 millones anuales para su operación (Afp, 2021c), pero carece de planes de contingencia efectivos, escenarios de riesgo rigurosos y análisis de datos masivos para toma de decisiones.
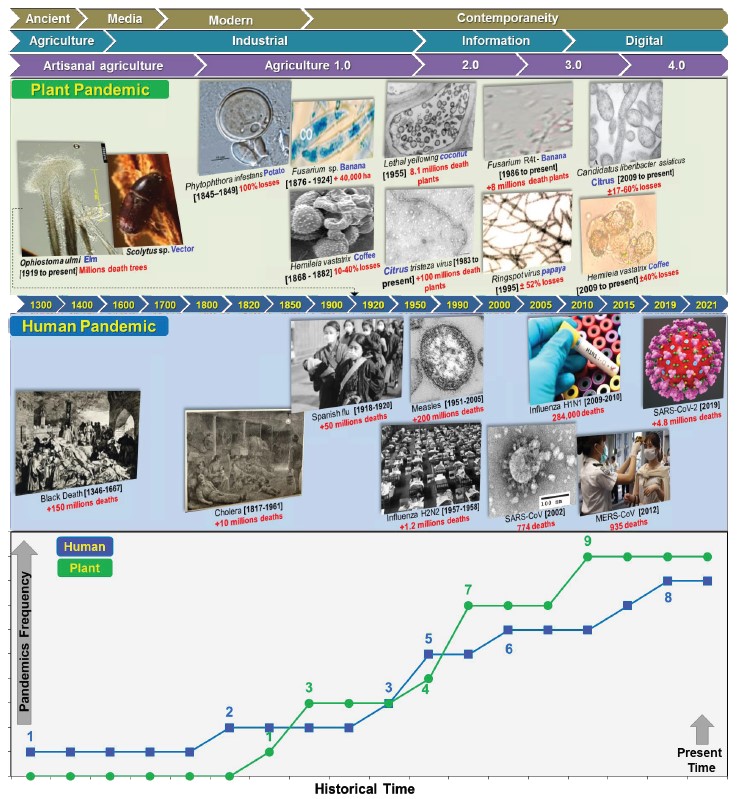
Figura 1 Línea de tiempo de procesos epidémicos/pandémicos más importantes ocurridas en poblaciones de humanos y plantas durante 1300-2021. Se muestran las curvas acumuladas de pandemias vegetales/humanas en el mismo periodo. Fuente: Elaboración propia con datos de literatura citada.
Salud pública: Infraestructura y recursos humanos. COVID-19 evidenció la ausencia y debilidad en infraestructura, tecnología e investigación avanzada en instituciones públicas para generar vacunas, incluidos países desarrollados. Esto comprometió la seguridad de salud pública en menos de 10 grandes farmacéuticas. Éstas, entre 2020 y 2021 lograron ganancias superiores a US$ 270 billones, siendo Moderna, creadora de la vacuna ARNm-1273, la más beneficiada con el 50% (Carbajal, 2021). La epidemia demostró, además de carencia en personal de salud y especialistas en terapia intensiva (p.e., neumólogos, internistas o urgenciólogos), la escasez de epidemiólogos enfocados a la investigación y mitigación de riesgos comunitarios, fuera del ámbito hospitalario, para desarrollar modelos preventivos al contagio, complementarios al diagnóstico, confinamiento y monitoreo aplicados a nivel mundial. Paradójicamente, México y muchos países estuvieron a la vanguardia en modelos educativos y de investigación. Como ejemplo, la Escuela de Salud Pública de México (ESPM) fundada hace más de 100 años, se creó bajo la filosofía del principio de prevención como alternativa lógica y racional (ESPM, 2021). Una definición de salud pública de 1920 establece claramente la adopción del principio de prevención: ‘la salud pública es la ciencia y el arte de prevenir las enfermedades, prolongar la vida y fomentar la salud y la eficiencia física mediante esfuerzos organizados de la comunidad para sanear el medio ambiente, controlar las infecciones de la comunidad y educar al individuo en cuanto a los principios de la higiene personal; organizar servicios médicos y de enfermería para el diagnóstico precoz y el tratamiento preventivo de las enfermedades, así como desarrollar la maquinaria social que le asegure a cada individuo de la comunidad un nivel de vida adecuado para el mantenimiento de la salud’ (Winslow, 1920). Si bien, se reconoce la evolución del concepto de salud pública, Julio Frenk puntualiza que ‘en el nivel de análisis poblacional de la salud pública, las condiciones de salud se abordan a través de la investigación epidemiológica’ (INSP, 2020). En consecuencia, una pandemia sin epidemiólogos que la investiguen es privilegiar la ‘cura’ como única respuesta a la enfermedad, justo como está ocurriendo actualmente con los tratamientos farmacológicos de COVID-19.
Vacunas y gestión global de riesgos. COVID-19 también evidenció desaciertos en la gestión global de riesgos. Es cuestionable la imparcialidad, o por lo menos el aparente burocratismo, de la OMS y la Agencia Europea de Medicamentos que han retrasado la aprobación de las vacunas Sinovac (CoronaVac), Cansino (Ad5-nCoV) y Sputnik V (Gam-COVID-Vac) creadas con participación de prestigiosas instituciones públicas Chinas y Rusas; inconformidad que los implicados han expresado en términos de ‘competencia desleal’ y ‘proteccionismo’ de los países del G-20 (Afp, 2021d). La dilación resulta incomprensible si se considera que Sputnik V fue la primera vacuna generada a nivel mundial y se ha aplicado en más de 70 países, incluido México. Las vacunas Chinas se han empleado en dosis completas para más de 1000 millones de personas (75.7% poblacional) y al menos 20 países (datosmacro, 2021a). Una crisis sanitaria, por definición, implica celeridad en la toma de decisiones y la innovación integral de todos los procesos asociados a la solución. A esta estrategia geopolítica se adiciona la reticencia de farmacéuticas, apoyadas por sus países, para liberar patentes de vacunas evidenciando intereses económicos por encima la salud humana. Una consecuencia lógica de la economía de mercado dominante. Como resultado, la humanidad atrapada en sus propias estructuras y reglas. Entonces, no sorprende el desaliento del Secretario de la ONU quien declara: ‘no asegurar una distribución equitativa de las vacunas no sólo es cuestión de ser inmoral, es también cuestión de ser estúpido’ en respuesta al ‘acaparamiento y las políticas nacionalistas de vacunación’ de países desarrollados como EUA, GB, Francia y Alemania (Navarrete, 2021; ONU, 2021).
México y Cuba: Producción de vacunas. BIRMEX, institución gubernamental mexicana, líder en los 50’s y 60’s en producción de vacunas (México erradicó la viruela 20 años antes que el resto del mundo en 1952), evidenció la inviabilidad para generar sus propios inmunológicos a partir del brote epidémico de Influenza A (H1N1) (BIRMEX, 2021). Por el contrario, es meritorio que Cuba, único país latinoamericano con vacunas desarrolladas, Abdala y Soberana 02, haya aplicado 14 millones 672 mil 62 dosis hasta el 4 de septiembre (52% poblacional), y fue el primer país en el mundo que inició una Campaña Nacional Infantil contra COVID-19 una vez asegurada su población adulta (Noda y Chávez, 2021). Este logro solo es comprensible con un robusto Sistema de Salud, iniciado en 1962, con énfasis en prevención. Este ejemplo de autosuficiencia y seguridad de salud pública constituye un logro excepcional considerando las restricciones en infraestructura y materiales de laboratorio debido al bloqueo económico impuesto por EUA desde los 60’s. Inhumano e inmoral ante la situación pandémica de COVID-19. Es paradójico, pero comprensible desde la óptica de la salud como negocio, que la humanidad padezca epidemias en el siglo XXI con florecimiento de sorprendentes revoluciones científicas. También es ignominioso que las epidemias humanas sucedan sin beneficiar modelos de salud pública más robustos, sustentables y resilientes.
3. Epidemias y pandemias en humanos
Pandemias y brotes epidémicos históricos. A través de la historia de la humanidad, los agentes infecciosos han coexistido y evolucionado con los humanos. Las enfermedades se han podido documentar al menos desde 1200 a. C. Sin embargo, la expresión epidémica ha sido el resultado del asentamiento de poblaciones en condiciones que favorecen el contagio rápido y efectivo como el comercio, migración, condiciones insalubres, deficiente nutrición, etc. Así, un total de 19 pandemias (Piret y Boivin, 2019) y 200 brotes epidémicos locales o regionales han ocurrido desde la última fase del medievo, destacando la Peste Negra (1346-1353), Cólera (1846-1860), Gripe Española (1918-1920), Gripe H2N2 (1957-1958), SARS-CoV (2002), Gripe H1N1 (2009-2010), MERS-CoV (2012) y SARS-CoV-2 (2019-presente) (Figura 1). Sin embargo, estos procesos epidémicos han estado exentos de un riguroso análisis integral desde la perspectiva científica, filosófica, social, económica y tecnológica (Figura 2). Por el contrario, persiste un desinterés generalizado por generar y sistematizar el conocimiento y aplicarlo en política pública, modelos educativos y en el fortalecimiento de Sistemas Públicos de Salud. Los éxitos y fracasos históricos son áreas de oportunidad para analizar y mejorar la política pública de salud.
La emergencia de pandemias está vinculada con el encumbramiento del ser humano sobre la naturaleza. El punto de quiebre fue la Revolución Industrial (1760 - 1840), una referencia histórica que representó intensificación de la producción mediante máquinas incorporadas a líneas de manufactura con el consecuente cambio radical en patrones socio-culturales, educativos, crecimiento poblacional urbano, precarización del trabajo, condiciones insalubres y la expansión tecnológica y de capital a países pobres. Marco ineludible para que Karl Marx, en El Capital (1867), desentrañara el paradigma de la mercancía en la economía moderna. Eventualmente, también originó el reacomodo de intereses geopolíticos internacionales y la Primera Guerra Mundial. En ese contexto ocurrió la Gripe Española (1918-1919), primera pandemia mundial, a partir de militares enfermos de EUA desplazados a Europa.

Figura 2 Línea del tiempo de eventos tecnológicos, científicos y sociales vinculados a importantes sucesos epidemiológicos en poblaciones humanas y plantas. Fuente: elaboración propia con datos de literatura citada.
La Gripe Española (1918-1919) y movilidad humana. La enfermedad es causada por el virus de la Influenza A (H1N1), variante identificada en 2005 con tecnología genómica (Figura 1). En un lapso de 18 meses, fue sorprendente la sincronía temporal del contagio en diferentes regiones geográficas del mundo a partir de movilidad de individuos enfermos. Su mortalidad se estimó en 50%. A la nula o baja comunicación del riesgo contribuyó la secrecía de la enfermedad por razones estratégicas de guerra. La Revolución Industrial representó el auge de la modernidad, el crecimiento acelerado-sostenido de la población desde el siglo XVII (Roseret al., 2013) y el incremento de la movilidad antropogénica por la invención de medios de transporte (locomotora y barcos de vapor, ferrocarril, automóvil, etc.) (Figura 2). Inevitablemente, estos desarrollos promovieron interconexiones económicas y socioculturales dinámicas entre regiones distantes, p.e., surgió el turismo, que se convertiría en un factor importante de muchas economías y causante de flujos humanos intensos. Es decir, los inicios de la globalización y con ello las pandemias contemporáneas. La movilidad de SARS-CoV-2 durante la fase inicial de la epidemia, y de sus variantes virales en posteriores etapas, demostró el peso de la globalización en la velocidad de contagio y dispersión del agente infeccioso, bastando poco más de dos meses para una condición pandémica (OMS, 2021a). También evidenció, sin precedente, la fragilidad de la economía global por la desagregación mundial de la producción y distribución de suministros. Un chip no producido en Asia cesó la producción de autos en América. Un virus que paralizó los canales de suministro e inmovilizó la economía mundial.
Peste Negra (1346-1667), teoría miasmática y causalidad. Aunque la Peste Negra o bubónica ha tenido históricamente la mayor tasa de mortalidad (60% estimada), su ocurrencia epidémica por muchos años se restringió principalmente a Europa en ciudades hacinadas e insalubres en convivencia con ratas y pulgas reservorios de la bacteria Yersinia pestis que la trasmiten al humano. La infección secundaria individuo-individuo fue efectiva por exudados bacterianos directos de piel. Un agente infeccioso movilizado desde Asia por el mercadeo (Figura 1). Aunque estrictamente no tuvo un carácter pandémico, la Peste Negra causó entre 75-200 millones de muertes a finales de la Edad Media (Figura 1). Ocurrió en un período convulso caracterizado por guerras (p.e., Guerra de los 100 Años, Cruzadas, invasiones, etc.). La teoría de la generación espontánea o miasmática prevalecía (Caponi, 2002) y la visión aristotélica permeaba la ciencia, básicamente filosófica. Los desarrollos tecnológicos eran esencialmente bélicos, icónicamente ilustrados con un Leonardo da Vinci inventor (1452-1519). La ausencia de sólidas bases científico-tecnológicas retrasó las posibilidades de un manejo eficiente de la Peste Negra. Fue hasta 1894, en esa etapa crucial en que se destruyeron las ideas miasmáticas y surge la etiología microbiológica, cuando Alexander Yersin, empleando el enfoque etiológico de asociación causa-efecto descubrió al agente causalYersina pestis y la relación zoonótica animal-humano. A. Yersin fue alumno de Robert Koch, descubridor de Mycobacterium tuberculosis causante de la tuberculosis y a quien se le atribuyen los famosos postulados de causalidad de amplio uso en la fitopatología.
Peste Negra, vacuna, higienismo y endemicidad. Los avances microbiológicos permitieron el desarrollo de la primera vacuna contra Y. pestis en 1897, i.e., 551 años después del primer brote epidémico. Sin embargo, fueron enfoques higienistas de Adrien Proust, entre otros, los que coadyuvaron a interrumpir las cadenas de contagio primaria implicadas con la Peste Negra, Cólera y Fiebre Amarilla, claramente expuestos en su libro (1873): l’hygiène internationale: ses applications contre la peste, la fièvre jaune et le choléra asiatique. Proust logró promover políticas higienistas en salud pública, medidas de distanciamiento social, cuarentenas, cordones sanitarios en puertos y el confinamiento para manejo de riesgos infecciosos (Figura 2). Estrategias que son aplicadas para COVID-19 en un contexto socio-económico muy contrastante y que han resultado devastadoras para economías pobres y emergentes. Así mismo, han sido alternativas desesperadas para un desmantelado Sistema de Salud mundial (Velázquez, 2021; CEPAL y OPS, 2021; Frenk, 2003), incapaz de prevenir y mitigar riesgos a pesar de un sofisticado talento científico actual y grandes avances tecnológicos.
Consecuentemente, a pesar de experiencias acumuladas, la Peste Negra, Cólera, Fiebre Amarilla, etc. aún están presentes, en baja prevalencia y espacialmente localizadas. Por ejemplo, durante 2010-2015, la OMS reportó 3248 casos asociados a Peste Negra con mortalidad del 17.98%. En 2017, se notificaron brotes en Madagascar, donde se considera endémico, Perú y Congo (OMS, 2017). La misma institución estima 3-5 millones de casos anuales de Cólera (Harris et al., 2012). Esto demuestra que un agente infeccioso evoluciona con el ser humano en un delicado balance biológico-ambiental y eventualmente transita, de condiciones epidémicas de desequilibrio, a una condición endémica de baja prevalencia con brotes recurrentes. En consecuencia, la vigilancia epidemiológica debe ser una estrategia fundamental de un Sistema de Salud preventivo pero con nuevos paradigmas vinculados a la innovación científica-tecnológica (Mora-Aguilera et al., 2021a).
Cólera (1817-1961), Koch, pandemias y antibióticos. El Cólera es otra enfermedad causada por una bacteria, Vibrio cholerae, también asociada con hacinamientos e insalubridad de ciudades. Tuvo fuerte impacto en Europa, particularmente en Londres, Inglaterra (1846-1860) en una etapa donde la microbiología ya estaba aportando a la etiología y a medidas de mitigación. Fue R. Koch, nobel en medicina (1905) y considerado el padre de la bacteriología, quien aisló por primera vez al agente causal (1883) a partir de trabajos interdisciplinarios en la India. De 1817 a 1961 se reconocen siete procesos pandémicos asociados a diferentes variantes y es endémica en algunas regiones de África y Asia (Harris et al, 2012). La pandemia de 1961, donde Latinoamérica estuvo involucrada, progresó en tres olas independientes pero sobrepuestas y asociadas a variantes contrastantes y factores de resistencia SXT. En este caso, la inducción de mutagénesis por antibióticos fue determinante en la ocurrencia de procesos epidémicos cíclicos (Harris et al., 2021). Notoriamente la mutación biológica, independientemente de la entidad microbiológica, p.e., bacteria o virus, es inherente a las enfermedades y sus epidemias; y que la cura de la enfermedad, ese recurso rentable promovido por farmacéuticas, en este caso sulphamethoxazole/trimethoprim son una solución temporal y eventualmente causal de nuevas variantes resistentes a los fármacos disponibles.
Cólera, lección curativa y mutación. La cura médica es una tendencia análoga al control químico de fitopatógenos (y plagas en general) en cultivos agrícolas. Un paradigma tóxico impulsado por empresas, p.e., Bayer y Pfizer, que poseen divisiones para plantas y humanos. Círculos perniciosos a costa de la salud. En consecuencia, el nivel etiológico ya no es suficiente en la vigilancia epidemiológica. Se requiere la integración de la epidemiologia molecular para un eficiente monitoreo de razas, variantes, patovares, etc. No con fines de detección de variantes como parece imperar con actuales pruebas COVID-19. El propósito debe ser inferencial. Integrar el monitoreo a modelos de riesgo de cambios en la prevalencia de variantes y en aparición de nuevos haplotipos patogénicos. COVID-19 ha progresado en sucesión de variantes con aptitud parasítica diferenciada a una velocidad mayor que la generación de vacunas y fármacos. La capacidad adaptativa de procesos de infección y la compleja multiplicación de SARS-CoV-2 (Li et al., 2021), obliga a trascender soluciones curativas de efectividad temporal implementando modelos de riesgo y pronóstico para COVID-19, integrando la genómica a factores de riesgo.
Cólera, contagione, epidemiorum, vacunas e inmunidad. Los principales brotes de Cólera ocurrieron posterior a la Ilustración (1700-1800) y durante la Revolución Industrial (1760 - 1840) (Figura 1). Ya había un importante avance en teorización y conceptualización patológica y epidemiológica en enfermedades humanas. El libro ‘De contagione et contagiosis morbis et eorum curatione’ escrito por Girolamo Fracastoro (1546), describió la ‘degeneración del aire’ asociado con el contagio de la peste negra, lepra, tisis, sarna, rabia, erisipela, viruela, ántrax, tracoma y otros problemas sanitarios de gran impacto en la época. Si bien la causalidad era miasmática (Caponi, 2002), se le reconoce a Francastoro plasmar la idea de transmisibilidad. Otra referencia de interés epidemiológico fue ‘Epidemiorum’ de Guillaume de Baillou (1580), quien describió epidemias de sarampión, difteria y peste bubónica en Europa (Figura 2). Existían además otros descubrimientos científicos trascendentales en biología y otras disciplinas, p.e., Leeuwenhoek, inventó el microscopio sin el cual la microbiología etiológica hubiera sido imposible. Su registro de células y organismos bacterianos (1670 - 1683) fueron referencias para posteriores estudios más formales de R. Koch o L. Pasteur (Figura 1).
Se requirieron sin embargo, poco más de 200 años para el surgimiento de la microbiología sustentada en el principio etiológico de la causalidad (Caponi, 2002). En este contexto, se puede explicar que el desarrollo de la primera vacuna contra Cólera (1885) se obtuvo 33 años después del primer brote, reduciendo la mortalidad a 10 millones de personas (Figura 2). En este periodo, ya existía el conocimiento de inmunidad y se habían generado otras vacunas contra la viruela (1796, Jenner), ántrax y rabia (1881, 1885, Pasteur, considerado el padre de la inmunología), y se había descubierto la penicilina (1897, Duchesne; 1928, Fleming) (Cáceres, 2012). Estos logros marcaron un hito en el desarrollo de la ciencia mostrando el valor del conocimiento científico y su esencia humanística. Las enfermedades y sus epidemias parecían tener rutas críticas para la prevención. Las millones de muertes serían experiencias irrepetibles. Sin embargo, 100 años después, con más de 250 millones de casos y 5 millones de muertes, COVID-19 ha mostrado lo contrario.
Cólera, J. Snow, contagio . El período de J. Snow también fue determinante para la epidemiología médica moderna. Emergió como ciencia con bases conceptuales y metodológicas poblacionales aplicadas nivel comunitario, comprensible por la ausencia de sistemas hospitalarios, los cuales en su concepción funcional y organizacional tuvieron origen con la guerra de Crimea (1853 y 1856), indisoluble a los aportes de Florence Nightingale (Turnes, 2009). Se fundó la primera Sociedad Epidemiológica de Londres en 1850, cuatro años después del brote de Cólera (Figura 2). John Snow, tuvo un rol activo en la comprensión del brote de Cólera en Londres, estudiando por primera vez la localización de individuos enfermos e infiriendo la dependencia espacial entre individuos enfermos y la población sana. Es decir, descubrió el contagio, principio fundamental de la epidemiología. Mostró también la importancia del dato poblacional, concretizado en una comunidad que convive y comparte espacio y recursos, para inferir la solución sin conocer la etiología del Cólera, la cual se dilucidó 37 años después.
El dato de ‘campo’ y ‘comunitario’, hoy está prácticamente olvidado. El registro clínico y hospitalario (o de puntos de ingreso en puertos y aeropuertos, en la Sanidad Vegetal) no es suficiente. Identificar el agente infeccioso/plaga en la ‘vía’ es un enfoque predominantemente etiológico desconectado del principio de contagio. La ausencia del dato estructurado en espacio-tiempo, oportuno, integrado en tiempo real a grandes bases de datos para toma de decisiones es una de las grandes limitaciones de la epidemiología actual en ámbitos de salud humana, animal y vegetal. En consecuencia, COVID-19 no fue la excepción. El registro de casos positivos ha permitido estimar la letalidad y mortalidad por SARS-CoV-2 y describir la dinámica epidémica temporal en poblaciones demográficas, pero no permite comprender e intervenir mecanismos de contagio los cuales operaran a nivel comunitario en ‘clusters’ laborales, familiares, sociales, etc. (Mora-Aguilera et al., 2021b).
Cólera, un mapa, el agua. En 1854, en un mapa de papel con trazos de calles de Londres, J. Snow ubicó y contó el número individuos enfermos en la ciudad. Incluyó otros elementos espaciales para explicar la asociatividad de casos enfermos. Esto permitió a J. Snow vincular el ‘agua’ de sitios de aprovisionamiento con el contagio:‘As soon as I became acquainted with the situation and extent of this irruption of cholera, I suspected some contamination of the water of the much-frequented street-pump in Broad Street’. Esta racionalización, fuera del paradigma reduccionista del individuo enfermo, permitió analizar y concluir que el sistema de distribución de agua estaba asociado a la dispersión de casos de cólera en la ciudad. El mapa de cólera original de Snow (Figura 3) muestra conceptual y manualmente la abstracción para representar en un espacio dado la distribución y vinculación de un evento epidémico, convirtiéndose en el precursor del análisis espacial de patrones de dispersión asociados al contagio.

Fuente: Autores con datos históricos. ArcGis: https://www.arcgis.com/home/webmap/viewer.html?webmap=752 37a7d4b7547c1b3addf9ffcd380fa.
Figura 3 A. Mapa urbano original de casos de cólera en Londres de J. Snow. B. Mapa de calor desarrollado usando ARGIS mejorando esa interpretación analítica. El color rojo indica una actividad contagiosa más intensa. En amarillo la ubicación del foco principal.
En la actualidad recursos computacionales y software espaciales especializados como Golden Surfer® (1985), ArcGis® (1999), QGIS® (2002) o Google Maps (2005), permiten su aplicación en la epidemiología para estudiar mecanismos de contagio. Diversos métodos geoestadísticos y proyecciones bi o tridimensionales permiten determinar dependencias espaciales o patrones de agregación mediante uso de herramientas para agregar, unir y superponer capas de información con un solo ‘click’. Estos desarrollos sugieren que el análisis espacial es un proceso simplista, pero obvian la concepción científica del problema en el contexto de un fenómeno epidemiológico (Escobar-Gutiérrezet al., 2020; Ibarra-Zapataet al., 2019; López-Avalos et al., 2017). Sin embargo, el precedente generado por la idea seminal de J. Snow, hoy tan simple y lógica, cambió el paradigma para la toma de decisiones en la dimensión espacial del contagio, primer frente de un proceso epidémico, e implicó considerar otros factores del ambiente además de la enfermedad (Velázquez, 2021; CEPAL y OPS, 2021; Frenk, 2003).
Cólera vigente, zoonosis. Cólera y otras epidemias históricas continúan siendo motivo de estudio constatando los modelos de salud deficitarios. En la última década, investigaciones sobreVibrio choleraeincluyen modelos espacio-temporales (Mariet al., 2012), condiciones climáticas (Escobaret al., 2015), reservorios ambientales utilizando sensores remotos (Recaultet al., 2019), entre otros. El escenario para los Sistemas de Salud es una más adverso ante la emergencia reciente de epidemias de origen zoonótico, un factor limitado en la historia de la salud humana donde la salubridad y el higienismo tenia un rol fundamental en mitigación epidémica (Figura 1). La globalización, la sobreexplotación de los recursos naturales y el impacto ambiental antropogénico estan entre las causas de estos puentes biológicos infecciosos entre animales y humanos, mediados principalmente por agentes virales sumamente efectivos por la simplesa estructural y sofisticada función replicativa mimética a la de humanos (García-Ruíz, 2021). Así, al cierre de este documento, se reportó por primera vez un coronavirus del género Deltacoronavirus (Porcine deltacoronavirus, PDCoV) infectando humanos en Haiti, una region altamente marginal con fuerte contacto entre humanos y puercos de traspatio, lo cual representa otro riesgo zoonótico potencial. Previos coronavirus adaptados a humanos se restringían a los géneros alfacoronavirus (HCoV-NL63) y betacoronavirus (MERS-CoV; SARS-CoV 2003; SARS-CoV-2) (Lednicky et al., 2021).
4. Epidemias y pandemias en plantas
Epidemias: Monocultivo, dispersión, movilidad. En el reino vegetal, los procesos epidémicos regionales y pandémicos también han afectado poblaciones de plantas, tanto cultivadas como nativas, durante la historia de la humanidad (Figura 1) (Mora-Aguilera et al., 2021a; Ristaino et al., 2021; Carvajal-Yepes et al., 2019; Parnell et al., 2017; Potter and Urquhar, 2017). Lógicamente, los fenómenos de parasitismo masivo se han acentuado con la evolución de la agricultura hacia sistemas de monocultivos extensivos y con la dispersión mundial de especies de plantas cultivadas a partir de sus centros de origen. Por ejemplo, en cítricos, originarios de Asia, el Citrus tristeza virus, endémico en el mundo, ha causado la muerte de más de 50 millones de plantas en América (más de 100 millones a nivel mundial) a partir del primer brote en Argentina y Brasil en 1930’s (CIPF, 2016), epidemia originada por naranjos infectados procedentes de Sudáfrica (Figura 1) (Rivas-Valencia et al., 2008). Las recientes pandemias en humanos han evidenciado el rol de movilidad humana y proximidad social en la rápida dispersión continental y transcontinental de patógenos (Davis et al., 2021), mientras que en fitopatógenos, con lenta dispersión sincrónica y ciclos productivos discontinuos de cultivos, ha sido más importante el comercio de productos y subproductos vegetales, y a partir de los 90’s el movimiento aéreo a grandes distancias por efecto de fenómenos climáticos extremos (Chown et al., 2014; Mora-Aguilera et al., 2014a).
Análogo a epidemias en humanos, la respuesta de organismos nacionales (ONPF) y regionales de protección fitosanitaria (ORPF), y de organismos internacionales como la Convención Internacional de Protección Fitosanitaria (CIPF), asociada a la FAO, tampoco ha sido efectiva al operar predominantemente bajo modelos regulatorios comerciales clásicos (Mora-Aguilera et al., 2021a; Santivañez et al., 2013). La restrictividad poblacional y la visión etiológica aqueja por igual a ambos campos de aplicación de la epidemiología, i.e., si en la epidemiologia médica el énfasis está en la población hospitalaria enferma, en la fitosanitaria se restringe a la incidencia del daño parcelario. En consecuencia, la historia de la epidemiología agrícola, y por extensión y por la extensión animal, no ha sido tan diferente a la humana.
Diversas epidemias continentales (i.e., restringidas a un continente) y pandemias han incidido en plantas cultivadas, incrementándose ante la necesidad de grandes volúmenes de alimentos requeridos para sustentar el crecimiento urbano en respuesta al auge industrial del siglo XIX. Análogamente, a principios del siglo XX se registró el primer brote epidémico en bosques nativos europeos de Ulmus spp. causado por Ophiostoma ulmi, posiblemente por la presión antropogénica sobre los recursos maderables con fines constructivos (Figura 1). Esta enfermedad pandémica-endémica, con recurrentes rebrotes, se estima que eliminó 30 millones de olmos entre 1970 y 1990 tan solo en UK, con severas consecuencias económicas y ambientales al destruir la población arbórea en algunas regiones (Potter y Urquhar, 2017; Potter et al., 2011).
Pandemias históricas en plantas. En epidemias de plantas también concurren diversos agentes infecciosos, incluyendo hongos, virus, bacterias, etc., los cuales tienen alta especificidad vegetal. Aunque no existen reportes de brotes epidémicos en humanos o animales con origen fitopatogénico, se han reportado algunas enfermedades de interés médico, generalmente por efectos de toxinas de hongos, p.e., Aspergillus, Fusarium, Claviceps y Cladosporium, y en bacterias destaca el género Pseudomonas que posee especies patogénicas en plantas y humanos (p.e., P. aeruginosa). En general, los fitopatógenos exhiben una barrera biológica, lo cual no ha sido el caso entre animales y humanos. Entre las enfermedades que han exhibido procesos epidémicos con muerte de millones de plantas destacan: Phytophthora infestans - Solanum tuberosum (1845-1849), Hemileia vastatrix - Coffea spp. (1868-1882, 2009 al presente), Fusarium oxysporum f. sp. cubense - Musa spp. (1876, 1924, 1990 al presente), Ophiostoma ulmi - Ulmus americana (1919 al presente), Moniliophthora perniciosa - Teobroma cacao (1987-endémico), Papaya ringspot virus - Carica papaya (1995), Citrus tristeza virus - Citrus spp. (1930-1937, 1990 al presente), Coconut lethal yellowing phytoplasma - Cocos nucifera (2000), Candidatus Liberibacter asiaticus - Citrus spp. (2009 al presente), entre otras (Mora-Aguilera et al., 2021a; Ristaino et al., 2021; Carvajal-Yepes et al., 2019; Potter y Urquhar, 2017; Mora-Aguilera et al., 2014b,c; Potter et al., 2011; Gonsalves et al., 2010; Rivas-Valencia et al., 2008) (Figura 1).
Fármacos y agroquímicos: Cura y mismos actores. Las epidemias y pandemias en plantas, además del efecto directo (p.e., riesgo en la sobrevivencia de acervos nativos y cultivados, y uso de energía para adaptaciones genéticas), tienen fuerte impacto en la calidad y viabilidad de la vida humana, no solo por limitar la producción e inocuidad de alimentos, sino también por los impactos agroecológicos, ambientales, económicos, sociales y culturales. Por otra parte, un patógeno de plantas asegura su pervivencia, endemicidad y potencial epidémico a través de un rango amplio de hospederos a nivel varietal, especie, género, familia y orden taxonómico. Esta plasticidad infecciosa ha generado un importante mercado de agroquímicos con énfasis en el principio curativo en demérito del preventivo análogo al manejo clínico de enfermedades en humanos.
Comprensiblemente, empresas como Bayer, empresa químico-farmacéutica fundada durante la Revolución Industrial y con mayor volumen de ventas mundiales, poseen divisiones de productos químicos para plantas (Cropscience, 45%), animales (Animal health, 3%) y humanos (Pharmaceuticals, 41% y Consumer Health, 12%). En términos porcentuales de ventas, de 41 mil 400 millones de euros en 2020, los químicos comercializados para ‘control plagas y protección de cultivos’ superan a los ‘medicamentos con receta’ para humanos (45% vs. 41%) (Díaz, 2021). Este es el gran reto. Cambiar el paradigma de curar por el de prevenir la enfermedad. Es decir, la prevención de epidemias. Implica modificar el enfoque actual de gestión y mitigación de riesgos. El enfoque curativo es rentable pero no sustentable.
Tizón tardío (1845-1850), diversidad varietal, de Bary. En la historia fitosanitaria, el primer desafío epidémico abordado con un enfoque científico fue el Tizón tardío (‘potato murrain’ nombre original en Europa), enfermedad de la papa (Solanum tuberosum), planta originaria de regiones andinas de Sudamérica y llevada Europa en el siglo XVI por españoles. Su condición epidémica entre 1845 y 1850 incluyó GB, Francia, Holanda y Bélgica (Figura 4) (Dyer, 1874). Pero tuvo mayor impacto en Irlanda con una hambruna (conocida como ‘The Potato Famine’) que resultó en 1.1 millones de personas muertas y 1.5 millones de migrantes en Europa y EUA (van Esseet al., 2019) (Figure 1, 2, 4 y 5). Este podría ser el primer caso del impacto potencial de enfermedades de plantas en la seguridad alimentaria humana y del riesgo de dispersar accidentalmente un patógeno asociado con un genotipo vegetal específico, seleccionado de una variabilidad genética nativa. Perú y Bolivia, reconocidos como principales centros de origen de la papa, poseen la mayor diversidad de las 130 especies silvestres conocidas (CIP, 2021); y la región, con México como referente (Galindo y Gallegly, 1960) fue por muchos años la única con presencia de la fase sexual del hongo, en consecuencia también de su mayor variabilidad. No obstante, no existen registros epidémicos en este patosistema en América en los siglos XVI y XVII (Figura 1y 5). Previamente, Peronosporahabía sido el género fungoso asociado con la enfermedad por científicos ingleses como Miles Joseph Berkeley (Berkeley, 1946), pero fue Anton de Bary quien la estudió con mayor profundidad en el contexto del concurso público ‘Grand Prix des Sciences Physiques, proposé pour 1857’ (Figura 5) convocado por la Académie des Sciences (Matta, 2010). Anton de Bary, entre otros hallazgos, observó que el crecimiento micelial estaba asociado al Tizón tardío de la papa, determinó su ciclo de vida y lo identificó como Phytophthora infestans, actualmente es considerado un pseudohongo perteneciente a la clase oomicetes (Turner, 2005).

Fuente: Saville y Ristaino, 2021.
Figura 4 Dispersión mundial de clado genotípico FAM-1 Phytophthora infestans (en amarillo) causante de la epidemia en papa (S. tuberosum) en 1840’s, responsable de la hambruna de Irlanda con más de 1.1 millones de muertos; y el clado genotípico US-1 de aparición posterior (en azul). Líneas punteadas indican rutas marítimas británicas estimadas para 1930. Líneas azules sugieren las posibles rutas y años de dispersión de FAM-1 a África y Asia. El año en cada país indica el registro de la colecta en herbario y la estrella indica lugar con reporte de la enfermedad.

Figure 5 A. Familias irlandesas afectadas por la hambruna entre 1845 - 1849. B. Notificación del del Grand Prix Des Science Physiques para estudiar el modo de formación de la estructura, el papel fisiológico, la germinación y la penetración de esporas de los hongos parásitos. C. Síntomas foliares del tizón de la papa. D. Estructura de esporas de Phytophthora infestans.
Tizón, Millardet, variabilidad y resistencia. La solución propuesta por de Bary estuvo acorde con el inicio del higienismo en la contención de epidemias en humanos a mitad del siglo XIX, p.e., de J. Snow en el manejo del Cólera (1854); de Bary sugirió la eliminación de fuentes de inóculo, práctica referida en la fitosanidad como sanitización, consistente en destruir tubérculos afectados. Sin embargo, la agresividad infecciosa del patógeno condujo al desarrollo del principio de curación/protección con el exhaustivo uso del caldo bordelés, desarrollado en 1885 (sulfato de cobre, cal hidratada, agua) (Millardet, 1885), considerado el precursor de la primera generación de fungicidas con acción de contacto. En la actualidad, a más de 150 años de la identificación de este microorganismo, la enfermedad es endémica con brotes epidémicos regionales ocasionados por migración génica del organismo, pérdida de resistencia varietal y de resistencia a fungicidas requiriéndose aplicar productos de tercera y cuarta generación, principalmente de acción sistémica (Mandipropamid y Azoxystrobin) (Lal et al., 2018; Romero et al., 2012); aun así se estiman pérdidas mundiales de US$ 6.7 billones anuales (Lal et al., 2018; Haas et al., 2009).
Al igual que SARS-CoV-2, la tecnología genómica aplicada en P. infestans ha demostrado que la caracterización de epidemias a nivel de población, bajo la asunción de homogeneidad de la especie, es insuficiente para la comprensión mecanística del parasitismo y que es necesario determinar los procesos subepidémicos a nivel de variantes o genotipos (Davis et al., 2021; 2011). Es decir, estudiar la estructura genómica poblacional. Por ejemplo, en P. infestans se ha podido identificar que un linaje genotípico, el FAM-1, fue responsable del proceso pandémico iniciado en 1840’s en Europa lográndose establecer en 144 años en seis continentes con una prevalencia del 73% estimada con muestras de herbarios colectadas entre 1845 y 1990 (Figura 4) (Saville y Ristaino, 2021). No obstante, el microorganismo es altamente variable. La secuenciación total del genoma de P. infestans ha revelado su complejidad y alta capacidad evolutiva y adaptativa al huésped (Haas et al., 2009). Esto explica el problema intrínseco con la aplicación irracional del principio curativo/protectivo que resulta en resistencia del patógeno a fungicidas debido a la presión mutagénica. Por ejemplo, se ha reportado la pérdida de efectividad biológica del metalaxyl en un periodo de 3 y 12 años (Lal et al., 2018), a pesar de la alternancia de fungicidas en programas de 16-24 aplicaciones por ciclo productivo de papa (Romero et al., 2012).
Resistencia a fármacos, análogo en fitopatógenos. La capacidad mutagénica de P. infestans a fungicidas no es privativa a patógenos de plantas. El desarrollo de resistencia a fármacos antimicrobianos en humanos (i.e., antibióticos, antivíricos, antifúngicos y antiparasitarios) es también una amenaza de salud para la humanidad de acuerdo a la OMS (Solano, 2021). Este organismo alerta que en 2050, si no se toman medidas para frenar la resistencia antimicrobiana, los decesos podrían alcanzar 10 millones tan solo a nivel intrahospitalario por ineficacia de los fármacos curativos. Sin embargo, esta institución es omisa al responsabilizar a la población implícitamente con su campaña 2021 ‘Corre la voz, frena la resistencia a los antimicrobianos’, por el uso indebido de medicamentos. Se soslaya la negligencia de este organismo, y de las instituciones de salud, por abandonar la prevención como estrategia de salud pública en beneficio del enfoque curativo predominante y conveniente para la industria farmacéutica y hospitales privados. Claramente, la aptitud parasítica microbiana adaptada a plantas, animales y humanos permite a los organismos evolucionar ante la presión que los agroquímicos o fármacos le impone. Epistemológicamente, la epidemiología emerge como una disciplina que permite introducir la racionalidad sistémica y holística en la solución sustentable de problemas de la salud en su amplia acepción biológica. Epidemias del pasado y presente indican que no lo hemos entendido.
Tizón, Pasteur, ciencia y causalidad. A diferencia de la Peste Negra, cronológicamente P. infestans había sido precedida de grandes descubrimientos científicos por Hooke, Leeuwenhoek, Koch, Pasteur y otros microbiólogos. La teoría de la generación espontánea estaba siendo severamente cuestionada para definitivamente desecharse en 1862 con el famoso experimento de ebullición de agua en un frasco de cuello de cisne por Pasteur (Institut Pasteur, 2021). Estos avances biológicos, incluyendo los evolutivos de Darwin (1859, 1871) y genéticos de Mendel (1864), entre otros, permitieron la fundación de las revistas Nature (1869) y Science (1880). Este fue el contexto de la ‘madurez’ de las ciencias que facilitaron dilucidar los mecanismos de parasitismo del hongo en las plantas de papa, aunque de Bary realizó pruebas de patogenicidad, su trabajo fue más descriptivo, de este y otros tipos de hongos como los causantes de las royas y carbones. El mérito de pruebas de patogenicidad lo tuvo B. Prevost en 1807, aun antes que R. Koch, publicando sus resultados en ‘Mémoire sur la cause immédiate de la carie oú charbon desblés, et de plusieurs autres maladies des plantes, et sur les préservatifs de la carie’. No obstante, de Bary es aceptado por la escuela americana como el precursor de la fitopatología. Sus logros fueron reconocidos en la revista Nature: ‘Prof. de Bary has worked out the scientific questions that occur as to the origin of the disease. It is owing to a fungus (Peronospora infestans)...’ (Dyer, 1874). En congruencia con la etapa fundacional de la microbiología donde las epidemias en humanos impulsaron su desarrollo, la epidemia fungosa de la papa y hambruna de Irlanda promovió también la consolidación de la fitopatología con el principio etiológico de la causalidad como su paradigma central (Yuen, 2021).
Curva COVID-19: Vicio del paradigma etiológico. El paradigma etiológico, como en la medicina humana, ha fortalecido el principio de protección (plantas) y curación (humanos) con la visión reduccionista de la identidad causal como evidencia suficiente para encontrar la cura de enfermedades. El paradigma etiológico también ha distorsionado el enfoque epidemiológico al enfatizar el estudio de la curva epidémica, construida con la progresión de la subpoblación enferma, cuando en realidad debería ser la prevención y la salud los principios de la epidemiología moderna (Figura 2). Esta visión restringida de la epidemiología está claramente exhibida con COVID-19. Existe un sinnúmero de sistemas web, siendo el Johns Hopkins Coronavirus Resource Center uno de los más conocidos (https://coronavirus.jhu.edu/map.html), que representan progresiones de incidencia y mortalidad en el tiempo con al menos dos problemas conceptuales (Mora-Aguilera and Acevedo-Sánchez, 2020): a. Las curvas son referidas a poblaciones demográficas de vastos territorios (p.e., país) sin una conexión funcional de dependencia espacial de contagio, b. La subpoblación enferma (i.e., positiva a SARS-CoV-2) es una muestra clínica proveniente de individuos que voluntariamente acceden a una prueba, ante la presunción de la enfermedad, o que son realizadas por razones de tratamientos hospitalarios; así, la tasa de contagio no es dinámica, se subestima, y no es aplicable a un modelo de mitigación preventivo.
Los indicadores epidemiológicos han funcionado con fines descriptivos del estatus epidémico (p.e., ocupación hospitalaria, número de camas usadas con ventilador, permisividad de movilidad y actividad comercial, valor porcentual de incremento o decremento de casos positivos, etc.), pero no para fines mecanísticos aplicables a la prevención de riesgos. Más aun, el interés por la comprensión epidemiológica de COVID-19 ha decrecido ante las expectativas de vacunación masiva. No obstante, al momento de escribir estas líneas, Europa exhibe su cuarta ola epidémica COVID-19. A Noviembre 2021, Alemania reportaba que ‘entró en un estado de emergencia nacional’ con un repunte mayor a 50 mil contagios diarios de acuerdo a Lothar Wieler, presidente del instituto de vigilancia sanitaria Robert Koch, y se reconocía que ni la vacunación, ni las restricciones contra personas no vacunadas ‘bastarán para frenar la nueva ola de infecciones’ (Ap et al., 2021b).
Curar: Otro vicio del paradigma etiológico. El paradigma etiológico, y en consecuencia el énfasis en la enfermedad, ha quedado tan arraigado que ha distorsionado los Sistemas Fitosanitarios y de Salud Pública constituyéndose, en el mejor de los casos, en modelos reactivos para la solución de problemas, no para su prevención. En consecuencia, relegan en la industria agroquímica y farmacéutica el aporte de la medicina curativa, y el abandono o desactualización técnica-científica de los Sistemas de Vigilancia (Mora-Aguilera et al., 2021a; Mora-Aguilera et al., 2021b). Así, no es sorprendente que un estudio reciente concluya que únicamente entre 1 y 3 infecciones de SARS-CoV-2 por cada 100 casos fueron detectados por los Sistemas de Vigilancia de EUA y varios países europeos durante la primera ola COVID-19 (Davis et al., 2021). La soberbia humana, acrecentada por las grandes revoluciones científicas y tecnológicas actuales, no permite comprender nuestra frágil ubicuidad en el mundo biológico. ‘El hombre se coloca a si mismo por encima de la vida´ (Erich Fromm).

Fuentes: A. https://fr-fr.facebook.com/pg/Lindoola-Coffee-Estate-225198544202156/posts/; B. MJ. Berkeley (1869); C. D. Morris (1879).
Figura 6 A. Deforestación y monocultivo de cafetales en Ceylán (Sri Lanka) en el auge cafetalero 1830-1870, escenario del primer brote epidémico de Roya del cafeto causado por Hemileia vastatrix (1868-1892); B. Esporas ‘kidney-shaped’ y ‘granulato-verrucose’ ilustradas por MJ. Berkeley (1869); C. Integración de estrategias de control sugeridas en 1869 por ‘practical men of considerable knowledge and experience in coffee cultivation, aided, by careful scientific observation’.
Roya del cafeto (1869-1892), razas y variedades. La historia epidémica de la Roya del café (Figura 6A-C), originalmente conocida como ‘Coffee leaf disease’, enfermedad fungosa de plantas de café (Coffea spp.) causada por Hemileia vastatrix, es análoga al Tizón tardío de la papa en términos de dispersión geográfica asociativa del patógeno-huésped, alternancia de eventos epidémicos con endemicidad y aparición constante de nuevas de razas del hongo. En la Roya se debe principalmente a la presión mutagénica por variedades resistentes, no por efecto de fungicidas (Alvarado-Alvarado et al., 2005). La estrategia genética se ha privilegiado sobre la química debido a la artificial depreciación del café en mercados internacionales con la consecuente reducción del valor de compra al productor por empresas intermediarias. El escaso margen de rentabilidad del cultivo para la vasta mayoría de cafetaleros, aun con los eventuales incrementos de precio internacional, opera en detrimento de la adquisición de agroquímicos. Esta es la razón de la proliferación productiva del cafetal orgánico. Una alternativa obligada por la sostenida depreciación del café. También explica la ausencia de un mercado rentable para empresas de agroquímicos. Sin embargo, tampoco lo es para empresas ‘semilleras’ (p.e., Syngenta).
En América, la generación de variedades de café, similar a muchos cultivos perennes, ha sido predominantemente un esfuerzo de instituciones nacionales (p.e., EMBRAPA, Brasil; ICAFE, Costa Rica), estatales (UFLA/EPAMING, Brasil), o de asociaciones de productores (IHCAFE, Honduras; Anacafe, Guatemala; FNC, Colombia) (EMBRAPA, 2021). Cuestionablemente, México carece de estos esfuerzos institucionalizados desde los 80’s, por la extinción del INMECAFE. La responsabilidad asumida por el Estado y productores ha permitido libre disponibilidad de genotipos, incluso entre países, sin patentes que pongan en riesgo la propiedad común del germoplasma. Caso contrario a lo que ocurre en muchos cultivos extensivos de granos y hortalizas donde las empresas impactan en la ‘agenda’ productiva. Contrario también a lo que ahora impera con farmacéuticas que ostentan las patentes de vacunas para SARS-CoV-2 ante la claudicación del Estado para generarlas. Esto se ilustró con BIRMEX en México en una sección previa (BIRMEX, 2021). La rectoría gubernamental y de productores ha permitido paliar brotes epidémicos recurrentes de Roya del Cafeto y Citrus Tristeza virus debido a la libre disponibilidad variedades en América. Por ejemplo, variedades Costa Rica 95 (Costa Rica), Lempira (Honduras) y Castillo (Colombia), entre otras, se usaron en México y otros países para reconvertir cafetales de Typica, Bourbon o Caturra, susceptibles a H. vastatrix durante el brote epidémico 2009-2015 en Centroamérica (Mora-Aguilera et al., 2021a).
Entonces, ¿Por qué continúan ciclos epidémicos de la Roya si no hay visiones empresariales que distorsionen los modelos fitosanitarios? Es decir, la curación como principio de mercado en la salud de plantas y humanos. Con esta enfermedad hay dos experiencias, la agronómica y el cambio climático, que se adicionan a la idea previamente discutida de intensidad epidémica en función directa con el desplazamiento del patógeno-cultivo a nuevas áreas de adaptación productiva. Regiones de introducción donde impera un menor conglomerado de factores de supresión y competencia biológica, y una menor diversidad genética del huésped. El café es presuntivamente originario de Kafa, Etiopia con antecedentes de cultivación desde el siglo IX, predominantemente la especie C. arabica (Ferreira et al., 2019). Es una región de alta montaña entre 1.830 y 2.440 msnm, 22 °C de temperatura media, y 510 a 1.525 mm de precipitación anual. Un tercio de este territorio y sus áreas limítrofes están cubiertos por bosque húmedo tropical con tres o más pisos altitudinales (Ferreira et al., 2019; Zewdie, 2003). ‘El bosque provee sombra para el cultivo del café y especias de valor comercial que prosperan al estar protegidas de las heladas y la luz solar directa’ (Zewdie, 2003). Las culturas locales lograron evitar la diseminación regional de semilla/plantas de café, hasta que Holandeses, Franceses y Británicos (siglo XVI y XVIII), lograron la movilización a sus colonias (Ferreira et al., 2019; McCook, 2006).
Roya del cafeto: Parasitismo biotrófico. La especificidad y especialización parasítica obligada o biotrófica de H. vastatrix a especies del género Coffea (Aime, 2006), el cual posee una diversidad de 124 especies aptas para un ambiente forestal variable (Ferreira et al., 2019; Davies et al., 2011), sugieren una coevolución muy estrecha patógeno-huésped en la zona ecuatorial africana (McCook, 2006). Estudios filogenéticos con el gen 18S rDNA y 28S rDNA ha permitido postular que las royas (Basidiomycetes: Uredinales) divergieron hace 150 o 250 millones de años a partir de ancestros adaptados al trópico arbóreo, entre los cuales se identificó a H. vastatrix (Aime, 2006; Wingfield et al., 2004). La ancestralidad de este hongo y su ciclo biológico en C. arabica, con rara presencia de una fase telial, espora sexual considerada de sobrevivencia invernal y recombinación genética, sugiere su adaptación a climas tropicales benignos como Kenia y Etiopia, más que el reflejo de una condición fisiológica primitiva. La fase sexual, sin embargo, posiblemente existe en C. canephora y C. eugenioides, progenitores de C. arabica (Carvalho et al., 2011; Aime, 2006). La coevolución de un parasitismo obligado, de infección foliar supra-estomático no sistémico, i.e., con ruptura del ciclo infeccioso por senescencia de hojas en detrimento de su sobrevivencia, acoplado a un amplio acervo genético del huésped, posiblemente derivó en limitada agresividad infectiva y baja prevalencia en Etiopia, Kenia y otras regiones de África ecuatorial, situación que prevalece hasta el presente. Es decir, ausencia de un proceso epidémico masivo ya que operaría contra la pervivencia del hongo mismo.
COVID-19: Parasitismo ‘biotrófico’, variantes y letalidad. El tipo de parasitismo biotrófico de H. vastatrix, pero de naturaleza sistémica y múltiple tropismo también lo exhibe SARS-CoV-2 (Saito et al., 2021) y la inmensa mayoría de los virus de plantas y animales. Este tipo de parasitismo, altamente específico, implica un proceso coevolutivo patógeno-huésped complejo y dinámico que debe ser entendido para predecir y prevenir brotes epidémicos (Robinson et al., 2013). El origen zoonótico de SARS-CoV-2 implica que el virus apenas inició su fase de adaptación y coevolución con el humano. No obstante, su éxito infeccioso masivo le ha permitido generar alta variabilidad genómica (O’Toole et al., 2021; Shu and McCauley, 2017), y una estructura poblacional compleja con clados diferenciados por regiones geográficas, género, edad, síntomas presentes o ausentes y letalidad (Lee et al., 2021; Hamed et al., 2021).
Se puede hipotetizar que la letalidad y mortalidad de SARS-CoV-2 es un estado transicional adaptativo y que se esperaría una evolución hacia variantes moderadas, compensado la gradual pérdida de severidad infecciosa con alta tasa de transmisibilidad y/o evasión al sistema inmunológico (Saito et al., 2021; Liu et al., 2021; Vashishtha, 2021). Así, existe una sucesión de variantes altamente prevalentes a nivel mundial (muchas variantes no tienen aptitud parasítica y desaparecen): B.1.1.7 (Alpha), B.1.351 (Beta), P.1 (Gamma), and B.1.617.2 (Delta) (Saito et al., 2021; WHO, 2021c). Esta última ha sido menos agresiva-letal (i.e., menor tasa de hospitalización) que las primeras variantes del virus, en ausencia de enfermedades crónicas de predisposición al virus (Álvarez-Maya et al., 2021). Sin embargo, su patogenicidad aparentemente es mayor en términos de velocidad y tropismo.
El incremento en transmisibilidad de Delta se ha asociado al efectivo reconocimiento viral con células del huésped debido a la mutación P681R del gen que sintetiza la proteína S (Saito et al., 2021). La variante Delta también exhibe un periodo de incubación y latencia más corto permitiéndole evadir al sistema inmunológico (Vashishtha, 2021). El incremento en transmisibilidad también es determinante porque aumentan los eventos de multiplicación viral y por consiguiente la probabilidad de variabilidad genómica; mantiene activa la epidemia; y puede reducir el beneficio de ‘inmunidad rebaño’ inducida con la vacunación (Liu et al., 2021). Toda variación genómica implica riesgo en pérdida de efectividad de vacunas. El riesgo es mayor considerando que estas fueron generadas con el linaje B1 original de China y predominante en la fase epidémica 2020 (Liu et al., 2021). La OMS recientemente anunció la pérdida de 40% de efectividad de vacunas debido a la variante Delta (Afp y Reuters, 2021).
COVID-19: Ómicron, comunicación y negocio. En este contexto, la nueva variante B.1.1.529 (Callaway, 2021), ‘altamente transmisible y preocupante’ denominada ‘Ómicron’ por la OMS (WHO, 2021d), ha desencadenado reacciones globales alarmantes aun sin tener suficientes datos científicos y que además no es concordante con la lógica evolutiva expuesta. Es preocupante que se continúa sin modelos predictivos de emergencia, establecimiento y prevalencia de nuevas variantes en la estructura población de SARS-CoV-2. Modelos que hasta el momento no se han desarrollado a pesar del gran avance en genómica funcional y cuantitativa (https://www.gisaid.org/hcov19-variants/). Los mismos investigadores que reportaron la nueva variante expresaron sus dudas: ‘It is also unclear whether the variant is more transmissible than Delta, says Moore, because there are currently low numbers of COVID-19 cases in South Africa’, también es necesario ‘see what this virus does in terms of competitive success and whether it will increase in prevalence’ (Callaway, 2021).
Los impactos del anuncio de Ómicron han sido inmediatos en la economía global con caídas de bolsas internacionales, cancelación de vuelos desde el sur de África, especulaciones sobre la efectividad antigénica de vacunas actuales, etc. (EFE y AFP, 2021). Esto implica que poco se ha aprendido en la gestión de la pandemia actual (o convenientemente no se ha querido aprender), y que no hay estrategias de comunicación de riesgo efectivas a todos los niveles de toma de decisiones. También estimula los intereses comerciales de grandes empresas que presionan para su ‘rescate’, ofreciendo a cambio ‘apoyo, estabilidad y evolución a las cadenas de valor’ (Español, 2021; Fernández-Vega, 2021). Pero son las farmacéuticas las más beneficiadas.
AstraZeneca, Pfizer/BioNTech, Moderna y Novavaxya inmediatamente expresaron su capacidad para combatir a la variante Ómicron. Crear una nueva vacuna sería ‘muy rápido’ (Afp y BBC, 2021). Funcionó la estrategia mediática. De inmediato el valor accionario de Pfizer y Moderna se dispararon en 6.4% y 27.5%, respectivamente. En la bolsa alemana, las acciones de BioNTech socio de Pfizer aumentaron en un 12% (Vivas, 2021). Irresponsablemente, se ejerce la coaptación de la sociedad con el fomento del miedo como recurso para obscuros intereses políticos y económicos. La pandemia como oportunidad de negocio, sin buscar la solución integral de raíz ante un Sistema Público de Salud desarticulado a nivel global y regional (CEPAL y OPS, 2021; Frenk, 2003). La misma OMS reconoce que el COVID-19 evidenció la necesidad de una nueva ‘arquitectura sanitaria internacional…para predecir, prevenir, detectar, evaluar y responder eficazmente a las pandemias de forma sumamente coordinada’ (WHO, 2021e).
Epidemias y pérdida de agresividad patogénica. La pérdida de agresividad de los virus por largos procesos adaptativos al huésped está demostrada con los adenovirus de humanos (HAdV-), causantes de gripe común, los cuales podrían tener su ancestro en virus de primates no-humanos (NHAdV-), con alta especificidad y sin evidencias actuales de transmisibilidad-infectividad interespecífica (Bots y Hoeben, 2020). Este es un escenario análogo a la Malaria o Paludismo pero con los protozoarios Plasmodium falciparum y P. vivax, excepto que estos exhiben una variabilidad genética altamente restringida (Sharp et al., 2020). Los adenovirus HAdV- se agrupan en seis especies (A-G) con una diversidad total de 103 tipos generados por procesos mutagénicos y recombinación homóloga (Robinson et al., 2013). Su especificidad y relativa baja agresividad, incluso asintomática, aunque con algunas mutaciones letales (Robinson et al., 2013), es la razón del uso de adenovirus, con replicación no-funcional o funcional, como vectores para la generación de vacunas contra SARS-CoV-2 (p.e., Johnson & Johnson y AstraZeneca) y con fines oncolíticos (Bots y Hoeben, 2020).
En plantas, la pérdida de agresividad viral en respuesta adaptativa al huésped está documentado con el Citrus tristeza virus, el cual modificó la predominancia de variantes severas con efectos letales (p.e., T36), presentes en el brote epidémico Sudamericano en los 30’s, con variantes moderadas asintomáticas (p.e., T30) durante su gradual y lento avance pandémico continental. Actualmente en México, el Citrus tristeza virus es asintomático con brotes aislados severos por movilidad de plantas infectadas (Rivas-Valencia et al., 2010; Rivas-Valencia et al., 2008). Estas variantes virales moderadas circulan por adquisición-inyección mediada por al menos cuatro especies de insectos vectores (Hemiptera: Aphididae) (Loeza-Kuk et al., 2008), pudiendo conferir ‘protección cruzada’ contra la infección eventual de variantes severas, como se ha implicado en España y Florida (Harper y Cowell, 2016). Esta ‘vacuna’ natural en plantas fue encontrada por primera vez en Brasil (Müller y Costa, 1977), la cual sin embargo, en esa región requiere ‘pre-inmunización’ artificial de plantas y uso de patrones resistentes para reducir el efecto de razas severas del Citrus tristeza virus (Rui Leite, IAPAR. Br. Comunicación Personal), las cuales se mantienen ‘latentes’ en la estructura poblacional del virus (Loeza-Kuk et al., 2008).
COVID-19: Patogenicidad y biología. La evidencia de la sección previa demuestran que la patogenicidad de SARS-CoV-2 y su implicación en los procesos epidémicos debe ser comprendida en un entorno poblacional comunitario para una efectiva prevención y mitigación de riesgos (Li et al., 2021). La patogenicidad clínica actualmente estudiada con ratones, hámsteres y células Vero (Lee et al., 2021; Liu et al., 2021; Saito et al., 2021) requiere complementarse con modelos digitales epidemiológicos comunitarios para acelerar la comprensión clínica, reacción inmunológica natural e inducida (vacunas), e interrelacionada con enfermedades crónicas no infecciosas. Es necesario fortalecer estudios evolutivos del SARS-CoV-2 para dilucidar virulencia, agresividad, transmisión, tropismo tisular y expresión de la enfermedad. Adicionalmente, la filogeografía de coronavirus a partir de la fuente(s) animal, la identificación de regiones genómicas variables que determinan su adaptabilidad al humano y generación de modelos genómicos predictivos es urgente ante la activa migración en los últimos 20 años de varios coronavirus, destacándose el PDCoV, HCoV-NL63, MERS-CoV, SARS-Co 2003, y SARS-CoV-2 (Lednicky et al., 2021; Li et al., 2021; García-Ruiz et al., 2021).
Roya: Diversidad genética, movimiento y monocultivo. En H. vastatrix, se puede hipotetizar que su coevolución a través de millones de años con 124 especies de café tuvo un fuerte efecto multilínea (sensu Jensen, Borlaug y Gibler) similar al concepto de mezcla de genotipos F4-F5 Castillo, cultivar compuesto, empleado por la FNC Colombia (Alvarado-Alvarado et al., 2005), lo que ocasionó una condición de baja prevalencia fungosa-infecciosa (McCook, 2006). La selección y movilización de C. arabica, y eventualmente del hongo, por colonizadores europeos entre los siglos XVI y XVIII (McCook, 2006), rompió este efecto estabilizador. El riesgo fue mayor por la sexualidad críptica del hongo, i.e., intercambio genético a nivel de uredosporas en ausencia de teliosporas, la cual se ha postulado como una especialización de H. vastatrix a C. arabica para asegurar su sobrevivencia produciendo mayor cantidad de inóculo heterogénico (Carvalho et al., 2011). Sin embargo, es posible que el hongo tuviera una diseminación lenta porque no infecta la semilla, presuntivamente empleada para la movilización del germoplasma (contrario al tubérculo de papa por P. infestans). Fue hasta que se logró cultivar plantas de cafeto en grandes plantaciones y se requirió transportar plantas. Por ejemplo, aunque ya se había introducido el café a nivel de jardines-traspatio y se consumían hojas, entre 1640 y 1796 los Holandeses reintrodujeron a Ceilán plántulas de café de Java, una de sus colonias cafetaleras (Boyle, 2014), y los Británicos lo continuaron entre 1865 y 1880 (McCook, 2006).
Ceilán ya como colonia británica, actualmente Sri Lanka, fue la primera región que tuvo éxito en el cultivo extensivo del café en condición de monocultivo sobre suelos deforestados para ese propósito (Figura 6A) (Sabaratnam, 2010). Este cambio agroforestal, a uno de monocultivo, combinado con un gradual incremento de la superficie cultivada, favoreció la dispersión y el contagio del hongo ocasionando el primer brote epidémico en 1869-1892 (Figura 1). Drásticamente se alteró el nicho forestal diverso del cafetal (Zewdie, 2003), por uno artificial, con poblaciones de plantas fenotípicamente uniformes y espacialmente continuas, físicamente expuestas, con pobre regulación microambiental (p.e., radiación foliar, alta variación diurna de humedad relativa y temperatura), estrés hídrico, erosión y pérdida de fertilidad de suelo. Todo esto causado por la deforestación, la cual se estimó en 100 mil ha (Boyle, 2014; Reddy, 2003). No es solo el movimiento de un cultivo y sus plagas-patógenos fuera del centro de origen. Emergió claramente otro factor condicionante para las epidemias, el manejo agronómico y ambiental como factores de predisposición. Esto equivale a factores de riesgo intrínsecos a poblaciones humanas como hacinamiento, desnutrición, agotamiento físico, ausencia de higiene, etc., que caracterizaron a las comunidades que padecieron la Peste Negra y Cólera durante el auge industrial europeo. Notoriamente, la enfermedad se llegó a conocer como la ‘Malaria del café’, endémica en el Londres suburbano del XVII, por el debilitamiento de la planta sin causar la muerte (McCook, 2006).
Roya: Impacto epidémico. La fiebre por cultivar café, llamada ‘coffee rush’, inició en 1830 y tuvo su auge en 1870. Ceilán llegó a cultivar 111400 ha y exportar 36 millones de kg en un año (746120 quintales) (Boyle, 2014). La enfermedad redujo la superficie a 4600 ha (Reddy, 2003). Entre 1869 y 1874 la enfermedad ya se había reportado en el sur de India, y Sumatra, Java y Bencoolen en Indonesia, reconociéndose su capacidad epidémica (Morris, 1869). Ceilán, junto con Brasil e Indonesia ostentaron la mayor producción de café en 1860; actualmente está en posición 35 mundial. La pérdida de plantaciones en 15 años provocó un cambio radical del consumo de café por té en Inglaterra (Reddy, 2003; Schumann, 1991; Schieber, 1972). En 1824, los británicos introdujeron plantas de té (Camellia sinensis) de China, país que ya había domesticado-cultivado y mejorado genéticamente la planta por casi 3000 y 1000 años, respectivamente (Pandey et al., 2021; Meegahakumbura et al., 2018), pero fue hasta 1867 que se estableció como cultivo en Ceylán. En 1893 ya se exportaba un millón de paquetes de té y había desplazado al café totalmente. A diferencia del C. arabica cultivado (Scalabrin et al., 2020), la planta de té exhibe alta variabilidad genética en linajes domesticados con acervos de hasta 5100 (China e India) y 20000 (Global) accesiones, incluidos híbridos naturales o artificiales, principalmente derivados de los centros de origen (Meegahakumbura et al., 2018; Pandey et al., 2021). Esto puede explicar la ausencia de reportes epidémicos de alto impacto e incipientes aplicaciones tecnológicas en etiología y control (Pandey et al., 2021). En la actualidad, Sri Lanka es el tercer productor mundial.
Roya: Marshall, intervención epidémica tardía. Durante la fase más intensa de la epidemia de Roya, en 1880 el ‘criptogamic botanist’ inglés H. Marshall Ward, contemporáneo de Anton de Bary, fue enviado a Ceilán por el gobierno colonial Británico para apoyar trabajos de investigación en desarrollo (Figura 6C) (Vines, 1906; Morris, 1879). Once años antes (Noviembre 1869), el ‘fungologist’ MJ. Berkeley ya había reportado, a partir de muestras vegetales de Ceylán: ‘it is not only quite new, but with difficulty referable to any recognized (sic) section of Fungi. Indeed it seems just intermediate between true moulds and Uredos….We are obligated, therefore, to propose a new genus…Hemileia Berk. and Broome’ (Figura 6B) (Berkeley, 1869). Aunque este reporte fue taxonómico ya que no implicó estudios de patogenicidad, existía la noción de causalidad infecciosa implicada por de Bary en P. infestans, por lo que se aceptó la causa microbiológica. Más aun, Berkeley sugirió ‘as the Fungus is confined under the surface of the leaves…it may be difficult to apply a remedy; but we should be inclined to try sulfhur…’. Esta recomendación no fue atendida. Era comprensible, el patógeno no tenía una dispersión más allá de 1.5 ha en julio 1869 (Morris 1879). En realidad, poco se sabía de sus mecanismos parasíticos y no se tenía un antecedente devastador epidémico en cafetales. Pero lo más importante, la prevención no existía como principio comprensible y aplicable para una condición ‘pre-epidémica’ espacialmente delimitada en un foco(s). No se tenía la noción que cuando una epidemia esta temporalmente definida en una curva y alcanza su fase exponencial es imposible detener su velocidad con estrategias preventivas (Figura 6C).
Roya: Población, contagio y aplanar curvas. En la Roya, como en Cólera y Peste Negra, altas poblaciones y el hacinamiento (monocultivo) tuvo su rol determinante como un factor de contagio. Así, de algunas plantas infectadas en mayo 1869, en ‘1873 all, or nearly all, the estates in the island were attacked’ y la reducción productiva por la enfermedad pasó de un promedio quinquenal de 565 (1867-1871) a 364 kg ha-1 (1872-1876), 36% pérdidas (Morris, 1879; Morris, 1880). Interesantemente, similar de nivel de pérdida máxima (31%) se encontró en 2014 en la fase de mayor intensidad epidémica en Chiapas (G. Mora, CP-LANREF. No publicado). Enfoques regionales de experimentación en ‘large scale’ para el control de la roya fueron impulsados por el ‘Legislative Council of Ceylon’, generándose en 1879 un conjunto de recomendaciones combinando ‘remedies’ y medidas de prevención parcelaria y regional (Figura 6C) (Morris, 1879). Pero ya era tarde. Prevenir precede una epidemia. ‘Aplanar’ la curva, un término recurrente durante la primera y segunda ola pandémica COVID-19 (ahora se omite el término), no se encuentra en ningún proceso epidémico histórico. El momentum exponencial de una epidemia obedece a principios biológicos que hace imposible ‘aplanar’ una curva sin la eliminación total de la población enferma. Implicaría una interrupción absoluta de cadenas de contagio. Lo pensaron los cafetaleros con plantas enfermas o abandonadas (Figura 6C). Nunca se aplicó. Aun se creía que ‘where careful and intelligent cultivation is pursued they still offer a promising and attractive investment’ (Morris, 1879).
Roya: Dispersión patogénica y Sistema Epidemiológico . Marshall encontró un escenario epidémico tardío en 1880. Lógicamente, no tuvo éxito en su misión de controlar la epidemia. Su aporte fue el mecanicismo biológico de la enfermedad acorde con el enfoque planta-patógeno de su contemporáneo de Bary. En esta etapa la epidemiología, vegetal o humana, aun no tenía un cuerpo conceptual-metodológico científico. El Sistema Epidemiológico, i.e., huésped, patógeno, clima, y manejo (Mora-Aguilera et al., 2021a), marco racional fundamental para comprender epidemias, surgió conceptualmente con E. A. Gäumann, en ‘Principles of plant infection’, libro publicado en 1946. Marshall como botánico, estudió histológicamente la patogénesis del hongo, pero propuso estrategias noveles para estudiar el ciclo de enfermedad mediante inoculaciones in vivo, e inferir el contagio a partir del trampeo de esporas en cafetales afectados (Ayres, 2005). La deducción no experimental de la ‘degeneración del aire’ como explicación de la ‘contagiosis’ de la Peste Negra y otras enfermedades propuesta 254 años antes por Girolamo Fracastoro (1546), se estaba demostrando por primera vez con un hongo. La epidemia como producto de inóculo liberado y dispersando por el viento: ‘the air must sometimes have turned red on windy days’. Comprender los mecanismos de contagio es fundamental para desarrollar estrategias de mitigación en toda epidemia (Coria-Contreras et al., 2015).
COVID-19. Dispersión viral e ‘higienismo’. Como en Roya y muchos fitopatógenos, con SARS-CoV-2 se usaron trampas volumétricas de succión de aire en sistemas de transporte público detectándose al virus con técnicas moleculares (RT-qPCR). Esto demuestra la capacidad de dispersión de partículas virales en gotículas de saliva justificando el empleo cubre bocas como medida preventiva (Moreno et al., 2021b). En el mismo estudio, y en otros, la detección de partículas en superficies justifica la higiene de manos. La reticencia de estas medidas básicas, paradójicamente mayor en países desarrollados, al igual que el rechazo a la vacunación, es otra evidencia de la deficiente o nula comunicación de riesgos de los Sistemas Públicos de Salud, exacerbados en algunos países, como EUA y Brasil, por dirigentes políticos negacioncitas. En este contexto, las medidas Austriacas muestran el esfuerzo para revertir la resistencia pública. Con menos del 66% de vacunación, la más baja de Europa occidental, inmersa en la cuarta ola epidémica y la detección de la nueva variante Omicrón, aplicará confinamiento obligatorio y multas a personas que rechacen la vacunación contra SARS-CoV-2 (Europa Press, 2021).
Roya: Prevención y sanitización en Marshall. Marshall, con sus estudios mecanísticos en la Roya, concluyó que la prevención era la única estrategia viable de mitigación: ‘... Not the killing of the parasite in the leaves infected…but preventing its development by covering preventively the surface of the leaves with various substances capable or making spores lose their viability or, at least, impeding their germination ’. Con el mismo fin ‘preventivo’ sugirió la ‘sanitización’, mediante eliminación e incineración de tejido dañado y plantas enfermas (en realidad no necesario ya que el patógeno no es sistémico), y vigorizar la planta con nutrición orgánica, una práctica ya realizada en Ceylán por la pérdida de fertilidad de suelos causada por la deforestación (Figura 6A). Sin embargo, la prevención efectiva precede una epidemia. Sus propuestas a 11 años del inicio epidémico no eran efectivas. En consecuencia, tuvo la presión de cafetaleros y políticos. Ward se defendía aduciendo la causalidad como su propósito (Ayres 2005). Error antes y ahora. Una epidemia no se mitiga con enfoques etiológicos. Pero era la época en que los científicos se habían visibilizado ante la sociedad y esta los percibía como sus salvadores. Snow, Proust, Pasteur, Koch, Jenner, de Bary, así lo probaban. Actualmente, ante COVID-19, en la óptica política y mediática, los ‘héroes’ son las farmacéuticas.
La causa sin su mecanismo es limitado para el control. Marshall lo comprendió. Estableció que la germinación de H. vastatrix era su fase vulnerable para controlar la infección y sugirió aplicar sustancias químicas foliares previo a la emisión del tubo germinativo. Una vez iniciado el proceso de infección determinó que el control era ineficaz. El azufre y la cal fueron sus únicas opciones. El ‘caldo bordelés’ todavía no se inventaba (Ayres, 2005; Schumann, 1991). Otro importante aporte conceptual de Marshall fue que ‘the history of all great planting enterprises teaches us that he who undertakes to cultivate any plant continuously in open culture over large areas must run the risk of epidemics’ (Zadoks y Koster, 1976). Así, se reconoció por primera vez el monocultivo extensivo como factor de predisposición epidémica. En 1970, la clásica epidemia del ‘tizón sureño del maíz’ (Bipoliaris maydis, sin. Helminthosporium maydis) en EUA, adicionó otro elemento fundamental. La uniformidad genética como base de la vulnerabilidad de los cultivos (Zadoks y Koster, 1976; Tatum, 1971). La población extensiva y genéticamente uniforme, que en esencia representa la optimización del contagio, se ha arraigado como un dogma epidemiológico.
Roya: Uniformidad genética, Revolución Verde, vigilancia. La población uniforme es en realidad un atributo antropogénico. Por ejemplo, la epidemia del ‘tizón sureño del maíz’, evidenció dramáticamente el riesgo inherente al énfasis en la resistencia genética monogénica o vertical, sensu Vanderplank, como principio curativo. También representó el fracaso del modelo preeminentemente genetista de la llamada Revolución Verde como modelo único e inequívoco de la agricultura moderna (Ceccon, 2008). Adicionalmente, demostró la omisión de empresas ‘semilleras’ al enfatizar el enfoque genético, reduciendo costos y tiempo, y subestimando la comprensión mecanística de procesos infecciosos y la generación de nuevas razas del hongo (Tatum, 1971). Analogía contundente en la tendencia tecnológica actual de farmacéuticas en su carrera por acaparar el mercado de inmunológicos contra SARS-CoV-2. Soluciones parciales pero rentables.
El propósito ‘preventing’, pero correctamente aplicado en condición de foco, ‘pre-epidémico’ de Roya del Cafeto, fundamentado en la biología infectiva del hongo, fue investigado para las condiciones cafetaleras de México. El principio preventivo fundamentó la generación de algoritmos computarizados automáticos para determinar alertas tempranas regionales. El objetivo fue detectar oportunamente focos locales de infección e ‘interrumpir cadenas contagio’ para prevenir la ocurrencia de epidemias temporales regionales de alta intensidad. Este modelo preventivo, operado por el gobierno federal (ONPF), se implementó para mitigar el brote epidémico en áreas mexicanas de producción de café iniciado en Centroamérica en 2009 (Avelino et al., 2015). Un Sistema Epidemiológico sistémico-holístico fue el marco racional para establecer el modelo de prevención aplicado a un Programa Nacional de Vigilancia Epidemiológica (PVEF-Cafeto). Con este sistema se logró el control del brote epidémico de la Roya entre 2013-2019 (Mora-Aguilera et al., 2021a).
Roya del cafeto: Cuatro eventos epidémicos. La dispersión global de H. vastatrix (McCook, 2006), ha ocurrido en tres etapas: 1. 1870-1920 en la cueca de Océano Índico; 2. 1950-1970 Oeste de África; y 3. 1970-1990 América. Recientemente, un cuarto proceso epidémico se presentó en América con mayor impacto en Centroamérica, 2009-presente (Figura 1). La actividad agresivamente colonialista tuvo una implicación fundamental en la primera etapa por transporte mercante y desplazamiento militar, y ante el colapso de la cafeticultora de Ceilán, por migración de inversionistas cafetaleros (la británica East India Company se consolidó en este periodo como facilitador de inversiones y comercio), y retorno de cosechadores hindúes Tamiles, los cuales podrían haber movilizado plantas. Está documentado que expediciones botánicas británicas contribuyeron activamente al movimiento de plantas de café y otros vegetales (McCook, 2006; Reddy 2003; Morris, 1879). En adición al rol antropogénico, se ha hipotetizado la implicación de vientos monzónicos desde Etiopía; sin embargo, la espora no es aerodinámica y las barreras forestales etíopes limitarían el efecto del viento como se comprobó para la vertiente del Soconusco, Chiapas (JJ. Coria. CP-LANREF, 2014. Datos no publicados). La segunda y tercera etapa dispersiva pudo deberse principalmente al movimiento de variedades o germoplasmas para generación de variedades comerciales de café, establecimiento o reconversión varietal de plantaciones, actividades que continúan hasta el presente (CIFC, 2021).
Roya: Clima en la cuarta epidemia y zoonosis. El actual brote epidémico de Roya en América, aunque con posible implicación del movimiento activo de cuadrillas de cosechadores entre países, es atribuible principalmente al desplazamiento del umbral térmico requerido para la infección de H. vastatrix, y de otros patógenos, acumulando un mayor número de horas favorables (NHF) para la germinación e infección de esporas (Mora-Aguilera et al., 2021a; Mora-Aguilera et al., 2014a). Esto se debe al sostenido incremento de temperatura global a partir de la Revolución Industrial, la cual se estima en 2.9 - 3.4 °C para 2050 en ausencias de acciones correctivas. Las evidencias con Hemileia - Coffea indican que el cambio climático podrá tener un efecto fundamental en la emergencia y reemergencia de epidemias contemporáneas en humanos, animales y plantas.
A nivel microambiental, los procesos infectivos son más sensibles a variaciones de clima lo que explica diversos eventos epidémicos a nivel regional. Esto justifica la inclusión rutinaria de medición de variables de clima y el cálculo automático NHF para monitoreo de riesgos biológicos en regiones cafetaleras y otros cultivos (Mora-Aguilera et al., 2021a). Adicionalmente, alteraciones climáticas también tendrán fuerte impacto en plantas cultivadas. Investigaciones recientes han demostrado el riesgo reductivo de la diversidad nativa del cafeto. Se proyecta que 50% de las 124 especies podrían desaparecer para 2088 (Davis et al., 2019; Moat et al., 2019; Rodríguez, 2019). El mayor daño sería para C. arabica, la especie más cultivada por calidad en taza, debido a su restringida variación genética en plantas nativas y cultivadas (Scalabrin et al., 2020). Esto limitaría su plasticidad adaptativa e implícitamente su resiliencia a un incremento de densidad de inóculo en patógenos (y plagas), como aparentemente ocurrió con H. vastatrix. En una visión más amplia del efecto antropogénico sobre el clima, la deforestación (históricamente vinculada al cultivo de café en varios países) (Figura 6A), presión urbana sobre áreas rurales, y prácticas agrícolas no sustentables podrían estar implicados en la recurrente ocurrencia de enfermedades zoonóticas en humanos al afectar los nichos ecosistémicos de animales (Rulli et al., 2021; Lawler et al., 2021).
Roya: Impacto epidémico y ‘Sistemas de Salud’. Migración local y trasfronteriza, problemas de seguridad alimentaria e incremento de enfermedades en comunidades cafetaleras como consecuencia de pérdida productiva de café, estimadas entre 10 - 55%, fueron los efectos del brote epidémico de Roya en Centroamérica. (Mora-Aguileraet al., 2021a; Lynch, 2019; Ruiz-de-Oñaet al., 2019; Cerdaet al., 2017). Colombia y Brasil, países con una mejor infraestructura y tecnología productiva, incluyendo programas para generar variedades resistentes contra H. vastatrix, nematodos, sequias, heladas, etc. como base de un modelo preventivo fueron los menos afectados. Esto se esperaría de un ‘Sistema de Salud’ funcional, con líneas de investigación de vanguardia para sustentar la planeación productiva de mediano y largo plazo, incluyendo proyecciones adaptativas ante el inminente cambio climático (Alvarado-Alvarado et al., 2005; Embrapa, 2021). En contraparte, un ‘Sistema de Salud’ disfuncional tuvo las consecuencias previsibles para el resto de países cafetaleros. Misma lección global ante la actual crisis sanitaria por SARS-CoV-2 con un generalizado modelo curativo individualizado en detrimento de la prevención comunitaria y con ausencia de Sistemas de Vigilancia modernos y efectivos.
Mutación de patógenos y vacunación COVID-19. La epidemia de Roya del cafeto, continúa en Centroamérica. La variedad Lempira (2017) y Costa Rica (2018), previamente resistentes a H. vastatrix, perdieron su resistencia debido a la alta presión poblacional del hongo derivando en la emergencia de nuevas razas (World Coffee Research, 2021; 2017). Esto es equivalente a la pérdida gradual de efectividad de las vacunas actuales contra SARS-CoV-2 ante ‘olas epidémicas’ que aumentan la probabilidad de mutaciones exitosas prevalentes (Afp y Reuters, 2021).
La variabilidad genética de un agente infeccioso está en directa proporción de ciclos cortos de infección, alta frecuencia de infección, tasa de contagio, e incidencia en la estructura poblacional del huésped. Pero también, está determinada por la presión mutagénica de medidas de control; en el caso de la Roya del cafeto, la presión génica de variedades resistentes, y en el Tizón tardío de la papa, fungidas. SARS-CoV-2 se comporta como cualquier agente biológico incentivado por el sistema inmunológico del humano que no ha ‘coevolucionado’ con el patógeno por largo tiempo. Sorprendentemente, en poco tiempo ha evidenciado su capacidad mutagénica, posiblemente por la sincronía global infecciosa en una población altamente heterogénea en factores de riesgo y desencadenantes, incluyendo condición étnica (Álvarez-Maya et al., 2021).
En el escenario actual, la revolución genómica ha sido fundamental para identificar con rapidez la emergencia de variantes de SARS-CoV-2 (https://www.gisaid.org/). Las variantes ‘preocupantes’ de impacto epidémico han emergido predominantemente de países con alta intensidad epidémica dispersándose rápidamente a más de 100 países: GB (Alfa-2020), Sudáfrica (Beta-2020), Brasil (Gamma-2020) e India (Delta-2020). Otras variantes de ‘interés’ epidémico, tienen una condición local en Perú (Lambda-2020) o Colombia (Mu-2021), o preocupan por su alta variación genética, como Ómicron reportada en Sudáfrica el 26 de noviembre (2021) y presente en 34 países (https://www.gisaid.org/). Estas variantes afectan los protocolos de diagnóstico, tratamientos clínicos y la efectividad de vacunas (WHO, 2021c).
Si bien la variabilidad genética es intrínseca a la capacidad biológica adaptativa del virus, limitar su capacidad mutagénica es posible restringiendo los procesos infecciosos masivos mediante la aplicación generalizada de inmunizantes contra SARS-CoV-2. No ha ocurrido. Se ha planteado reiteradamente que la distribución inequitativa de vacunas puede prolongar la pandemia y aumentar los riesgos de nuevas variantes. Sudáfrica, origen de 2/5 variantes de interés epidémico, tiene 25% de población vacunada, mientras que a nivel de África continental es del 5% (ONU, 2021). Un contraste con países desarrollados que en promedio tienen 65% de la población con al menos una dosis, contra el resto del mundo menos desarrollado que exhibe el 7% (Afp, 2021e). Las acciones antropogénicas no solo pueden operar contra la naturaleza, condicionando las epidémicas de humanos, plantas, y animales, sino también contra sí mismo.
5. Los epidemia y pandemia en la historia
Epidemios, población y vigilancia en Hipócrates. El concepto de epidemia ( epidemios = epi + demos), etimológicamente entendida como lo que está sobre una población, se atribuye por primera vez a Homero en la Odisea (600 a.C.) para referirse a persona que está en su país, no en un contexto de enfermedad (Martin y Martin-Granel, 2006). Fue Hipócrates en su libro ‘ Of the epidemics ’ (Hippocrates, 400 a.C) quien hace referencia a síndromes clínicos en diferentes localidades de Grecia respecto a una población (people) . Por ejemplo: ‘ In Thasus…the whole season being wet, cold, and northerly, people (ed. demos) were, for the most part, healthy during winter; but early in the spring very many, indeed, the greater part, were valetudinary. At first ophthalmies set in, with rheums, pains, unconcocted discharges, small concretions… ’. Notar que Hipócrates establece la asociatividad de la condición sana (healthy) y enferma (rheums, pain, etc.) con el espacio (Thasus), tiempo (during winter, early spring) y población (people), marcos racionales fundamentales de todo proceso epidémico (Hippocrates, 400 a.C).
Fuente: Vanderplank, 1963.
Figure 7 Progreso del tizón en la papa causado por Phytophthora infestans. La mitad superior muestra el aumento de x, y la mitad inferior el aumento de log10 [x/(1-x)].
Más interesante aun, los principios de prevención y curación (protección) subyacen en las descripciones primigenias de la epidemiología en Hipócrates. La vigilancia de la condición sana (healty during winter) es la base de la prevención, como la enferma o clínica (early in spring…were valetudinary) es de la curación. Esta es la falla estructural de la epidemiología actual enfocada en la curva del daño/enfermedad (Figura 7), e intrínsecamente en la adopción del principio curativo como estrategia de mitigación. La limitación analítica de curvas epidémicas COVID-19 y la ausencia de una vigilancia preventiva se han documentado durante el desarrollo de este documento. La epidemiologia no es el registro de la epidemia. Los registros solo describen su progreso temporal, valioso, pero no permite el desarrollo mecanístico de ideas (Zadoks, 1976).
Hipócrates empleó epidemios como un adjetivo para referiste a una condición de enfermedad establecida (‘preveiled’) o que ‘circula’ en la población en conexión con el ambiente: ‘ In this state of things, during winter, paraplegia set in, and attacked many, and some died speedily; and otherwise the disease prevailed much in an epidemical (ed. ‘epidemios’ en griego) form ’ (Hippocrates, 400 a.C). La diferenciación de un proceso epidémico esporádico, i.e., enfermedades que visitan a la población ( epidemeion = epidemia ), de uno establecido, enfermedades que residen ( endemion = endemia ), implica que Hipócrates mantenía contante vigilancia de la salud en la población. Por esta visión comunitaria de la salud, algunos consideran a Hipócrates como el padre de la epidemiología; otros lo identifican como el primer epidemiólogo. Sin duda, fue el fundador de la medicina bajo la presunción de una causalidad física y racional, una práctica ética ‘Juramento de Hipócrates’ y su visión humanística, hoy tan cuestionada por el énfasis mercantil de la salud: ‘wherever the art of Medicine is loved, there is also a love of Humanity’ (Hipócrates 460-370 a.C.).
El concepto original epidemios ha evolucionado en términos semióticos por más de 2500 años configurando términos conceptuales complementarios acordes con el desarrollo científico de la epidemiología. A partir del adjetivo epidemios se generó el sustantivo ‘ epidemia ’ y en la segunda mitad del siglo XIX emergieron los términos epidemiología, epidemiológica(o) y epidemióloga(o) a partir del francés épidémiologie (1855), épidémiologique (1878), épidémiologiste (1896) (Martin y Martin-Granel, 2006).
Pandemios, Pandemick y dimensionalidad. El término pandemios también tuvo su origen en la Grecia antigua, fuera de la connotación médica, para referirse a ‘lo público’ ‘lo que concierne a todas la gente’ (https://bit.ly/3moj9Nj). Sin embargo, fue hasta el hasta el siglo XVII que se asoció el término ‘pandemick’ con una enfermedad ‘vernácula´ en humanos (Morens et al., 2021). El contexto sugiere la ocurrencia regional de una enfermedad. La dimensionalidad del proceso epidémico como característica pandémica en realidad fue posible hasta que el desarrollo urbano, movilidad comercial y turística alcanzaron un nivel de interacción poblacional favorable al contagio. Este contexto se tuvo a partir del auge de la Revolución Industrial y la Peste Negra, Gripe Española y siete brotes epidémicos recurrentes de Cólera (1817 a 1961). Ante la laxitud en la aplicación del concepto (Morens et al., 2021; Piret y Boivin, 2019), los reportes pandémicos son variables. Por ejemplo, el brote de Cólera de 1831-1832, es reconocida como la primera pandemia pero su dispersión geográfica incluyó Europa y Asia (Morens et al., 2021). Otros autores, con un criterio más global, consideran a la Gripe Española. Esta enfermedad impactó en un año (1918-1919) en la mayoría de los continentes en concordancia con la mayor movilidad humana y el movimiento de tropas de la Primera Guerra Mundial. Con el criterio geográfico y de efecto poblacionalmente masivo se han reportado 19 pandemias de enfermedades en la historia (Figura 1) (Piret y Boivin, 2019).
La caracterización pandémica en enfermedades en plantas también ha tenido una connotación imprecisa, pero coincide en la implicación global de la dispersión (Figura 1). Sin embargo, no existe ninguna pandemia vegetal de carácter mundial asociado a un proceso sincrónico infectivo (Figura 1). Comparativamente, las epidemias en plantas exhiben lenta dispersión geográfica a partir del brote o foco inicial, pudiendo incluso restringirse a una región debido a la topología poblacional del huésped: 1. Discontinuidad poblacional en tiempo determinado por anualidad de cultivos, o por estacionalidad de eventos fenotípicos, interrumpiendo abruptamente procesos de infección-contagio; 2. Discontinuidad poblacional espacial debido a la especificidad de condiciones edafo-climáticas requeridas para un cultivo, diversidad de especies cultivadas, y/o heterogeneidad genética varietal en una región; 3. La población es intrínsecamente fija o inmóvil y dependen del ambiente o de factores antropogénicos para la movilidad del inóculo. 4. Existen restricciones normativas y comerciales que evitan el libre movimiento trasfronterizo de plantas, productos y/o subproductos requiriéndose un certificado o ‘pasaporte fitosanitario’ reconocido por la Organización Mundial de Comercio (WTO siglas en inglés) y tratados comerciales regionales. Este es análogo al pasaporte de salud o vacunación COVID-19, ya requerido por algunos países, pero no aceptado por la OMS al considerarlo discriminatorio. En efecto, este sistema, aunque efectivo para restringir la movilidad de patógenos (y plagas), en ciertos casos se ha empleado con fines proteccionistas en la agricultura (Sputnik et al., 2021).
Pandemia, precisión conceptual. La concepción de pandemia, previamente expuesta, se puede precisar como un ‘proceso epidémico de ocurrencia sincrónica en el tiempo de vida del huésped y en un espacio intercontinental o continental respecto a relaciones funcionales de contagio, a partir de una fuente primaria del agente infeccioso, resultando en múltiples procesos subepidémicos cuyas estructuras están determinadas por el Sistema Epidemiológico específico al clúster comunitario regional’. Esta definición se ha restringido a patógenos pero puede extenderse a otros agentes bióticos (Mora-Aguilera et al., 2021a). En plantas, es más probable un proceso de contagio sincrónico a nivel continental. Por ejemplo, CLas-Citrus spp. ha progresado en América gradualmente de 2009 al presente a partir de su detección en Brasil (Figura 1). Así la sincronía opera en un periodo de tiempo de n-ciclos productivos. En humanos, como se ha demostrado con SARS-CoV-2, este proceso ha sido multicontinental, pero también puede involucrar uno o más continentes como ocurrió con varias epidemias históricas, p.e., Cólera o Peste Negra, y recientemente con la Influenza A H1N1 (WHO, 2021f).
La OMS, como ‘autoridad directiva y coordinadora de la acción sanitaria mundial’ de la ONU, es la facultada para determinar una condición pandémica a partir de un brote de enfermedad, ‘disease outbreak’, o emergencia de sanitaria, ‘health emergency’. Sin embargo, sus directrices han sido ambiguas o circunscritas a casos específicos (Morens et al., 2021). Así, la OMS define ‘Pandemic: increased and sustained transmission in general population’, en el contexto de una estrategia polietápica para direccionar acciones de Sistemas Públicos de Salud respecto a la Influenza (WHO, 2005). En otra definición, el mismo organismo establece, pandemia es ‘The worldwide spread of a new disease’. En contraste, la Asociación Internacional de Epidemiología la enuncia como ‘An epidemic occurring worldwide, or over a very wide area, crossing international boundaries and usually affecting a large number of people’ (IEA, 2021; Porta, 2014).
La definición de pandemia debe diferenciar el estricto criterio epidemiológico de uno inherente a justificar el desarrollo y gestión de políticas en salud pública global como corresponde a la OMS. Así, epidemiológicamente, no es válida la acepción de la OMS respecto a que ‘a pandemic agent must be infectious, must be new, must spread easily, and must cause serious illness’ (Morens et al., 2021). Para fines cuantitativos de un Sistema de Vigilancia Epidemiológica de un país, la escalabilidad potencial de una epidemia constituye uno de n-factores de riesgo y la declaración oficial de un brote, emergencia o pandemia no debe impactar en la estructura y concepción de un modelo de riesgo (Mora-Aguilera et al., 2021a; 2021b).
La cadena de infección: Gäumann y Smith. Los antecedentes de la epidemiología vegetal, orientada al enfoque infeccioso clásico de fitopatológico, se pueden encontrar con E. Gäumann (1946) en su libro ‘Pflanzliche Infektionslehre: Lehrbuch der allgemeinen Pflanzenpathologie für Biologen, Landwirte, Forster und Pflanzenzuchter’ (Teoría de la infección vegetal: libro de texto sobre patología vegetal general para biólogos, agricultores, silvicultores y fitomejoradores) (Figura 2). En el Capítulo 2, Gäumann integró principios de infección vegetal relacionados con factores ambientales, períodos de incubación, umbrales de infección, mecanismos de colonización, capacidad parasítica, susceptibilidad del hospedero, principios básicos del control (protección) de enfermedades de plantas y exclusión de un patógeno potencial. ‘Every epidemic develops according to its own rules, changes its character, expands and becomes malignant, decreases and becomes milder: it has an appearance of its own, its morphology, its own genius epidemicus’ (Gäumann, 1946). Su genius epidemicus, variable, aplica a un mismo patosistema y es equivalente al ‘memory factor’ de Vanderplank (1963) y al momentum de epidemia usado en este documento para referirnos a una epidemia que entra a una fase de progresión dinámica determinada por una carga de inóculo (plaga) y velocidad de infección tal que supera un umbral de control o mitigación. Una epidemia en fuga.

Figura 8 Comparación de los principales atributos poblacionales (PN) en plantas y humanos que determinan el proceso de contagio (recuadro superior izquierdo). Características poblacionales intrínsecas a un proceso epidémico independiente de la naturaleza humana, animal o vegetal (recuadro derecho). Criterios genéricos adoptados ante la pandemia COVID-19 que adolecen del marco racional sistémico que aporta el Sistema Epidemiológico. La Figura inferior muestra la conceptualización aplicativa secuencial de los principios de prevención y cura para la intervención de la epidemia SARS-CoV-2. Se incluye un putativo umbral de endemicidad viral en función de un sistema inmunológico humano activado en forma natural y/o inducida mediante vacunación.
Gäumann en el mismo libro (1946) planteó que: ‘Infection is considered as a fundamental biological problem of the threefold interaction of the constitution of host plants, the invasive potentiality of parasites, and the conditioning factors of the environment’ . Este aserto dio origen al clásico concepto de triángulo epidemiológico también empleado en la epidemiología médica. Su principal evolución conceptual incluye al manejo antropogénico en la agricultura, y la concepción como un Sistema Epidemiológico abierto con la planta sana como eje integrador (Mora-Aguilera et al., 2021a). Su importancia como marco racional epidemiológico se discute en varios contextos en este documento.
A Gäumann también se le atribuye la introducción de un concepto conocido como cadena de infección de Gäumann (1946). Sin embargo, en medicina se le reconoce a T. Smith mismo concepto (Langmuir, 1961), expuesto previamente en su libro Parasitism and Disease (1934), en el cual lo expuso en el contexto del ciclo de vida de un parásito: ‘ We may divide the life of parasites into four critical stages or periods: 1. Their entrance into or invasion of the host; 2. Their multiplication within the body of the host; 3. Their discharge, emigration or excretion outwards; and 4. Their active or passive transfer or transmission to another host ’. Actualmente este concepto es más empleado en la epidemiologia médica reconociendo cinco o seis eventos diferenciando al agente infeccioso y/o huésped con el fin de intervenir o controlar un brote epidémico con estrategias preventivas o curativas (CDC, 2006).
En epidemiología vegetal, la aplicación de la cadena de infección se ha sustituido por tres eventos biológicos distintivos que involucran tanto a la población como al ambiente: dispersión, patogénesis y sobrevivencia. Estos eventos complementan criterios epidemiológicos para la correcta aplicación secuencial en tiempo, y en la selección de procedimientos preventivos y curativos (protección) para la efectiva intervención epidémica (Figura 8).
La posibilidad de realizar ensayos de infección, sin las restricciones que implican intervenir poblaciones humanas, ha permitido una mayor precisión biológica y mecanística en la comprensión de epidemias en plantas. Sin embargo, a nivel mundial, esto no justifica los limitados estudios epidémicos con metadatos para comprender la dinámica infecciosa de SARS-CoV-2 a nivel comunitario, con un marco racional más robusto que la cadena de infección, para diseñar estrategias de mitigación poblacionales. En realidad, la ausencia de Sistemas de Vigilancia, y la integración y procesamiento automático de grandes volúmenes de datos digitales (big data) en tiempo real, impiden la comprensión sistémica de la emergencia sanitaria actual (Mora Aguilera et al., 2021a; 2021b). Prevalece la visión hospitalaria y el monitoreo de pruebas diarias como indicadores de estatus epidémico denotando el abandono estructural de los Sistemas de Salud y la ausencia de directrices efectivas de la OMS bajo un enfoque preventivo.
Prevención y Cura: Whetzel y Proust. Herbert H. Whetzel introdujo en la fitopatología los términos inoculación, incubación e infección como eventos inherentes a la patogénesis y su aplicación en el control. En ese contexto, propuso en 1926 la erradicación, exclusión, protección, e inmunización como categorías de control, el último en referencia a la resistencia varietal (Newhall, 1980). Estos se reconocen actualmente como principios de control. La exclusión ya se había adoptado como base de sistemas regulatorios cuarentenarios, p.e. en EUA en 1912; y en Croacia, en 1377, se instauró la ‘quarentena’ por 40 días en centros de aislamiento a viajeros y tripulación de barcos como medida de exclusión de la Peste Negra (Tognotti, 2013). A. Proust, el higienista, fue activo promotor de un organismo internacional de salud para la exclusión de Europa de enfermedades ‘importadas’ por vía marítima, como Cólera, Peste Negra y Fiebre Amarilla (Howard-Jones, 1975). La erradicación, en sanidad vegetal, se propuso por primera vez en 1913 al seno del International Institute of Agriculture, antecedente de la FAO/ONU, como posible estrategia pero con dudas de aplicabilidad (Nature, 1913). En salud humana, con un enfoque global y científico, ha sido impulsada por la OMS, siendo la Viruela la única enfermedad de humanos erradicada. Se logró en 1977 mediante extensivas campañas de vacunación (Roser et al., 2014).
Con una visión aplicativa en vigilancia epidemiológica (Mora-Aguilera et al., 2021a), estos principios se han categorizado en preventivo (exclusión y erradicación) y protectivo (cura en medicina), en el cual se incluye la resistencia, y se ha establecido su secuencialidad en función de intensidad epidémica y de umbrales poblaciones del patógeno. En la Figura 8 se propone su conceptualización aplicativa para la epidemia SARS-CoV-2 y un umbral de endemicidad en función de un sistema inmunológico activado en forma natural y/o inducido mediante vacunación.
Epidemia: Su evolución conceptual. La definición de epidemia, en plantas y humanos, y por extensión a animales, en tanto que la población y el contagio son los principios que la definen y determinan, también ha evolucionado en la historia. Se incluye una selección conceptual a partir de la revisión ‘A historical survey of botanical epidemiology’ por Zadoks y Koster (1976), complementada con otras referencias:
‘Epidemia fuiffe in pueris diximus: unum notavimus infolentia fymptomata…( hemos tenido una epidemia entre los niños: una centrada en síntomas del folículo )’. (Ballonii, 1571).
Has anyone until now observed contagious epidemics in plants? HL. Duhamel de Monceau (1728).
‘ Epidemics among man and animals appear suddenly and unexpectedly, spread destruction over whole regions for a while and then slowly disappear and so do plant epidemics ’ JG. Kühn (1858).
‘ The same behaviour in the world of disease among humans leads to epidemics, among animals to epizootics, and among plants to epiphytotics, generally conditions of exacerbation of some disease species… ’. F. Unger (1833).
‘Epidemics (ed. in medicine) resemble each other in the extent of their range… Epidemics…derive their name from attacking large numbers at once’. S. Smith (1866).
‘Epidemics (ed. in medicine) are those peculiar affections which, springing up suddenly in some particular spot, spread over a certain portion of the habitable globe, and then disappear altogether’. J. Parkin (1873).
‘By an epidemic (ed. in plants) we therefore understand the frequent incidence, the local concentration of an infectious disease within a limited period of time’. E.Gäumann (1946).
‘Epidemic is…any increase or decrease within the range 0 < y ≤ 1’. J.Kranz (1974). Note: 1=100% incidence / severity.
‘Epidemic refers to an increase, often sudden, in the number of cases of a disease above what is normally expected in that population in that area’ (CDC, 2006).
‘Epidemia es un proceso de contagio, colonización u ocurrencia de eventos abióticos no infecciosos determinados por un Sistema Epidemiológico específico que resulta en la pérdida de salud de una población definida estructural y funcionalmente en tiempo y espacio’. G. Mora y G. Acevedo (2021).
Población e infección en epidemiología. La población, debe correctamente definirse en estudios epidemiológicos. Desde un enfoque epistemológico se debe establecer su estructura y función biológica respecto a la interacción con el ambiente; y analíticamente, deben definirse las variables y factores que representarán a la población como ‘metadatos’ en una matriz epidemiológica, la cual que incluye otras variables asociadas al Sistema Epidemiológico. La pertinencia de éste, al problema específico de salud, garantizará la adecuada parametrización de la población en análisis descriptivos y cuantitativos (Mora-Aguilera et al., 2021a). Por ejemplo, edad, sexo y etnia constituyeron factores estructurales y la respuesta inmunológica la función poblacional en un estudio comparativo reciente de efectividad de vacunas en Ómicron. Se concluyó que esta variante representa un riesgo 5.4 veces mayor de reinfección en comparación con Delta (Reuters et al., 2021).
La infección , si bien es el principio que define a la epidemiología vegetal por ‘unknown reasons’ (Zadoks y Koster, 1976), en la epidemiología médica se reconocen epidemias de procesos crónicos no infecciosos como diabetes, hipertensión, etc. En la actualidad, se ha impulsado en la fitosanidad la necesidad de un enfoque epidemiológico holístico con énfasis en la salud y en la planta como eje integrador de los procesos sanitarios. Así, algunos Sistemas de Vigilancia Epidemiológica operan la prevención multiplaga, en la amplia acepción, son sustentables y optimizan en forma integral estrategias operativas, científicas y de planeación de política pública (Mora-Aguilera et al., 2021a). La formalización científica de esta disciplina inició en 1874 con la revista alemana enfocada a la epidemiología médica ‘Allgemeine Zeitschrift für Epidemiologie’ (General Journal for Epidemiology). Mientras que en epidemiologia vegetal inició en 1913 con la publicación francesa ‘Annales du service des épiphyties’ (Anuario del servicio de epifítias) (Zadoks y Koster, 1976).
6. La curva y el mapa: Una misma epidémica
La maduración de la epidemiología vegetal como disciplina científica se puede atribuir a Vanderplank a partir de su libro ‘Plant Diseases: Epidemics and Control’ (1963) (Figura 2). En contraste al enfoque espacial para el análisis del Cólera utilizado por J. Snow (1854) en epidemiología humana, Vanderplank aborda la epidemiología desde la dimensión temporal , principalmente para aplicar modelos (p.e., logístico) a curvas del progreso de la enfermedad para determinar una tasa de infección ‘aparente’. Vanderplank concibe la tasa de infección como la velocidad o aumento epidémico de x-intensidad de enfermedad por unidad de t-tiempo (actualmente, y es la intensidad de enfermedad). Su capítulo “How to trace the progress of an epidemic” fue una idea seminal (Figura 7), que hoy también parece simple y lógica como el propio mapa de Cólera de Snow (Figura 3), pero permite entender la abstracción gráfica de una curva para cuantificar los cambios en la intensidad de la enfermedad en n-intervalos de tiempo y, a partir de ahí, establecer estrategias para el control y pronóstico de enfermedades. También por primera vez se subordina la comprensión de ‘disease in populations’ al desarrollo de estrategias de control o mitigación. Vanderplank desarrolló la epidemiología cuantitativa con el fin evaluar la resistencia de su germoplasma de papa (S. tuberosum) a Phytophothra infestans mediante la comparación de tasas epidémicas (Vanderplank, 1963). El enfoque aplicado al manejo de enfermedades también fue compartido JC. Zadoks y J. Kranz, epidemiólogos fundacionales de esta disciplina con sus aportes holísticos y multivariados, abandonando la tasa epidémica de la curva como el único parámetro de interpretación mecanística de una epidemia. Un enfoque hoy poco comprendido y adoptado en el análisis sistémico de epidemias en todos los campos. SARS-CoV-2 en la salud humana no es la excepción. La intervención de la cadena de infección o contagio es el símil más próximo al enfoque de entender la estructura y mecánica de una epidemia temporal para la efectiva aplicación del principio preventivo y curativo (Figura 8).
No podemos omitir que la ‘curva epidémica’ ha sido el objetivo central principalmente durante las primeras dos ‘olas’ epidémicas de SARS-CoV-2. Epidemiólogos formales, físicos, matemáticos, politólogos, etc., disertaron (y aún lo hacen) sobre el modelaje de curvas para pronóstico de ‘casos’ y de ‘aplanamiento de la curva’. El problema no era (y sigue sin serlo) la curva, sino la ausencia de un análisis de curvas en el contexto de poblaciones funcionales, es decir, de la epidemiología aplicada al contexto de clústeres comunitarios donde se establecen relaciones funcionales de contagio. En consecuencia, el espacio debe integrarse al modelaje. Espacio y tiempo definen integralmente una epidemia. Su individualización obnubila el mecanismo del contagio. Más aun, la curva es un proceso tardío bajo el principio de prevención. Es el foco(s), el parámetro Yo, sensu J. Kranz, el que debe enfatizarse (Figura 8). El foco-espacio en un mapa que J. Snow entendió perfectamente en 1854 para mitigar el brote de Cólera en Londres.
La curva descriptiva y el pronóstico de ‘casos’ no son la solución mecanística para la pandemia SARS-CoV-2. La comunidad humana en su compleja interrelación ambiental, social, laboral, y de salud mental y física, asociado a la estructura poblacional de SARS-CoV-2, i.e., una visión holística y multivariada, en la correcta contextualización espacio-tiempo, es la estrategia correcta basada en las experiencias históricas epidémicas (Figura 8). Se comprenden entonces las limitaciones y errores de modelos SIR, SIER y otros que de forma restrictiva predecían fechas de ‘incrementos’ y ‘aplanamiento de la curva’. Esta ‘fiebre’ matemática del 2020, actualmente ha decrecido. La pandemia y sus múltiples ‘olas’, aun con vacunación masiva y restricciones sociales, ha sorprendido con su ‘momentum’, ‘genius epidemicus’ o ‘memory factor’ que elude soluciones simplistas y que van más allá de una curva. A la fecha, no se conoce un modelo que haya sido eficaz con margen de error aceptable. No solo en referencia al error estadístico, sino también conceptual e intrínseco al marco racional que emana del Sistema Epidemiológico. Vanderplank colocó en el escenario de la epidemiología vegetal la posibilidad del análisis temporal a través del concepto de ‘tasa-r’ (Figura 7). Nunca logró o intentó ‘aplanar curvas’. Siempre fueron ‘curvas’ con diferente ‘tasa de infección aparente’, según la genética de una variedad de papa, porque son inherentes a n-procesos de patogénesis, igual que un proceso infeccioso en humanos, que se imbrican con el tiempo, y cuya expresión sintomatológica (i.e., clínica) solo estima, de ahí el término ‘aparente’, la tasa real de infección. La subpoblación asintomática no está representada en la ‘curva’.
Epidemiología: Su evolución conceptual. Al igual que la visión reduccionista del paradigma fitopatológico (y médico) enfocado a la etiología y a partir de ahí buscar la cura, en la epidemiología ha sido la curva, la tasa de la curva, el modelo en pos de la tasa. Una disociación de la estructura y función de poblaciones, tanto en la salud vegetal como en la humana y animal. Pero además omitiendo que el objetivo de la epidemiología NO es el ‘estudio de la enfermedad en poblaciones’ (Vanderplank, 1963), sino el estudio de la población sana como eje integrador del Sistema Epidemiológico que permita articular la prevención y protección como principios de manejo de riesgo y mitigación de epidemias y pandemias (Figura 8) (Mora-Aguilera et al., 2021b). En este contexto, se postula que la epidemiología es el estudio multifactorial, multidimensional y dinámico de relaciones intrínsecas al Sistema Epidemiológico para dilucidar estrategias racionales de prevención de epidemias y mitigación de riesgos sanitarios. El Sistema Epidemiológico emerge como el nuevo objeto de estudio. Este concepto evolucionó del triángulo epidemiológico o triada epidemiológica clásica asociado a un proceso infeccioso en humanos, animales y plantas. La organización como sistema abierto, con n-factores etiológicos y n-determinantes de la salud, entre otros atributos, superan la restrictividad de la triada (Mora-Aguilera et al., 2021a). Esta acepción de epidemiología considera factores bióticos y abióticos como causalidad determinística o probabilística. En consecuencia se incluyen procesos no infecciosos en plantas, como insectos-plaga, o desbalances cardiovasculares y metabólicos en humanos.
Bajo el enfoque holístico e integral de la epidemiología se garantiza el marco racional para la epidemiología teórica y la epidemiología aplicada a los Sistemas de Salud (humana, animal o vegetal). Permite la integración de modelos clásicos basados en procesos infecciosos, p.e., Gompertz en plantas, o SIR en humanos, con modelos multivariados probabilísticos aptos para estimar riesgos independientemente de la causa infecciosa o no infecciosa. Así mismo, se evita la emergente tendencia disciplinaria, fragmentada, de la epidemiología, i.e., epidemiología molecular, epidemiología nutricional, epidemiología cardiovascular, epidemiología de la diabetes, etc. (Frérot et al., 2018). La epidemiología epistemológicamente es indivisible, holística, sistémica. Es el Sistema Epidemiológico, como marco racional, el que se adapta al problema y obliga a definir los factores y variables pertinentes, así como a establecer la dimensionalidad espacio-temporal operativa, en la investigación del problema, y aplicativa en su solución. Así, el Sistema Epidemiológico determina a la epidemiología como ciencia.
En epidemiología médica, la cadena de infección (‘chain of infection’), no la triada epidemiológica, i.e., patógeno, huésped y ambiente, (CDC, 2006), es la más referida como marco racional para comprender un proceso epidémico y determinar estrategias de interrupción del contagio (‘to break the chain of infection’). Sin embargo, la aplicación global de esta estrategia en COVID-19, ha evidenciado su limitación al aislar el contagio de determinantes sociales, ambientales y demográficos. Aspectos que subsana el Sistema Epidemiológico y que es congruente con un estudio de M. Parascandola sobre la concepción contemporánea de la epidemiología médica y la necesidad de nuevos marcos analíticos y metodológicos (Parascandola, 2011). Más recientemente, M. Frérot y colaboradores revisaron la evolución conceptual de epidemiología de 1978 a 2017, identificando a la población, salud y enfermedad como los términos más comunes, mientras que enfermedad infecciosa y fenómeno masivo estuvieron ausentes como elementos estructurales en las 102 definiciones (Frérot et al., 2018). Estos análisis exhaustivos muestran que la epidemiología transita hacia reconocer la preponderancia de población y salud en una estrategia integral preventiva y curativa. Sin embargo, tomará tiempo reconocer la enfermedad como efecto, no como un fin epidemiológico. Con fines comparativos se incluyen definiciones seleccionadas de los trabajos referidos y otras complementarias:
‘Epidemiology is the science of disease in populations’. Vanderplank (1963).
‘Epidemiology is a method of reasoning about disease that deals with biological inferences derived from observations of disease phenomena in population groups’. D. Lilienfeld (1978).
‘Epidemiology is the quantitative analysis of the circumstances under which disease processes, including trauma, occur in population groups, the factors affecting their incidence, distribution, and host responses, and the use of this knowledge in prevention and control’. A.S. Evans (1979).
‘Epidemiology is the study of the distribution and determinants of health related states or events (including disease), and the application of this study to the control of diseases and other health problems’. OMS
‘Epidemiology is the science of populations of pathogens in populations of hosts, and the disease resulting therefrom under the influence of environment and human interference’ J. Kranz (1973).
‘Epidemiología es el estudio multifactorial, multidimensional y dinámico de relaciones intrínsecas al Sistema Epidemiológico para dilucidar estrategias racionales de prevención de epidemias y mitigación de riesgos sanitarios’. G. Mora y G. Acevedo (2021).
7. COVID-19: Una visión de la pandemia
La actual pandemia SARS-CoV-2/COVID-19, con dispersión activa en más de 194 países (https://coronavirus.jhu.edu/map.html; https://www.gisaid.org/), ha evidenciado fuertes limitaciones en la implementación de principios epidemiológicos aplicables a la vigilancia sanitaria para la prevención y manejo de riesgos. No se ha racionalizado de manera sistemática las experiencias conceptuales, metodológicas y científicas derivadas de epidemias históricas y se exhibe un retroceso fundamental con la transición de la prevención, exitosa en los 50-70’s, a la cura actual, abandonado el principio filosófico y científico fundacional de los Sistemas Públicos de Salud con énfasis comunitario. La cura emerge como el paradigma que sustenta el actual modelo paciente-enfermedad que articula sistémicamente, no solo la visión de los Sistemas Públicos de Salud, sino todo el sistema hospitalario y práctica médica privada, estructura y oferta educativa, desarrollo científico, tecnología e innovación de grandes consorcios, y la política pública gubernamental y organizacional. La preeminencia etiológica y del diagnóstico, exacerbado con expectativas de la medicina genómica, en el tratamiento paciente-enfermedad. La coaptación de la salud como estrategia de negocio y la omisión del estado para preservarla como un derecho universal. Paradójicamente, se demanda al Estado enfrentar la crisis sanitaria con un modelo de salud inoperante y desarticulado sin que el aparato privado, y la OMS como líder mundial en la gestión de salud, asuman el costo de la adopción del nuevo paradigma. A su vez el Estado, descarga en la población fallas en la contención de COVID-19, reclamando baja cooperación en la adopción de medidas paliativas, que no efectivas, para la intervención epidémica. Es la población humana, en su pervivencia, y en el vasto tejido de relaciones sociales, económicas, espirituales, educativas y culturales la que conlleva el mayor costo; empero no enteramente cuantificable en una economía global de consumo que solo adjudica un valor a las mercancías. El deterioro sistemático de los Sistemas de Salud y sus efectos discriminatorios ha sido ampliamente documentado (CEPAL y OPS, 2021; Velázquez, 2021; Frenk, 2003). La consecuencia lo ilustra con los ciclos epidémicos sucesivos COVID-19, independientemente del porcentaje poblacional inmunizada, y los cambios de prevalencia con nuevas variantes virales, Ómicron la más reciente, reportada por primera vez en el continente africano con 5% de vacunación. Mientras se escribe, los Países Bajos y varios europeos reasumían por enésima vez el confinamiento severo, ante masivo contagio por Ómicron configurando la quinta ola epidémica. En este contexto, la salud como negocio es ignominiosa (Vivas, 2021). Especular en la bolsa de valores con soluciones para Ómicron debería penalizarse tanto como se criminaliza a la sociedad su aparente negligencia preventiva a COVID-19 (Europa Press, 2021).
El análisis histórico de epidemias, y de la gestión pandémica/epidémica de COVID-19, permite identificar limitaciones conceptuales y metodológicas que restringen la comprensión mecanística y los alcances de estrategias de intervención epidémica (Figura 8):
Fuente: Mora-Aguilera et al., 2021a.
Figura 9 Modelo de integración de tecnología digital aplicable a la generación y gestión web de datos de un Sistema de Vigilancia Epidemiológico.
1. La población(P N ) define un proceso epidémico en tanto que enmarca el proceso de contagio. En COVID-19 se ha omitido que la población posee una estructura y función multidimensional y que está acotada en tiempo y espacio. Los sistemas públicos web de ‘vigilancia’ o trazabilidad COVID-19 articulan sus indicadores en una población territorial que no representa el fenómeno de contagio efectivo. Así, la curva o mapa del estatus epidémico de México es solo una representación numérica de casos COVID-19 en el tiempo o espacio pero no permite su intervención ya que las tasas de contagio no son estructural y funcionalmente reales. La población territorial (sexo, edad, etnia, comorbilidad, ocupación, etc.) es valiosa en modelos dinámicos de riesgo multivariados espacio-temporales. No aplica para modelos epidemiológicos clásicos. La limitación es que los países, y la OMS como ente líder, carecen de Sistemas de Vigilancia digitales concebidos para articular algoritmos automatizados en tiempo real para toma de decisiones preventivas y gestión de riesgos regionales comunitarios (Figura 9) (Mora-Aguilera et al., 2021a; Mora-Aguilera et al., 2021b).
2. El contagio opera a nivel P N estableciendo relaciones de dependencia continua o discontinua medibles en espacio-tiempo. El contagio, cuantificado en sus determinantes biológico, clínico y epidemiológico, aporta el atributo mecanístico de una epidemia. COVID-19 ha mostrado que la infección primaria (I p-t1,e1 ) es múltiple, cuasi-sincrónica y aleatoria en tiempo (t) y espacio (e) trasfronterizo. Es la infección secundaria (I S-t1+n, e1+n ) la que puede ser operativamente cuantificable y detectable en una subpoblación-i (SP N-i ). Es por tanto el contagio comunitario-j (Cluster j) de la SP N-i , a su vez estructurado en n-subclústeres j de relaciones funcionales (laborales, familiares, sociales, etc.), donde debe operar la detección temprana para la intervención de un foco o brote COVID-19 comunitario, p.e. confinamiento (Mora-Aguilera et al., 2021b). Es la intervención espacial de la epidemia. No la intervención de la curva. Las epidemias COVID-19, representadas como curvas acumulativas de casos clínicos por país (Dong et al., 2020), violan las concepciones de población y contagio. En consecuencia, los modelos SIR (subpoblación Susceptible, Infectada o Recuperada), Logístico, Gompertz y otros (Moein et al., 2021, Mwaliliet al., 2020; Holmdahl and Buckee, 2020; Alanaziet al., 2020; Cooperet al., 2020) han fallado en su capacidad predictiva, y el ‘aplanamiento de la curva’ con fines de mitigación, carecen de sustento biológico y operativo. Las curvas de escala de país/estado son descriptivas pero no inferenciales. La población-contagio, el gran paradigma de las epidémicas infecciosas ha sido pobremente entendido y aplicado en COVID-19.
3. El Sistema Epidemiológico (SE). La epidemiología médica restringe su marco racional a la ‘triada epidémica’ y con más frecuencia a la cadena de infección. Ambos son restrictivos. Los define un proceso determinístico infeccioso y se acota a 3 ó 6 eventos. Un Sistema Epidemiológico, abierto a n-subsistemas, con la población saludable (¡no la enferma!) como eje central e integrador de n-factores causales y n-determinantes de salud, en conjunción con el ambiente (Mora-Aguilera et al., 2021a); constituye una alternativa para establecer el marco racional para la comprensión, e intervención holístico-sistémica del riesgo de ocurrencia una epidemia (prevención) y la mitigación de sus efectos (prevención y cura).
4. La comunidad se define por n-individuos pertenecientes a una subpoblación -i territorial (SP N-i ) que exhiben relaciones funcionales en tiempo-espacio. Se organizan en n-clústeres j y n-subclústeres j definidos por dependencias espaciales determinadas por roles articulados estructural y funcionalmente, pero también por valores comunitarios de corresponsabilidad y convivencia. Los n-individuos del n-subclústeres j operan como sujetos de salud y como sujetos de riesgo de enfermedad, por lo que deben ser actores activos en un modelo preventivo y de mitigación de riesgos. Los individuos de esta subpoblación, integrada a un Sistema de Vigilancia digital, puede comunicar su estado de salud en tiempo real impelido por sus valores y porque así conviene a su comunidad de pertenencia. No por una imposición externa (Mora-Aguilera et al., 2021b). La gestión epidémica actual considera a la población como una unidad continua e inconexa de múltiples realidades de riesgos concretos y cuantificables. Una caja Negra de efectos confundidos. Confiere a la población un rol pasivo en las decisiones y lo responsabiliza de fallas en adopción de estrategias decididas fuera de su entorno, pero que no resuelven de raíz el deterioro de los Sistemas de Salud Pública, actualmente desarticulados y obsoletos privilegiando de facto la salud como negocio y la cura como paradigma.
8. Vigilancia epidemiológica humana, animal y vegetal. Una misma salud
En un trabajo previo se expuso la necesidad de Sistemas de Vigilancia Epidemiológica (SVE), holístico-sistémicos, para la aplicación de modelos preventivos con el fin de intervenir riesgos epidémicos regionales en cultivos agrícolas (Mora-Aguilera et al., 2021a). El empleo de tecnología web y aplicaciones móviles permite la integración de datos en matrices estructuradas con criterios racionales fundamentados en un Sistema Epidemiológico ad hoc al problema fitosanitario (Figura 9). La generación de algoritmos automatizados relacionales y funcionales, i.e., alertas tempranas permiten el análisis y toma de decisiones para la prevención y manejo, i.e., mitigación de una epidemia. El dato se genera en campo por múltiples usuarios certificados para garantizar la trazabilidad y calidad de la información epidemiológica. Estos SVE tipo 3, difieren de los sistemas presencia-ausencia de un patógeno (plaga) (tipo 1), o de sistemas cuantitativos de prevalencia espacial-temporal (tipo 2), los cuales tienen un fuerte soporte normativo. Los tipos 1 y 2 son los que se emplean comúnmente en los Sistemas Públicos de Salud integrando información de centros primarios y secundarios de atención de salud. Incluyen el modelo centinela propuesto por la OMS y adoptado por México para Influenza A H1N1, y posteriormente adaptado para SARS-CoV-2. Los SVE tipo 3 se han desarrollado en México, con distinto nivel de aplicación y consolidación, en cafeto (Coffea spp.), agave azul (Agave tequilana) y cítricos (Citrus spp.) por la DGSV (SENASICA) responsable de la sanidad vegetal nacional (Moral-Aguilera et al., 2021a; Mendoza-Ramos et al., 2021; López-Bautista et al., 2020; Coria-Contreras et al., 2019; Flores-Sánchez et al., 2017).
Los principios epidemiológicos de SVE tipo 3 fueron aplicados en el desarrollo de un prototipo digital tiempo-real aplicado a la prevención de riesgos de contagio comunitario de SARS-CoV-2. La premisa fundamental es que la interrupción de cadenas de contagio es más efectiva a nivel de clúster-subclúster comunitarios debido a la dependencia espacial de riesgos identificados, evaluados y automáticamente comunicados al inmediato entorno social. La integración horizontal de los actores comunitarios en un sistema digital aplicado a la detección de infección temprana, confinamiento, trazabilidad clínica y reinserción segura del individuo a su clúster-subclúster familiar-social-laboral garantizaría la corresponsabilidad en decisiones esenciales de salud pública bajo el principio de prevención participativa. Se abandona la noción de la población como ‘rebaño’ o ente pasivo en la solución de un problema de salud pública (Mora-Aguilera et al., 2021b).
Este prototipo, denominado SMAT COLPOS fue aplicado en un entorno laborar académico-investigación del Colegio de Postgraduados en Ciencias Agrícolas (CP) de septiembre a diciembre 2020, durante una fase crítica de incidencia de casos positivos a SARS-CoV-2 y restricción máxima social-laboral en el Edo. de México y CDMX tipificada por la Secretaria de Salud con ‘semáforo rojo’. El sistema validó con éxito la premisa fundamental y el modelo operativo de gestión de riegos. La segunda etapa del desarrollo del prototipo actualmente está en función del interés de la Secretaria de Salud. La fase de gestión no ha sido fácil, comprensible ante la ausencia de políticas con visiones de salud transversales.
Una ‘sola salud’, una meta para una nueva ‘arquitectura sanitaria’ que la OMS ha reconocido como una necesidad internacional estructuralmente articulada a los países ante la pandemia COVID-19 y futuras epidemias, es fácil en la concepción política que en su operativización (https://www.who.int/es/news-room/commentaries). El riesgo de convertir política en burocracia puede ser tan peligroso para la salud pública como la epidemia misma. Una ‘sola salud’ para la OMS aplica a la humana y animal, pero el modelo es incompleto si no se suma la vegetal por su implicación en la calidad e inocuidad de alimentos, directamente asociada a determinantes de salud humana y animal y por su condición esencial en la seguridad alimentaria vinculada con desnutrición y hambrunas que constituyen factores de riesgo de enfermedades en humanos.
9. Perspectivas
El coronavirus SARS-CoV-2, causante de COVID-19, de naturaleza zoonótica, y con el ser humano como único vehículo de transmisión, ha superado todos los agentes pandémicos históricos en su velocidad parasítica adaptativa al huésped; dispersión geográfica efectiva del inóculo primario; complejidad del proceso infectivo, tropismo tisular, patogénico y clínico; y estructura poblacional con linajes altamente dinámicos debido a su capacidad mutagénica (Lee et al., 2021; Hamed et al., 2021; Saito et al., 2021; O’Toole et al., 2021). Tasas de reproducción mundial de R t > 1 son congruentes con variantes más transmisibles, como Delta y Ómicron, como atributo de sobrevivencia subletal. Por ejemplo, México, ha mantenido R t máximas de 1.15, 1.26 y 1.01 en sus tres ciclos epidémicos. Sin embargo, este virus no ha exhibido la mortalidad y letalidad de otros patógenos a pesar de la multiplicidad de factores de riesgo inherentes a las poblaciones humanas actuales. Entre estos se incluyen enfermedades crónicas no infecciosas y ambientes laborales, sociales y urbanos proclives al contagio debido a la alta movilidad y proximidad social (OMS, 2021a; Davis et al., 2021; Álvarez-Maya et al., 2021). Más aun, la letalidad ha disminuido de 11.1 - 15.2%, rango de picos máximos en los epicentros del primer ciclo pandémico 2020, a 2.5% promedio mundial actual (Ritchie et al., 2020; https://ourworldindata.org/mortality-risk-covid#citation). En contraste, otros procesos epidémicos/pandémicos recientes han tenido niveles más altos, en valores absolutos, como los asociados al Ebola 40%, MERS 34%, Influenza A H1N1 10%, y SARS-2002 10%. No existen estimaciones históricas de letalidad debido al sistema hospitalario incipiente, con limitada trazabilidad clínica y acotadas metodologías epidemiológicas; pero se puede inferir, a partir de mortalidades estimadas, que la letalidad también fue mayor en la Peste Negra, Gripe Española y Viruela con 60%, 50% y 30% de mortalidad de la población europea, respectivamente. La influenza estacional, predominantemente causada por el virus Influenza A H1N1 (https://www.paho.org/es/temas/influenza-otros-virus-respiratorios), disminuyó su letalidad del 2009 (10% máximo) a 0.1-0.2% anual en su condición endémica (Ritchie et al., 2020; Roser et al., 2014; Wong et al., 2013). La transición endémica de SARS-CoV-2 también es altamente probable considerando las características epidémicas y patogénicas, con decrecimiento de su letalidad como evolución natural adaptativa al huésped. No debido exclusivamente al proceso de vacunación como se ha implicado. La limitada agresividad patogénica de Ómicron, la más reciente variante, pero con mayor transmisibilidad en África, con menos del 6% de población vacunada, evidencia la tendencia biológica esperada de un parásito obligado como se ha discutido en este trabajo (https://elpais.com/sociedad/2021-12-18/los-primeros-estudios-en-sudafrica-apuntan-que-omicron-se-contagia-mas-rapido-pero-con-sintomas-mas-leves.html).
No obstante, es impostergable el diseño de estrategias innovadoras preventivas a nivel ambulatorio comunitario, articuladas a Sistemas de Vigilancia Epidemiológica, por las siguientes razones:
La evolución clínica de la enfermedad es impredecible
El diagnóstico clínico es restrictivo y puede depender de la variante viral
Similitud de algunos síntomas con otras enfermedades respiratorias
Requerimiento de pruebas de diagnóstico especializadas
Ausencia de una vacuna con efectividad absoluta y permanente
Antivirales curativos limitados (Molnupiravir y Paxlovid)
Politización mundial y nacional por gestión de la emergencia de salud
Infraestructura y recursos humanos limitados en Sistemas Públicos de Salud
La cura es el paradigma del modelo paciente-enfermedad. Costoso y paliativo.
Las expectativas de ‘nueva normalidad’ previstas para mediados de 2020, como resultado de severas restricciones de movilidad y distanciamiento social, pronto fueron superadas por sucesivos ciclos epidémicos (olas epidémicas). Actualmente, algunos países ya exhiben el quinto ciclo epidémico retornado al confinamiento y medidas adicionales previamente empleadas. En Alemania, Gran Bretaña, EUA, India y Brasil, los efectos de ciclos posteriores fueron incluso mayores colapsando prácticamente sus Sistemas de Salud (Ap et al., 2021b; Donget al., 2020). Sorprendentemente, la tercera ola pandémica, que comenzó el primer trimestre de 2021 demostró que la vacunación no es la solución absoluta. Datos públicos actuales han evidenciado que la infección SARS-CoV-2 puede ocurrir independientemente de la inmunización aunque con menor riesgo de mortalidad. También es claro que Delta y Ómicron, la variante más reciente, han reducido la capacidad inmunológica de vacunas (Townsendet al., 2021; WHO, 2021c). En países, principalmente del boque G7, donde 80% o más de la población esta vacunada con dosis completa, se comprobó que la ‘inmunidad rebaño’, originalmente establecida con un umbral teórico de 60-70% (Aschwanden, 2021), no está operando. Lo explica la inmunidad temporal conferida por las vacunas, variaciones activas del virus, y vacunación asimétrica a nivel mundial. En este contexto, México finalizó la tercera ola epidémica con 46% de la población con dosis completa (SSA, 2021), y aparentemente enfrenta el cuarto ciclo epidémico con 52% inmunizados. (Datosmacro, 2021b).
En este contexto pandémico, cíclico y con fuertes implicaciones sociales, educativas, culturales, espirituales y económicas se han propuesto al menos cinco explicaciones por las cuales no se logra una solución a la crisis de salud causada por COVID-19 (ONU, 2021; Afp, 2021e; Navarrete, 2021; Afp, 2021d; Europa Press, 2021; Li et al., 2021; Afp et al., 2021a):
La sorprendente investigación mundial, desarrollada principalmente a nivel clínico, inmunológico, histológico y genómico, esta coaptada por intereses de grandes consorcios farmacéuticos en colusión con sus gobiernos.
La inequitativa distribución de vacunas con 80-90% de la población mundial, representada en 56 países, sin acceso a ningún biológico. Por ello, no se genera la ‘inmunidad rebaño’ y continúa la aparición de variantes virales.
La negativa de consorcios farmacéuticos de liberar patentes de inmunológicos. Imposibilita la inclusión de países pobres al acceso de la cura.
Políticas proteccionistas limitan la autorización, por la OMS y otras agencias, de vacunas de China y Rusia. Algunos países/sectores de la población rechazan aplicarse esas vacunas, p.e., Sinovac y Sputnik V.
La sociedad rechaza o adopta parcialmente las medidas de mitigación. Justifica la implementación de medidas coercitivas (multa, cárcel, acceso controlado a lugares públicos, etc.)
Sin embargo, estos argumentos eluden la verdadera omisión en la solución de la emergencia sanitaria. Es evidente que a nivel global, bajo los lineamientos de la OMS, y de las políticas en materia de salud de los países, la gestión pandémica/epidémica de SARS-CoV-2/COVID-19 carece de un modelo pansistémico integral de solución, sustentable y resiliente, basado en la innovación sistémica del proceso de investigación, la innovación de política pública y la innovación del modelo operativo de los Sistemas de Salud.
Este modelo pansistémico integral es inexistente e inviable en el contexto actual por una razón también evidente ante los efectos mundiales de COVID-19: los Sistemas Públicos de Salud han tenido una gradual depauperación proporcional al abandono de la prevención como principio fundacional y de la adopción de la cura como estrategia paciente-enfermedad mercantilizada. En consecuencia, no existen las estructuras de planeación, operación y soporte científico suficientemente robustas para una interlocución internacional-regional armonizada y para la correcta racionalización, implementación e intervención del proceso epidémico. COVID-19 constituye una oportunidad para desburocratizar, transformar e innovar los procesos de salud pública.
Es necesario admitir que la visión reduccionista de la vacunación/antivirales y de medidas higienistas que funcionaron en otros contextos históricos pandémicos/epidémicos no constituyen:
1. Un modelo orgánico sistémico.
2. Una opción en la estructura de consumo hipernodal y multidependiente mundial.
3. La esencia de un paradigma preventivo de salud.
4. Soluciones sustentables para un ambiente con fuerte intervención antropogénica que desencadena efectos microbiológicos mutagénicos y zoonóticos, y factores determinantes de la salud.
5. Un estímulo al desarrollo de Sistemas de Vigilancia Epidemiológica holístico-sistémicos.
Una ‘sola salud’, una meta para una nueva ‘arquitectura sanitaria’ que la OMS ha reconocido como una necesidad internacional ante la pandemia COVID-19 y futuras epidemias (https://www.who.int/es/news-room/commentaries), es posible si se revierte el sistemático deterioro de los Sistemas Públicos de Salud, se retoma la prevención como eje rector, y se reconfigura el modelo paciente-enfermedad dentro de un modelo integral incluyente y humano.
Conclusiones
La pandemia SARS-CoV-2/COVID-19 evidenció que, no obstante los grandes avances científico-tecnológicos, talento humano altamente especializado, y la experiencia histórica de epidemias y pandémicas que permitieron la evolución de un marco teórico conceptual y metodológico operacional, los Sistemas Públicos de Salud y privados carecen de un modelo pansistémico sobre el cual articular modelos regionales racionales y operativos de Vigilancia Epidemiológica preventiva aplicables a toma de decisiones en manejo de riesgos y de intervención epidémica. Las políticas públicas a su vez, mostraron la ausencia de una visión de Estado en materia de salud debido a la paulatina adopción de facto del enfoque curativo e individualizado impulsado por el sector farmacéutico. En consecuencia han prevalecido estrategias de diagnóstico, clínicas y hospitalarias, sobre estrategias ambulatorias comunitarias efectivas. Se omite que la prevención anticipa e interviene el contagio en la comunidad. En el espacio de relaciones funcionales de riesgo comunitario. La población-contagio, el gran paradigma de epidemias infecciosas, ha sido pobremente entendido y aplicado en COVID-19.
La estrategia global, a casi dos años de la emergencia sanitaria muestra las siguientes tendencias: 1. No se ha restablecido la ‘normalidad’ de las actividades humanas; 2. La pandemia mantiene una dinámica cíclica con sucesión de variantes SARS-CoV-2 cada vez más transmisibles; 3. Países con mayor movilidad y polos urbanos densamente poblados han tenido las tasas de contagio y mortalidad más altas independientemente de su desarrollo económico; 4. El distanciamiento social y confinamiento, estrategias periódicamente reincidentes, y la vacunación masiva no han contenido el proceso epidémico; 5. Los Sistemas Públicos de Salud han sido rebasados recurrentemente en centros urbanos de alta incidencia; 6. La agenda de investigación está determinada por consorcios farmacéuticos enfocados a la generación de vacunas y antivirales bajo un enfoque clínico curativo.
Es necesario fortalecer la comprensión biológica, patogénica y epidemiológica de SARS-CoV-2 mediante estudios evolutivos para dilucidar virulencia, agresividad, transmisión, tropismo tisular y expresión de la enfermedad. Adicionalmente, la filogeografía del coronavirus a partir de la fuente(s) animal; el estudio dinámico de regiones genómicas variables que determinan adaptabilidad humana de nuevas variantes; y generación de modelos genómicos predictivos son urgentes ante la activa migración zoonótica de coronavirus en los últimos 20 años, destacándose el PDCoV, HCoV-NL63, MERS-CoV, SARS-CoV 2003, SARS-CoV-2.
Literature cited
Afp y BBC. 2021. Oxford: podría haber vacuna contra ómicron “muy rápido”. DW.COM. (27 noviembre, 2021). https://p.dw.com/p/43ZOQ [ Links ]
Afp y Reuters. 2021. La variante delta redujo a 40% la eficacia de las vacunas, advierte la OMS. La Jornada. (25 noviembre, 2021). https://www.jornada.com.mx/2021/11/25/politica/014n1pol [ Links ]
Afp, Ap y Europa Press. 2021. Pedirá Pfizer autorización para su pastilla contra el Covid antes de fin de mes. La Jornada. (6 de noviembre, 2021a). https://www.jornada.com.mx/2021/11/06/politica/010n1pol [ Links ]
Afp, Ap y Reuters. 2021. Acaparamiento de vacunas, inmoral y estúpido, estalla secretario de la ONU. La Jornada. (09 de octubre, 2021b). https://www.jornada.com.mx/notas/2021/10/09/politica/acaparamiento-de-vacunas-inmoral-y-estupido-estalla-secretario-de-la-onu/ [ Links ]
Afp, Reuters, y Ap. 2021. Inequidad en vacunación, causa de mutaciones: activista. La Jornada. (04 diciembre, 2021e). https://www.jornada.com.mx/notas/2021/12/04/politica/inequidad-en-vacunacion-causa-de-mutaciones-activista/ [ Links ]
Afp. 2021. Lanza OMS nuevo plan contra el Covid; pide fondos por 23 mil mdd. La Jornada. (28 de octubre, 2021c). https://www.jornada.com.mx/notas/2021/10/28/mundo/lanza-oms-nuevo-plan-contra-el-covid-pide-fondos-por-23-mil-mdd/ [ Links ]
Afp. 2021. China y Rusia piden al G20 reconocimiento mutuo de vacunas anti Covid. La Jornada. (30 de octubre, 2021d). https://www.jornada.com.mx/notas/2021/10/30/mundo/xi-y-putin-piden-reconocimiento-mutuo-de-vacunas-en-el-g-20 [ Links ]
Aime MC. 2006. Toward resolving family-level relationships in rust fungi (Uredinales). Mycoscience 47:112-122. https://doi.org/10.1007/s10267-006-0281-0 [ Links ]
Alanazi SA, Kamruzzaman MM, Alruwaili M, Alshammari N, Alqahtani SA and Karime A. 2020. Measuring and preventing COVID-19 using the SIR model and machine learning in smart health care. Journal of Healthcare Engineering 2020: 8857346 https://doi.org/10.1155/2020/8857346 [ Links ]
Alvarado-Alvarado G, Posada-Suárez HE y Cortina-Guerrero HA. 2005. Castillo: Nueva variedad de café con resistencia a la roya. Avances Técnicos Cenicafé 337:1-8. https://www.cenicafe.org›publications›avt0337 [ Links ]
Ap, Dpa y Reuters. 2021. Alemania: emergencia nacional por Covid. La Jornada. (20 de noviembre, 2021b). https://www.jornada.com.mx/2021/11/20/politica/009n1pol [ Links ]
Ap. 2021. Autoriza Reino Unido la primera píldora contra el Covid. La Jornada. (11 de abril de 2021a). https://www.jornada.com.mx/notas/2021/11/04/mundo/autoriza-reino-unido-la-primera-pildora-contra-el-covid/ [ Links ]
Aschwanden C. 2021. Five reasons why COVID herd immunity is probably impossible. Nature 591: 520-522. https://doi.org/10.1038/d41586-021-00728-2 [ Links ]
Avelino J, Cristancho M, Georgiou S, Imbach P, Aguilar L, Bornemann G, Läderach P, Azueto F, Hruska AJ and Morales C. 2015. The coffee rust crises in Colombia and Central America (2008-2013): impacts, plausible causes and proposed solutions. Food Security 7: 303-321. https://doi.org/10.1007/s12571-015-0446-9 [ Links ]
Ayres PG. 2005. Harry Marshall Ward and the Fungal Thread of Death. Ed. American Phytopathological Sciety. 168p. [ Links ]
Ballonii G. 1571. Epidemiorum, Lib 1. p.24, Constitutio Quarta. https://books.google.com.mx/books?id=9fZaAAAAQAAJ&printsec=frontcover&hl=es&source=gbs_ge_summary_r&cad=0#v=onepage&q&f=false. [ Links ]
Berkeley MJ. 1846. Observations, botanical and physiological, on the potato murrain. Journal of the Horticultural Society of London 1: 9-34. Cited by Matta C. 2010. Spontaneous generation and disease causation: Anton de Bary’s experiments with Phytophthora infestans and late blight of potato. Journal of the History of Biology 43(3): 459-91. https://doi.org/10.1007/s10739-009-9220-1. PMID: 20665075. [ Links ]
Berkeley MJ. 1869. Hemileia Berk. and Broome. 1157 pp. https://www.biodiversitylibrary.org/item/103387#page/1069/mode/1up. [ Links ]
BIRMEX. 2021. Los Laboratorios de Biológicos y Reactivos de México, S.A. de C.V. (Birmex). (21 Octubre, 2021). https://www.birmex.gob.mx/nosotros.html [ Links ]
Bots STF and Hoeben RC. 2020. Non-human primate-derived adenoviruses for future use as oncolytic agents? International Journal of Molecular Science 21: 4821 https://doi.org/10.3390/ijms21144821 www.mdpi. [ Links ]
Boyle R. 2014. From ‘coffee rush’ to ‘devastating emily’: A history of ceylon coffee. http://serendib.btoptions.lk/article.php?issue=49&id=1261 [ Links ]
Cáceres GG. 2012. Un momento de reflexión acerca de las vacunas. Sanidad Militar 68(2): 109-114. https://doi.org/10.4321/S1887-85712012000200009 [ Links ]
Callaway E. 2021. Heavily mutated Omicron variant puts scientists on alert. Nature 600: 21. https://doi.org/10.1038/d41586-021-03552-w. [ Links ]
Campbell CL and Madden LV. 1990. Introduction to Plant Disease Epidemiology. John Wiley & Sons. New York. 532p. [ Links ]
Caponi S. 2002. La generación espontánea y la preocupación higienista por la diseminación de los gérmenes. História, Ciências, Saúde 9(3): 591-608. https://doi.org/10.1590/S0104-59702002000300006 [ Links ]
Carbajal B. 2021. Farmacéuticas han ganado 270 mil mdd por la pandemia. La Jornada. (18 de octubre de 2021). https://www.jornada.com.mx/notas/2021/10/18/economia/farmaceuticas-han-ganado-270-mil-mdd-por-la-pandemia/ [ Links ]
Carvajal-Yepes M, Cardwell K, Nelson A, Garrett KA, Giovani B, Saunders DGO, Kamoun S, Legg JP, Verdier V, Lessel J, Neher RA, Day R, Pardey P, Gullino ML, Records AR, Bextine B, Leach JE, Staiger S and Tohme J. 2019. A global surveillance system for crop diseases. Science 364 (6447): 1237-1239. https://doi.org/10.1126/science.aaw1572 [ Links ]
Carvalho CR, Fernandes RC, Carvalho GMA, Barreto RW and Evans HC. 2011. Cryptosexuality and the genetic diversity paradox in coffee rust, Hemileia vastatrix. PLoS ONE 6(11): e26387. https://doi.org/10.1371/journal.pone.0026387. [ Links ]
Centers for Disease Control and Prevention (CDC). 2006. Principles of Epidemiology in Public Health Practice. 511 p. Third Edition. https://www.cdc.gov/csels/dsepd/ss1978/SS1978.pdf [ Links ]
Ceccon E. 2008. La revolución verde tragedia en dos actos. Ciencias 1(91): 21-29. http://redalyc.uaemex.mx/src/inicio/ArtPdfRed.jsp?iCve=64411463004. [ Links ]
Centro de Investigação das Ferrugens do Cafeeiro (CIFC). 2021. https://www.isa.ulisboa.pt/en/cifc/about/history;%20https://varieties.worldcoffeeresearch.org/info/coffee/about-varieties/bourbon-and-typica [ Links ]
Centro Internacional de la Papa (CIP). 2021. Especies de Papas Silvestres. (20 noviembre, 2021). https://cipotato.org/es/potato/wild-potato-species/ [ Links ]
CEPAL y OPS. 2021. COVID-19 Informe CEPAL-OPS. La prolongación de la crisis sanitaria y su impacto en la salud, la economía y el desarrollo social. https://hdl.handle.net/11362/47301 [ Links ]
Cerda R, Avelino J, Gary C, Tixier P, Lechevallier E and Allinne C. 2017. Primary and secondary yield losses caused by pests and diseases: Assessment and modeling in coffee. PLoS ONE 12(1): e0169133. https://doi.org/10.1371/journal.pone.0169133 [ Links ]
Chown SL, Hodgins KA, Griffin PC, Oakeshott JG, Byrne M and Hoffmann AA. 2014. Biological invasions, climate change and genomics. Evolutionary Applications 8:23-46. https://doi.org/10.1111/eva.12234 [ Links ]
Convención Internacional de la Protección Fitosanitaria (CIPF). 2016. NIMF 27 Anexo 15: Virus de la tristeza de los cítricos. www.ippc.int/static/media/files/publication/es/2017/02/DP_15_2016_Es_2017-01-31.pdf [ Links ]
Cooper I, Mondal A and Antonopoulos CG. 2020. A SIR model assumption for the spread of COVID-19 in different communities. Chaos Solitons Fractals 139: 110057. https://doi.org/10.1016/j.chaos.2020.110057 [ Links ]
Coria-Contreras JJ, Acevedo-Sánchez G, Mora-Aguilera G y Martínez-Bolaños M. 2015. Modelos de pronóstico de ocurrencia regional de la roya del cafeto (Hemileia vastatrix) en el Soconusco Chiapas. Revista Mexicana de Fitopatología 33S: 121. https://www.smf.org.mx/rmf/suplemento/docs/Volumen332015/Suplemento332015FULL.pdf [ Links ]
Coria-Contreras JJ, Mora-Aguilera G, Yañez-Morales MJ, Acevedo-Sánchez G, Santana-Peñaloza B, Mendoza-Ramos C, Jiménez-González L, Martínez-Bustamante VI, García-Martínez DC and Rubio-Cortés R. 2019. Applied regional epidemiology to inductive characterization and forecasting of blue agave gray spot (Cercospora agavicola) in Jalisco, Mexico. Mexican Journal of Phytopathology 37(1): 71-94. http://doi.org/10.18781/R.MEX.FIT.1809-4 [ Links ]
Datosmacro. 2021a. China - COVID-19 - Vacunas administradas. (28 Octubre, 2021a). https://datosmacro.expansion.com/otros/coronavirus-vacuna/china [ Links ]
Datosmacro. 2021b. México - COVID-19 - Vacunas administradas. (18 Diciembre, 2021b). https://datosmacro.expansion.com/otros/coronavirus-vacuna/mexico [ Links ]
Davis JT, Chinazzi M, Perra N, Mu K. Pastore A, Ajelli M, Dean NE, Gioannini C, Litvinova M, Merler S, Rossi L, Sun K, Xiong X, Longini IM, Halloran ME, Viboud C and Vespignani A. 2021. Cryptic transmission of SARS-CoV-2 and the first COVID-19 wave. Nature 600: 127-132. https://doi.org/10.1038/s41586-021-04130-w [ Links ]
Davis AP, Chadburn H, Moat J, Robert O’Sullivan R, Hargreaves S and Lughadha EN. 2019. High extinction risk for wild coffee species and implications for coffee sector sustainability. Science Advances 5: eaav3473. https://doi.org/10.1126/sciadv.aav3473 [ Links ]
Davis AP, Tosh J, Ruch N and Fay MF. 2011. Growing coffee: Psilanthus (Rubiaceae) subsumed on the basis of molecular and morphological data; implications for the size, morphology, distribution and evolutionary history of Coffea. Botanical Journal of the Linnean Society 167:357-377. https://doi.org/10.1111/j.1095-8339.2011.01177.x. [ Links ]
Díaz J. 2021. Grupo Bayer - Datos estadísticos. (22 noviembre, 2021). https://es.statista.com/temas/3642/grupo-bayer/#dossierKeyFigures [ Links ]
Dong E, Du H and Gardner L. 2020. An interactive web-based dashboard to track COVID-19 in real-time. Lancet Infectious Diseases 20(5): 533-534. https://doi.org/10.1016/S1473-3099(20)30120-1 [ Links ]
Dyer W. 1874. The Potato Disease. Nature 11: 167. https://doi.org/10.1038/011167a0 [ Links ]
EFE y AFP. 2021. Bolsas de valores se hunden por temor desatado por la variante ómicron. DW.COM. (26 noviembre, 2021). https://p.dw.com/p/43YmA [ Links ]
Empraba. 2021. Cultivares de Café da Embrapa. https://www.embrapa.br/cultivar/cafe [ Links ]
Escobar LE, Ryan SJ, Stewart-Ibarra AM, Finkelstein JL, King CA, Qiao H and Polhemus ME. 2015. A global map of suitability for coastal Vibrio cholerae under current and future climate conditions. Acta Tropical 149: 202-211. https://doi.org/10.1016/j.actatropica.2015.05.028 [ Links ]
Escobar-Gutierrez A, Martinez-Guarneros A, Mora-Aguilera G, Vazquez-Chacon CA, Acevedo-Sanchez G, Sandoval-Díaz M, Villanueva-Arias JC, Ayala-Chavira N, Vargas-Amado ME and Alvarez-Maya I. 2020. The First exploratory spatial distribution analysis of tuberculosis and associated factors in Tonala, Mexico. The Journal of Infection in Developing Countries 14(2): 207-213. https://doi.org/10.3855/jidc.11873 [ Links ]
Escuela de Salud Pública de México (ESPM). 2021. (23 Octubre, 2021). https://www.espm.mx/ [ Links ]
Español M. 2021. Las grandes empresas, las más beneficiadas del rescate económico de la pandemia. esglobal. (16 junio, 2021). https://www.esglobal.org/las-grandes-empresas-las-mas-beneficiadas-del-rescate-economico-de-la-pandemia/ [ Links ]
Europa Press. 2021. Austria fija multas de hasta 7.200 euros para quien se niegue a vacunarse. (29 noviembre, 2021). https://www.europapress.es/internacional/noticia-austria-fija-multas-7200-euros-quien-niegue-vacunarse-20211129221649.html [ Links ]
Fernández-Vega C. 2021. Cuarta ola=especulación a galope. La Jornada. (27 noviembre, 2021). https://www.jornada.com.mx/2021/11/27/opinion/024o1eco [ Links ]
Ferreira T, Shuler J, Guimarães JR and Farah A. 2019. Introduction to Coffee Plant and Genetics. In: Coffee: Production, Quality and Chemistry, pp. 1-25 https://doi.org/10.1039/9781782622437-00001. [ Links ]
Flores-Sánchez JL, Mora-Aguilera G, Loeza-Kukc E, López-Arroyo JI, Gutiérrez-Espinosa MA, Velázquez-Monreal JJ, Domínguez-Monge S, Bassanezi RB, Acevedo-Sánchez G and Robles-García P. 2017. Diffusion model for describing the regional spread of Huanlongbing from first-reported outbreaks and basing an area wide disease management strategy. Plant Disease 101: 1119-112. https://doi.org/10.1094/PDIS-04-16-0418-RE [ Links ]
Frenk, J. 2003. La salud de la población. Hacia una nueva salud pública. 3ed. FCE, SEP, CONACYT. 166p. [ Links ]
Frérot M, Lefebvre A, Aho S, Callier P, Astruc K, and Aho Glélé LS. 2018. What is epidemiology? Changing definitions of epidemiology 1978-2017. PLoS ONE 13(12): e0208442. https://doi.org/10.1371/journal.pone.0208442 [ Links ]
Galindo J and Gallegly ME. 1960. The nature of sexuality in Phytophthora infestans. Phytopathology 50: 123-128. https://www.cabdirect.org/cabdirect/abstract/19601602875 [ Links ]
García-Ruíz H. 2021. Perspectives and Applications of Omics Sciences in Plant Pathology. Mexican Journal of Phytopathology 39(S): 14-16. https://rmf.smf.org.mx/suplemento/suplemento392021/SimposiosS392021.pdf [ Links ]
Gäumann E. 1946. Pflanzliche Infektionslehre: Lehrbuch der allgemeinen Pflanzenpathologie fur Biologen, Landwirte, Forster und Pflanzenzuchter. 611 p. Verlag Birkhauser. Basel, Switzerland. Record Number: 19460602091. https://www.cabdirect.org/abstract/19460602091 [ Links ]
Gonsalves D, Tripathi S, Carr JB and Suzuki JY. 2010. Papaya ringspot virus. The Plant Health Instructor 10: 1094. https://doi.org/10.1094/PHI-I-2010-1004-01 [ Links ]
Marshall H and Ward BA. 2009. Researches on the life-history of Hemileia vastatrix, the fungus of the ‘coffee-leaf disease’. Botanical Journal of the Linnean Society 19: 299-335, https://doi.org/10.1111/j.1095-8339.1882.tb00377.x [ Links ]
Haas BJ, Kamoun S, Zody MC, Jiang RHY et al. 2009. Genome sequence and analysis of the Irish potato famine pathogen Phytophthora infestans. Nature 461: 393-398. https://doi.org/10.1038/nature08358 [ Links ]
Hamed SM, Elkhatib WF, Khairalla AS et al. 2021. Global dynamics of SARS-CoV-2 clades and their relation to COVID-19 epidemiology. Scientic Report 11: 8435. https://doi.org/10.1038/s41598-021-87713-x. [ Links ]
Harper SJ and Cowell SJ. 2016. The past and present status of Citrus tristeza virus in Florida. Journal of Citrus Pathology 3(1): 1-6. https://escholarship.org/uc/item/9q22m433 [ Links ]
Harris JB, LaRocque RC, Qadri F, Ryan ET and Calderwood SB. 2012. Cholera. The Lancet 379: 2466-2476. https://doi.org/10.1016/S0140-6736(12)60436-X [ Links ]
Hernández-Ávila M and Alpuche-Aranda CM. 2020. Mexico: Lessons learned from the 2009 pandemic that help us fight COVID-19. Healthcare management forum 33(4): 158-163. https://doi.org/10.1177/0840470420921542 [ Links ]
Hippocrates. 400 B.C. Of the Epidemics. Book 1 and 2. Translated by Francis Adams. 31p http://classics.mit.edu//Hippocrates/epidemics.html [ Links ]
Holmdahl SM and Buckee DP. 2020. Wrong but useful - What Covid-19 Epidemiologic Models Can and Cannot tell us. New England Journal of Medicine 383(4): 303-305. https://www.nejm.org/doi/pdf/10.1056/NEJMp2016822?articleTools=true [ Links ]
Howard-Jones N. 1975. The scientific background of the International Sanitary Conferences 1851-1938. 108 p. World Health Organization. Geneva. https://apps.who.int/iris/bitstream/handle/10665/62873/14549_eng.pdf [ Links ]
Ibarra-Zapata E, Gaytán-Hernández D, Mora-Aguilera G y González-Castañeda ME. 2019. Escenario de riesgo de introducción de la influenza tipo A en México estimado mediante geointeligencia. Revista Panamericana de Salud Pública 43: 1-9. https://doi.org/10.26633/RPSP.2019.32 [ Links ]
Institut Pasteur. 2021. The Middle Years 1862-1877. (20 de noviembre 2021). https://www.pasteur.fr/en/institut-pasteur/history/middle-years-1862-1877 [ Links ]
Instituto Nacional de Salud Pública (INSP). 2020. Conceptos fundamentales de la salud pública: Julio Frenk. https://www.insp.mx/avisos/4515-salud-publica-conceptos-juliofrenk.html [ Links ]
International Epidemiological Association (IEA). 2021. https://www.ieaweb.org/ [ Links ]
June-Ho K, Ah-Reum AJ, SeungJu JO, Juhwan Oh and Jong-Koo L. 2021. Emerging COVID-19 success story: South Korea learned the lessons of MERS. Exemplars in Global Health. https://ourworldindata.org/covid-exemplar-south-korea [ Links ]
Kranz J. 1985. Die Epidemiologie der Pflanzenkrankheiten. Naturwissenschaften 72(8):419-426. https://link.springer.com/content/pdf/10.1007/BF00404883.pdf [ Links ]
Kranz J. 1988. The Methodology of comparative epidemiology. 279-289 pp. in: Kranz J and Rotem J. (eds.). Experimental Techniques in Plant Disease EpidemiologySpringer-Verlag. Berlin, London. [ Links ]
Kranz J. 1996. Epidemiologie der Pflanzenkrankheiten. Ulmer. Germany. 413p. [ Links ]
Kranz J. 2003. On the Methodology of Comparative Epidemiology. In: Comparative Epidemiology of Plant Diseases. Springer, Berlin, Heidelberg. https://doi.org/10.1007/978-3-662-05261-7_3 [ Links ]
Lal M, Sharma S, Yadav S and Kumar S. 2018. Management of Late Blight of Potato. IntechOpen 25p. https://doi.org/10.5772/intechopen.72472 [ Links ]
Langmuir AD. 1961. Public health implications of airborne infection: medical aspects. Bacteriological Reviews 25:356-358. https://doi.org/10.1128/br.25.3.356-358.1961 [ Links ]
Lednicky JA, Tagliamonte MS, White SK, Elbadry MA, Alam MdM, Stephenson CJ, Bonny TS, Loeb JC, Telisma T, Chavannes S, Ostrov DA, Mavian C, De Rochars VMB, Salemi M and Morris JG. 2021. Independent infections of porcine deltacoronavirus among Haitian children. Nature https://doi.org/10.1038/s41586-021-04111-z [ Links ]
Lee TY, Lee H, Kim N, Jeon P, Kim JW, Lim HY, Yang JS, Kim KC and Lee JY. 2021. Comparison of SARS-CoV-2 variant lethality in human angiotensin-converting enzyme 2 transgenic mice. Virus Research 305: 198563. https://doi.org/10.1016/j.virusres.2021.198563. [ Links ]
Li X, Zhang L, Chen S, Ouyang H and Ren L. 2021. Possible targets of pan-coronavirus antiviral strategies for emerging or re-emerging coronaviruses. Microorganisms 9(7): 1479. https://doi.org/10.3390/microorganisms9071479 [ Links ]
Liu Y, Liu J, Plante KS, Plante JA, Xie X, et al. 2021. The N501Y spike substitution enhances SARS-CoV-2 infection and transmission. Nature https://doi.org/10.1038/s41586-021-04245-0. [ Links ]
Loeza-Kuk E, Ochoa-Martínez D, Mora-Aguilera G, Rivas-Valencia P, Gutiérrez-Espinosa MA, de Jesús WC, Villegas-Monter A, Arno-Wulff N and Perez-Molphe-Balch E. 2008. Detection of Citrus sudden death-associated virus and Haplotypes of Citrus tristeza virus in Toxoptera citricida and Aphis spiraecola and implication on citrus sudden death in Brazil. Agrociencia 42: 669-678 http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S1405-31952008000600007. [ Links ]
López-Avalos G, Gonzalez-Palomar G, Lopez-Rodriguez M, Vazquez-Chacon CA, Mora-Aguilera G, Gonzalez-Barrios JA, Villanueva-Arias JC, Sandoval-Diaz M, Miranda-Hernández U and Álvarez-Maya I. 2017. Genetic diversity of Mycobacterium tuberculosis and transmission associated with first-line drug resistance: a first analysis in Jalisco, Mexico. Journal of Global Antimicrobial Resistance 11: 90-97. https://doi.org/10.1016/j.jgar.2017.07.004. [ Links ]
López-Bautista V, Mora-Aguilera G, Gutiérrez-Espinosa MA, Mendoza-Ramos C, Martínez-Bustamante VI, Coria-Contreras JJ, Acevedo-Sánchez G and Santana-Peñaloza B. 2020. Morphological and molecular characterization of Fusarium spp. associated to the regional occurrence of wilt and dry bud rot in Agave tequilana. Mexican Journal of Phytopathology 38(1): 79-106. https://doi.org/10.18781/R.MEX.FIT.1911-4 [ Links ]
Lynch C. 2019. The Impacts of Warming Coffee: The Climate Change-Coffee-Migration Nexus in the Northern Triangle of Central America. Independent Study Project (ISP) Collection. 3008. https://digitalcollections.sit.edu/isp_collection/3008 [ Links ]
Mari L, Bertuzzo E, Righetto L, et al. 2012. Modelling cholera epidemics: the role of waterways, human mobility and sanitation. Journal of the Roya Society Interface 9(67): 376-388. https://doi.org/10.1098/rsif.2011.0304 [ Links ]
Martin PMV and Martin-Granel E. 2006. 2500-year Evolution of the term epidemic. Emerging Infectious Diseases 12: 976-980. https://doi.org/10.3201/eid1206.051263 [ Links ]
Matta C. 2010. Spontaneous generation and disease causation: Anton de Bary’s experiments with Phytophthora infestans and late blight of potato. Journal of the History of Biology 43(3): 459-91. https://doi.org/10.1007/s10739-009-9220-1 [ Links ]
McCook S. 2006. Global rust belt: Hemileia vastatrix and the ecological integration of world coffee production since 1850. Journal of Global History 1(2): 177-195. https://doi.org/10.1017/S174002280600012X [ Links ]
Meegahakumbura MK, Wambulwa MC, Li M-M, Thapa KK, Sun Y-S, Möller M, Xu J-C, Yang J-B, Liu J, Liu B-Y, Li D-Z and Gao L-M. 2018. Domestication origin and breeding history of the tea plant (Camellia sinensis) in China and India based on nuclear microsatellites and cpDNA sequence data. Frontiers in Plant Science 8:2270. https://doi.org/10.3389/fpls.2017.02270 [ Links ]
Mendez-Dominguez N, Alvarez-Baeza A and Carrillo G. 2020. Demographic and Health Indicators in Correlation to Interstate Variability of Incidence, Confirmation, Hospitalization, and Lethality in Mexico: Preliminary Analysis from Imported and Community Acquired Cases during COVID-19 Outbreak. International Journal of Environmental Research and Public Health 17(12): 4281. https://doi.org/10.3390/ijerph17124281 [ Links ]
Mendoza-Ramos C, Mora-Aguilera G, Coria-Contreras JJ, Santana-Peñaloza B, Acevedo-Sánchez G, Martínez-Bustamante V, Gutiérrez-Espinosa MA and Rubio-Cortés R. 2021. Fusarium spp. and inoculum load estimation associated to commercial Agave tequilana offsets at different regional epidemic inductivity levels. Mexican Journal of Phytopathology 39(1): 94-121. http://dx.doi.org/10.18781/R.MEX.FIT.2006-8 [ Links ]
Millardet PMA. 1933. The Discovery of Bordeaux Mixture (trans. F. J. Schneiderhan). The American Phytopathological Society. https://apsjournals.apsnet.org/doi/book/10.1094/9780890545188 [ Links ]
Ministry of Health Mexico (SSA). Daily Technical Communication COVID-19 (Accessed June 30, 2020) [ Links ]
Moat J, Gole TW and Davis AP. 2019. Least concern to endangered: Applying climate change projections profoundly influences the extinction risk assessment for wild Arabica coffee. https://doi.org/10.1111/gcb.14341. [ Links ]
Moein S, Nickaeen N, Roointan A, Borhani N, Heidary Z, Javanmard SH, Ghaisari J and Gheisari Y. 2021. Inefficiency of SIR models in forecasting COVID-19 epidemic: a case study of Isfahan. Scientifc Reports 11(1): 1-9. https://doi.org/10.1038/s41598-021-84055-6 [ Links ]
Mora-Aguilera G, Acevedo-Sánchez G, Guzmán-Hernández E, Flores-Colorado OE, Coria-Contreras JJ, Mendoza-Ramos C, Martínez-Bustamante VI, López-Buenfil A, González-Gómez R and Javier-López MA. 2021a. Web-based epidemiological surveillance systems and applications to coffee rust disease. Mexican Journal of Phytopathology 39(3): 452-492. https://doi.org/10.18781/R.MEX.FIT.2104-6 [ Links ]
Mora-Aguilera G, Martínez-Bustamante V, Acevedo-Sánchez G, Coria-Contreras JJ, Guzmán-Hernández E, Flores-Colorado OE, Mendoza-Ramos C, Hernández-Nava G, Álvarez-Maya I, Gutiérrez-Espinosa MA, Gómez-Linton R, Robles-Bustamante AC and Gallardo-Hernández A. 2021b. Surveillance web system and mouthwash-saliva qPCR for labor ambulatory SARS-CoV-2 detection and prevention. International Journal of Environmental Research and Public Health 2021, 18(x). https://doi.org/10.3390/ijerph19031271 (Accepted). [ Links ]
Mora-Aguilera G and Acevedo-Sánchez G. 2020. COVID-19: A principles review from plant epidemiology perspective. Mexican Journal of Phytopathology 38(S):138-139. https://rmf.smf.org.mx/suplemento/suplemento382020/Resumenes_Posters.pdf [ Links ]
Mora-Aguilera G, Acevedo-Sánchez G, Calderón-Estrada G, Flores-Sánchez J, Domínguez-Monge S, Baker P and González-Gómez R. 2014a. Epidemiological considerations of climate change on tropical crops health. Mexican Journal of Phytopathology 32(2): 147-167. http://www.scielo.org.mx/scielo.php?pid=S0185-33092014000200147&script=sci_arttext&tlng=en [ Links ]
Mora-Aguilera G, Flores-Sánchez F, Acevedo-Sánchez G, Domínguez-Monge S, Oropeza-Salin C, Flores-Olivas A, González-Gómez R and Robles-García P. 2014b. Epidemiological surveillance and current status of coconut lethal yellowing, potato purple top and citrus Huanglongbing (HLB) in Mexico. Mexican Journal of Phytopathology 32(2): 120-131. https://www.researchgate.net/publication/300533174_Epidemiolo-gical_Surveillance_and_Current_Status_of_Coconut_Lethal_Yellowing_Potato_Purple_Top_and_Citrus_Huanglongbing_HLB_in_Mexico [ Links ]
Mora-Aguilera G, Robles-García P, López-Arroyo JL, Flores-Sánchez J, Acevedo-Sánchez G, Domínguez-Monge D and González-Gómez R. 2014c. Current situation and perspectives in management of citrus HLB. Mexican Journal of Phytopathology 32(2): 108-119. https://www.smf.org.mx/rmf/Vol3222014/AR/32-2_03.pdf [ Links ]
Moreno T, Pintó RM, Bosch A, Moreno N, Alastuey A, et al., 2021. Tracing surface and airborne SARS-CoV-2 RNA inside public buses and subway trains. Environment International 147: 106326. https://doi.org/10.1016/j.envint.2020.106326. [ Links ]
Morris D. 1879. Coffee-leaf disease of Ceylon and Southern India. Nature 20: 557-559. https://doi.org/10.1038/020557a0. [ Links ]
Morris D. 1880. Note on the structure and habit of Hemileia vastatrix, the coffee-leaf disease of Ceylon and Southern India. Botanical Journal of the Linnean Society 17: 512-517. https://doi.org/10.1111/j.1095-8339.1880.tb01240.x [ Links ]
Müller GW and Costa AS. 1977. Tristeza control in Brazil by preimmunization with mild strains. Proceedings of the International Society of Citriculture 3: 868-872. [ Links ]
Mwalili S, Kimathi M, Ojiambo V. et al. 2020. SEIR model for COVID-19 dynamics incorporating the environment and social distancing. BMC Research Notes 13: 352. https://doi.org/10.1186/s13104-020-05192-1 [ Links ]
Nature. 1913. Eradication of Plant Diseases. 91; 299. https://doi.org/10.1038/091299a0 [ Links ]
Navarrete JE. 2021. Pandemia: ¡son las vacunas, estúpido! La Jornada. (14 de octubre de 2021). https://www.jornada.com.mx/notas/2021/10/14/politica/pandemia-son-las-vacunas-estupido/ [ Links ]
Noda AS y Chávez FL. 2021. Actualización sobre estrategia de vacunación anti-COVID-19 en Cuba. Ministerio de Salud República de Cuba. (7 de septiembre de 2021). https://salud.msp.gob.cu/actualizacion-sobre-estrategia-de-vacunacion-anti-covid-19-en-el-pais/ [ Links ]
Newhall AG. 1980. Herbert Hice Whetzel: Pioneer American Plant Pathologist. Annual Review of Phytopathology 18:27-36. https://doi.org/10.1146/annurev.py.18.090180.000331 [ Links ]
ONU. 2021. COVID-19: La ONU presenta la Estrategia Global de Vacunación para alcanzar al 40% de la población a fin de año. (7 de octubre de 2021). https://news.un.org/es/story/2021/10/1498032 [ Links ]
Organización Panamericana de la Salud (OPS) . 1998. La Organización Mundial de la Salud cumple 50 años. Revista Panamericana de Salud Pública 4(4): 282-286. https://scielosp.org/j/rpsp/i/1998.v4n4/ [ Links ]
Organización Panamericana de Salud (OPS). 2021. Eliminación del sarampión en las Américas. (22 Octubre, 2021). https://www3.paho.org/hq/index.php?option=com_content&view=article&id=12526:measles-elimination-in-the-americas&Itemid=40721&lang=es [ Links ]
O’Toole Á, Hill V, Pybus OG et al. 2021. Tracking the international spread of SARS-CoV-2 lineages B.1.1.7 and B.1.351/501Y-V2 [version 1; peer review: 3 approved]. Wellcome Open Research 6:121. https://doi.org/10.12688/wellcomeopenres.16661.1 [ Links ]
Pandey A, Sinniah GD, Azariah BK and Tanti A. 2021. How the global tea industry copes up with fungal diseases-challenges and opportunities. Plant Disease 105: 1868-1879. https://doi.org/10.1094/PDIS-09-20-1945-FE. [ Links ]
Parascandola M. 2011. The epidemiologic transition and changing concepts of causation and causal inference. Revue d’histoire des sciences 2011/2 (Tome 64): 243-262. ISSN 0151-4105. https://doi.org/10.3917/rhs.642.0243. [ Links ]
Parnell S, van den Bosch F, Gottwald T and Gilligan CA. 2017. Surveillance to inform control of emerging plant diseases: An epidemiological perspective. Annual Review of Phytopathology 55: 591-610. https://doi.org/10.1146/annurev-phyto-080516-035334 [ Links ]
Porta M. (Ed). 2014. A dictionary of epidemiology. Sixth edition / edited for the International Epidemiological Association. 377 p. ISBN 978-0-19-997672-0 [ Links ]
Potter C and Urquhar J. 2017. Tree disease and pest epidemics in the Anthropocene: A review of the drivers, impacts and policy responses in the UK. Forest Policy and Economics 79: 61-68. https://doi.org/10.1016/j.forpol.2016.06.024 [ Links ]
Potter C, Harwood T, Knight J and Tomlinson I. 2011. Learning from history, predicting the future: the UK Dutch elm disease outbreak in relation to contemporary tree disease threats. Philosophical Transactions of the Royal Society b366: 1966-1974. https://doi.org/10.1098/rstb.2010.0395 [ Links ]
Quanjer HM. 1946. Pflanzliche Infektionslehre. Lehrbuch der allgemeinen Pflanzenpathologie fur Biologen, Landwirte, Förster und Pflanzenzüchter. Tijdschrift Over Plantenziekten 52: 123-124. https://doi.org/10.1007/BF02000423 [ Links ]
Racault, MF., Abdulaziz, A., George, G., Menon, N CJ., Punathil, M., McConville, K., Loveday, B., Platt, T., Sathyendranath, S. and Vijayan, V. 2019. Environmental Reservoirs of Vibrio cholerae: Challenges and Opportunities for Ocean-Color Remote Sensing. Remote Sensing 11(23): 2763. https://doi.org/10.3390/rs11232763 [ Links ]
Reddy LR. 2003. Sri Lanka pasado y presente. Publicación APH Publication. 382p. https://books.google.com.mx/books?id=JsRmJrqo5qQC&pg. [ Links ]
Reuters, Ap y Afp. 2021. El riesgo de reinfección con ómicron, cinco veces mayor que con delta: estudio. La Jornada. (18 diciembre, 2021). https://www.jornada.com.mx/notas/2021/12/18/politica/el-riesgo-de-reinfeccion-con-omicron-cinco-veces-mayor-que-con-delta-estudio/ [ Links ]
Ristaino, JB., Anderson, PK., Bebber, DP., Brauman, KA., Cunniffe, NJ., Fedoroff, NV. et al., 2021. The persistent threat of emerging plant disease pandemics to global food security. Proceedings of the National Academy of Sciences of the United States of America 118: 1-9. www.pnas.org/cgi/doi/10.1073/pnas.2115792118 [ Links ]
Rivas-Valencia P, Loeza-Kuk E, Mora-Aguilera G, Febres V, Ochoa-Martínez D, Gutiérrez-Espinosa MA, Cintra JJW, Correia-Malvas C and Arno-Wulff N. 2008. Estructura poblacional de aislamientos del citrus tristeza virus y su asociación con la muerte súbita de los cítricos en Brasil. Agrociencia 42(1): 85-93. http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S1405-31952008000100009&lng=es&tlng=es [ Links ]
Rivas-Valencia P, Loeza-Kuk E, Mora-Aguilera G, Ruiz-García N, Ochoa-Martínez DL, Gutiérrez-Espinosa A y Febres V. 2010. Análisis espacio-temporal de aislamientos del Citrus tristeza virus de Yucatán y Tamaulipas. Revista Mexicana de Ciencias Agrícolas 1: 493-507. http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S2007-09342010000400004. [ Links ]
Robinson CM, Singh G, Lee JY, Dehghan S, Rajaiya J, et al. 2013. Molecular evolution of human adenoviruses. Scientific Report 3:1812. https://doi.org/10.1038/srep01812. [ Links ]
Rodríguez ME. 2019. Wild coffee species threatened by climate change and deforestation. Nature. https://doi.org/10.1038/d41586-019-00150-9. [ Links ]
Romero MG, Lozoya SH, Mora-Aguilera G, Fernández PS y Grünwald NJ. 2012. Rendimiento de papa en función de epidemia por tizón tardío (Phytophthora infestans Mont. de Bary). Revista Fitotecnia Mexicana 35: 69-78. http://www.scielo.org.mx/pdf/rfm/v35n1/v35n1a10.pdf [ Links ]
Roser M, Ritchie H and Ortiz-Ospina E. 2013. World Population Growth. Published online at OurWorldInData.org. https://ourworldindata.org/world-population-growth [ Links ]
Roser M, Ochmann S, Behrens H, Ritchie H and Dadonaite B. 2014. Eradication of Diseases. Published online at OurWorldInData.org. https://ourworldindata.org/eradication-of-diseases [ Links ]
Ritchie H, Mathieu E, Rodés-Guirao L, Appel C, Giattino C, Ortiz-Ospina E, Hasell J, Macdonald B, Beltekian D, and Roser M. 2020. Coronavirus Pandemic (COVID-19). Published online at OurWorldInData.org. https://ourworldindata.org/coronavirus [ Links ]
Ruiz-de-Oña C, Rivera-Castañeda P and Merlín-Uribe Y. 2019. Coffee, migration and climatic changes: challenging adaptation dichotomic narratives in a transborder region. Social sciences 8(12):323. https://doi.org/10.3390/socsci8120323 [ Links ]
Sabaratnam T. 2010. Sri Lankan Tamil Struggle https://sangam.org/2010/10/Tamil_Struggle_10.php?uid=4082. [ Links ]
Saito A, Irie T, Suzuki R, Maemura T, Nasser H, et al. 2021. Enhanced fusogenicity and pathogenicity of SARS-CoV-2 Delta P681R mutation. Nature https://doi.org/10.1038/s41586-021-04266-9. [ Links ]
Santivañez T, Mora-Aguilera G, Díaz-Padilla G. José Isabel López-Arrollo JI y Vernal P. 2013. Citrus: Marco Estratégico para la Gestión Regional del Huanglongbing en América Latina y el Caribe. FAO, Chile. 75p. https://www.researchgate.net/publication/275640678_Citrus_Marco_Estrategico_para_la_Gestion_Regional_del_Hanglongbing_en_America_Latina_y_el_Caribe. [ Links ]
Saville AC and Ristaino JB 2021. Global historic pandemics caused by the FAM-1 genotype of Phytophthora infestans on six continents. Scientific Reports 11: 12335. https://doi.org/10.1038/s41598-021-90937-6 [ Links ]
Scalabrin S, Toniutti L, Gaspero GD, Scaglione D, Magris G, et al. 2020. A single polyploidization event at the origin of the tetraploid genome of Coffea arabica is responsible for the extremely low genetic variation in wild and cultivated germplasm. Scientific Reports 10:4642. https://doi.org/10.1038/s41598-020-61216-7. [ Links ]
Schieber E. 1972. Economic impact of coffee rust in Latin America. Annual Review of Phytopathology 10(1): 491-510. https://www.annualreviews.org/doi/pdf/10.1146/annurev.py.10.090172.002423 [ Links ]
Schumann GL. 1991. Why Europeans Drink Tea. In Plant Diseases: Their Biology and Social Impact. American Phytopathological Society. https://www.apsnet.org/edcenter/apsnetfeatures/Pages/ICPP98CoffeeRust.aspx [ Links ]
Sharp PM, Plenderleith LJ and Hahn BH. 2020. Ape origins of human malaria. Annual Review Microbiology 74: 39-63. https://doi.org/10.1146/annurev-micro-020518-115628. [ Links ]
Shu Y and McCauley J. 2017. GISAID: Global initiative on sharing all influenza data - from vision to reality. Euro Surveillance 22(13): https://doi.org/10.2807/1560-7917.ES.2017.22.13.30494 [ Links ]
Smith T. 1934. Parasitism and disease. Princeton University Press. 196p. https://wellcomecollection.org/works/rs2hxwpe [ Links ]
Solano PL. (20 de noviembre 2021). Alerta la OMS sobre resistencia a los fármacos antimicrobianos. La Jornada. https://www.jornada.com.mx/notas/2021/11/20/sociedad/alerta-la-oms-resistencia-a-los-farmacos-antimicrobianos/ [ Links ]
Sputnik Ap y Reuters. 2021. Exigir pasaporte de vacunación en este momento es discriminatorio, acusa OMS. La Jornada. (15 de septiembre 2021). https://www.jornada.com.mx/notas/2021/09/15/politica/exigir-pasaporte-de-vacunacion-en-este-momento-es-discriminatorio-acusa-oms/ [ Links ]
Tatum LA. 1971. The southern corn leaf blight epidemic: A new race of the fungus Helminthosporium maydis threatens domestic prices and corn reserves for export. Science 171:1113-1116. https://doi.org/10.1126/science.171.3976.1113. [ Links ]
Tognotti E. 2013. Lessons from the history of quarantine, from plague to influenza A. Emerging infectious diseases 19(2): 254-259. https://doi.org/10.3201/eid1902.120312 [ Links ]
Townsend JP, Hassler HB, Wang Z, Miura S, Singh J, Kumar S, Ruddle NH, Galvani AP and Dornburg A. 2021. The durability of immunity against reinfection by SARS-CoV-2: a comparative evolutionary study. The Lancet Microbe. https://doi.org/10.1016/S2666-5247(21)00219-6. [ Links ]
Turner R. 2005. After the famine: Plant pathology, Phytophthora infestans, and the late blight of potatoes, 1845-1960. Historical Studies in the Physical and Biological Sciences 35(2): 341-370. https://doi.org/10.1525/hsps.2005.35.2.341 [ Links ]
Turnes AL. 2009. Origen, evolución y futuro del hospital. 1-93 p. https://www.smu.org.uy/dpmc/hmed/historia/articulos/origen-y-evolucion.pdf [ Links ]
Van Esse HP, Reuber TL and Van der Does D. 2020. Genetic modification to improve disease resistance in crops. New Phytologist 225(1): 70-86. https://doi.org/10.1111/nph.15967 [ Links ]
Vanderplank JE. 1963. Plant Diseases: Epidemics and Control. Academic Press. New York, London. 349p. [ Links ]
Vashishtha V. 2021. As the Delta variant family grows, the ancestor continues to dominate. The Wire Science https://science.thewire.in/the-sciences/as-the-delta-variant-family-grows-the-ancestor-continues-to-dominate/. [ Links ]
Velázquez MA. 2021. Oliva López: se recuperó en 70% el sistema salud de CDMX. La Jornada. (06 diciembre, 2021). https://www.jornada.com.mx/notas/2021/12/06/capital/oliva-lopez-se-recupero-en-70-el-sistema-salud-de-cdmx/ [ Links ]
Vines SH. 1906. Prof. H. Marshall Ward, F.R.S. Nature 74:493-495. https://doi.org/10.1038/074493a0. [ Links ]
Vivas MA. 2021. La variante ómicron impulsa el crecimiento de las farmacéuticas en las bolsas de valores. Consultorsalud. (29 noviembre, 2021). https://consultorsalud.com/farmaceuticas-crecen-por-variante-omicron/ [ Links ]
Wingfield BD, Ericson L, Szaro T and Burdon JJ. 2004. Phylogenetic patterns in the Uredinales. Australasian Plant Pathology 33: 327-335. https://doi.org/10.1071/AP04020. [ Links ]
Winslow CE. 1920. The Untilled Fields of Public Health. Science 51(1306): 23-33. https://doi.org/10.1126/science.51.1306.23. PMID: 17838891. [ Links ]
Wong JY, Kelly H, Ip DKM, Wu JT, Leung GM and Cowling BJ. 2013. Case Fatality Risk of Influenza A (H1N1pdm09). Epidemiology 24(6): 830-841. doi: 10.1097/EDE.0b013e3182a67448. [ Links ]
World Coffee Research. 2021. Costa Rica 95 Catimor. Variedad de muy alto rendimiento, adaptada para las zonas cálidas y suelos ácidos. https://varieties.worldcoffeeresearch.org/es/varieties/costa-rica-95 [ Links ]
World Coffee Research. 2017. Coffee Leaf Rust Resistant Coffee Variety Overcome in Honduras. Guatemala City, May 12. Consulted in https://worldcoffeeresearch.org/news/coffee-leaf-rust-resistant-coffee-variety-overcome-honduras/ [ Links ]
World Health Organization (WHO). 2021a. Coronavirus disease (COVID-19) pandemic. https://www.who.int/emergencies/diseases/novel-coronavirus-2019. [ Links ]
World Health Organization (WHO). 2021b. WHO Coronavirus (COVID-19) Dashboard. https://covid19.who.int. [ Links ]
World Health Organization (WHO). 2021c. Seguimiento de las variantes del SARS-CoV-2. https://www.who.int/es/activities/tracking-SARS-CoV-2-variants. [ Links ]
World Health Organization (WHO). 2021d. Classification of Omicron (B.1.1.529): SARS-CoV-2 Variant of Concern. https://www.who.int/news/item/26-11-2021-classification-of-omicron-(b.1.1.529)-sars-cov-2-variant-of-concern. [ Links ]
World Health Organization (WHO). 2021e. La COVID-19 muestra por qué es necesaria una acción conjunta para una arquitectura sanitaria internacional más sólida. https://www.who.int/es/news-room/commentaries/detail/op-ed---covid-19-shows-why-united-action-is-needed-for-more-robust-international-health-architecture. [ Links ]
World Health Organization (WHO). 2021f. Influenza (avian and other zoonotic). Available in: https://www.who.int/health-topics/influenza-avian-and-other-zoonotic#tab=tab_1 [ Links ]
World Health Organization (WHO). 2017. Plague. https://www.who.int/es/news-room/fact-sheets/detail/plague. [ Links ]
World Health Organization (WHO). 2005. WHO global influenza preparedness plan: the role of WHO and recommendations for national measures before and during pandemics. https://apps.who.int/iris/handle/10665/68998 [ Links ]
Yuen J. 2021. Pathogens which threaten food security: Phytophthora infestans, the potato late blight pathogen. Food Security 13: 247-253. https://doi.org/10.1007/s12571-021-01141-3 [ Links ]
Zadoks JC and Koster LM. 1976. A historical survey of botanical epidemiology. Centre for Agricultural Publishing and Documentation, Wageningen, The Netherlands. 56p. [ Links ]
Zadoks JC and Schein RD. 1979. Epidemiology and Plant Disease Management. Oxford University Press. New York Oxford. 427p. [ Links ]
Zewdie Y. 2003. Acceso forestal: política y realidad en Kafa, Etiopía. Leisa 19(3). https://www.leisa-al.org/web/index.php/volumen-19-numero-3/2158-acceso-forestal-politica-y-realidad-en-kafa-etiopia. [ Links ]
Recibido: 02 de Febrero de 2021; Aprobado: 30 de Noviembre de 2021











 text in
text in 


