Introducción
Hoy en día, la catarata sigue siendo la causa número uno de ceguera tratable y discapacidad visual severa en todo el mundo1. La cirugía de catarata mejora la agudeza visual en la mayoría de los pacientes, y se considera una de las intervenciones de atención médica con una gran relación costo-eficacia2. La cirugía de catarata asistida con láser de femtosegundo (FLACS) parece mejorar los resultados y la seguridad en comparación con la facoemulsificación convencional, y ha ganado popularidad entre los cirujanos de catarata. En un estudio reciente que compara FLACS y facoemulsificación convencional, ambas técnicas tuvieron resultados refractivos y visuales comparables. Sin embargo, FLACS mostró un menor uso de energía de facoemulsificación, menos inflamación postoperatoria de la cámara anterior y menor pérdida de células endoteliales corneales3.
Las técnicas actuales de cirugía de catarata reducen significativamente las complicaciones postoperatorias. Sin embargo, el edema macular cistoide pseudofáquico (EMCP) sigue siendo la causa más común de disminución de la agudeza visual central (AVC) después de una cirugía de catarata exitosa. El EMCP clínico se define por una pérdida visual sintomática, y su incidencia varía de 1.17-4.04%4. Sin embargo, la incidencia de EMCP diagnosticado mediante tomografía de coherencia óptica (OCT) puede ser tan alta como 10.9%5. Estudios previos han mostrado menos inflamación de la cámara anterior y un menor grosor macular central con FLACS en comparación con la facoemulsificación convencional6-8, sin embargo, se ha reportado EMCP con FLACS. La prevalencia reportada de edema macular cistoide (EMC) postoperatorio asociado con FLACS es de alrededor del 0.8%9, y es comparable con los valores publicados previamente para la cirugía de catarata mediante facoemulsificación convencional (0.1-2.35%)10,11.
El EMCP clínicamente significativo generalmente comienza de 4 a 12 semanas después de la cirugía, con la incidencia más alta a las 4 a 6 semanas. Los pacientes con EMCP clínicamente significativo comúnmente experimentan una mejora de la agudeza visual postoperatoria inicial, seguida de una reducción de la visión central12. Los factores de riesgo conocidos para EMCP incluyen diabetes mellitus4,13, capsulotomía YAG, uveítis4,14, uso de análogos de prostaglandinas tópicos15,16, trauma17 y complicaciones transoperatorias18,19.
La patogénesis del EMCP es compleja e implica la producción de prostaglandinas (PG), citocinas y otros factores liberados durante el trauma quirúrgico, que alteran la barrera hematorretiniana12. Las herramientas terapéuticas disponibles para la profilaxis y el tratamiento del EMCP se basan en la comprensión de estos factores y sus vías. No se ha establecido el mejor régimen profiláctico para el EMCP, pero los corticosteroides y los antiinflamatorios no esteroideos (AINE) tópicos, solos o combinados, han demostrado ser útiles20-23, y se utilizan ampliamente como medicamentos de primera línea24. Un estudio integral previo que evaluó la prevención del EMCP después de la cirugía de catarata, demostró que la terapia tópica con AINE (bromfenaco al 0.09%) o esteroides (dexametasona al 0.1%) solos, se relacionó con una mayor incidencia de EMCP clínicamente significativo 12 semanas después de la cirugía (incidencia de 3.6 y 5.1%, respectivamente) en comparación con la terapia combinada (incidencia del 1.5%)25.
La mayor eficacia de la combinación tópica podría estar relacionada con los diferentes mecanismos de acción de los esteroides y los AINE. Los corticosteroides bloquean la síntesis de leucotrienos y PG y reducen la migración de macrófagos y neutrófilos, así como la permeabilidad capilar y la vasodilatación. Por otro lado, los AINE inhiben las enzimas de la ciclooxigenasa, bloqueando la síntesis de PG y tromboxanos, lo cual disminuye la vasodilatación y evita la alteración de la barrera hematoocular24. La actividad terapéutica reducida de los corticosteroides tópicos podría explicarse por la concentración limitada del fármaco que llega al segmento posterior del ojo debido a la presencia de las barreras ocular y hematorretiniana. Por otro lado, las inyecciones intravítreas de esteroides logran concentraciones intraoculares adecuadas, ya que evitan las barreras oculares26.
El EMCP crónico y refractario se puede manejar con éxito con corticosteroides intravítreos. El acetónido de triamcinolona intravítreo (ATIV) mejora efectivamente la agudeza visual y disminuye el grosor macular27-30. Sin embargo, el ATIV se asocia con complicaciones potencialmente graves, como aumento de la presión intraocular27,30, endoftalmitis, lesión del cristalino, desprendimiento de retina31-33, formación o progresión de cataratas y endoftalmitis no infecciosa34-36.
Existe la necesidad de estrategias alternativas de administración de fármacos para el EMCP que minimicen los riesgos de las inyecciones intravítreas pero que sean tan efectivas como el ATIV. Recientemente, informamos sobre una formulación tópica de liposomas cargados con acetónido de triamcinolona (FL-AT) que administra eficazmente triamcinolona en el vítreo y la retina de conejos37, y su actividad biológica y terapéutica también se confirmó en pacientes con EMCP refractario38, mostrando que el uso de esta formulación indujo una mejora de la agudeza visual mejor corregida (AVMC) y del grosor foveal central (GFC). Además, recientemente publicamos la comparación de la FL-AT con AINE39. En este estudio, demostramos que la FL-AT se correlaciona con mejores resultados de sensibilidad al contraste en comparación con la terapia combinada (prednisolona al 1% y nepafenaco al 0.1%) después de FLACS. Es interesante notar que no se observaron diferencias en la incidencia de edema macular clínicamente significativo (EMCS) entre los grupos39. En el estudio actual, decidimos comparar la FL-AT con suspensiones oftálmicas de esteroides convencionales, para informar la evaluación de tolerabilidad, seguridad y eficacia de la FL-AT tópica para la prevención del EMCP después de FLACS.
Pacientes y métodos
Diseño del estudio
Este fue un estudio prospectivo, aleatorizado, doble ciego, de dos grupos, en un solo centro (Centro de Retina Medica y Quirúrgica SC, Guadalajara, México). El estudio se adhiere a los principios de la Declaración de Helsinki y las aprobaciones del Comité de Ética del hospital, y los acuerdos regulatorios locales y federales (COFEPRIS 173300410A0035/2017). Todos los pacientes que se sometieron al procedimiento e ingresaron al estudio firmaron un consentimiento informado, y todos los datos se recolectaron prospectivamente en formularios estandarizados de informes de casos.
Pacientes
Se incluyeron pacientes con edades de 21 años o más que requerían FLACS e implante de lentes de cámara posterior en al menos un ojo. Se recopilaron los datos demográficos y de un examen clínico basal que incluyó la medición de GFC mediante OCT, de 1 a 14 días antes de la cirugía. Los criterios de exclusión incluyeron el uso de esteroides tópicos o AINE tópicos 1 mes antes del estudio, la colocación de un implante ocular de esteroides 12 meses antes del reclutamiento en el estudio, el uso de corticosteroides intraoculares o medicamentos antiangiogénicos 3 meses antes del estudio, catarata traumática u opacidad nuclear o color del cristalino mayor a grado 3 (según el sistema de clasificación de opacidades del cristalino III [LOCS III]). También excluimos a los pacientes con enfermedades oculares que impedían un examen adecuado del fondo de ojo, cualquier enfermedad ocular que pudiera disminuir la agudeza visual (retinopatía diabética, oclusión vascular, degeneración macular), hipertensión ocular, glaucoma, enfermedad sistémica inestable, incluida la hipertensión sistémica, diabetes mellitus, enfermedad ocular previa que resultara en un historial médico de EMC. También se excluyeron los sujetos con accidente cerebrovascular previo o infarto de miocardio. Solo se incluyeron pacientes que se sometieron a cirugía de catarata sin complicaciones.
TÉCNICAS QUIRÚRGICAS Y TERAPIA ASIGNADA
Todos los pacientes recibieron el mismo tratamiento preoperatorio y transoperatorio en ambos ojos. Todas las cirugías se realizaron bajo anestesia tópica utilizando clorhidrato de tetracaína al 5% (Ponti Ofteno, Sophia Labs., Zapopan, Mex.). Para mantener la dilatación de la pupila durante toda la cirugía, se utilizaron tropicamida al 0.8% y clorhidrato de fenilefrina al 5% (TP Ofteno, Sophia Labs., Zapopan, Mex.). Los pacientes se sometieron a FLACS, y se aplicó la parte con láser del procedimiento primero. El sistema de láser LenSX (Alcon, Inc., EE.UU.) se utilizó para realizar la capsulotomía anterior, la fragmentación del cristalino y luego las incisiones corneales (incisión temporal principal y dos puertos laterales de paracentesis), en esa secuencia. Primero se aplicó un anillo de succión. Se creó una capsulotomía circular con la energía establecida en 9 μJ. El diámetro de la capsulotomía fue de 5.0 mm. Se utilizó un patrón combinado circular (2 círculos, diámetros de 2.0 mm y 2.8 mm) y 4 cortes en forma de cruz (diámetro de 8.0 mm) para la fragmentación del cristalino con una energía de pulso de 10 μJ. El láser de femtosegundo se utilizó para crear dos puertos de paracentesis y una incisión corneal clara. El ancho de la incisión corneal del puerto principal fue de 2.2 mm, y de 1.0 mm para cada uno de los 2 puertos laterales. El puerto principal se colocó a 210° en el ojo derecho y a 30° en el ojo izquierdo. Los puertos laterales estaban a 95° y 275° en el ojo derecho, y a 100° y 280° en el ojo izquierdo.
Después del tratamiento con láser de femtosegundo, los pacientes fueron transferidos a la sala de operaciones para la facoemulsificación. Después de la sedación, se abrieron las incisiones corneales y la cápsula anterior separada se retiró con fórceps. Todos los demás pasos fueron similares a la facoemulsificación convencional. Todos los pacientes recibieron el lente intraocular corrector de presbicia AcrySof® IQ PanOptix de Alcon.
Después de la cirugía, los pacientes fueron asignados aleatoriamente a 1 de 2 grupos de tratamiento. Los pacientes en el grupo de acetónido de triamcinolona (AT) recibieron gotas de acetónido de triamcinolona al 0.1% disponibles comercialmente en México (Softram, Laboratorios Grin, SA de CV; 03-04-2008 / 087M2008 SSA / IPP: DEAR 05330060101527 / R-2008) cuatro veces al día durante 21 días después de la cirugía, mientras que los pacientes en los grupos de FL-AT recibieron una formulación liposomal que contiene 2 mg/ml de AT (0.2%) cuatro veces al día durante 21 días después de la cirugía. No se permitieron otros corticosteroides oculares o AINE durante el curso del estudio. Todos los pacientes recibieron gatifloxacino al 0.3% después de la cirugía, cuatro veces al día durante 14 días (Zymar, Allergan, Irvine, CA, EE.UU.).
Evaluación de eficacia
Para evaluar la eficacia terapéutica de FL-AT al 0.2% en comparación con AT al 0.1%, se realizó un seguimiento que incluyó agudeza visual, sensibilidad al contraste, GFC y volumen macular total (VMT). La AVMC se midió utilizando la cartilla del ETDRS (del inglés, Early Treatment Diabetic Retinopathy Study) a 4 m, y la agudeza visual medida se expresó como el logaritmo del ángulo mínimo de resolución (logMar). La sensibilidad al contraste (SC) se evaluó mediante la prueba de sensibilidad al contraste de Pelli-Robson. Los valores logarítmicos de sensibilidad al contraste (1/contraste), así como los valores de agudeza visual, se registraron en cada visita del estudio. El análisis de GFC y VMT se realizó mediante OCT (Cirrus OCT Carl Zeiss, Meditec, Dublin, CA). Las visitas del estudio se programaron el día 1 y las semanas 6 y 12 después de la cirugía. Además, se realizaron tinción de la superficie ocular con fluoresceína, medición de presión intraocular (PIO) y evaluación del segmento anterior y posterior con lámpara de hendidura en cada visita, con el propósito de identificar cualquier evento adverso ocular.
La aparición de EMC y EMCS se exploró en las semanas 6 y 12. El EMC se definió como un aumento del grosor macular medio del subcampo central del 10% o más sobre el valor basal, con cambios quísticos mediante OCT. Los cambios cistoides y otros trastornos de la retina fueron identificados por dos especialistas en retina independientes y enmascarados. El EMCS se definió como EMC con una mejora de menos de 0.2 logMAR de AVMC en comparación con la basal preoperatoria25.
Evaluación de seguridad
La tolerabilidad se evaluó mediante la recopilación y el Resumen de eventos adversos (EA) oculares y no oculares, EA serios (EAS), evaluaciones oculares y signos vitales, referidos espontáneamente por los pacientes reclutados, descubiertos por el personal del sitio de estudio durante el interrogatorio o por otros medios. Los sujetos eran retirados si mostraban alguna evidencia de mala tolerabilidad o algún evento adverso, como úlceras corneales, opacidades corneales, defectos epiteliales, inflamación de la cámara anterior (células/flare) o inyección conjuntival y/o epiescleral relacionada con el uso de esta formulación tópica. Los EA se codificaron utilizando los términos de códigos estándar para el evento con base en el Diccionario médico para la Terminología de Actividades Regulatorias (MedDRA) versión 18.1.
TRATAMIENTO DE RESCATE
Se consideró el tratamiento de rescate con una combinación tópica de prednisolona al 1% 4 veces al día y nepafenaco al 0.1% 3 veces al día durante 4 semanas, cuando los pacientes desarrollaban EMCS durante el transcurso del estudio. Si el EMCS se resolvía dentro de estas 4 semanas, se suspendía el nepafenaco y las gotas de prednisolona se disminuían gradualmente 1 gota por día cada semana. Si el EMCS persistía después de 4 semanas de tratamiento tópico, los pacientes recibían una inyección intravítrea de 4 mg de AT sin conservantes. Se consideraba el uso de fármacos reductores de la PIO cuando la PIO ≥ 22 mmHg o si existía una diferencia > 4 mmHg en comparación con el ojo contralateral.
Preparación de la formulación liposomal
OPKO Health, Inc. (Guadalajara, Jalisco, México) proporcionó una formulación de liposomas cargados con FL-AT. La preparación de FL-AT se realizó como se describió previamente37. Brevemente, se generaron espontáneamente liposomas cargados con AT termodinámicamente estables (QuSomes®) al agregar polietilenglicol (PEG-12) gliceril dimiristato a una solución acuosa de AT. La composición de la FL-AT se describe en la tabla 1. La concentración final de AT en la dispersión resultante fue de 2 mg/ml (0.2%).
Tabla 1 Composición de la formulación de liposomas cargados con acetónido de triamcinolona
| Reactivo | Volumen |
|---|---|
| Acetónido de triamcinolona | 2.0 mg |
| Kolliphor HS 15 | 50 mg |
| PEG-12 gliceril dimiristato | 100 mg |
| Alcohol etílico | 14 μL |
| Ácido cítrico anhidro | 0.8 mg |
| Citrato de sodio dihidrato | 4.675 mg |
| Cloruro de benzalconio | 0.1 mg |
| Agua purificada de grado 2 | Afore a 1.0 ml |
PEG: polietilenglicol
Análisis estadístico
Los datos se analizaron utilizando el software SPSS 22.0 (IBM SPSS Statistics para Macintosh, Versión 22.0. Armonk, NY, EE.UU.: IBM Corp.). Las variables cuantitativas se describieron utilizando media y desviación estándar. Las variables cualitativas se describieron utilizando frecuencias y porcentajes. Realizamos la prueba de los rangos con signo de Wilcoxon y la prueba U de Mann-Whitney para el análisis de la edad, AVMC, SC, GFC, VMT y PIO en muestras dependientes e independientes, respectivamente. Para el análisis del género y el ojo del estudio, se realizó una prueba exacta de Fisher. La correlación entre las variables se midió mediante la r de Pearson para calcular posteriormente el coeficiente de determinación (r2). La significancia se definió como un valor de p menor de 0.05.
Resultados
Se reclutaron 55 ojos de 32 pacientes. De los 55 ojos del estudio, 29 eran derechos y 26 eran izquierdos. La pro-porción hombre:mujer de los pacientes reclutados fue de 15:17. Fueron asignados al grupo de AT 27 ojos, mientras que 28 ojos fueron asignados al grupo de FL-AT. Solo 21 ojos del grupo de AT completaron 12 semanas de seguimiento, ya que seis pacientes requirieron tratamiento de rescate en la semana 6 debido a EMCS. Todos los pacientes del grupo de FL-AT finalizaron el seguimiento. La figura 1 muestra un diagrama de flujo con el número de ojos aleatorizados y analizados. Las características clínicas de los pacientes en los grupos de AT y FL-AT se Resumen en la tabla 2.
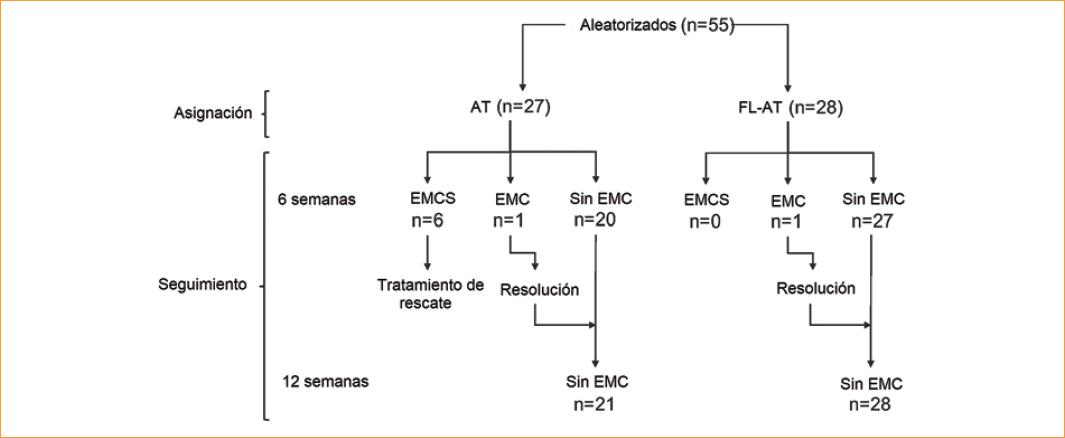
Figura 1 Diagrama de flujo con el número de ojos aleatorizados y analizados. AT: grupo de acetónido de triamcinolona; EMC: edema macular cistoide; EMCS: edema macular clínicamente significativo; FL-AT; grupo de formulación liposomal que contiene 2 mg/ml de AT.
Tabla 2 Características clínicas de los grupos
| AT | FL-AT | Valor p | |
|---|---|---|---|
| n = 27 | n = 28 | ||
| Edad | 57.25 ± 7.0 | 58.39 ± 5.7 | 0.5099 |
| Género | |||
| F | 15 (0.55) | 18 (0.64) | 0.5088 |
| M | 12 (0.45) | 10 (0.36) | |
| Ojo | |||
| OD | 13 (0.48) | 13 (0.46) | 0.8983 |
| OI | 14 (0.52) | 15 (0.54) |
AT: grupo acetónido de triamcinolona; F: femenino; FL-AT: grupo de formulación liposomal que contiene 2 mg/ml de AT; OD: ojo derecho; OI: ojo izquierdo.
Con respecto a los resultados de tolerabilidad y seguridad, observamos que la FL-AT fue bien tolerada durante el periodo de estudio. No se informaron EA oculares (aumento de la presión intraocular, anomalías de la superficie ocular) o sistémicos. Ninguno de los pacientes mostró un aumento significativo de la PIO. De hecho, se observó una reducción significativa de la PIO en los grupos de AT y FL-AT. Los niveles de PIO disminuyeron de 15.11 ± 3.25 a 12.88 ± 3.02 en la semana 6 en el grupo de AT, y de 15.71 ± 2.20 a 12.89 ± 2.69 en la semana 6 en el grupo de FL-AT (Tabla 3). Ninguno de los pacientes requirió fármacos reductores de la PIO. Ninguno de los pacientes mostró signos de irritación o problemas de superficie debido a la formulación del estudio hasta el final del estudio (Fig. 2).
Tabla 3 Diferencias dentro de los grupos de agudeza visual, sensibilidad al contraste, grosor macular y volumen macular total
| Basal | 6 s | 12 s | Valor p | ||
|---|---|---|---|---|---|
| Agudeza visual (logMAR) | AT | 0.054 ± 0.148 | 0.072 ± 0.189 | 0.077 ± 0.195 | 0.9779 |
| FL-AT | 0.252 ± 0.248 | 0.03 ± 0.142 | 0.005 ± 0.136 | < 0.0001 | |
| Sensibilidad al contraste (1/contraste) | AT | 1.214 ± 0.219 | 1.194 ± 0.173 | 1.229 ± 0.178 | 0.513 |
| FL-AT | 1.087 ± 0.339 | 1.217 ± 0.191 | 1.266 ± 0.147 | 0.0346 | |
| GFC (mm) | AT | 258.33 ± 32.50 | 275.37 ± 43.22 | 275.38 ± 47.26 | 0.0143 |
| FL-AT | 256.21 ± 15.16 | 266.42 ± 16.06 | 265.92 ± 18.55 | < 0.0001 | |
| VMT (mm3) | AT | 10.14 ± 0.70 | 10.41 ± 0.58 | 10.52 ± 0.69 | 0.031 |
| FL-AT | 10.08 ± 0.71 | 10.55 ± 0.52 | 10.50 ± 0.52 | < 0.0001 | |
| PIO (mmHg) | AT | 15.11 ± 3.25 | 12.88 ± 3.02 | 13.52 ± 2.50 | 0.0193 |
| FL-AT | 15.71 ± 2.20 | 12.89 ± 2.69 | 13.50 ± 1.93 | 0.0193 |
AT: grupo de acetónido de triamcinolona; FL-AT: grupo de la formulación liposomal que contiene 2 mg / ml de AT; GFC: grosor foveal central; logMAR: logaritmo del ángulo mínimo de resolución; PIO: presión intraocular; s: semana; VMT: volumen macular total.
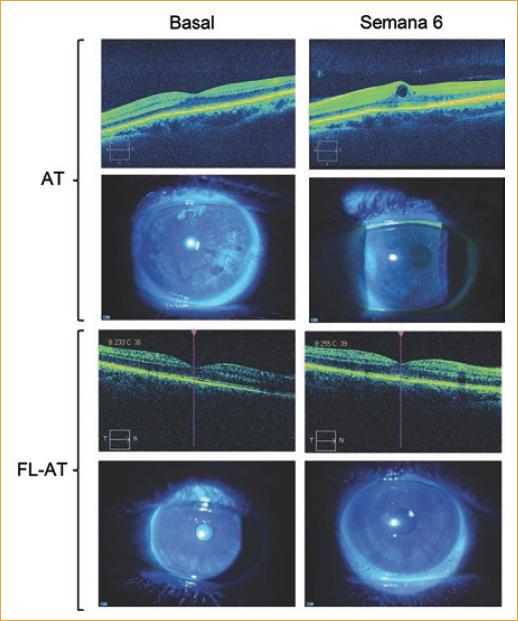
Figura 2 Casos representativos. Imágenes basales y postoperatorias de tinción con fluoresceína e imágenes de OCT en los grupos de AT y FL-AT. Las imágenes tomográficas en el grupo de AT corresponden a uno de los seis casos con EMCS, mientras que las imágenes tomográficas en el grupo de FL-AT corresponden al único caso de EMC. Como mostramos en las fotografías, no se observaron eventos adversos en la superficie ocular mediante tinción con fluoresceína a las 6 semanas de seguimiento en ningún grupo. AT: grupo de acetónido de triamcinolona; EMC: edema macular cistoide; EMCS: edema macular clínicamente significativo; FL-AT: grupo de formulación liposomal que contiene 2 mg/ml de AT.
Por otro lado, como se esperaba, hubo un aumento significativo del GFC y del VMT postoperatorios, en comparación con los valores preoperatorios, en ambos grupos; sin embargo, solo el grupo de FL-AT mostró una mejora significativa de la sensibilidad al contraste (valor basal; 1.087 ± 0.339 frente a la semana 12; 1.266 ± 0.147) y de la agudeza visual en comparación con las mediciones preoperatorias (valor basal; 0.252 ± 0.248 frente a la semana 12; 0.005 ± 0.136). La tabla 3 resume el análisis de variables dentro de los grupos.
El análisis de eficacia entre los grupos mostró que los pacientes tratados con FL-AT tuvieron el grosor macular postoperatorio más bajo y la mejor AVMC y sensibilidad al contraste después de la corrección para las mediciones basales (Tabla 4); sin embargo, estos hallazgos no fueron estadísticamente diferentes en comparación con el grupo de AT. No hubo diferencias estadísticamente significativas del VMT y la PIO entre los grupos de AT y FL-AT en ningún caso. Las diferencias entre los grupos en agudeza visual, SC, grosor macular, VMT y PIO se Resumen en la tabla 4.
Tabla 4 Diferencias dentro de los grupos en agudeza visual, sensibilidad al contraste, grosor macular y VMT
| Parámetro | AT | FL-AT | Valor p | |
|---|---|---|---|---|
| Agudeza visual (logMAR) | Basal | 0.054 ± 0.148 | 0.252 ± 0.248 | 0.000791 |
| 6 s | 0.072 ± 0.189 | 0.03 ± 0.142 | 0.349688 | |
| 12 s | 0.077 ± 0.195 | 0.005 ± 0.136 | 0.135063 | |
| Sensibilidad al contraste (1/contraste) | Basal | 1.214 ± 0.219 | 1.087 ± 0.339 | 0.105633 |
| 6 s | 1.194 ± 0.173 | 1.217 ± 0.191 | 0.637007 | |
| 12 s | 1.229 ± 0.178 | 1.266 ± 0.147 | 0.437292 | |
| GFC (μm) | Basal | 258.333 ± 32.504 | 256.214 ±15.164 | 0.756522 |
| 6 s | 275.37±43.229 | 266.428 ± 16.065 | 0.310517 | |
| 12 s | 275.38 ± 47.267 | 265.928 ± 18.553 | 0.338887 | |
| VMT (mm3) | Basal | 10.14± 0.707 | 10.085 ± 0.711 | 0.774737 |
| 6 s | 10.414 ± 0.584 | 10.557 ± 0.52 | 0.343936 | |
| 12 s | 10.52± 0.697 | 10.503 ± 0.52 | 0.886292 | |
| PIO (mmHg) | Basal | 15.11 ± 3.25 | 15.71 ± 2.2 | 0.424754 |
| 6 s | 12.88 ± 3.02 | 12.89 ± 2.69 | 0.989694 | |
| 12 s | 13.52 ± 2.5 | 13.5 ± 1.93 | 0.974905 |
AT: grupo acetónido de triamcinolona; FL-AT: grupo de formulación liposomal que contiene 2 mg/ml de AT; GFC: grosor foveal central; logMAR: logaritmo del ángulo mínimo de resolución; PIO: presión intraocular; s: semana; VMT: volumen macular total.
Es importante mencionar que el GFC y el VMT se correlacionan significativamente con la sensibilidad al contraste solo en el grupo de FL-AT. El r2 para el GFC y la sensibilidad al contraste fue de 0.1675 (p = 0.0306), mientras que el r2 para el VMT y la SC fue de 0.1675 (p = 0.0055) (Tabla 5).
Tabla 5 Correlación entre el GFC y el VMT con la agudeza visual y la sensibilidad al contraste en los grupos de AT y FL-AT
| Agudeza visual (logMAR) | Sensibilidad al contraste (1/contraste) | ||||
|---|---|---|---|---|---|
| r2 | Valor de p | r2 | Valor de p | ||
| AT | GFC | 0.04249 | 0.3023 | 0.01382 | 0.854 |
| VMT | 0.00008 | 0.9629 | 0.01236 | 0.5809 | |
| FL-AT | GFC | 0.1036 | 0.0948 | 0.1675 | 0.0306 |
| VMT | 0.06301 | 0.1976 | 0.2605 | 0.0055 | |
AT: grupo de acetónido de triamcinolona; FL-AT: grupo de formulación liposomal que contiene 2 mg/ml de AT; GFC: grosor foveal central; logMar: logaritmo del ángulo mínimo de resolución; s: semana. VMT: volumen macular total,
Finalmente, encontramos que la FL-AT mostró la mejor acción preventiva para el EMCS. Las incidencias de EMC y EMCS en el grupo de AT a las 6 semanas fueron de 3.7 y 22.2%, respectivamente, mientras que la incidencia en el grupo de FL-AT fue de 3.7% y 0% (Tabla 6). Las probabilidades de desarrollar EMCS fueron significativamente mayores en el grupo de AT que en el grupo de FL-AT (OR: 9.44; IC 95%, 1.76 -50.66; p = 0.027). Todos los pacientes con EMCS en el grupo de AT requirieron tratamiento de rescate. La incidencia de EMC se mantuvo sin cambios en los grupos de AT y FL-AT durante el estudio, y no fue estadísticamente significativa en todos los puntos de tiempo (Tabla 6). Las imágenes de OCT de un caso representativo de EMCS en el grupo de AT y las imágenes de OCT del único caso de EMC en el grupo de FL-AT se presentan en la figura 2.
Tabla 6 Incidencia de los valores de EMC y EMCS y relación de probabilidades
| Parámetro | AT | FL-AT | OR (IC 95 %)* | Valor de p |
|---|---|---|---|---|
| Incidencia n/N (%) | Incidencia n/N (%) | |||
| EMC dentro de 6 s | 1/27 (3.7) | 1/28 (3.5) | 1.038 (0.0617-17.48) | 0.97 |
| EMC dentro de 12 s | 1/21 (4.7) | 1/28 (3.5) | 1.33 (0.078- 22.57) | 0.84 |
| EMCS dentro de 6 s | 6/27 (22.2) | 0/28 (0) | 9.44 (1.76-50.66) | 0.027 |
| EMCS dentro de 12 s | 0/21 (0) | 0/28 (0) | 1.325 (0.025-69.52) | 0.88 |
AT: grupo de acetónido de triamcinolona; CI: intervalo de confianza; EMC: edema macular cistoide; EMCS: edema macular clínicamente significativo; FL-AT: grupo de formulación liposomal que contiene 2 mg/ml de AT; OR: relación de probabilidades.
Se presentan las posibilidades de desarrollar EMC y EMCS en el grupo de AT.
Discusión
El EMCP continúa siendo la complicación postoperatoria más frecuente que resulta en deterioro visual después de la cirugía de catarata. Aunque es casi siempre autolimitado40, los casos persistentes y refractarios representan un desafío terapéutico13. Se ha utilizado una amplia gama de agentes farmacológicos para el tratamiento del EMCP, incluidos los esteroides29,41,42 y AINE43-45. Los corticosteroides son potentes moléculas antiangiogénicas y antiinflamatorias que desempeñan un papel importante en el tratamiento de diferentes enfermedades vitreorretinianas debido a su capacidad para regular la expresión de genes clave como el VEGF y la interleucina-646,47. Sin embargo, los corticosteroides tópicos tienen baja penetración al segmento ocular posterior debido a las barreras ocular y hematorretiniana. Por otro lado, las inyecciones intravítreas de esteroides logran concentraciones intraoculares adecuadas ya que evitan las barreras oculares26. El AT intravítreo ha demostrado ser adecuado para el tratamiento del EMCP refractario y de otras enfermedades vitreorretinianas27-30,48-50. Sin embargo, para disminuir los riesgos oculares relacionados con las inyecciones intravítreas de AT y para preservar los beneficios de su uso en el EMCP refractario, es necesario desarrollar estrategias alternativas para la administración de medicamentos.
Un estudio farmacocinético reciente de una nueva formulación tópica de FL-AT informó que esta formulación es capaz de liberar AT de manera eficiente en el vítreo y la retina37. Además, un estudio clínico reciente en pacientes con EMCP refractario mostró que la FL-AT es eficaz para reducir el GFC y mejorar la AVMC en pacientes con esta afección. Fue bien tolerado con un perfil de seguridad adecuado y sin eventos adversos oculares observados o cambios significativos de la PIO38. Estos hallazgos sugieren que la FL-AT tópica podría ser efectiva en el tratamiento de pacientes con EMCP refractario, y que tiene el potencial de sustituir a los esteroides intravítreos. Estos antecedentes nos llevaron a evaluar la eficacia de la FL-AT en la prevención del EMCP en este ensayo clínico. Como se muestra, la FL-AT tuvo la mejor acción preventiva para el EMCS después de FLACS cuando esta formulación se compara con una formulación de esteroides tópicos convencionales (AT al 0.1%). La incidencia de EMCS en el grupo de AT a las 6 semanas fue de 22.2%, en contraste con la incidencia en el grupo de FL-AT de 0%. Como se puede observar, la incidencia de EMCS en el grupo de AT es perceptiblemente mayor en comparación con la incidencia en el grupo de FL-AT. Suponemos que este fenómeno está relacionado con la mayor capacidad de la FL-AT para llegar al vítreo y la retina y liberar AT en dosis terapéuticas. Esta suposición se basa en la equivalencia de los grupos de AT antes y después de FLACS. Además, la incidencia de EMCS después de FLACS (22.2%) difiere mucho en comparación con la incidencia previa de EMCS (0.8%) informada por Ewe, et al.9. Es posible que la mayor incidencia observada en nuestra serie se deba a la definición operativa de EMCS utilizada en nuestro estudio25. Ewe, et al., definieron el EMCS como una agudeza visual deficiente inesperada (es decir, falta de mejora postoperatoria) o deterioro de la agudeza visual (en comparación con visitas anteriores), ya sea en el examen de 3 a 4 semanas o en cualquier visita posterior, con evidencia de EMC mediante examen de fondo de ojo, OCT de dominio espectral (SD-OCT) o angiografía con fluoresceína9. Por otro lado, nosotros utilizamos la definición de EMCS propuesta en el ensayo multicéntrico europeo de la prevención del EMC después de cirugía de catarata en no diabéticos (ESCRS PREMED). Este ensayo es un gran estudio multicéntrico de gran impacto para evaluar la acción preventiva de los AINE y los esteroides como monoterapia o terapia combinada para el EMCP25. En este trabajo, la definición de EMCS fue edema macular (aumento del grosor macular medio del subcampo central de 10% o más en comparación con el valor basal, con cambios quísticos mediante SD-OCT), con una mejora de menos de 0.2 logMAR de AVMC en comparación con el valor basal preoperatorio25.
Además, el uso de la formulación convencional de esteroides aumentó el riesgo de EMCS, con un OR de 9.44 (IC de 95%: 1.76 -50.66; p = 0.027) cuando esta solución se comparó con la nueva FL-AT. Estos resultados sugieren que la FL-AT supera la actividad terapéutica de la formulación convencional de esteroides tópicos. Curiosamente, el aumento de la PIO, un efecto adverso común de los esteroides tópicos, no se observó en ningún grupo tratado con la formulación de esteroides tópicos convencionales o la formulación de esteroides liposomales. Quizás el tiempo de uso del medicamento fue relativamente corto (15 días) para inducir este efecto no deseado. De hecho, la PIO disminuyó significativamente después de la cirugía de catarata. Este fenómeno no es inesperado, ya que es bien sabido que la cirugía de catarata reduce la presión intraocular en alrededor de 1.5 a 4 mmHg51. El mecanismo de este efecto no está claro, pero parece estar relacionado con los cambios anatómicos y fisiológicos inducidos por la cirugía de cristalino52.
En comparación con estudios previos que utilizan otros esteroides tópicos, la FL-AT sigue siendo terapéuticamente superior. Por ejemplo, un estudio retrospectivo que comparó los esteroides tópicos para la prevención del EMCP (definido como edema macular anatómico nuevo o que empeora, o engrosamiento demostrado mediante OCT) informó una diferencia no significativa en la tasa de EMC postoperatorio en pacientes que reciben acetato de prednisolona al 1% y fosfato sódico de dexametasona al 0.1% (4.0 vs. 4.1%, p = 0.94)22, mientras que en un gran estudio prospectivo, la incidencia de EMCS fue de 5.1% para el fosfato sódico de dexametasona al 0.1%. En cualquier caso, la incidencia de EMC es menor que con FL-AT25, presumiblemente debido al uso de liposomas.
Las gotas oculares basadas en liposomas se han propuesto como un nuevo sistema de administración de medicamentos para el segmento posterior del ojo, con el potencial de administrar medicamentos a concentraciones terapéuticas en la cavidad vítrea y la retina37. Los liposomas son partículas compuestas de un núcleo acuoso delimitado por una bicapa lipídica similar a una membrana que actúa como portador de fármacos anfifílicos, solubles en lípidos y solubles en agua53-56. Los LP no son tóxicos, son poco antigénicos, se metabolizan fácilmente y son biodegradables57, y se han utilizado para mejorar el transporte de fármacos y la biodisponibilidad en los tejidos oculares58,59. Los hallazgos de este estudio respaldan el potencial de los liposomas para aumentar la biodisponibilidad (con base en su eficiencia terapéutica superior), así como su seguridad, ya que ninguno de los pacientes mostró signos de irritación o problemas en la superficie, ni aumentos significativos de PIO secundarios a la formulación del estudio. Sin embargo, se deben realizar estudios complementarios para confirmar estos hallazgos.
Es interesante notar que los pacientes tratados con FL-AT tuvieron el grosor macular postoperatorio más bajo y la mejor AVMC y sensibilidad al contraste después de la corrección para las mediciones basales (Tabla 3); sin embargo, estos hallazgos no fueron estadísticamente significativos en comparación con el grupo de AT. Es posible que en estudios posteriores con tamaños de muestra más grandes, se puedan lograr diferencias significativas. Esta posibilidad es de gran interés para la cirugía de cristalino moderna, especialmente en la cirugía de cristalino para presbicia, donde el objetivo principal es la calidad visual.
Finalmente, hay varias limitaciones en nuestro estudio. Primero, la falta de un grupo control es una preocupación importante, pero debido a consideraciones éticas, no se consideró un grupo placebo. La segunda limitación importante de nuestro estudio es el pequeño tamaño de la muestra.
En conclusión, la formulación liposómica cargada con AT es efectiva para la prevención del EMCS asociado con FLACS, y parece que su actividad terapéutica podría ser superior a la actividad de las formulaciones de esteroides tópicos convencionales. Sin embargo, se debe considerar realizar más estudios.











 nova página do texto(beta)
nova página do texto(beta)


