Introducción
Los hongos micorrizógenos arbusculares (HMA) del Phylum Glomeromycota (Schüßler et al., 2001) forman una asociación simbiótica mutualista con el 72 % de las familias de plantas en los ecosistemas terrestres (Brundrett y Tedersoo, 2018). En esta asociación, los HMA contribuyen de forma significativa a la nutrición de las plantas, aportándoles nutrimentos minerales como el fósforo, nitrógeno y otros micronutrimentos poco móviles presentes en la solución del suelo. De esta manera, los HMA aportan mayor tolerancia a las plantas ante condiciones bióticas (e.g. plagas y enfermedades) y abióticas (e.g. acidez, sequía) adversas; a cambio los HMA reciben de la planta carbohidratos y lípidos que les permiten realizar su metabolismo y complementar su ciclo de vida (Smith y Read, 2008; Keymer et al., 2017). Los HMA son un componente fúngico importante para el funcionamiento de los ecosistemas terrestres ya que influyen en la agregación del suelo, la diversidad florística y en la productividad vegetal (Rillig, 2004; Van Der Heijden et al., 2008). En consecuencia, la asociación micorrízica arbuscular y la diversidad de HMA se han investigado en una amplia variedad de ecosistemas a nivel global (Turrini y Giovanneti, 2012; Brundrett y Tedersoo, 2018). En el caso de México, se tienen registros principalmente de ecosistemas transformados para la agricultura, sin embargo, en años recientes se ha presentado un avance importante en el estudio de la simbiosis micorrízica arbuscular y sus registros en ecosistemas naturales como selvas tropicales lluviosas y secas, desiertos, humedales, bosques mesófilos de montaña y bosques templados (Montaño et al., 2012). Sin embargo, en los bosques templados son escasas las investigaciones sobre la condición micorrízica de las plantas y las comunidades de HMA, a pesar que cubren casi el 20 % del territorio mexicano y brindan múltiples servicios ecosistémicos importantes para nuestro bienestar y sobrevivencia (Challenger, 2003; Sarukhán et al., 2009). Los ecosistemas templados se caracterizan por su alta diversidad y endemismos de especies vegetales de los géneros Quercus L. y Pinus L., México es un importante centro de diversificación de estos taxa vegetales (Challenger, 2003; Valencia, 2004; Sánchez-González, 2007). Asimismo, en el sotobosque hay una amplia diversidad de especies vegetales herbáceas y arbustivas de diversas familias como Acanthaceae, Asteraceae, Brassicaceae, Compositae, Crassulaceae, Lamiaceae, Leguminosae, Plantaginaceae, Poaceae, Pteridaceae, Rubiaceae, Selaginaceae, Solanaceae, entre otras (Challenger, 2003) que constituyen un recurso no maderable importante, muchas de estas especies son medicinales con propiedades antiinflamatorias, antibacterianas, astringentes o antihemorrágicas (Yan et al., 2013).
Actualmente se reconoce que los HMA son un componente importante en la rizosfera de las plantas medicinales ya que pueden tener efectos sobre su metabolismo secundario e influir en la producción y acumulación de ingredientes activos como terpenos, fenoles y alcaloides en la biomasa de las plantas medicinales (Yan et al., 2013). Por ejemplo, Thokchom et al. (2020) detectaron que Rhizophagus intraradices incrementó la concentración de eugenol y otros terpenoides de importancia médica en plantas micorrizadas de Ocimum tenuiflorum L. De igual manera, Chen et al. (2013) reportaron que en plantas de Cucumis sativus L. inoculadas con Funneliformis mosseae y bajo condiciones de estrés (bajas temperaturas 10-15 °C), el contenido de metabolitos secundarios de la planta mejoró significativamente, esto sugiere, que es fundamental reconocer la estructura e identidad de la comunidad de HMA para su uso potencial como inoculantes de plantas medicinales que, además de promover su crecimiento, tengan un efecto positivo en su metabolismo secundario. Los objetivos de este trabajo fueron evaluar la colonización micorrízica y las comunidades de HMA asociadas a la rizosfera de plantas medicinales en un bosque de pino-encino en Taxco, Guerrero.
Materiales y métodos
Área de estudio
La zona de estudio corresponde a un bosque templado de pino-encino ubicado en la localidad “Agua Escondida” (18° 35´13´´N, 99° 39´13´´ O; 2410 msnm) de la Sierra de Taxco, Guerrero, México. La serranía se caracteriza por presentar turbiditas plegadas con abundantes fósiles del Cretácico Tardío, donde aflora un bloque de rocas foliadas constituido por depósitos volcánicos, terrígenos y calizas (Campa-Uranga et al., 2012). El clima es templado subhúmedo (Cm y Cw) con lluvias durante los meses de junio a septiembre. El tipo de suelo corresponde a un Luvisol, aunque para el municipio de Taxco también se encuentran suelos clasificados como Litosol, Cambisol crómico y Phaeozem háplico (INEGI, 2009).
En el bosque de pino-encino se realizaron 5 transectos de 400 m de longitud cubriendo un área aproximada de 2 hectáreas, en donde se ubicaron y seleccionaron 14 especies vegetales registradas como medicinales en la región. De cada especie de planta seleccionada, se recolectó y herborizó material para corroborar su identidad taxonómica en el Herbario de la Facultad de Ciencias, UNAM. Para la escritura correcta de los nombres de las especies y sus familias botánicas se consultó el sitio web “The Plant List” http://www.theplantlist.org/.
Muestreo de suelo y raíces
De cada especie de planta se eligieron cinco individuos, separados a una distancia aproximada de cinco metros entre ellos. De cada individuo, se recolectó una muestra de raíces finas, las cuales fueron colocadas en recipientes de plástico con alcohol al 50 % y se etiquetaron con los datos de colecta (fecha, localidad, especie vegetal y número de réplica). Asimismo, se recolectaron muestras de 150 g de suelo rizosférico (0 a 10 cm) de cada individuo en sólo 10 de las 14 especies de plantas medicinales y se guardaron de forma independiente en bolsas de plástico con los datos de colecta. Las muestras se transportaron al Laboratorio de la Unidad de Investigación en Ecología Vegetal de la Facultad de Estudios Superiores Zaragoza, de la Universidad Nacional Autónoma de México. El suelo se secó a temperatura ambiente en el invernadero, después se mantuvieron a 4 ºC hasta su procesamiento.
Extracción y montaje de esporas de los HMA
Mediante el método de tamizado y decantación en húmedo (Gerdeman y Nicolson, 1963) seguido de centrifugación con una solución de sacarosa al 60 % se realizó la extracción de las esporas de HMA de 50 g de suelo de cada una de las muestras. Con la ayuda de un microscopio de disección (Nikon modelo SMZ660) se realizó la extracción, el conteo y la selección de las esporas de los HMA que fueron montadas en preparaciones permanentes en alcohol polivinílico en lactoglicerol (PVLG) y en una mezcla de PVLG y reactivo de Melzer (1:1) para su determinación taxonómica (Hernández-Cuevas et al., 2008).
Determinación taxonómica de los HMA
Las laminillas permanentes con las esporas de los HMA aisladas, agrupadas y seleccionadas de cada planta medicinal fueron revisadas bajo un microscopio óptico Zeiss, equipado con luz polarizada e iluminación Nomarski que permitió realizar una revisión detallada de sus características morfológicas. Para cada morfotipo de esporas se registró el color, tamaño, presencia/ausencia de hifas, tipos de hifas, número de capas de la pared de la espora, presencia/ausencia de ornamentaciones, reacción o no al reactivo de Melzer de las capas y presencia de escudos de germinación que permitieron una comparación con las especies de HMA descritas a nivel mundial disponibles en las páginas web: https://invam.wvu.edu/ , http://amf-phylogeny.com/ y http://www.zor.zut.edu.pl/Glomeromycota/Taxonomy.html.
Análisis de la estructura de la comunidad de HMA
De cada muestra de suelo analizada se calculó la abundancia total de esporas (N) y su abundancia relativa (A) [A=(n )/N X 100]; donde “n” es el número de esporas de una morfo-especie específica. La riqueza de especies de HMA se cuantificó como el número total de morfo-especies registradas en cada especie vegetal. La diversidad de especies de HMA se estimó con base en los índices de diversidad de Shannon-Winner [H´=-∑pi*ln pi], dominancia de Simpson (D=∑(pi)2) y equidad de Pielou (J´=H´/ln S); en donde pi es la abundancia relativa de la i-enésima especie de HMA, ln es el logaritmo natural y S es la riqueza de especies observada. La similitud de las comunidades de HMA entre las plantas medicinales analizadas se comparó con el índice de similitud de Morisita, que indica el grado de cambio de especies entre las plantas, tomando en cuenta datos cuantitativos de la abundancia relativa de las especies de HMA. Por último, la frecuencia de ocurrencia se calculó como el porcentaje de las muestras de suelo en que una especie de HMA en particular se recuperó en una determinada planta medicinal (Moreno, 2001; Quinn y Keough, 2010).
Tinción de raíces
El método de Phillips y Hayman (1970) fue empleado para blanquear, eliminar el contenido celular y los pigmentos de las raíces; posteriormente la tinción de las estructuras de los HMA dentro de las raíces se realizó con Azul de Tripano (0.05 %) durante 24 h a temperatura ambiente (Hernández-Cuevas et al., 2008).
Colonización micorrízica arbuscular
Las raíces teñidas de las plantas medicinales se colocaron en una caja de Petri con lactoglicerol, se cortaron 15 segmentos de 1 cm de largo, se colocaron en un portaobjetos y se fijaron con PVLG. Las raíces se observaron en un microscopio óptico a 40X, en total se revisaron 45 campos de observación por laminilla, en cada uno se registró las estructuras de los HMA como hifas, vesículas o arbúsculos. El porcentaje de colonización micorrízica arbuscular total se calculó dividiendo el número de campos colonizados entre el número total de campos observados y multiplicado por 100 (Hernández-Cuevas et al., 2008).
Análisis químico del suelo
Los análisis de las propiedades del suelo rizósferico de las plantas medicinales se realizaron siguiendo el protocolo propuesto en la norma oficial mexicana (NOM-021-RECNAT-2000, 2000): 1) el pH del suelo se determinó con potenciómetro en una solución suelo (10 g) y agua desionizada (20 mL) en una relación 1:2 (peso/ volumen), 2) la determinación de la materia orgánica del suelo se realizó con la técnica de Walkley y Black (1934), 3) la determinación del fósforo extraíble para suelos ácidos y neutros se realizó con el procedimiento de Bray y Kurtz (1945) y 4) el porcentaje de nitrógeno total se determinó con el método micro-Kjeldahl.
Análisis estadístico
Los datos correspondientes a las variables de abundancia de esporas, riqueza de especies de HMA, índices de diversidad, porcentaje de colonización micorrízica y propiedades químicas del suelo se analizaron mediante un análisis de varianza (ANOVA) de un factor (especie de planta medicinal). Cuando el ANOVA indicó diferencias estadísticamente significativas (P≤ 0.05), se realizó una prueba de diferencia significativa honesta de Tukey-Kramer (P≤0.05). Para determinar diferencias entre las comunidades de HMA en las plantas medicinales se realizó un análisis de similitud con el índice de Morisita que considera datos cuantitativos de la abundancia; asimismo se generó un dendograma de similitud y para determinar la significancia se aplicó un análisis de similitudes (ANOSIM) de un sólo factor. Para explorar la relación de la composición de especies de HMA con las propiedades del suelo asociado a la rizosfera de las plantas medicinales, se realizó un análisis de correspondencia canónica (Quinn y Keough, 2010). Todos los análisis estadísticos se efectuaron con los programas estadísticos NCSS versión 2019 y PAST v3.25 (Hammer et al., 2001).
Resultados y discusión
Dentro del bosque templado “Agua Escondida” en Taxco, Guerrero, México, catorce especies de plantas medicinales fueron recolectadas y analizadas. Con excepción de una especie que se ubicó en la familia Apiaceae, el resto de las plantas se identificaron taxonómicamente a nivel de especie y pertenecen a las siguientes familias: Brassicaceae (1 sp.), Compositae (5 spp.), Crassulaceae (2 spp.), Lamiaceae (1 sp.), Plantaginaceae (1 sp.), Polemoniaceae (1 sp.), Pteridaceae (1 sp.) y Selaginellaceae (1 sp.) (Figura 1, Tabla 1). A todas las especies de plantas medicinales se les determinó su colonización micorrízica arbuscular y solamente a diez especies se les analizó además su comunidad de hongos micorrizógenos arbusculares asociados a su rizosfera con parámetros de abundancia, riqueza, diversidad y composición de especies.

Figura 1 Plantas medicinales del área de estudio y su colonización micorrízica arbuscular con micelio y vesículas en A: Adiantum capillus-veneris. B: Baccharis conferta. C: Gnaphalium viscosum. D: Senecio stoechadiformis. E: Loeselia mexicana. F: Salvia lavanduloides. G: Selaginella lepidophylla. H: Senecio salignus. I: Sedum oxypetalum. J: Roldana angulifolia. K: Sedum praealtum. L: Lepidium virginicum.
Tabla 1 Plantas medicinales del bosque templado “Agua Escondida” Taxco Guerrero, México con sus porcentajes de colonización micorrízica arbuscular y propiedades químicas del suelo
| Especie vegetal | Colonización Total (%) |
pH (1:2) |
MOS (%) |
Nt (%) |
Pi (mg/Kg) |
| Adiantum capillus-veneris L. (Pteridaceae) | 58.76 | 6.32(±0.3)a | 10(±3.5)a | 0.202(±0.1)a | 1.04(±0.6)b |
| Baccharis conferta Kunth (Compositae) | 34.22 | 6.02(±0.3)a | 6.2(±2.2)ab | 0.14(±0.1)a | 4.51(±3.3)b |
| Lepidium virginicum L. (Brassicaceae) | 30 | Nd | Nd | Nd | Nd |
| Loeselia mexicana (Lam.) Brand (Polemoniaceae) | 40.74 | 6.17(±0.3)a | 1.6(±0.3)bc | 0.1(±0.01)a | 1.64(±0.5)b |
| Plantago major L. (Plantaginaceae) | 49.33 | 7.13(±0.2)a | 1.1(±0.6)bc | 0.14(±0.06)a | 1.08(±0.8)b |
| Gnaphalium viscosum Kunth (Compositae) | 37.65 | 6.2(±0.1)a | 2.3(±0.9)bc | 0.24(±0.1)a | 0.81(±0.7)b |
| Roldana angulifolia (DC.) H.Rob. & Brettell (Compositae) | 35.57 | 6.3 | 9.6 | 0.16 | 0.79 |
| Salvia lavanduloides Kunth (Lamiaceae) | 60.28 | 6.6(±0.1)a | 9.1(±2.1)a | 0.168(±0.09)a | 2.38(±1.2)b |
| Sedum oxypetalum Kunth (Crassulaceae) | 45.77 | 5.84(±0.4)a | 7.4(±2.5)ab | 0.168(±0.09)a | 0.99(±0.9)b |
| Sedum praealtum A. DC. (Crassulaceae) | 23.29 | 6.05 | Nd | 0.63 | 3.34 |
| Selaginella lepidophylla (Hook. & Grev.) Spring (Selaginellaceae) | 31.07 | 6.22(±0.2)a | 13.1(±0.6)a | 0.336(±0.06)a | 0.84(±0.3)b |
| Senecio salignus DC. (Compositae) | 73.33 | 7.02(±0.2)a | 1.5(±0.8)bc | 0.042(±0.02)a | 16.09(±5.1)a |
| Senecio stoechadiformis DC. (Compositae) | 43.81 | 6.52(±0.1)a | 2.0(±0.9)bc | 0.158(±0.1)a | 0.68(±0.2)b |
| Apiaceae “hierba del golpe” | 15.55 | Nd | Nd | Nd | Nd |
MOS: Materia orgánica del suelo. Nt: Nitrógeno total. Pi: Fósforo disponible. Nd: Análisis no determinado. Letras minúsculas diferentes dentro de la misma columna indican diferencias significativas.
Abundancia de esporas
Las plantas medicinales presentaron abundancia promedio por debajo de las 150 esporas por cada 100 g de suelo seco. Sedum oxypetalum presentó el valor más bajo (27.6) mientras que Senecio salignus tuvo la mayor abundancia de esporas (140.8). Aunque en el análisis de varianza (ANOVA) no se detectaron diferencias significativas en la abundancia de esporas en la rizosfera de las diez plantas medicinales (Figura 2).
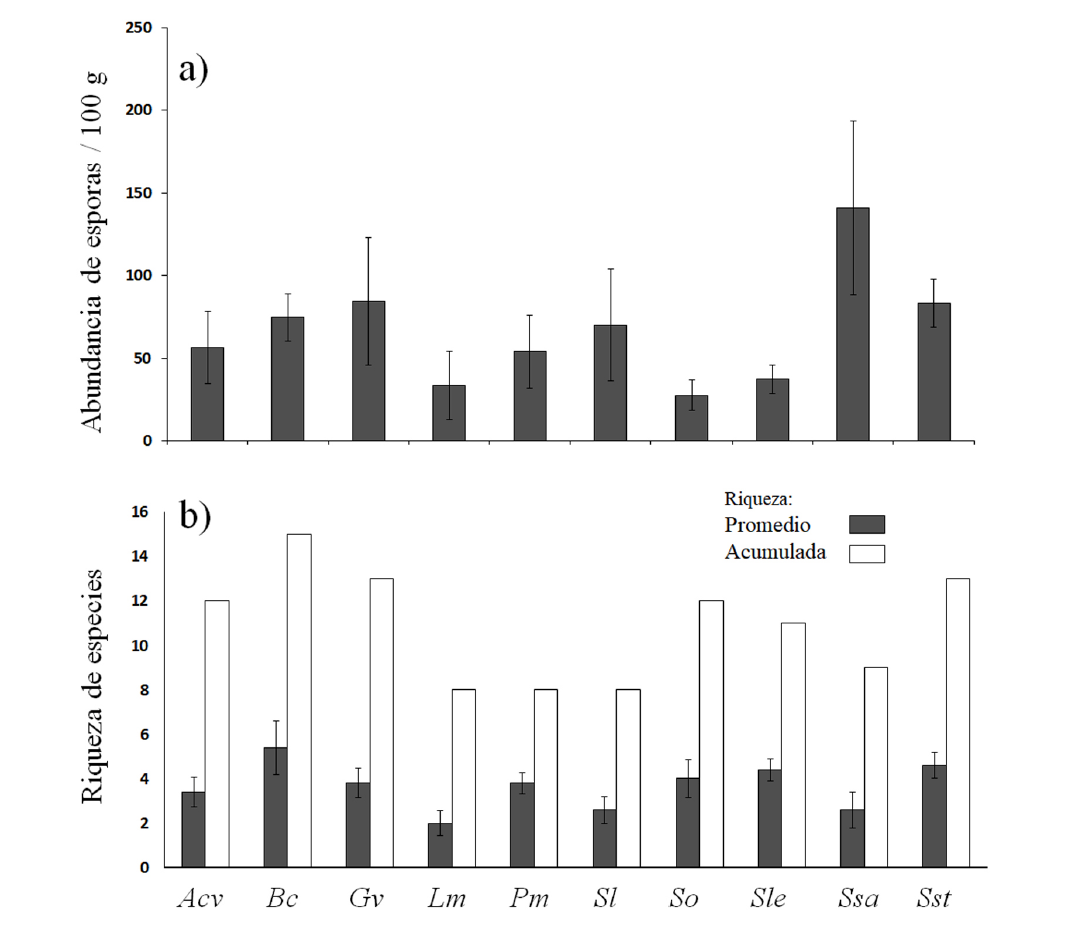
Figura 2 Abundancia de esporas (a) y riqueza de especies (b) de hongos micorrizógenos arbusculares asociadas a la rizosfera de plantas medicinales del bosque templado “Agua Escondida” de Taxco Guerrero, México. Acv: Adiantum capillus-veneris. Bc: Baccharis conferta. Gv: Gnaphalium viscosum. Lm: Loeselia Mexicana. Pm: Plantago major. Sl: Salvia lavanduloides. So: Sedum oxypetalum. Sle: Selaginella lepidophyla. Ssa: Senecio salignus. Sst: Senecio stoechadiformis.
Riqueza de especies de HMA
El ANOVA indicó que no hay diferencias significativas en la riqueza de especies promedio en las plantas medicinales (Figura 2). Sin embargo, desde un análisis cualitativo, la riqueza acumulada y observada sugiere que Baccharis conferta (15 spp.), Gnaphalium viscosum (13 spp.), Senecio stoechadiformis (13 spp.) presentaron la mayor riqueza de especies y que Sedum oxypetalum (12 spp.), Adiantum capillus-veneris (12 spp.) y Selaginella lepidophyla (11 spp.) tuvieron una riqueza intermedia, mientras que Loeselia mexicana, Plantago major, Salvia lavanduloide (8 spp., c/u) y Senecio salignus (9 spp.), fueron las plantas medicinales con la menor riqueza de especies en su rizosfera (Figura 2). Un total de 30 morfoespecies de HMA fueron distinguidas en las diez especies de plantas medicinales. La riqueza se distribuyó en un 40 % en la familia Acaulosporaceae seguido de las familias Gigasporaceae y Glomeraceae que aportaron cada una un 16.6 % de las especies, Claroideoglomeraceae con un 10%, Ambisporaceae y Diversisporaceae cada una con 6.7 % y por último, la familia Entrophosporaceae con 3.3 % de las especies. La mayoría de las especies de HMA presentaron una frecuencia de ocurrencia (FO) del 20 al 40 %; mientras que ciertas especies de HMA tuvieron una FO del 60 o del 80 % en determinadas plantas medicinales (Tabla 2, Figura 3).
Tabla 2 Riqueza de especies y frecuencia de ocurrencia de hongos micorrizógenos arbusculares asociados a la rizosfera de plantas medicinales del bosque templado “Agua Escondida”
| Especie hongo micorrizógeno arbuscular | Frecuencia de ocurrencia (%) | |||||||||
| Acv | Bc | Gv | Lm | Pm | Sl | So | Sle | Ssa | Sst | |
| Acaulospora aff. cavernata Blaszk | 0 | 20 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| A. aff. undulata Sieverd | 0 | 0 | 0 | 0 | 0 | 0 | 40 | 20 | 0 | 0 |
| A. alpina Oehl, Sýkorova & Sieverd | 80 | 20 | 0 | 0 | 0 | 0 | 0 | 40 | 0 | 20 |
| A. bireticulata F.M. Rothwell & Trappe | 0 | 60 | 40 | 20 | 80 | 60 | 20 | 20 | 40 | 60 |
| A. denticulata Sieverd. & S. Toro | 20 | 0 | 20 | 0 | 0 | 0 | 20 | 80 | 20 | 40 |
| A. koskei Blaszk | 20 | 20 | 40 | 0 | 40 | 20 | 20 | 0 | 0 | 20 |
| A. laevis Gerd. & Trappe | 20 | 60 | 40 | 20 | 40 | 40 | 40 | 0 | 40 | 40 |
| A. morrowiae Spain & N. C. Schenck | 0 | 0 | 60 | 40 | 100 | 20 | 0 | 0 | 20 | 40 |
| A. scrobiculata Trappe | 20 | 60 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Acaulospora sp. 1 | 0 | 0 | 0 | 0 | 20 | 0 | 0 | 0 | 0 | 0 |
| Acaulospora sp. 2 | 0 | 0 | 0 | 0 | 20 | 0 | 40 | 20 | 0 | 0 |
| A. spinosa C. Walker & Trappe | 20 | 40 | 20 | 20 | 40 | 20 | 40 | 60 | 0 | 40 |
| Ambispora appendicula C. Walker | 20 | 20 | 20 | 0 | 0 | 0 | 40 | 60 | 0 | 80 |
| A. fennica C. Walker, Vestberg & Schuessler | 20 | 60 | 0 | 20 | 0 | 20 | 20 | 80 | 20 | 20 |
| Entrophospora infrequens Ames & Schneid | 0 | 20 | 0 | 20 | 20 | 0 | 0 | 0 | 0 | 0 |
| Claroideoglomus claroideum Walker & Schuessler | 20 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 20 | 0 |
| C. aff. drummondii Walker & Schuessler | 0 | 0 | 20 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| C. etunicatum Walker & Schuessler | 0 | 0 | 20 | 0 | 0 | 0 | 0 | 20 | 40 | 0 |
| Diversispora arenaria Oehl, G.A. Silva & Sieverd. | 0 | 0 | 20 | 0 | 0 | 0 | 0 | 20 | 0 | 0 |
| D. aff. trimurales Walker & Schuessler | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 20 | 0 |
| Gigaspora decipiens I. R. Hall & L. K. Abbott | 0 | 0 | 0 | 20 | 0 | 0 | 80 | 20 | 40 | 0 |
| G. gigantea Gerd. & Trappe | 0 | 20 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| G. margarita W. N. Becker & I. R. Hall | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 20 |
| Scutellospora dipurpurescens J.B. Morton & Koske | 0 | 60 | 20 | 40 | 0 | 0 | 20 | 0 | 0 | 0 |
| S. scutata C. Walker & Dieder | 0 | 0 | 20 | 0 | 0 | 0 | 20 | 0 | 0 | 40 |
| Funneliformis aff. geosporum Walker & Schuessler | 20 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| F. aff. monosporum Oehl, G.A. Silva & Sieverd. | 0 | 20 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| F. halonatum Oehl, G.A. Silva & Sieverd. | 60 | 20 | 40 | 0 | 0 | 60 | 0 | 0 | 0 | 20 |
| Glomus macrocarpum Tul. & C. Tul. | 20 | 20 | 0 | 0 | 0 | 20 | 0 | 0 | 0 | 0 |
| Sclerocystis rubiformis Gerd. & Trappe | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 20 |
| Riqueza de especies total | 12 | 15 | 13 | 8 | 8 | 8 | 12 | 11 | 9 | 13 |
Acv: Adiantum capillus-veneris. Bc: Baccharis conferta. Gv: Gnaphalium viscosum. Lm: Loeselia Mexicana. Pm: Plantago major. Sl: Salvia lavanduloides. So: Sedum oxypetalum. Sle: Selaginella lepidophyla. Ssa: Senecio salignus. Sst: Senecio stoechadiformis.
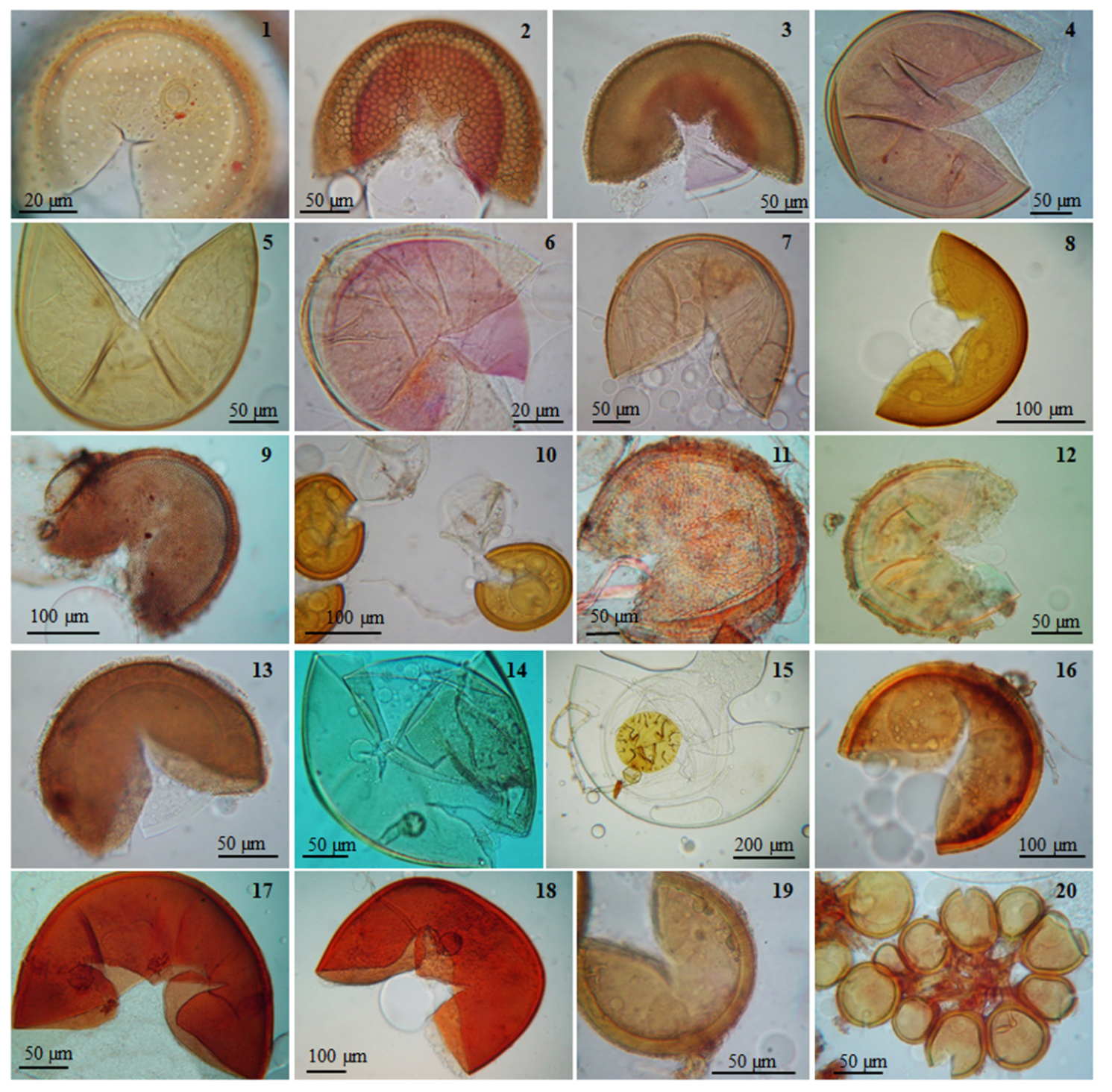
Figura 3 Imágenes de las especies de hongos micorrizógenos arbusculares detectadas en la rizosfera de plantas medicinales del área de estudio. 1: Acaulospora alpina. 2: A. bireticulata. 3: A. denticulata. 4: A. koskei. 5: A. laevis. 6: A. morrowiae. 7: A. spinosa. 8: A. aff. cavernata. 9: Acaulospora sp. 1. 10: Acaulospora sp. 2. 11: Ambispora appendicula. 12: A. fennica. 13: Entrophospora infrequens. 14: Scutellospora dipurpurenscens. 15: S. scutata. 16: Gigaspora decipiens. 17: G. gigantea. 18: G. margarita. 19: Funneliformis halonatum. 20:Sclerocystis rubiformis.
Diversidad
Los valores del índice de diversidad de Shanon-Wienner variaron desde 0.51 en S. salignus hasta un valor máximo de 1.16 en S. lepidophylla. En el caso del índice de dominancia de Simpson los valores registrados fueron entre 0.37 para S. oxypetalum y 0.72 para S. salignus. Mientras que para los valores del índice de equidad de Pielou estos variaron entre 0.42 para S. salignus y 0.86 para S. oxypetalum. Sin embargo, en todos los casos, en el ANOVA no se detectaron diferencias significativas en los valores de diversidad calculados para las plantas medicinales (Figura 4).
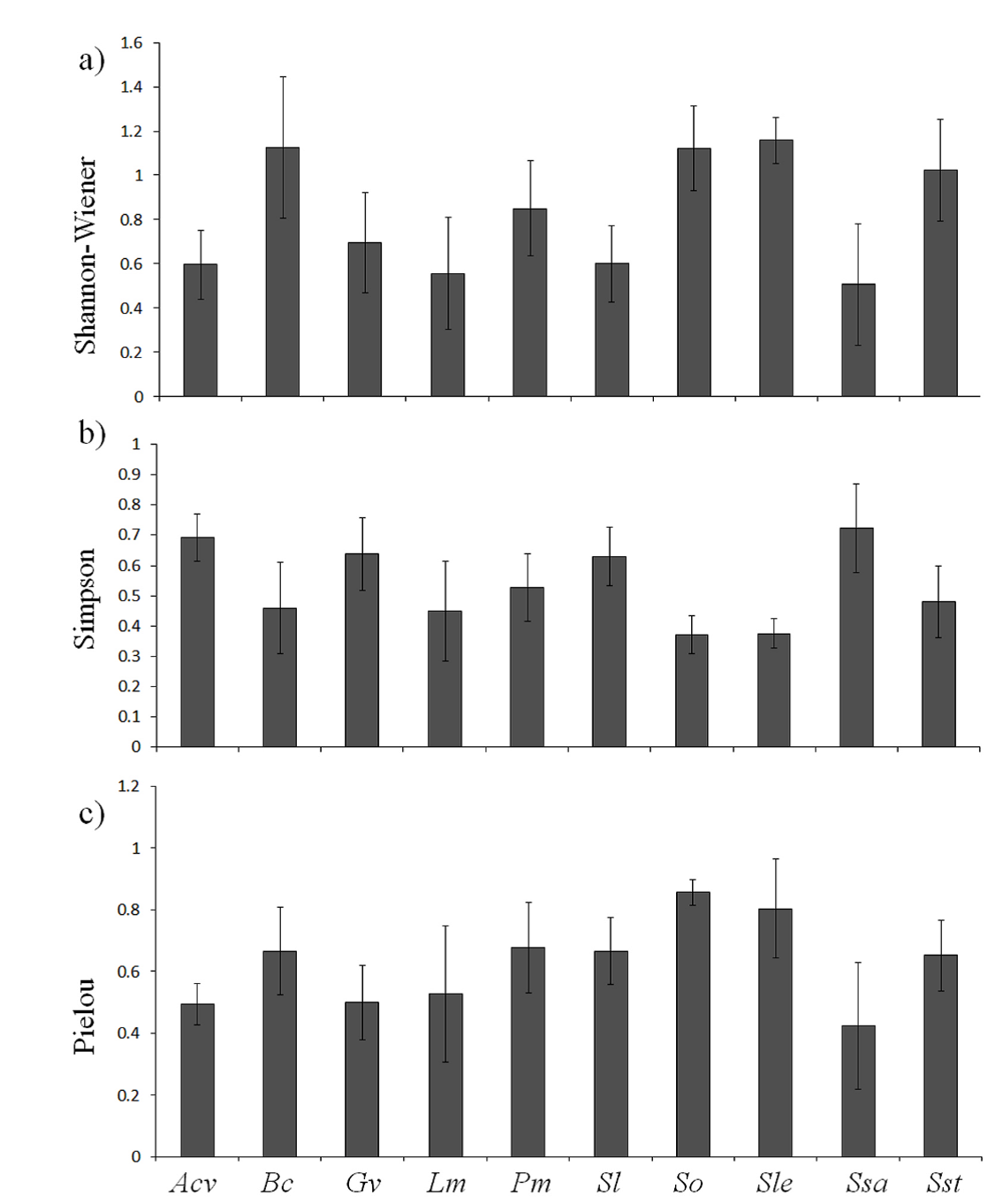
Figura 4 Diversidad de la comunidad de las esporas de hongos micorrizógenos arbusculares detectados en la rizósfera de plantas medicinales del área de estudio. a: Shannon-Wiener. b: dominancia de Simpson. c: equidad de Pielou. Acv: Adiantum capillusveneris. Bc: Baccharis conferta. Gv: Gnaphalium viscosum. Lm: Loeselia Mexicana. Pm: Plantago major. Sl: Salvia lavanduloides. So: Sedum oxypetalum. Sle: Selaginella lepidophyla. Ssa: Senecio salignus. Sst: Senecio stoechadiformis.
Composición de especies
De acuerdo al análisis de similitud (ANOSIM; P=0.0001) con el índice de Morisita se distinguieron cuatro grupos entre las plantas medicinales de acuerdo a su composición de especies de HMA asociados a su rizósfera (Figura 5). El primer grupo lo formaron S. oxypetalum, S. lepidophylla y S. salignus; el segundo estuvo conformado por G. viscosum, P. major y S. stoechadiformis; el tercero se formó con las plantas medicinales L. mexicana, S. lavanduloides y B. conferta; mientras que el cuarto sólo estuvo conformado con el helecho A. capillusveneris. Las plantas que conformaron el grupo II ó el grupo III presentaron una composición de especies de HMA con la mayor similitud (75-85 %) dentro del grupo; pero baja similitud entre los grupos II y III que representó sólo el 37 %. El grupo I tuvo una composición de especies de HMA que fue diferente en un 50 % entre S. oxypetalum y S. lepidophylla hasta un 75 % de estas dos especies de plantas medicinales con respecto de S. salignus. Por último, la composición de especies de HMA en A. capillus-veneris sólo presentó un 12 % de similitud con las otras especies de plantas en los grupos I, II y III.
Colonización micorrízica
Las catorce plantas medicinales analizadas presentaron estructuras características de los hongos micorrizógenos arbusculares (micelio cenocítico y vesículas asociadas a las raíces). Los porcentajes de colonización micorrízica variaron de bajos (< 25 %) para S. praealtum y Apiaceae hasta valores altos (58-73 %) en A. capillus-veneris, S. lavanduloides y S. salignus; mientras que las otras especies de plantas medicinales analizadas presentaron valores intermedios entre 30 y 45 % (Figura 1, Tabla 1).
Propiedades del suelo
El pH del suelo no varió entre las muestras de suelo rizosférico de las plantas medicinales (F = 2.04, P = 0.11). Los valores de pH del suelo asociado a la rizosfera de las plantas medicinales fueron de ligeramente ácido (5.8) en S. oxypetalum a un suelo con un pH neutro (7.1) en P. major (Tabla 1). El porcentaje de materia orgánica del suelo (MOS) fue diferente entre el suelo rizosférico de las plantas medicinales (F = 5.75, P = 0.0019); de esta manera en la rizósfera de S. lepidophyla se detectó un suelo con alto contenido de MOS (> 11 %), A. capillus-veneris, B. conferta, S. lavanduloides y S. oxypetalum registraron un suelo con niveles medios de MOS (6.1-10.9 %); mientras que el resto de las plantas analizadas tuvieron niveles muy bajos (< 4.0) (Tabla 1). El porcentaje de nitrógeno total (Nt) no presentó diferencias significativas (F = 1.4162, P = 0.2698) y la mayoría de las plantas registraron un suelo con bajo contenido de Nt. Los valores promedios variaron entre 0.04 % para S. salignus hasta un valor máximo de 0.33 % en S. lepidophyla (Tabla 1). El ANOVA indicó diferencias significativas (F = 4.2183, P = 0.008) en la concentración de fósforo disponible en el suelo de las plantas medicinales (Tabla 1). En general el fósforo disponible en el suelo rizosférico de todas las plantas medicinales fue muy bajo (< 4.0 mg kg-1) y únicamente S. salignus presentó valores medios (> 15 mg kg-1) de este macronutrimento.
Relación composición especies HMA y propiedades del suelo
El análisis de correspondencia canónica explicó el 85 % de la varianza y ordenó distintamente las diez plantas medicinales en función de la composición de especies de HMA y de las propiedades químicas del suelo analizadas. El fósforo disponible, el nitrógeno total y el pH estuvieron asociados al primer eje con un 53 % de la varianza explicada; mientras que la materia orgánica del suelo fue la variable asociada con el segundo eje explicando el 32 % de la varianza restante. De esta manera, el ordenamiento generó tres grupos, en el primero la composición de especies de HMA en Senecio salignus con la mayor concentración de fósforo disponible, este grupo es diferente a las otras nueve especies de plantas medicinales debido a la baja disponibilidad de fósforo y un suelo ligeramente ácido. Por lo tanto, el ACC también ordenó la composición de especies de HMA en éstas nueve especies medicinales restantes en dos grupos en función a la concentración de la materia orgánica en el suelo (Figura 6).
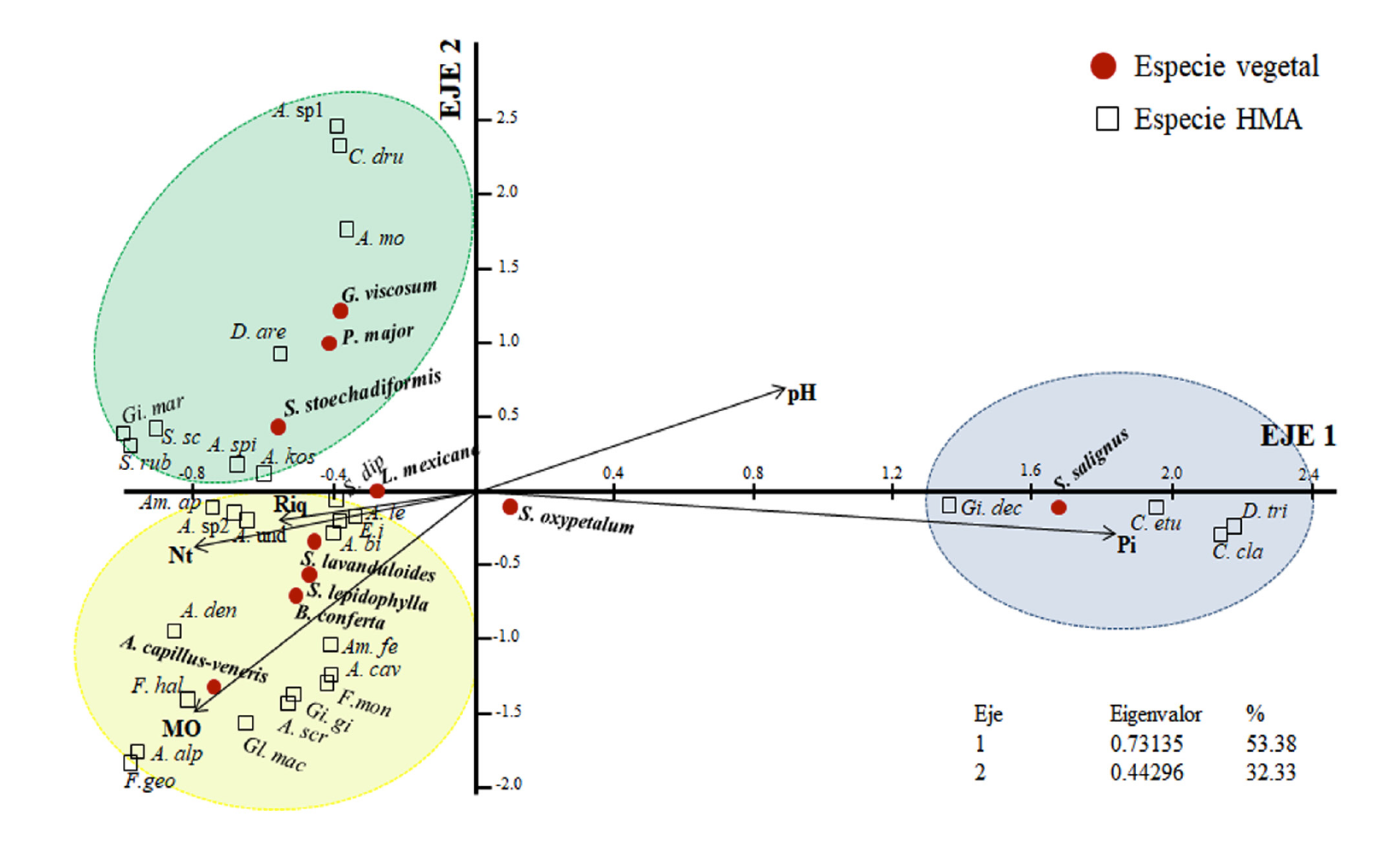
Figura 6 Relación de la composición de la comunidad de hongos micorrizógenos arbusculares con las propiedades del suelo en la rizosfera de plantas medicinales del bosque templado.
Los resultados de esta investigación contribuyen al conocimiento florístico de 14 plantas medicinales del bosque templado de pino-encino en la localidad de Agua Escondida, Taxco Guerrero, México. Asimismo, proporciona información sobre las interacciones que establecen estas plantas con los hongos micorrizógenos arbusculares. De los análisis, se reporta que todas las plantas medicinales estudiadas presentaron colonización micorrízica arbuscular (Figura 1, Tabla1). La mayoría se ubicó en familias botánicas que comúnmente forman micorriza arbuscular (De la Rosa-Mera et al., 2012; Yan et al., 2013; Piszczek et al., 2019), aunque hay que destacar que Lepidium virginicum (Brassicaceae), Sedum oxypetalum y S. praealtum (Crassulaceae) con porcentajes de colonización menor al 30 %, corresponden a especies que pertenecen a familias reportadas como no micorrízicas (Brundrett, 2009; Brundrett y Tedersoo, 2018) lo cual contrasta con nuestros resultados e indica que hay especies vegetales dentro de estas familias que pueden ser micotróficas facultativas como en Rhodiola kirilowii Crassulaceae (Piszczek et al., 2019), L. virginicum, L. bidentaum junto con otras 120 especies de Brassicaceae analizadas e inoculadas con Rhizophagus intraradices (DeMars y Boerner, 1996) que presentaron colonización micorrízica arbuscular; por lo tanto, probablemente la colonización en L. virginicum, S. oxypetalum y S. praealtum es una respuesta a la baja disponibilidad de fósforo en el suelo de este bosque (Tabla 1).
La presencia de estructuras de los HMA en todas las raíces analizadas sugiere que estas plantas medicinales requieren establecer la simbiosis micorrízcica para complementar sus requerimientos nutrimentales bajo las condiciones adversas de baja disponibilidad de fósforo y ligera acidez en el suelo rizosférico en que se desarrollan (Figura 1, Tabla 1). Se conoce que uno de los principales beneficios que reciben las plantas al asociarse con los HMA es el mejoramiento en la captación de fósforo en suelos de baja fertilidad (Smith y Read, 2008). Aunque también es probable que los HMA en las plantas medicinales, además de contribuir en su nutrición, influyan en la producción de ciertos metabolitos o aceites esenciales, tal y como se ha reportado en una amplia variedad de plantas medicinales (Yan et al., 2013) de familias como Asteraceae, Lamiaceae o Plantaginaceae (Schweiger y Müller, 2015), aunque esta hipótesis tendría que probarse con futuros estudios bioquímicos a nivel de invernadero y laboratorio enfocados en la síntesis de metabolitos secundarios.
Las variables utilizadas para medir la estructura de la comunidad de HMA en las plantas medicinales tuvieron valores similares de abundancia de esporas, riqueza promedio de especies y diversidad (Figuras 2 y 4). Se ha reconocido que la identidad de la especie vegetal tiene influencia en la actividad y funcionamiento de la micorriza arbuscular (Smith y Read, 2008), así como en la composición de especies de HMA asociadas a la raíz (Scheublin et al., 2004) este es un componente biótico importante que afecta la respuesta de los hongos en su producción de esporas y por consiguiente afecta la riqueza de especies asociada al suelo, demostrando que hay diferencias entre las familias de Glomeromycota en sus estrategias de colonización micorrízica (Hart y Reader, 2002) y patrones de esporulación (Pringle y Bever, 2002). Nuestros resultados reflejaron que en el bosque templado de pino-encino, las diez plantas medicinales mantienen en su rizosfera una estructura de sus comunidades de HMA muy similares en abundancia de esporas, riqueza de especies e índices de diversidad. En contraste, el análisis de similitud sugiere cambios en la composición de sus especies de HMA; relacionado con la identidad de la especie vegetal como un factor biótico importante que la determina (Figura 5).
Esto se corrobora con los resultados del análisis de correspondencia canónica en el cual se apreció que las diez plantas medicinales mantienen una composición de especies de HMA diferente asociada a cambios en las propiedades del suelo (Figura 6); principalmente el fósforo disponible (Pi) y la materia orgánica del suelo (MOS). Oehl et al. (2010) reportaron que el tipo de suelo y sus propiedades químicas determinan la composición de especies de la comunidad de HMA; por ejemplo, suelos del tipo Cambisol y Fluvisol con un pH ligeramente ácido (5.3-6.3) tuvieron una mayor representatividad de HMA de las familias Acaulosporaceae y Gigasporaceae en comparación con suelos calcáreos como los Leptosoles (pH>7.6), con una mayor representatividad de la familia Glomeraceae. Asimismo, este efecto ha sido reportado por Song et al. (2019) en la planta medicinal Sophora flavescens Aiton (Leguminosae) en donde variables como el Pi, MOS y Nt contribuyeron en los cambios de composición de especies de HMA. Estos trabajos revelan que las propiedades del suelo son un factor abiótico que modifica la composición de especies de HMA. Los análisis de similitud y de correspondencia canónica en nuestro trabajo sugieren que la identidad de la especie vegetal en conjunto con sus propiedades del suelo asociadas a la rizósfera; son factores bióticos y abióticos que en conjunto podrían estar determinando la composición de especies de HMA en cada una de las plantas medicinales analizadas en el bosque de pino-encino de Agua Escondida, Taxco Guerrero.
Entender la estructura de la comunidad de HMA en las plantas medicinales es, sin duda, uno de los primeros pasos en el uso potencial de estos microorganismos simbióticos como promotores del crecimiento y nutrición vegetal. Al respecto, Almeida et al. (2020) analizaron la estructura de la comunidad de HMA en la rizosfera de Matricaria chamomilla L., una planta medicinal cultivada bajo condiciones de agricultura orgánica en China, los autores reportaron valores de riqueza de especies (5.5 spp), índices de diversidad de Shannon-Wiener (0-56-1.84) y equidad de Pielou (0.44-0.95) similares a lo registrado en el presente estudio. Asimismo, Wang y Jiang (2015) reportaron que los porcentajes de colonización (8 a 100 %), la abundancia de esporas (270 a 2860) e índices de diversidad (H=0.52 a 2.0) son muy variables y responden a la identidad de las 20 especies de plantas medicinales que analizaron y lo asociaron con las propiedades del suelo; lo cual concuerda con nuestros resultados y resalta la importancia de caracterizar las comunidades de HMA de las plantas medicinales bajo determinadas condiciones ambientales.
Las diez plantas medicinales estudiadas en conjunto, reportaron una riqueza de 30 especies de HMA que de acuerdo a Montaño et al. (2012) y Varela et al. (2020) son los primeros registros para Guerrero; uno de los estados de la República Mexicana que ocupa el quinto lugar en diversidad vegetal con cerca de 6 000 especies y el tercero en endemismos de plantas vasculares con 262 especies registradas (Morales-Saldaña et al., 2015). Esta riqueza de HMA se distribuyó predominantemente en la familia Acaulosporaceae (40 %), Gigasporaceae (16.6 %) y Glomeraceae (16.6 %); lo cual resulta consistente con lo reportado por González-Cortés et al. (2012) para bosques templados de Michoacán. La predominancia de especies de HMA de la familia Acaulosporaceae en los bosques templados podría estar relacionado con la acidez del suelo, debido a que son hongos que están adaptados a estas condiciones estresantes para las plantas, brindando a sus hospedantes mayor tolerancia a pHs ácidos y así mejoran la capacidad de absorción de fósforo, un nutrimento de baja disponibilidad bajo estas condiciones (Aguilera et al., 2015).
Con respecto a la acidez del suelo, nuestros datos muestran, en general, que las plantas con menores valores de pH y disponibilidad de fósforo presentan mayor riqueza de especies del género Acaulospora y algunas especies con frecuencias de ocurrencia mayores al 60 %. Así Baccharis conferta (pH=6.0), Sedum oxypetalum (pH=5.8) y Senecio stoechadiformis (pH=6.5) presentaron 7 de las 12 especies de Acaulospora en comparación con S. salignus (pH=7.02) que sólo tuvo 4 especies de Acaulospora en su rizosfera y con frecuencias de ocurrencia menores al 40 % (Tabla 2). Lo que sugiere que los HMA del género Acaulospora podrían ser especies importantes para la generación de inoculantes y probar su efectividad en las plantas medicinales; sin embargo, la mayoría de los estudios que han probado la efectividad de los HMA en plantas medicinales pertenecen a la familia Glomeraceae (Yan et al., 2013) por lo que se requiere mayor exploración de la efectividad de inoculantes micorrízicos basados en especies de Acaulospora.
Conclusiones
El bosque de pino-encino de la localidad de Agua Escondida en Taxco, Guerrero mantiene una riqueza de plantas medicinales que establecen simbiosis micorrízica arbuscular, en respuesta a la baja disponibilidad de fósforo y la acidez del suelo. Asimismo, las diez plantas medicinales analizadas albergan una importante riqueza de especies de hongos micorrizógenos arbusculares en su rizósfera, en especial especies de la familia Acaulosporaceae; que en conjunto, constituyen el 9.5 % de la diversidad de los Glomeromycota descritos a nivel mundial y el 20 % de las especies registradas en los ecosistemas terrestres de México (Varela et al., 2020). Este estudio sugiere que en los bosques templados como el de Agua Escondida, en donde predominan bosques de pinos y encinos comúnmente asociados a hongos ectomicorrízicos (Read y Pérez-Moreno, 2003), en las plantas del sotobosque destacan las de uso medicinal quienes contribuyen al mantenimiento de las comunidades de HMA en coexistencia con la simbiosis ectomicorrízica.











 nueva página del texto (beta)
nueva página del texto (beta)




