Introducción
Los nematodos parásitos de plantas son un grupo de patógenos importantes con origen en el suelo, varias especies inducen la formación de agallas en tejidos radiculares, los cuales afectan la absorción de nutrientes y agua, lo que ocasiona mayor susceptibilidad de las plantas a otros patógenos (Zhang et al., 2015). En la actualidad el control biológico de fitopatógenos se ha impulsado debido a la aplicación desmedida del control químico y sus efectos deletéreos. La incorporación de cepas nativas de agentes biocontroladores como Trichoderma spp., adaptadas a condiciones de donde se aíslan, mostraron efectos significativos en el control de especies de fitonematodos (Candelero et al., 2015; Pinzón et al., 2015).
Las especies de Trichoderma están ampliamente distribuidas en el suelo, poseen propiedades parasíticas y antibióticas y su capacidad metabólica y su competencia en la naturaleza por espacio y nutrientes, las hacen altamente competentes en las actividades agrícolas (Hermosa et al., 2013). Especies como Trichoderma asperellum, T. harzianum, T. virens y T. longibrachiatum se utilizan como antagonistas de nematodos agalladores de la raíz en diversos cultivos (Mendoza et al., 2013; Elgorban et al., 2014; Hernández-Ochandía et al., 2015). Estas especies fueron eficaces en el manejo de Meloidogyne incognita, M. javanica y Heterodera avenae ya que redujeron significativamente las poblaciones de estos organismos en los cultivos de pepino (Cucumis sativus L.), chile habanero (Capsicum chinense Jacq.), tomate (Solanum lycopersicum L.) y trigo (Triticum aestivum L.), cuando se aplicaron de forma individual (Zhang et al., 2014; Candelero et al., 2015, Zhang et al., 2015). El efecto de control es mayor cuando se aplican consorcios de microorganismos de la misma especie (relación intraespecífica) o de especies diferentes (relación interespecífica), que interactúan entre sí y muestran un comportamiento antagónico (interacción incompatible). Varias investigaciones han indicado que la combinación de aislados para el biocontrol puede ser compatible o incompatible para que se produzca mayor inhibición de los patógenos (Ortuño et al., 2013). De esta forma las interacciones incompatibles de aislados fúngicos pueden ampliar el rango de control de patógenos (Hernández-Ochandía et al., 2015).
El uso de Trichoderma spp., antagonistas con diferentes espectros de acción, constituyen un reto y una vía para la elaboración de consorcios comerciales. La selección de aislados nativos en evaluaciones in vitro reduce la variabilidad en el control biológico in vivo. También, se ha observado que pueden favorecer el sinergismo con otros agentes biocontroladores similares o distintos (Benítez et al., 2004).
Estudios previos en Yucatán, reportaron con aislados nativos de Trichoderma spp. actividad promotora de crecimiento vegetal en pepino (Cucumis sativus L.), chile habanero (Capsicum chinense Jacq.) y tomate (Solanum lycopersicum L.), y antagonismo in vitro de manera individual contra M. incognita y Fusarium spp. (Candelero et al., 2015; Pinzón et al., 2015). Con base a lo anterior, los objetivos del presente estudio fueron identificar molecularmente los aislamientos de Trichoderma spp., así como evaluar in vitro la relación interespecífica de Trichoderma spp. y su efectividad antagónica de las especies incompatibles contra M. incognita en condiciones de invernadero.
Materiales y métodos
Obtención de aislados de Trichoderma
Los aislados de Trichoderma spp. en estudio se obtuvieron de la colección del laboratorio de Fitopatología del Instituto Tecnológico de Conkal, en total fueron 10 aislados provenientes de la rizosfera de suelos con (Th02-04, Th20-07, Th26-52, y Th32-09) y sin actividad agrícola (Th09-06, Th27-08, Th33-58, Th33-59, Th43-13, Th43-14). Estos hongos se reactivaron en medio de cultivo Papa-Dextrosa-Agar (PDA) y se mantuvieron a 25 °C por ocho días.
Identificación molecular de aislados de Trichoderma spp.
Para las identificaciones específicas de los aislados fúngicos se hicieron extracciones de DNA, a partir de micelio fúngico con tres días de crecimiento, con el Kit ZR Fungal/Bacterial DNA MiniPrep TM. La Reacción en Cadena de la Polimerasa (PCR) y la secuenciación para el análisis molecular se desarrolló siguiendo la metodología modificada por Moo-Koh et al. (2014). La amplificación de las regiones ITS1 e ITS2 y 5.8s del ARN ribosomal, se realizó con los iniciadores ITS1 e ITS4 (White et al., 1990). Los productos de PCR se enviaron a secuenciar a la empresa Macrogen USA, las secuencias obtenidas se analizaron y compararon con el banco de genes de NCBI (National Center for Biotechnology Information) y con ayuda del programa Blast. Adicionalmente, se comparó con el International subcommission on Trichoderma and Hypocrea Taxonomy en el programa TrichoBlast, posteriormente las secuencias fueron depositadas al banco de genes del GenBank (https://www.ncbi.nlm.nih.gov/).
Bioensayo de enfrentamiento dual in vitro de aislados
Los enfrentamientos duales se realizaron en cajas de Petri de 90 mm de diámetro conteniendo PDA. Un disco de micelio de 5 mm de diámetro de cada aislado (de ocho días de crecimiento) se depositó en puntos equidistantes de la caja de Petri. De esta forma se obtuvieron 45 enfrentamientos duales, todos con cuatro réplicas y como testigo se utilizaron los aislados individuales. Los cultivos se incubaron a 25 °C por ocho días. Al final de este tiempo se realizó una selección de los aislados fúngicos, donde se consideraron tres características: a) el crecimiento proporcional (50/50%) de ambos aislados en la caja de Petri, b) la presencia de barrera micelial (incompatibilidad de los aislados) y c) la coloración en el medio de cultivo (Ortuño et al., 2013). Posteriormente, los aislados seleccionados se evaluaron in vivo como antagonistas de M. incognita.
Evaluación de aislados incompatibles de Trichoderma spp. en el control de Meloidogyne incognita en Solanum lycopersicum
Para la evaluación de los aislados incompatibles en el control de Meloidogyne incognita, con cada uno de los enfrenamientos duales seleccionados in vitro, se preparó una suspensión de conidios de 106 conidios mL-1. Como modelo de estudio se utilizaron semillas de tomate (Solanum lycopersicum L.) del tipo Saladette cv. Río Grande, las cuales se depositaron en charolas de poliestireno de 200 cavidades que contenían sustrato comercial Cosmopeat®, mezclado previamente con agrolita 50:50 (v/v). En cada cavidad de la charola y directamente al sustrato se inoculó 1 mL de las soluciones de conidios, de cada uno de los enfrentamientos. Las inoculaciones se realizaron al momento de la siembra, ocho y 15 días posteriores a la germinación de las semillas. A partir de los ocho días después de la germinación, y durante toda la evaluación, las plántulas se mantuvieron con riegos diarios y con una dosis de fertilización recomendada total para el cultivo de 300-150-200, para 20,000 plantas ha- 1, balanceada con los fertilizantes grado comercial: Urea (46-00-00), fosfato monoamónico (MAP, 12-61-00) y nitrato de potasio (NKS, 13-2-44) (Rellano-Gil y Gutiérrez-Coronado, 2006).
Para la obtención y preparación del inóculo de Meloidogyne incognita, se extrajeron masas de huevos a partir de raíces agalladas de tomate del mismo cultivar, empleado en la evaluación y cultivado en invernadero en suelo infestado con el nematodo y sin la aplicación de nematicidas. Cuando las plántulas alcanzaron una altura aproximada de 15 cm se trasplantaron en vasos de poliestireno de un litro de capacidad conteniendo una mezcla de sustrato de suelo: agrolita (80:20), en seguida se depositaron 1500 huevos de M. incognita, seguido de la suspensión de conidios de los enfrentamientos seleccionados. Dos testigos se prepararon, uno comercial que consistió en la aplicación de Oxamil al 24 % (Vydate®) en dosis de 2 mL L-1 (Mendoza et al., 2013), al momento de trasplante, y otro solo con el nematodo sin la inoculación de los hongos. Con los hongos y el Oxamil se hicieron adicionalmente dos aplicaciones, a los ocho y 15 días posteriores al trasplante. El experimento se condujo en un invernadero tipo túnel con temperatura promedio de 32 °C, 40-50 % de humedad relativa y con fotoperiodo 10-12 horas luz.
El experimento se evaluó a los 60 días posteriores al trasplante, donde se consideraron como variables de control del nematodo la severidad del daño radical, estimada con la escala de severidad de seis clases propuesta por Taylor y Sasser (1978), el número de huevos por g de raíz licuada-1 (NHU) y el número de hembras por g de raíz licuada-1 (NHE). Como variables de crecimiento de las plantas se registraron: altura de la planta (AP), diámetro del tallo (DT), longitud de la raíz (LR), volumen radical (VR), biomasa seca aérea (BSA) y peso seco de la raíz (PSR). Cada tratamiento constó de 20 plantas, distribuidas en un diseño experimental completamente al azar. Con los datos obtenidos se realizaron análisis de varianza (ANDEVA) y la comparación de medias se estimó con el método de Scott-Knott (P≤0.05), con la ayuda del programa InfoStat (http://www.infostat.com.ar).
Resultados
Identificación molecular de aislados de Trichoderma spp.
Los resultados obtenidos de las comparaciones de las secuencias de nucleótidos permitieron realizar las asignaciones de las especies correspondientes a cada uno de los 10 aislados, con un porcentaje de homología del 99-100% con las secuencias de referencias. Los aislados correspondieron a cinco especies: Trichoderma citrinoviride (Th33-58), T. ghanense (Th02-04 y Th26-52), T. harzianum (Th20-07, Th43-14 y Th33-59), T. simmonsii (Th09-06) y T. virens (Th27-08, Th32-09 y Th43-13) (Tabla 1).
Tabla 1 Identificación de Trichoderma spp., aisladas de Yucatán
| Clave de aislado | Identificación Molecular | ||||
|---|---|---|---|---|---|
| Especie | % de homología | % de cobertura | Secuencia de referencia del GenBank | Núm. de acceso del GenBank | |
| Th33-58 | T. citrinoviride | 99 | 99 | X93957 | MF078653 |
| Th02-04 | T. ghanense | 99 | 99 | JN564003 | MF078652 |
| Th26-52 | 99 | 99 | LN846701 | MF078651 | |
| Th20-07 | T. harzianum | 99 | 99 | LN846710 | MF078650 |
| Th43-14 | 99 | 99 | LN846710 | MF078649 | |
| Th33-59 | 100 | 99 | FR872742 | MF078648 | |
| Th09-06 | T. simmonsii | 99 | 99 | KX632493 | MF078647 |
| Th27-08 | T. virens | 100 | 99 | KJ739790 | MF078646 |
| Th32-09 | 99 | 99 | KT599099 | MF078645 | |
| Th43-13 | 99 | 99 | KJ739790 | MF078644 | |
Incompatibilidad de Trichoderma spp.
Con los 10 aislados fúngicos se generaron 45 enfrentamientos duales, de los cuales solo 15 manifestaron la misma capacidad de competencia ya que crecieron de manera proporcional en el área de la caja de Petri, de éstos 11 presentaron barrera de defensa entre 0.1-0.6 cm, donde, ocho tuvieron la barrera en el centro de la caja (mayor competencia por espacio), y cuatro presentaron coloración en el medio de cultivo con un rango de barrera de defensa de 0.5 a 0.6 cm. Con base a esta evaluación, se seleccionaron cuatro enfrentamientos incompatibles para la evaluación in vivo contra Meloidogyne incognita. Estos correspondieron a T. virens (Th27-08)/T. harzianum (Th33-59), T. citrinoviride (Th33-58)/T. harzianum (Th33-59), T. virens (Th43-13)/T. ghanense (Th26-52), T. simmonsii (Th09-06)/T. harzianum (Th33-59) (Figura 1).
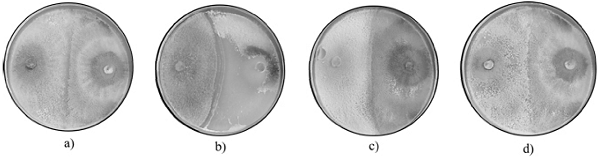
Figura 1 Enfrentamientos incompatibles seleccionados para la evaluación contra Meloidogyne incognita. a: Trichoderma simmonsii (Th09-06)/T. harzianum (Th33-59). b: T. virens (Th43-13)/T. ghanense (Th26-52). c: T. citrinoviride (Th33-58)/T. harzianum (Th33-59). d: T. virens (Th27-08)/T. harzianum (Th33-59).
Efecto de aislados incompatibles en el control de Meloidogyne incognita
Los ANDEVA para las variables de control del nematodo mostraron diferencias significativas (P≤0.01). Con respecto al tratamiento testigo sin inoculantes fúngicos, con la aplicación de especies incompatibles, en el daño radical, se estimaron valores según la escala de severidad (Taylor y Sasser, 1978) desde 2.8-8.1%, lo que significó una reducción del 50.8-83.0% de la severidad; en el número de huevos por g de raíz licuada y el número de hembras por g de raíz teñida los rangos de promedios fueron de 65.9-247.9 y 7.6-88.1 esto representó reducciones del 25.7-80.3% para el primero y 31.5-94.1% para el segundo. (Tabla 2).
Tabla 2 Efecto de las interacciones incompatibles de Trichoderma spp. en el control de Meloidogyne incognita
| Tratamientos | SDR (%) | NHU | NHE |
|---|---|---|---|
| T. virens (Th27-08)/T. harzianum (Th33-59) | 8.1± 0.8 b | 247.9± 10.7 b | 14.8± 1.9 c |
| T. citrinoviride (Th33-58) /T. harzianum (Th33-59) | 2.8± 0.5 d | 65.9 ± 17.6 e | 7.6± 2.1 d |
| T. virens (Th43-13)/T. ghanense (Th26-52) | 3.9± 2.0 d | 157.6± 9.8 c | 88.1± 5.4 b |
| T. simmonsii (Th09-06)/T. harzianum (Th33-59) | 5.7± 4.9 c | 135.8± 9.8 d | 12.8± 2.9 c |
| Nematicida (Vydate®) | 1.7± 0.2 d | 60.80± 14.6 e | 4.5± 3.3 d |
| Testigo (sin inoculantes fúngicos) | 16.5± 1.1a | 333.8± 14.5 a | 128.7± 2.0 a |
SDR: Severidad (%) del daño radical, NHU: Número de huevos por gramo de raíz licuada, NHE: Número de hembras por gramo teñida. Medias con diferente literal dentro de columnas son estadísticamente diferentes (Scott-Knott, P≤0.05).
La interacción T. citrinoviride (Th33-58) /T. harzianum (Th33-59) fue la más promisoria al tener un efecto igual al Oxamil, ya que las comparaciones de medias no mostraron diferencias estadísticas (Scott-Knott, P≤0.05) en las tres variables de control con este tratamiento. Esta interacción ejerció reducciones del 83.0% en la severidad de daño radical, el 80.3% en el número de huevos y un 94.1% en número de hembras.
En la severidad del daño radical le siguen en efectividad la interacción T. virens (Th43-13) /T. ghanense (Th26-52), T. simmonsii (Th09-06) /T. harzianum (Th33-59) y T. virens (Th27-08) /T. harzianum (Th33-59), con reducción del 76.7, 65.5 y 50.8 %, respectivamente. Las cuales se consideraron también con buenos efectos de control del nematodo.
Para la variable número de huevos por g de raíz licuada, la interacción de T. simmonsii (Th09-06) /T. harzianum (Th33-59) mostró un 59.3% en la reducción de huevos, a la que le siguió, T. virens (Th43-13) /T. ghanense (Th26-52) y T. virens (Th27-08) /T. harzianum (Th33-59) con 52.8 y 25.7%, respectivamente. En el número de hembras por g de raíz teñida, T. simmonsii (Th09-06) /T. harzianum (Th33-59), T. virens (Th27-08) /T. harzianum (Th33-59) y T. virens (Th43-13) /T. ghanense (Th26-52) mostraron 90.1, 88.1 y 31.5%, respectivamente.
El control del nematodo se reflejó en las variables de crecimiento de la planta, por lo que los ANDEVA mostraron diferencias significativas (P≤0.01) entre tratamientos. Las interacciones de Trichoderma spp. indujeron los mayores promedios con respecto al testigo sin inoculantes fúngicos con incrementos del 31.3-33.7% en altura de la planta, 2.3-4.1% en diámetro del tallo, 2.4-14.6% en la longitud de raíz (Figura 2), 8.6-17.1% en el volumen radical, 8.8-17.6% en la biomasa seca aérea y un 11.5% en el peso seco de raíz (Tabla 3).
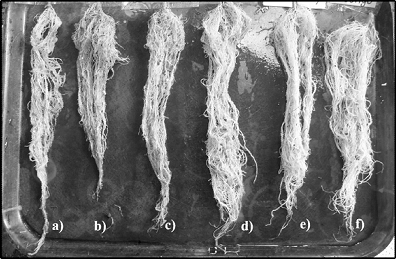
Figura 2 Enfrentamientos incompatibles. a: Trichoderma virens (Th43-13)/T. ghanense (Th26-52). b: T. simmonsii (Th09-06)/T. harzianum (Th33-59). c: T. virens (Th27-08)/T. harzianum (Th33-59). d: T. citrinoviride (Th33-58)/T. harzianum (Th33-59). e: Oxamil. f: Testigo.
Tabla 3 Efecto de las interacciones incompatibles de Trichoderma spp. en las variables de crecimiento de S. lycopersicum infectadas con Meloidogyne incognita
| Tratamiento | ALT | DT | LR | VR | BSA | PSR |
|---|---|---|---|---|---|---|
| (cm) | (mm) | (cm) | (mL) | (g) | (g) | |
| T. virens (Th27-08)/ | 92.2±3.4 b | 5.79±0.34 b | 37.6±2.3 a | 24.1±1.9 b | 3.64±0.42 c | 0.59±0.08 c |
| T. harzianum (Th33-59) | ||||||
| T. citrinoviride (Th33-58)/ | 94.3±1.8 a | 6.60±0.32 a | 37.3±1.6 a | 26.9±0.9 a | 4.54±0.29 a | 0.87±0.01 a |
| T. harzianum (Th33-59) | ||||||
| T. virens (Th43-13)/ | 93.0±3.0 a | 5.90±0.34 b | 34.9±2.6 b | 25.0±1.1 b | 4.14±0.33 b | 0.67±0.08 c |
| T. ghanense (Th26-52) | ||||||
| T. simmonsii (Th09-06)/ | 91.0±1.2 b | 6.48±0.25 a | 32.9±2.3 c | 24.4±1.2 b | 4.10±0.19 b | 0.58±0.06 c |
| T. ghanense (Th26-52) | ||||||
| Oxamil 24% (Vydate®) | 75.5±1.3 c | 6.50±0.22 a | 34.4±2.4 b | 23.5±1.3 c | 3.99±0.36 b | 0.74±0.14 b |
| Testigo | 62.5±1.2 d | 6.33±0.17 a | 32.1±1.5 c | 22.3±1.4 c | 3.74±0.27 c | 0.77±0.08 b |
ALT: altura de la planta, DT: diámetro del tallo, LR: longitud de la raíz, VR: volumen radical (VR), BSA: biomasa seca aérea y PSR: peso seco de la raíz. Medias con diferente literal dentro de columnas son estadísticamente diferentes (Scott-Knott, P≤0.05).
La interacción T. citrinoviride (Th33-58) /T. harzianum (Th33-59), mostró significativamente (Scott-Knott, P≤0.05) raíces con mayor vigor, ya que superó a los tratamientos con interacciones fúngicas y al testigo sin inoculantes.
Discusión
La caracterización de Trichoderma mediante aspectos morfológicos se complementa con la aplicación de técnicas moleculares, dentro de los cuales la amplificación de las regiones ITS1, ITS2 y 5.8S del ARN ribosomal han sido ampliamente utilizados; ya que existe una diversidad intraespecífica e interespecífica que viene establecida por las diferencias entre las distintas condiciones donde se desarrollaron los aislados (Hernández et al., 2013; Moo-Koh et al., 2014).
En la actualidad, se han registradas 381 especies de Trichoderma (http://www.indexfungorum.org), en este estudio se reportan cinco especies, de las cuales T. citrinoviride, T. ghanense y T. simmonsii no ha sido registradas para México, y para el estado de Yucatán se incluye el primer reporte de éstas y T. virens.
La cantidad de especies aisladas fue más alta en suelos sin actividad agrícola, lo que demuestra mayor diversidad de especies en ambientes menos perturbados, como ocurrió en las especies de T. citrinoviride (Th33-58), T. harzianum (Th43-14 y Th33-59), T. simmonsii (Th09-06) y T. virens (Th27-08 y Th43-13). Sin embargo, especies como T. harzianum (Th20-07) y T. virens (Th32-09) también se encontraron en suelos con actividad agrícola. Esto puede representar un ejemplo de cómo las especies pueden desarrollarse a través de la selección impuesta por el ambiente o condiciones ecológicas particulares. Además de evidenciar el flujo de genes por la actividad agrícola al incorporar biocontroladores en las aéreas cultivadas (Torres-De la Cruz et al., 2015).
Lo anterior contribuye al acervo de especies presentes en México y representa información valiosa al momento de registrarlos en el GenBank (Guigón-López et al., 2010), también proporciona información disponible que permite, un mejor diseño de experimentos posteriores a fin de evaluar la actividad biológica de las especies bajo diferentes condiciones de crecimiento y determinar los mecanismos de acción que desarrollan para seleccionar aislamientos promisorios para el control de fitopatógenos.
Se pudo demostrar la incompatibilidad de aislados de Trichoderma en los aislados de suelos con y sin actividad agrícola. Sin embargo, entre aquellos aislados que provinieron de suelos sin actividad agrícola, tuvieron mayor incompatibilidad en particular, el enfrentamiento de T. citrinoviride (Th33-58) /T. harzianum (Th33-59) resultó el mejor tratamiento al controlar el nematodo, lo que sugiere un proceso de coadaptación como producto de las asociaciones entre especies (Ortuño et al., 2013).
En resumen T. harzianum (Th33-59) mostró incompatibilidad con T. citrinoviride (Th33-58), T. simmonsii (Th09-06) y T. virens (Th27-08); para T. citrinoviride solo mostró esta actividad contra T. harzianum (Th20-07, Th33-59 y Th43-14) y T. virens (Th32-09, Th27-08), siendo esta la más frecuente al estar presente en cinco enfrentamientos incompatibles de los 11 observados. Estas interacciones ayudan a comprobar los criterios de incompatibilidad interespecífica: formación de barrera de defensa, competencia por espacio según el crecimiento proporcional del 50% en la caja de Petri y antibiosis mediante las coloraciones en el medio de cultivo (Martínez et al., 2013).
Estudios previos han mostrado actividad variable de las especies del género Trichoderma para el control de M. incognita. Por ejemplo, en T. harzianum se ha reportado el parasitismo in vitro en huevos, lo que favoreció la destrucción total de los mismos (Mendoza et al., 2013), mientras que con filtrados de varios aislados locales de T. harzianum (Th43-14, Th02-01), T. virens (Th43-13, Th27-08) y T. simmonsii (Th09-06) ejercieron un efecto nematicida in vitro del 100% en juveniles de segundo estadio (J2) después de 48 h de exposición, en el presente estudio estos aislados no mostraron incompatibilidad con otras especies (Candelero et al., 2015). En el cultivo de S. lycopersicum una cepa de T. harzianum, causó reducciones en el daño radical del 59.72% (Qureshi et al., 2012), 69.80% (Radwan et al., 2012) y 88.3% (González et al., 2012) valores menores de los que se obtuvo en el estudio al combinar dos aislado como T. citrinoviride (Th33-58) /T. harzianum (Th33-59). Estudios realizados en el estado de Yucatán en M. incognita, con inoculaciones de Trichoderma spp. mostraron reducciones en la formación de agallas hasta un 78.10% (Pinzón et al., 2015).
Las especies de Trichoderma presentan diferentes mecanismos de acción, que les confieren el potencial de control de fitopatógenos, entre estos están: competencia por espacio, favorecido por la velocidad de crecimiento de los aislados; micoparasitismo, donde se involucran procesos quimiotróficos, que promueven reconocimiento, adhesión, enrollamiento y actividad lítica de quitinasas y celulasas, principalmente. Otro mecanismo es la antibiosis o la acción directa de metabolitos secundarios tóxicos sobre fitopatógenos sensibles; sin embargo, diferentes aislados de la misma especie muestran variación en su potencial nematicida (Infante et al., 2009; Qureshi et al., 2012, Martínez et al., 2013).
El beneficio del control de los patógenos se ve reflejado en las variables de crecimiento de las plantas al notarse un incremento en ellas, así, Zhang y Zhang (2009), evaluaron dos aislados de T. viride en combinación con composta y observaron un aumentó en el peso promedio de las raíces del 26.64% y 30.45%. Pinzón et al. (2015) al incorporar a T. harzianum obtuvieron incrementos del 28.13% en la altura y del 41.16% en la ganancia de biomasa seca total, respecto al testigo sin la aplicación del hongo, Li et al. (2015) obtuvieron el 31% en el aumento de peso seco de plántulas. Asimismo, estudios mostraron con T. harzianum incrementos en el número de hojas, área foliar, diámetro de tallo, abundancia de pelos radicales y raíces laterales (Samolski et al., 2012; López-Bucio et al., 2015). Bharti et al. (2012) con cinco aislados de T. harzianum en plantas de S. lycopersicum, observaron incrementos en peso fresco aéreo en un rango de 14.59-20.21%, en el peso de la raíz de 7.03-16.05%. Además observaron mayor actividad de la glucosa-6-fosfato deshidrogenasa, enzima clave para la síntesis de ácidos nucleicos y lípidos derivada de la vía de las hexosas monofosfato, lo que hizo concluir la capacidad de los aislados para promover el crecimiento o su capacidad inhibitoria; ya que tres aislados redujeron en un 14% peso fresco aéreo y 42.6% el peso de la raíz como ocurrió en el presente estudio en las variables de diámetro del tallo, biomasa seca aérea y peso seco de la raíz con la interacción T. virens (Th27-08)/T. harzianum (Th33-59) al obtener reducciones de 9.33%, 2.75% y 30.5%, respectivamente. Hermosa et al. (2013) explicaron que una alta concentración de ácido indolacético producido por Trichoderma inhibe el crecimiento vegetal, lo que podría ser estimado en futuros estudios. La actividad de Trichoderma varía según la especie y el aislado, ya que diferentes especies muestran actividad promotora variable, así como controladora de M. incognita (Hernández-Ochandía et al., 2015; Candelero et al., 2015).
Conclusiones
La identificación específica de aislados del género Trichoderma empleando técnicas moleculares permitió reforzar la identificación tradicional, aportando tres nuevos registros de especies para México y cuatro para el estado de Yucatán. Las especies incompatibles T. citrinoviride (Th33-58) y T. harzianum (Th33-59) redujeron el parasitismo de Meloidogyne incognita por lo que mejoraron significativamente las variables de crecimiento de la planta. Esta interacción es una candidata para la composición de ingredientes activos y elaboración de bioplaguicidas. Por otra parte, la interacción T. citrinoviride (Th33-58) /T. harzianum (Th33-59), mostró significativamente (Scott-Knott, P≤0.05) raíces con mayor vigor, ya que superó a los tratamientos y el testigo sin inoculantes fúngicos.











 nueva página del texto (beta)
nueva página del texto (beta)


