Introducción
En años recientes los tumores malignos se han colocado como una de las principales causas de mortalidad en población mexicana1. En el 2017, según el Instituto Nacional de Estadística y Geografía (INEGI)2, estaban en tercer lugar tanto en hombres como mujeres; año en el cual se registraron 83,476 defunciones3, por encima de enfermedades del hígado, accidentes de tránsito y homicidios, por mencionar algunas2. Así, el cáncer de mama (CaMa) (C50) registró 6,854 decesos2, esto es, un incremento del 8% (n = 550) en comparación con 20154; principalmente en mujeres > 45 años, y se colocó por encima de otros, como el cervicouterino2, lo cual ya había sido reportado desde el año 20065. Más aún, de acuerdo con estimaciones de mortalidad por CaMa, para los próximos años se espera un continuo incremento en mujeres > 25 años6.
Ante dicho panorama, se ha planteado que la falta de un programa de detección organizado6, capaz de realizar suficientes mastografías a la población blanco, proporcionar un diagnóstico y tratamiento adecuado, como lo establece la NOM-041-SSA2-2011 para la prevención, diagnóstico, tratamiento, control y vigilancia epidemiológica del CaMa7, podría explicar parcialmente la magnitud de la mortalidad por CaMa en México5, que ha sido documentada recientemente2-4. En EE.UU., por ejemplo, la disminución de la mortalidad a lo largo de varios años se ha asociado, en parte, a la implementación de estrategias de detección temprana mediante mastografía, junto con los avances en los tratamientos médicos8. Inclusive, algunos autores argumentan que la mortalidad también es consecuencia de los diagnósticos en fase avanzada, una problemática señalada en México desde 20039; una de cada dos mujeres son clasificadas en estadios IIb-IV6,10. Por ello se argumenta que un programa organizado de detección temprana de CaMa, como lo establece la NOM-041-SSA2-20117, junto con los suficientes recursos humanos, materiales y técnicos para asignar tratamientos, podría disminuir la mortalidad entre el 216 y el 40%7; en comparación con otros métodos, como la autoexploración y el examen clínico, que hasta el momento no han demostrado el mismo impacto9.
Sin embargo, el Sistema Nacional de Salud no cuenta con los recursos suficientes para realizar tamizaje poblacional5 y, de ser necesario, atender clínicamente el CaMa en mujeres11, aunado a que la infraestructura disponible es subutilizada, lo cual ocasiona bajas coberturas en varios Estados del país5,12. Si bien es cierto que la identificación de factores de riesgo a nivel individual, como la edad o antecedentes familiares, permite definir grupos de población susceptibles de tamizaje7, también resulta importante determinar los lugares (vecindarios, municipios, regiones sanitarias) donde se deben focalizar los programas de detección temprana, lo cual implica no solo mejorar la distribución de los servicios de salud orientados a dicho propósito y aproximar geográficamente el tamizaje a los grupos de mayor riesgo (mujeres ≥ 40 años)13, sino también incrementar sustancialmente la eficiencia de los programas13.
Por lo anteriormente expuesto, es indispensable optimizar los recursos disponibles relacionados con los programas de tamizaje, que en gran parte del país son limitados, y de esta manera intentar cumplir adecuadamente con la demanda de la detección temprana del CaMa en mujeres; particularmente en aquellos lugares asociados a un mayor riesgo de detección en categorías 4 o 5, según la clasificación Breast Imaging Report and Database System (BIRADS)6,14, dado que estas sugieren un resultado sospechoso o altamente sugestivo de malignidad de CaMa, respectivamente. Ante la falta de investigaciones en México, que involucren un enfoque epidemiológico y geográfico (epidemiología espacial)15, se realizó un estudio en el Estado de Jalisco, cuyo objetivo fue examinar la variabilidad geográfica de mastografías sospechosas y altamente sugestivas de malignidad (BIRADS 4 y 5)6,14 de CaMa, para identificar zonas de riesgo en las que se requiere focalizar o reforzar los programas de detección temprana de CaMa.
Metodología
Para lograr el objetivo planteado, se realizó un diseño ecológico en el que se incluyeron datos relacionados con el proceso de detección de CaMa en mujeres residentes del Estado de Jalisco, cuya atención médica se registró en un hospital especializado en el área oncológica, localizado en la ciudad de Guadalajara, durante el trienio 2013-2015; dicho hospital pertenece a la Secretaría de Salud de Jalisco, atiende a población abierta diagnosticada con diferentes tipos de cánceres y es uno de los principales centros de referencia de atención oncológica en el Occidente de México. Antes de iniciar la investigación se obtuvo la aprobación por el comité de ética e investigación del mismo hospital.
Fuente y recolección de datos
Los datos de interés se obtuvieron mediante un proceso de revisión de expedientes clínicos realizado en el hospital mencionado, garantizando la confidencialidad y anonimato de las usuarias. Se seleccionaron aquellos casos cuyo estudio de mastografía reportó la categoría sospechoso y altamente sugestivo de malignidad, esto es, BIRADS 4 y 5, respectivamente, de usuarias ≥ 40 años atendidas en el periodo de estudio y residentes del Estado de Jalisco6,14. En la fase de recolección de datos se realizó una estandarización y evaluación de la confiabilidad, lo cual se explica en detalle en otro manuscrito16. Brevemente, este proceso se llevó a cabo para verificar que la información capturada y analizada correspondió con lo reportado en los expedientes clínicos incluidos en el estudio, y de esta manera minimizar posibles sesgos en el diseño.
Georreferenciación de datos y unidad espacial
Una vez terminada la etapa de recolección, los datos se integraron en el Marco Geoestadístico Municipal de Jalisco mediante el Sistema de Información Geográfica (SIG) QGIS (versión 3.10), lo cual se refiere a la delimitación política administrativa de 125 municipios según el Instituto Nacional de Estadística y Geografía (INEGI)17. Esta etapa fue útil para vincular los datos recolectados con un referente espacial, agrupar los municipios según las 13 regiones sanitarias en el Estado, así como determinar la frecuencia de ambas categorías BIRADS por municipio (datos agregados), para posteriormente estimar tasas estandarizadas por edad, municipio y año.
Cálculo de indicadores y análisis geoestadístico
Con base en la delimitación municipal de Jalisco, se estimaron tres indicadores espaciales para el trienio de estudio: 1) casos sospechosos y 2) altamente sugestivos de malignidad por 100 mil mujeres ≥ 40 años, así como 3) riesgo relativo (exceso de riesgo) para cada categoría. La estimación de las tasas se obtuvo mediante método directo18, al dividir el total de usuarias ≥ 40 años cuyo estudio de mastografía reportó BIRADS 4 o 5 por municipio (2013-2015), entre la población femenina ≥ 40 años reportada a nivel municipal durante el mismo periodo, según datos oficiales de la Dirección General de Información en Salud (DGIS)19. Ambos indicadores se agruparon en cuartiles para identificar los valores superiores e inferiores atípicos según municipio. El riesgo relativo, por otro lado, consistió en comparar, mediante una razón, cada tasa estimada por unidad espacial entre el promedio municipal obtenido en el trienio; los tres indicadores fueron calculados mediante el software SIG GeoDa (versión 1.14).
A partir de lo anterior, se realizó un análisis geoestadístico20 para examinar no solo la magnitud, sino también la variabilidad geográfica de los indicadores, y de esta manera determinar zonas de mayor o menor riesgo. Adicionalmente, se realizaron mediciones de tendencia espacial20,21 para identificar los municipios donde se concentró el mayor riesgo de detección de casos sospechosos o altamente sugestivos de malignidad. Los resultados se presentaron mediante mapas elaborados en los SIG antes mencionados.
Resultados
Durante el trienio de estudio se revisaron 1,150 (N) expedientes clínicos relacionados con usuarias diagnosticadas con CaMa; de estas, el 55.1% (n = 633) fueron casos sospechosos de malignidad (BIRADS 4), cuya edad promedio fue 52.4 años (desviación estándar [DE] ± 11.9); en tanto que la categoría altamente sugestiva de malignidad (BIRADS 5) fue reportada en el 44.9% (n = 517) de los casos, sin embargo, la edad promedio de este grupo fue diferente (p < 0.05) al anterior, esto es, 55.4 años (DE ± 11.9).
En la figura 1 se observa la distribución de las usuarias clasificadas en BIRADS 4 durante el trienio 2013-2015 según municipio de residencia. A partir de ello, se identificó que el total de estas residían solo en el 68.8% (n = 86) de los municipios de Jalisco, cuya frecuencia de casos osciló entre 1 (27 municipios) y 164 (Guadalajara). Además, los municipios localizados en la zona centro, pertenecientes a las regiones sanitarias Zapopan, Tonalá, Tlaquepaque y Guadalajara, fueron los que concentraron una mayor proporción de casos, esto es, hasta 6 de cada 10 (n = 389).
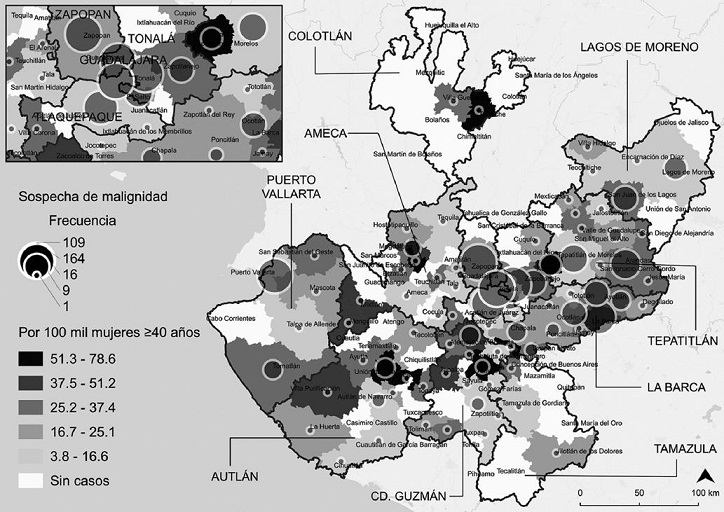
Figura 1 Frecuencia de casos (n = 633) sospechosos de malignidad según municipio de residencia en Jalisco, 2013-2015 (elaboración propia a partir de trabajo de campo y el Marco Geoestadístico Nacional, 201817).
Respecto a los valores estandarizados a nivel municipal, solo dos municipios registraron un valor superior atípico: Ejutla (zona suroeste) con 75.3 y Atoyac (zona sur) con 78.6 casos con sospecha de malignidad por 100 mil mujeres ≥ 40 años, en comparación con los valores más bajos registrados en la región sanitaria Lagos de Moreno (Fig. 1). Sin embargo, el mayor riesgo de detección de BIRADS 4 se extendió hacia aquellos municipios localizados de suroeste a noreste de Jalisco, lo cual está representado por la elipse de la figura 2; como resultado, Acatic, Atoyac, Ejutla, Totatiche y Unión de Tula (en color negro) mostraron un riesgo relativo hasta cuatro veces mayor que el promedio municipal (Poncitlán: 18.9 casos sospechosos de malignidad por 100 mil mujeres ≥ 40 años).
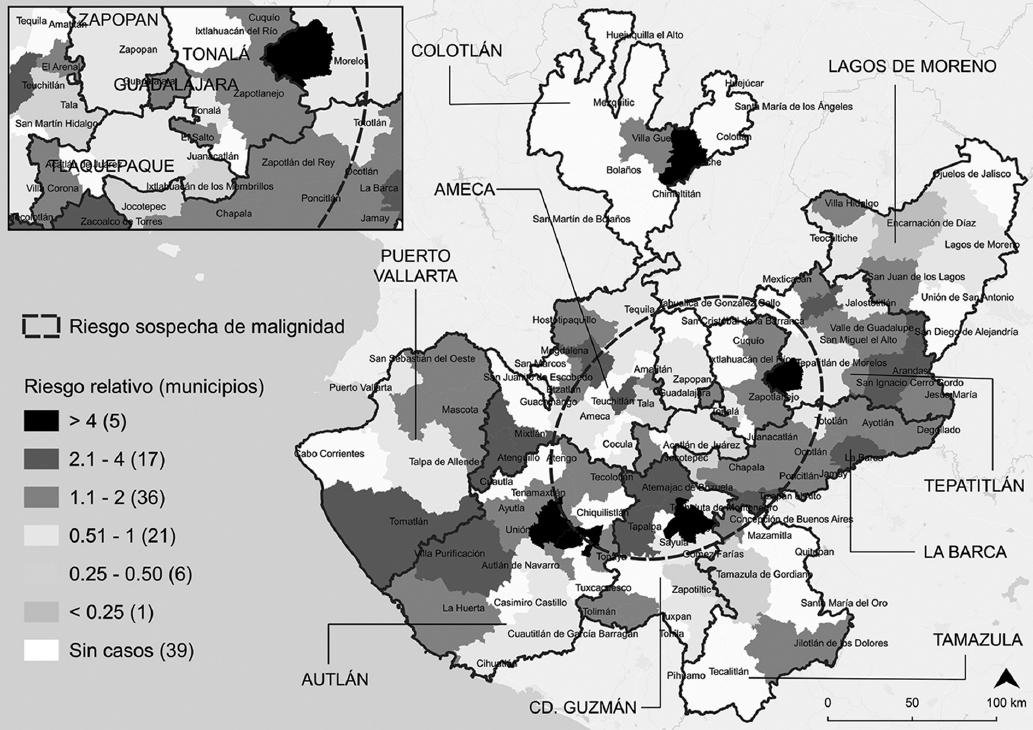
Figura 2 Riesgo relativo de detección de casos sospechosos de malignidad según municipio de residencia de las usuarias en Jalisco, 2013-2015 (elaboración propia a partir de trabajo de campo y el Marco Geoestadístico Nacional, 201817).
Por otra parte, considerando el área de residencia de las usuarias clasificadas como altamente sugestivo de malignidad (Fig. 3), se identificó que el total residía en el 65.6% (n = 82) de los municipios de Jalisco, con una frecuencia de casos entre 1 (28 municipios) y 130 (Guadalajara); pero en comparación con los demás, los municipios del centro (regiones sanitarias Zapopan, Tonalá, Tlaquepaque y Guadalajara ) y noreste (región sanitaria Tepatitlán) concentraron hasta el 62% (n = 320) de las usuarias clasificadas en dicha categoría.
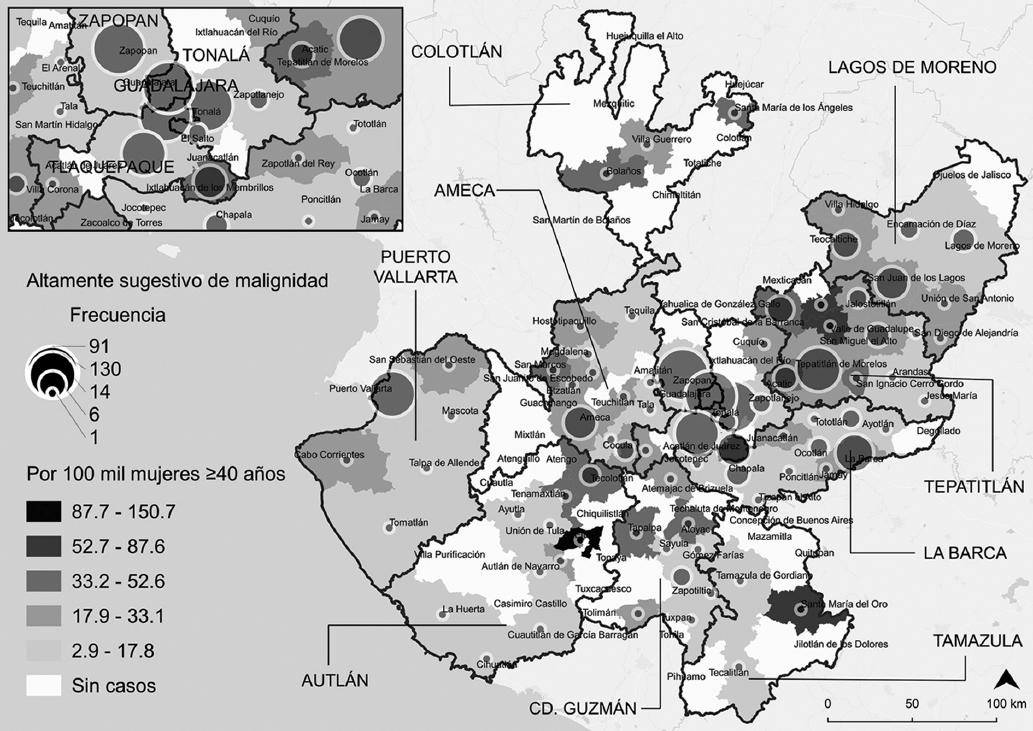
Figura 3 Frecuencia de casos (n = 517) altamente sugestivos de malignidad según municipio de residencia en Jalisco, 2013-2015 (elaboración propia a partir de trabajo de campo y el Marco Geoestadístico Nacional, 201817).
En la figura 3 se observa la magnitud y variabilidad de la detección altamente sugestiva de malignidad, cuyos valores superiores atípicos fueron: 71.8 (Santa María del Oro, región sanitaria Tamazula), 73.3 (Cañadas de Obregón, región sanitaria Tepatitlán), 87.5 (Valle de Guadalupe, región sanitaria Tepatitlán) y 150.7 (Ejutla, región sanitaria Autlán) casos por 100 mil mujeres ≥ 40 años; a diferencia de los valores más bajos registrados en las regiones sanitarias Puerto Vallarta y Autlán. No obstante, el riesgo relativo fue hasta cuatro veces mayor en municipios del suroeste y noreste del Estado (elipse) (Fig. 4), esto es, Ejutla, Santa María del Oro, Valle de Guadalupe y Cañadas de Obregón; en comparación con el promedio municipal de 15.8 casos altamente sugestivos de malignidad por 100 mil mujeres ≥ 40 años registrado en Encarnación de Díaz.
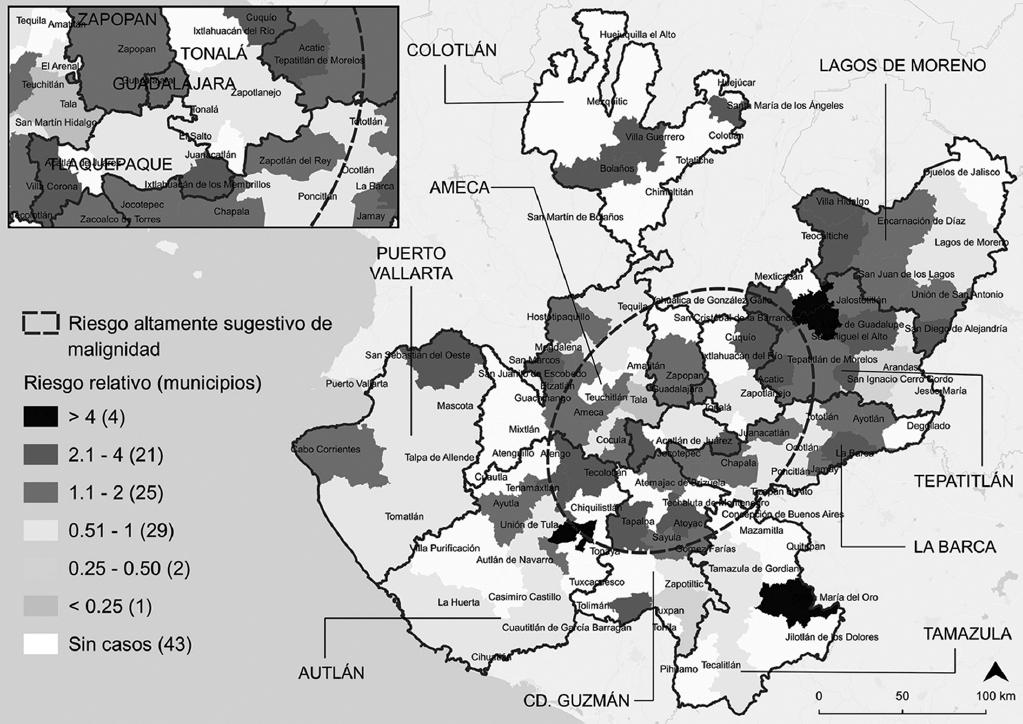
Figura 4 Riesgo relativo de detección de casos altamente sugestivos de malignidad según municipio de residencia de las usuarias en Jalisco, 2013-2015 (elaboración propia a partir de trabajo de campo y el Marco Geoestadístico Nacional, 201817).
Discusión
La variabilidad geográfica de la detección de CaMa mediante mastografía mostró municipios con un riesgo hasta cuatro veces mayor en comparación con otras áreas del Estado de Jalisco, por lo que el área administrativa y médica del hospital especializado en oncología, como parte del Sistema Nacional de Salud, podría contribuir a reforzar programas de detección temprana en los municipios de residencia y de mayor riesgo según las usuarias que generalmente son atendidas. Aunado a que las categorías analizadas BIRADS 4 y 5 indican que la mastografía parece ser una opción de la evaluación diagnóstica y no un método de detección temprana de CaMa, como lo establece la NOM-041-SSA2-20117.
Sin duda, uno de los principales propósitos de los programas de tamizaje es mejorar los procesos de detección, diagnóstico de CaMa y favorecer el uso de terapias efectivas en las mujeres6,7,13. Sin embargo, se han documentado diversas problemáticas importantes que impiden lograr tal propósito a nivel nacional. Por un lado, se ha reportado una cobertura de mastografías limitada5, que oscila entre el 11.7 y el 22.8% para los grupos de mujeres 40-49 y 50-69 años, respectivamente; según el área de residencia, también se han encontrado diferencias entre el 19.1% (40-49 años) en zona rural y el 17.7% (50-69 años) en zona urbana12. Si a esto agregamos que el diagnóstico de CaMa en México se realiza generalmente en fases avanzadas6,10, resulta importante el análisis de las categorías BIRADS reportadas por estudios mastográficos al igual que la edad en la que esto ocurre. De acuerdo con los resultados aquí presentados, hubo diferencias significativas (p < 0.05) entre las categorías BIRADS 4 y 5 según el promedio de edad, esto es, 52 y 55 años, respectivamente; un rango (de riesgo)6 similar a lo reportado en otro estudio10. Por ello, es posible que los lineamientos establecidos en la NOM-041-SSA2-20117, respecto al proceso de detección en mujeres según el grupo de edad al que pertenecen, por ejemplo autoexploración, examen clínico o programas de tamizaje, no estén funcionando en algunos municipios localizados en la zona suroeste y noreste de Jalisco, que podrían contribuir a incrementar el número de estudios mastográficos como método de detección temprana.
La importancia de un tamizaje poblacional efectivo radica, entre otros aspectos, en incrementar la detección en etapas preclínicas así como la referencia oportuna y, eventualmente, reducir las tasas de mortalidad por CaMa en mujeres6,8,9; caso contrario, se incrementa el costo de la atención médica y disminuyen considerablemente las posibilidades de supervivencia6,9. Sin embargo, en Jalisco se ha reportado una cobertura de mastografías < 30%12, es decir, dos veces por debajo de la recomendación de la Organización Mundial de la Salud de tamizar, por lo menos, al 70% de la población en riesgo22; lo cual podría ser explicado en parte por las carencias de infraestructura en el Sistema Nacional de Salud para realizar las suficientes mastografías en mujeres ≥ 40 años5,7. Ante esta situación, se hace necesario mejorar o reforzar un programa de detección organizado como establece la NOM-041-SSA2-20117, como parte de las medidas de prevención secundaria7,23. Por consiguiente, la identificación de grupos y áreas de mayor riesgo adquiere importancia para determinar en quiénes y en dónde se requiere focalizar, por ejemplo, los programas de detección organizados en función del perfil de usuarias que generalmente son atendidas en hospitales que brindan atención oncológica.
En este sentido, el enfoque de la epidemiología espacial, mediante el mapeo y análisis de datos asociados a la detección y diagnóstico de CaMa15, contribuye en la identificación de áreas de riesgo que podrían ser beneficiadas mediante intervenciones focalizadas; ya sea que estén relacionadas con fases avanzadas de la enfermedad, o bien tasas de mortalidad superiores a lo esperado, como se ha realizado en otros países24,25. Más aún, la identificación de áreas de riesgo podría adecuarse a diversas escalas territoriales, por ejemplo, unidades censales, vecindarios, municipios, regiones sanitarias; en las cuales, incluso, se dispone de información sociodemográfica o de servicios de salud que podría complementar un análisis con enfoque epidemiológico espacial.
En efecto, una de las enfermedades no transmisibles respecto a la cual se ha desarrollado mayor investigación desde el enfoque epidemiológico espacial ha sido el cáncer15,24. El potencial de dicho enfoque radica, entre otros aspectos, en examinar variaciones y patrones espaciales, mediante el uso de tecnología geoespacial, que podrían apoyar en el control y vigilancia epidemiológica del CaMa, identificar lugares donde se necesita desarrollar más investigación (epidemiológica) o focalizar intervenciones25, así como mejorar la efectividad del tamizaje poblacional, por ejemplo, mediante la aproximación geográfica de este tipo de servicios de salud con la finalidad de incrementar la detección precoz de casos, aumentar la supervivencia, mejorar la calidad de vida y, eventualmente, reducir las tasas de mortalidad por CaMa9.
Considerando el diseño epidemiológico presentado, es necesario señalar algunas limitaciones. Por un lado, el uso de una fuente secundaria limitó la posibilidad de conocer si el estudio mastográfico de las usuarias fue utilizado como método de tamizaje o diagnóstico, según los criterios de la NOM-041-SSA2-20117; dado que esto podría aportar evidencia respecto al proceso de referencia, diagnóstico y tratamiento de las usuarias atendidas en el hospital de atención oncológica. Inclusive, al ser un centro de referencia estatal, que también recibe pacientes de otras entidades federativas, es probable que la mayoría de los estudios mastográficos se relacionen con categorías BIRADS sospechosas y altamente sugestivas de malignidad en comparación con las demás.
Por otro lado, no fue posible determinar las subcategorías establecidas en la clasificación 4 según BIRADS6,14, lo que ciertamente hubiera aportado resultados más específicos sobre lo reportado en los estudios mastográficos. Sin embargo, ello depende en gran parte de la accesibilidad y disponibilidad de los datos, lo que, por cierto, explica que este diseño no fue de base poblacional, esto es, no se incluyeron usuarias del sector privado u otros servicios de salud (Instituto Mexicano del Seguro Social, Instituto de Seguridad y Servicios Sociales de los Trabajadores del Estado, entre otros). Aun así, un aspecto que destacar en el diseño presentado es el análisis geográfico respecto a datos clínicos que generalmente no son accesibles, o bien son utilizados únicamente en el ámbito clínico. Por lo tanto, los resultados aportaron otra perspectiva a la problemática que actualmente representa el proceso de detección del CaMa en mujeres en el Estado de Jalisco, que bien podría complementar las actividades en el ámbito administrativo y médico en los hospitales que proporcionan atención oncológica.
Conclusiones
En conclusión, los resultados de estudios mastográficos de usuarias atendidas en un hospital oncológico (2013-2015) permitieron identificar, por un lado, diferencias en la edad promedio de detección con sospecha y altamente sugestiva de malignidad de CaMa, esto es, entre 52 y 55 años, respectivamente. Por otro lado, se identificaron los municipios cuyo riesgo de detección en ambas categorías se incrementó hasta cuatro veces, esto es, zona suroeste y noreste de Jalisco. Por ello, la evidencia podría contribuir a determinar cuáles son los municipios donde se necesitan focalizar programas de tamizaje poblacional, como una alternativa para mejorar los procesos de detección y, por consiguiente, incrementar la oportunidad de un diagnóstico temprano de CaMa en las mujeres que son atendidas en el hospital oncológico que forma parte del Sistema Nacional de Salud.











 text new page (beta)
text new page (beta)


