Introducción
Se ha considerado que el cáncer constituye un problema mundial de salud pública1. En el 2002, la Organización Mundial de la Salud reportó que 24.6 millones de personas lo padecían2. En nuestro país, durante el 2005 se estimó que los tumores malignos constituyen la tercera causa de mortalidad nacional3.
El dolor en los enfermos oncológicos se presenta del 80 al 90% de los casos y es de origen multifactorial4,5. La causalidad de este síntoma se ha asociado con la enfermedad oncológica, la terapéutica antineoplásica y enfermedades concomitantes5. Se ha documentado que el dolor en estos pacientes se asocia a la enfermedad tumoral en el 92.5% de los casos, tiene una intensidad promedio de 3.6 a 4.3 mediante la escala visual analógica (EVA), presenta exacerbaciones con una intensidad de 6.6 a 7.7 mediante la EVA, tiene una duración promedio de 5.9 meses, es de tipo irruptivo en el 64.4% de los casos y se presenta dolor en más de un sitio en el 24.8% de los casos6.
Aunado a lo anterior, se ha documentado que el enfermo con cáncer presenta una gran diversidad de síntomas asociados5; entre ellos se encuentran los desórdenes del sueño. Se estima que estas alteraciones se presentan en el 29 al 95% de los casos. La frecuencia de las alteraciones del dormir en estos pacientes depende del tipo, estadio y tratamiento de la neoplasia7.
En este sentido, se han identificado diversas alteraciones del dormir en el enfermo con dolor por cáncer; entre las que destacan: dificultad en el inicio del sueño y la capacidad de mantenerse dormido, un despertar temprano, incremento del número de horas en vigilia, una pobre eficiencia del sueño e incremento de la somnolencia diurna8,9. Así mismo, se ha documentado que estos pacientes presentan una mala calidad de sueño10,11 y que esta serie de alteraciones inciden en las condiciones de vida de estos enfermos.
Por otro lado, se ha observado que el sentimiento de desesperanza, la farmacoterapia opioide y la interferencia del dolor con el estado de ánimo son elementos que pueden influir en la calidad del sueño12. Por ello, es de vital importancia documentar la calidad de este en los enfermos con cáncer, con la finalidad de mejorar sus condiciones de vida y proporcionarles un abordaje terapéutico integral en forma óptima y racional. Con base en esta serie de consideraciones, el objetivo del presente trabajo es evaluar la calidad del sueño en enfermos con dolor de origen oncológico.
Materiales y método
Selección de los pacientes de estudio
Siguiendo la normativa mexicana para la investigación en salud y los parámetros éticos para las investigaciones en seres humanos13-15, y una vez obtenida la aprobación del protocolo por el Comité de Ética e Investigación de la institución, se realizó un estudio de cohorte comparativo y transversal, en pacientes que acudieron a una clínica del dolor.
En coincidencia con el teorema central del límite, se compararon dos grupos: el grupo A, formado por enfermos oncológicos con dolor por cáncer (n = 30), y el grupo B, formado por individuos sanos (n = 30). Se incluyó a sujetos: a) mayores de 18 años de edad, b) con ausencia de trastornos psiquiátricos, c) con deseos de participar en el estudio, d) capaces de contestar o completar los instrumentos de evaluación, y e) con presencia de dolor de origen oncológico (Fig. 1).
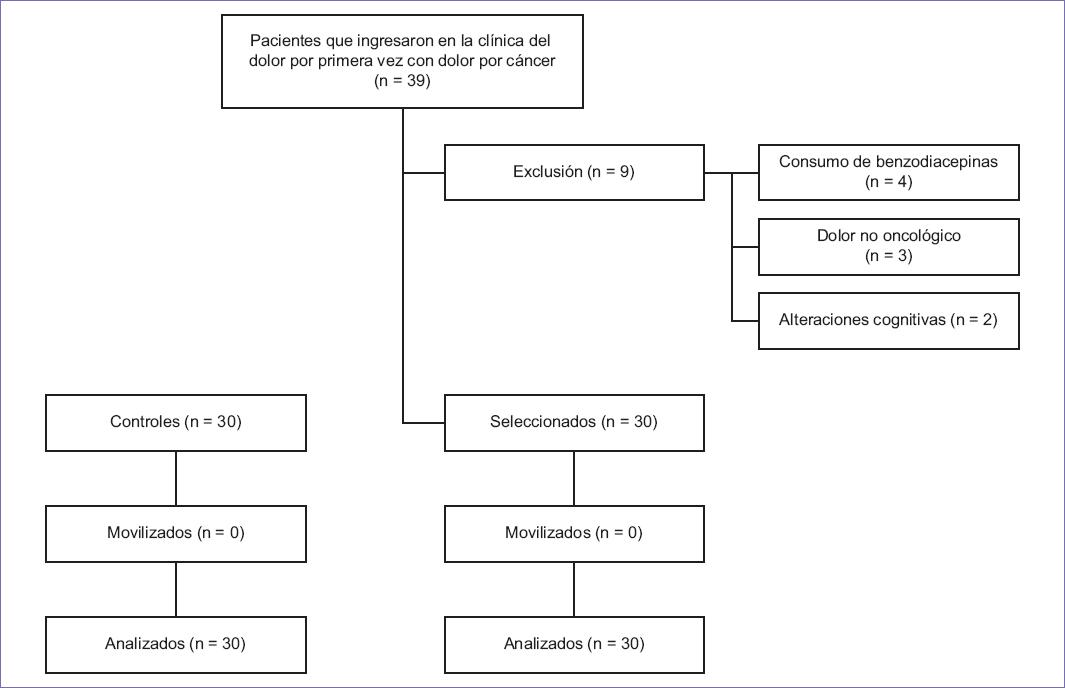
Figura 1 Diagrama de flujo de la selección de los sujetos de estudio. Se formaron dos grupos: un grupo control (n = 30) y un grupo de personas con dolor por cáncer (n = 30).
Los enfermos con: a) dolor localizado en región facial, b) dolor originado por enfermedades autoinmunitarias, c) fibromialgia, d) sensación y/o dolor de miembro fantasma, y/o e) cefalea migrañosa fueron eliminados del estudio. Se movilizó a aquellos con instrumentos de evaluación incompletos.
Características del instrumento de evaluación
El instrumento de evaluación utilizado en este estudio se aplicó a ambos grupos en una sola ocasión mediante entrevista directa, y contenía los siguientes elementos:
–Variables demográficas. Se recolectó información acerca del sexo, edad, estado civil y escolaridad de los sujetos de estudio.
–Escala funcional de Karnofsky (KFS). Esta escala califica la funcionalidad de los individuos oncológicos en forma ascendente con múltiplos de 10. La calificación de cero corresponde a la muerte física; mientras que una calificación de 100 corresponde a una funcionalidad normal sin evidencia de enfermedad16,17.
–Características de la neoplasia. Se documentó el tipo (tumores sólidos y tumores hematopoyéticos), estadio (I al IV) y tratamiento (quimioterapia y radioterapia) de la enfermedad oncológica.
–Escalas de evaluación del dolor. De acuerdo con los parámetros de práctica para el tratamiento del dolor por cáncer18; se utilizaron las siguientes escalas para evaluar la intensidad del dolor: la EVA de 100 mm (0 mm corresponde a la ausencia de dolor y 100 mm al peor dolor posible) y la Escala Verbal Analógica (EVERA) de 4 puntos (ausencia de dolor, dolor leve, dolor moderado y dolor severo).
–Índice de Calidad del Sueño de Pittsburgh (PSQI). Se utilizó la versión colombiana de este instrumento19,20. El PSQI, evalúa siete áreas o campos asociados al sueño, cada uno de estos campos se valora del 1 al 7 (C1-C7) y evalúan: la calidad subjetiva del sueño (C1), la latencia del sueño (C2), la duración del sueño (C3), la eficiencia habitual del sueño (C4), los desórdenes del sueño (C5), el empleo de medicamentos para dormir (C6) y la disfunción diurna (C7). A cada componente se le otorga un valor de 0 a 3 puntos; la sumatoria de estos corresponde a la calificación global PSQI. Una calificación mayor de 5 puntos es indicativa de una mala calidad del sueño.
–Escala de Somnolencia Diurna de Epworth. Este instrumento evalúa en forma general la somnolencia diurna presente en los enfermos; consta de 8 reactivos los cuales se califican en una escala del 0 al 3 (0, no somnolencia; 1, somnolencia leve; 2, moderada; y 3, severa). La sumatoria de estos reactivos proporciona una calificación global; la cual, de 0 a 6 puntos corresponde a suficiente sueño, de 7 a 8 puntos corresponde a una calificación de somnolencia promedio a la poblacional, y de 9 o más puntos corresponde a somnolencia diurna que requiere atención médica21.
–Estado psicoafectivo. Esta evaluación tomó en consideración las validaciones mexicanas de los inventarios de Beck para depresión22 y ansiedad23. El inventario de depresión de Beck (BDI) se utiliza para medir la severidad de los síntomas de depresión, el de ansiedad (BAI) mide la severidad de los síntomas de ansiedad. Ambos instrumentos tiene 21 reactivos y dependiendo del puntaje obtenido, estos síntomas son clasificados como mínimos, leves, moderados o severos.
Análisis estadístico
Se identificaron las medidas de tendencia central y de dispersión de las variables de estudio. Se compararon los resultados obtenidos de ambos grupos. A las variables paramétricas se les aplicó una prueba t de Student y análisis de regresión; a las no paramétricas se les aplicó una prueba de χ2 y ANOVA. Se consideraron significativos los valores de p ≤ 0.05. Para el análisis estadístico se utilizó un software compatible con plataforma de Windows (SPSS v.11®; SPSS, Inc.; Chicago, Ill, EE.UU.).
Resultados
Variables demográficas generales
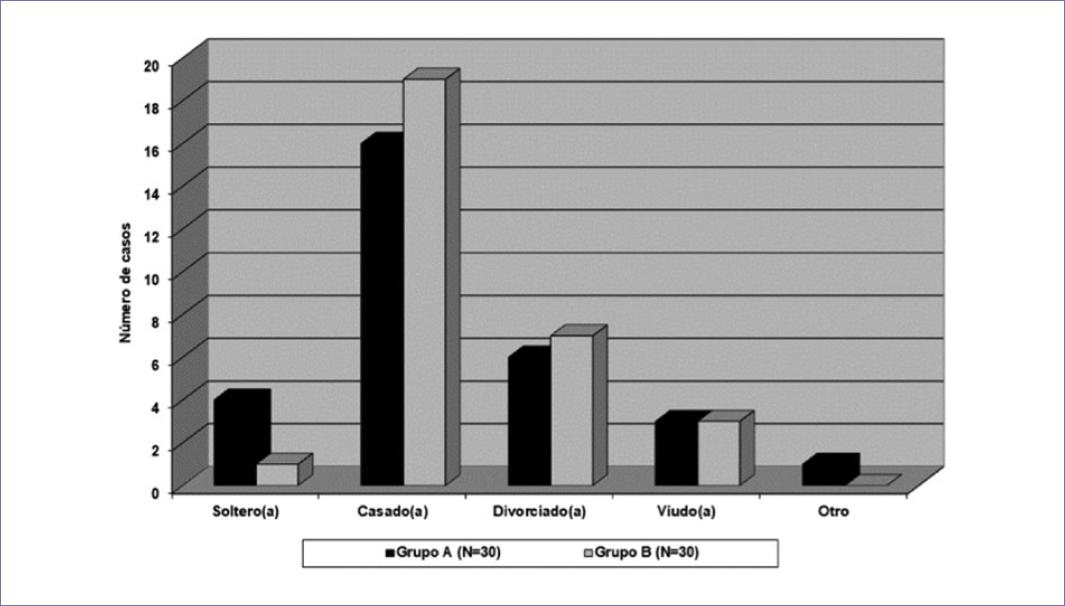
Los resultados demográficos de ambos grupos se representa en la tabla 1 y la figura 2; no se identificaron diferencias estadísticamente significativas entre ellos. Se encontró una mayor proporción de mujeres en ambos grupos. El promedio de edad, en ambos grupos, se situó en la sexta década de la vida. De igual forma, la escolaridad promedio en ambos grupos fue de 9 a 10 años de estudios.
Tabla 1 Variables demográficas de los sujetos de estudio (n = 60).
| Variable | Grupo A (n = 30) | Grupo B (n = 30) | Valor de p* | |||
|---|---|---|---|---|---|---|
| n | % | n | % | |||
| Mujeres | 18 | 60 | 20 | 66 | 0.42 | |
| Media ± DS | Media ± DS | Diferencia media | Valor de p† | |||
| Edad (en años) | 58 ± 13.3 | 57 ± 13.7 | 0.96 | 0.65 | ||
| Escolaridad (en años) | 10 ± 4.9 | 9 ± 4.9 | 1.2 | 0.35 | ||
El grupo A está constituido por individuos con dolor de origen oncológico; el grupo B por sujetos sanos (grupo control).
p*, valor de p obtenido mediante †2 (Pearson).
p†, valor de p obtenido mediante una prueba pareada de t de Student.
DS: desviación estándar; n: número de sujetos.
Características del dolor en los pacientes con cáncer
En este grupo de pacientes se identificó que: el 77% presentaron un tumor sólido y el 23% un tumor hematopoyético; el 10% tenía una neoplasia estadio I, el 17% estadio II, el 40% estadio III y el 33% un estadio IV; el 20% se encontraba en tratamiento con quimioterapia, el 16.7% con radioterapia, el 3.3% presentaba ambos esquemas y el 66.7% ninguno de ellos; y la KFS presentó un promedio de 80 (desviación estándar [DS]: 13) (Tabla 2).
Tabla 2 Tipo y estadío de la neoplasia (Grupo A, n = 30)
| Tipo de neoplasia | |||||||
|---|---|---|---|---|---|---|---|
| Sólido | Hematopoyético | Valores acumulados | |||||
| n | % | n | % | Total | % total | ||
| Estadio de la neoplasia | I | 2 | 9 | 1 | 14 | 3 | 10 |
| II | 3 | 13 | 2 | 29 | 5 | 17 | |
| III | 11 | 48 | 1 | 14 | 12 | 40 | |
| IV | 7 | 30 | 3 | 43 | 10 | 33 | |
| Total | 23 | 77 | 7 | 23 | 30 | 100 | |
La tabla corresponde al Grupo A. Número (n) y proporción (%) de los estadíos tumorales por tipo de neoplasia.
Respecto a las características del dolor, se observó en el 40% de los pacientes dolor de tipo somático, en el 50% visceral y en el 10% neuropático. Así mismo, se identificó que la intensidad del dolor promedio mediante la EVA fue de 4 (DS: 1). Mediante la EVERA, el 3.3% no presentaron dolor, el 43.3% mostraron dolor leve, el 50% moderado y el 3.3% severo (Tabla 3). En los pacientes con una tumoración sólida la intensidad del dolor mediante la EVA fue en promedio de 4.09 (DS: 1.2) y en los que presentaron un tumor de tipo hematopoyético de 4.29 (DS: 1.9); no se identificaron diferencias estadísticamente significativas entre ambos tipos de neoplasia.
Tabla 3 Intensidad del dolor (EVA y EVERA) con respecto al tipo de dolor (Grupo A, n = 30)
| Intensidad del Dolor | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| EVA | EVERA | ||||||||||
| No dolor | Dolor leve | Dolor moderado | Dolor severo | ||||||||
| Tipo de dolor | Media | DS | N | % | N | % | N | % | N | % | |
| Somático | 4 | ± | 2 | 0 | - | 3 | 10 | 8 | 27 | 1 | 3 |
| Visceral | 4 | ± | 1 | 1 | 3 | 8 | 27 | 6 | 20 | 0 | - |
| Neuropático | 4 | ± | 1 | 0 | - | 2 | 7 | 1 | 3 | 0 | - |
| Mixto | 0 | - | 0 | - | 0 | - | 0 | - | 0 | - | |
La tabla corresponde a los sujetos del Grupo A.
EVA: escala visual análoga; EVERA: escala verbal análoga; DS: desviación estándar; N: Número de sujetos.
Por otro lado, los pacientes con un estadio I presentaron una intensidad promedio de 4 (DS: 0), los que tenían un estadio II mostraron una intensidad promedio de 3.4 (DS: 1.5), en estadio III una intensidad promedio de 4.1 (DS: 1.5), y en estadio IV una intensidad promedio de 4.5 (DS: 1.6). No se observaron diferencias significativas respecto al estadio de la neoplasia y la intensidad del dolor evaluado mediante la EVA. Respecto a la EVERA, en los pacientes que reportaron la ausencia de dolor solo se presentó un caso (estadio III), con dolor leve se identificaron 13 casos (1 estadio I, 2 estadio II, 6 estadio III y 4 estadio IV), con dolor moderado se documentaron 15 casos (2 estadio I, 3 estadio II, 5 estadio III y 5 estadio IV), y con dolor severo un caso (estadio IV). No se observaron diferencias significativas respecto al estadio de la neoplasia y la intensidad del dolor mediante la EVERA.
Los pacientes que recibieron quimioterapia presentaron una intensidad del dolor mediante la EVA en promedio de 4.6 (DS: 2.3), los que recibieron radioterapia de 3.5 (DS: 0.5), los que recibieron ambos abordajes de 3 (DS: 0.5) y los que no fueron tratados de 4.1 (DS: 1.3). No se observaron diferencias significativas respecto a la intensidad del dolor (EVA) y el abordaje antineoplásico (quimioterapia y radioterapia) (Tabla 4). Con respecto a la intensidad del dolor según la EVA y la FKS, se identificó que a una menor puntuación en la KFS, mayor era la intensidad del dolor (R lineal: 0.5; p = 0.002) (Fig. 3).
Tabla 4 Intensidad del dolor respecto a las características de la neoplasia
| EVA | ||
|---|---|---|
| Media | DS | |
| Tipo de neoplasia | ||
| Sólido | 4 | 1 |
| Hematopoyético | 4 | 2 |
| Estadio de la neoplasia | ||
| I | 4 | 0 |
| II | 3 | 2 |
| III | 4 | 1 |
| IV | 5 | 2 |
| Quimioterapia | ||
| Sí | 4 | 2 |
| No | 4 | 1 |
| Radioterapia | ||
| Sí | 4 | 1 |
| No | 4 | 2 |
Se muestran los datos del Grupo A.
EVA: escala visual análoga; DS: desviación estándar.
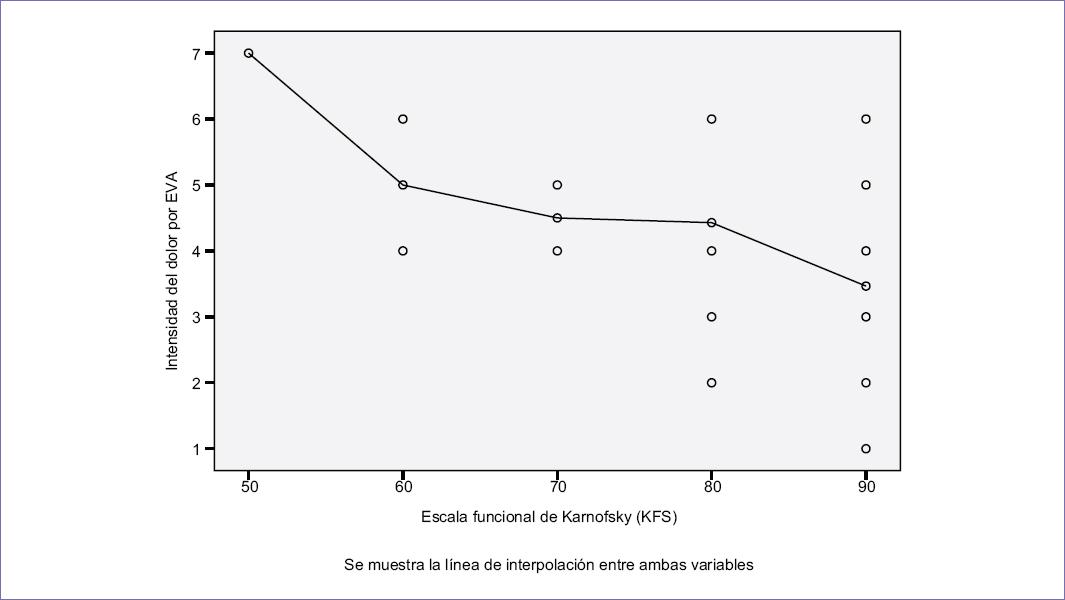
Figura 3 La figura correlaciona la intensidad del dolor medida con la escala visual analógica (EVA) con la escala funcional de Karnofsky. Podemos identificar que existe una correlación positiva entre ambas variables. A mayor intensidad de dolor corresponde una menor calificación de Karnosfsky (R lineal: 0.5; p = 0.002).
Características de la calidad del sueño en los pacientes con cáncer
En los pacientes con dolor por cáncer: a) la calificación del PSQI fue en promedio de 9.8 (DS: 4.6), b) se presentaron diferencias estadísticamente significativa entre los «buenos» y los «malos dormidores» (p = 0.007), y c) la somnolencia diurna presentó una calificación de 4.3 (DS: 3.0). Se observó que al incrementarse la intensidad del dolor según la EVA aumentó la puntuación obtenida en el PSQI (R lineal: 0.51; p = 0.004) y la calificación obtenida en el Epworth (R lineal: 0.4; p = 0.025) (Fig. 4). Así mismo, se identificó que al disminuir la puntuación de la KFS, se incrementa la calificación obtenida en el PSQI (R lineal: 0.67; p = 0.000) (Fig. 5)
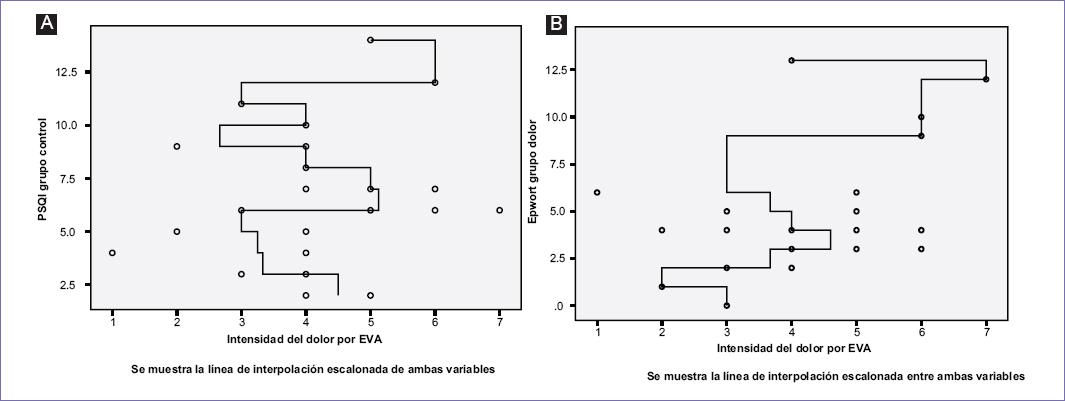
Figura 4 La figura muestra la intensidad del dolor valorada mediante la escala visual analógica (EVA) y su correspondencia con el índice de calidad de sueño de Pittsburgh (PSQI) o la escala de somnolencia de Epworth. Se observó que al incrementarse la intensidad del dolor según la EVA aumentó la puntuación obtenida en el PSQI (R lineal: 0.51; p = 0.004) y la calificación obtenida en el Epworth (R lineal: 0.4; p = 0.025) en forma significativa.
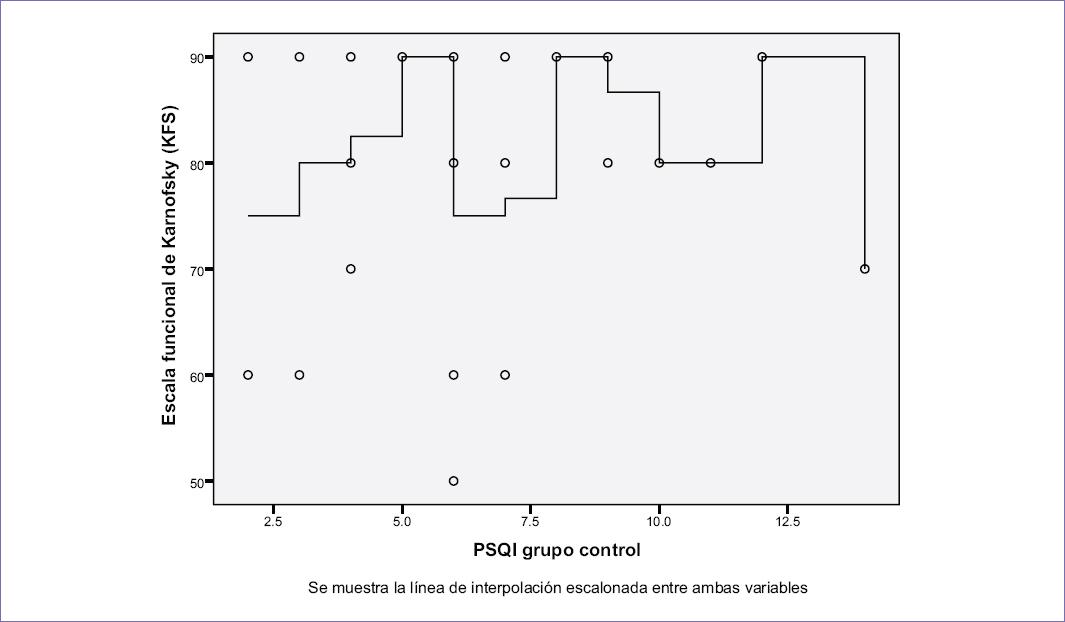
Figura 5 La figura muestra la calificación obtenida en la escala funcional de Karnosfsky (KFS) y la calificación obtenida en el índice de calidad de sueño de Pittsburgh (PSQI). Se identificó que al disminuir la puntuación de la KFS se incrementa la calificación obtenida en el PSQI (R lineal: 0.67; p = 0.000).
Del mismo modo, en los pacientes con tumores hematopoyéticos se observó una mayor puntuación en la calificación del PSQI (media: 13 ± 5.4) que en los pacientes con tumores sólidos (media: 8.8 ± 4); estas diferencias fueron significativas (p = 0.03). La clasificación del PSQI en «buenos» y «malos dormidores» no presentó diferencias respecto al tipo de neoplasia. La calificación obtenida en el estadio IV presentó diferencias sobre las observadas en los estadios II y III (IV vs. II, p = 0.02; IV vs. III, p = 0.005); estas no se observaron respecto a la clasificación de este instrumento. En comparación con los enfermos oncológicos que no recibieron quimioterapia o radioterapia, los pacientes con estos tratamientos no presentaron diferencias estadísticamente significativas con respecto al puntaje obtenido en el PSQI y en el Epworth.
Análisis comparativo entre enfermos con cáncer y sujetos control
En los pacientes con dolor la calificación del PSQI fue en promedio de 9.8 (DS: 4.6) y en los pacientes control de 6.3 (DS: 2.9); estas diferencias fueron estadísticamente significativas (p = 0.001) (Tabla 5). Mediante la clasificación del PSQI, en los pacientes con dolor se presentaron diferencias estadísticamente significativa entre los «buenos» y «malos dormidores» (p = 0.007); en los pacientes control no se observó esta diferencia. Entre ambos grupos (A vs. B), los «buenos dormidores» no presentaron diferencias significativas; por el contrario, los «malos dormidores» sí presentaron diferencias estadísticamente significativas (grupo A: 27 casos vs. grupo B: 21 casos; p = 0.001) (Fig. 6).
Tabla 5 Evaluación de la calidad del sueño y somnolencia diurna.
| Grupo A (n = 30) | Grupo B (n = 30) | Diferencia media (A-B) | Valor de p* | |
|---|---|---|---|---|
| Media ± DS | Media ± DS | |||
| PSQI | 10 ± 5 | 6 ± 3 | 3.4 | 0.002 |
| Epworth | 4 ± 3 | 3 ± 2 | 1.7 | 0.011 |
El grupo A está constituido por individuos con dolor de origen oncológico; el grupo B por sujetos sanos (grupo control).
p*, valor de p obtenido mediante una prueba pareada de t de Student.
DS: desviación estándar; PSIQ: índice de calidad del sueño de Pittsburgh.
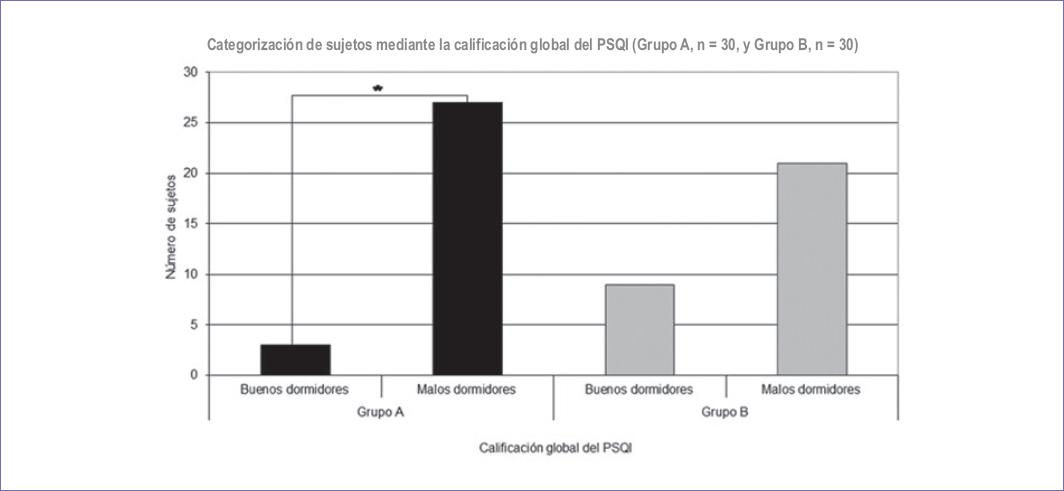
Figura 6 Se muestra la calificación global obtenida en el índice de calidad de sueño de Pittsburgh (PSQI) mediante su categorización en dos grupos («buenos dormidores» vs. «malos dormidores») con punto de corte en una calificación global de 5 puntos. Se comparan los resultados de ambos grupos (grupo A [personas con dolor por cáncer], n = 30, y grupo B [control], n = 30). Se aprecia que en las personas con dolor por cáncer existe un número mayor de «malos dormidores» y eso es estadísticamente significativo (p = 0.001).
En los pacientes oncológicos, la somnolencia diurna presentó una calificación de 4.3 (DS: 3.0) y en los sujetos control de 2.6 (DS: 1.9); esta diferencia presentó diferencias estadísticamente significativas (p = 0.012). Del mismo modo, se caracterizó que a una mayor calificación en el PSQI corresponde una mayor calificación en el Epworth (R lineal: 0.6; p = 0.000).
Respecto al estado psicoafectivo, se identificó que en los enfermos con cáncer la puntuación obtenida en el BAI fue en promedio de 6.4 (DS: 6.2) y en los sujetos control de 1.1 (DS: 1.7); esta diferencia fue estadísticamente significativa (p = 0.000). Así mismo, se caracterizó que a una mayor calificación en la BAI corresponde una mayor calificación en el PSQI (R lineal: 0.72; p = 0.000). Respecto a la escala de depresión, se observó que los enfermos con cáncer tuvieron una puntuación promedio de 7.33 (DS: 8.0) y en los sujetos control fue de 0.6 (DS: 1.0); esta diferencia fue estadísticamente significativa (p = 0.000). De igual forma, se identificó que a una mayor calificación en la BDI corresponde una mayor calificación en el PSQI (R lineal: 0.65; p = 0.000).
Discusión
En nuestro país, durante el 2005, se estimó que los tumores malignos constituyen la tercera causa de mortalidad nacional3. El dolor en estos enfermos se presenta del 80 al 90% de los casos y es de origen multifactorial4,5. Así mismo, la frecuencia de las alteraciones del dormir se presentan en el 29 al 95% de los casos y depende del tipo, el estadio y el tratamiento de la neoplasia7. Se ha documentado que estos pacientes presentan una mala calidad de sueño10,11 y que esta serie de alteraciones incide en sus condiciones de vida.
En este reporte se observó que en los pacientes con dolor de origen oncológico, el número de «malos dormidores» mediante el PSQI fue significativamente mayor. En este sentido, Gooneratne, et al. (2007) reportaron que en comparación con sujetos sanos, el 56% de los enfermos con dolor por cáncer fueron considerados «malos dormidores». Más aún, dicho estudio puntualiza que el inicio de las alteraciones del dormir observadas en el enfermo oncológico se asociaron con el diagnóstico de la neoplasia24.
Se ha documentado que el incrementarse la intensidad del dolor según la EVA, se favorece una mala calidad del sueño25. Mystakidou, et al. (2007) han documentado que en el paciente oncológico la intensidad del dolor según la EVA se relaciona con la calidad del sueño, la calidad de vida y la percepción del dolor10. En forma coincidente, en este estudio observamos que una mayor intensidad del dolor aumenta significativamente la puntuación obtenida en el PSQI.
Aunado a lo anterior, este estudio caracterizó que una mayor calificación global de la PSQI o un dolor más intenso se asocian a una mayor somnolencia mediante la escala de Epworth. En este sentido, Sela, et al. (2005) han reportado que la fatiga se relaciona con la dificultad para iniciar el sueño y un despertar más temprano8. Esta asociación ha sido descrita por otros investigadores26.
En este reporte se observó que la clasificación del PSQI en «buenos» y «malos dormidores» no presenta diferencias con respecto al tipo de neoplasia. En este sentido, al parecer la bibliografía existente no ha documentado el efecto del tipo de neoplasia sobre la calidad del sueño. Sin embargo, se ha reportado que la KFS se asocia a una mala calidad de sueño26. Esta aseveración es coincidente con lo identificado en este estudio.
Davidson, et al. (2002) compararon la presencia de alteraciones del dormir en pacientes con quimioterapia, radioterapia o cirugía respecto a enfermos oncológicos sin tratamiento; en este estudio no se reportaron diferencias significativas entre ambos grupos27. En coincidencia, en este reporte, observamos que en comparación con los enfermos oncológicos que no recibieron quimioterapia o radioterapia, los pacientes con estos tratamientos no presentaron diferencias estadísticamente significativas con respecto al puntaje obtenido en el PSQI y en el Epworth.
Se ha documentado una alta correlación entre la presencia de ansiedad y la dificultad para iniciar el sueño8. De igual forma, la desesperanza y la analgesia son factores que se han asociado a una mala calidad del sueño en pacientes con cáncer en etapas avanzadas10. En este sentido, en el presente trabajo se observó que los índices de depresión y ansiedad se asocian a una mala calidad del sueño. Estos hallazgos son coincidentes a lo reportado con anterioridad por otros autores8,10,26,28. Este fenómeno es de especial relevancia, debido a que la depresión, la desesperanza, el uso de somníferos y una mala calidad del sueño presentan una alta correlación con el «deseo de muerte» en los enfermos con cáncer28.
Se ha identificado que los trastornos del sueño inciden en la intensidad del dolor, en el estado psicoafectivo y en la calidad de vida de los pacientes8,10,26. Aunado a lo anterior, diversos trabajos sugieren que el sueño y la intensidad del dolor presentan una asociación recíproca; de tal forma que la disminución en la intensidad del dolor mejora la calidad del sueño y viceversa29,30. Por tal motivo, la identificación de los desórdenes del sueño en los enfermos con dolor por cáncer puede ser un elemento que mejore las condiciones de vida de estos pacientes. Así mismo, la evaluación de la interacción de estas variables fisiológicas (sueño y dolor) posiblemente, nos oriente hacia la obtención de nuevas estrategias en el tratamiento del dolor y de los desórdenes del dormir.











 nueva página del texto (beta)
nueva página del texto (beta)