Introducción
A lo largo de la historia de la psiquiatría ha sido descrita una posible asociación entre ciertos trastornos psiquiátricos y diferentes anormalidades inmunológicas e inflamatorias.1 Un extenso rango de trastornos, incluyendo la esquizofrenia y otros trastornos psicóticos, han sido implicados en la presunta relación entre los síntomas neuropsiquiátricos y respuestas inflamatorias aberrantes.2 El descubrimiento de los anticuerpos dirigidos contra proteínas de la superficie neuronal, particularmente aquellos dirigidos contra el receptor N-metil-D-aspartato (NMDAr), ha revivido el interés en este campo de estudio, considerando la posibilidad de que un subgrupo de pacientes con psicosis afectivas y no afectivas puedan tener una etiología autoinmune.3 Así, en 2019 un consenso internacional marcó las pautas para el abordaje diagnóstico y tratamiento de los pacientes con psicosis de presunto origen autoinmune, buscando en gran medida identificar y tratar tempranamente a los pacientes con psicosis secundaria a enfermedades autoinmunes propias del sistema nervioso central (encefalitis autoinmune, EA) por anticuerpos de superficie neuronal, en ausencia de síntomas neurológicos claros.4
En el marco de la interacción genético-ambiental, los desórdenes autoinmunes ocurren luego de un fallo en los procesos de autorreconocimiento, provocando una producción de anticuerpos patogénicos dirigidos contra diferentes tejidos.3 Varios anticuerpos, tanto de enfermedades autoinmunes sistémicas como enfermedades autoinmunes primarias del sistema nervioso central, prototipo EA, ocasionan manifestaciones neuropsiquiátricas.4 Estas manifestaciones, incluidos los síntomas psicóticos, provocan que un elevado número de pacientes busquen evaluación psiquiátrica como un primer contacto con el sistema de salud.5,6 Emerge entonces la posibilidad de cometer errores o retrasos diagnósticos y terapéuticos en el marco de un abordaje clínico insuficiente, pues es solo cuando aparecen los síntomas neurológicos claros como crisis epilépticas, movimientos anormales o deterioro del nivel de consciencia que surge la sospecha de una encefalitis de origen autoinmune.7
Actualmente, las EA explican aproximadamente 6.5% de los primeros episodios de psicosis.8 Por esto, es crucial que los médicos psiquiatras y neurólogos consideren estas entidades como parte de su diagnóstico diferencial y reconozcan las banderas rojas para sospechar autoinmunidad en los pacientes que debutan con un inicio agudo/subagudo de síntomas psicóticos.4 La identificación temprana de estos pacientes es crucial para instaurar un tratamiento dirigido a la enfermedad de forma oportuna e impactar positivamente en su desenlace.9
El objetivo del trabajo es realizar una revisión sobre el concepto y el abordaje diagnóstico de la psicosis autoinmune.
Métodos
Las bibliografías utilizadas para el desarrollo de esta revisión narrativa fueron identificadas a través de búsquedas en PubMed y Google Scholar entre marzo de 2019 y marzo de 2020. Los artículos fueron seleccionados sin un límite de tiempo. Para la búsqueda se utilizaron los siguientes términos clave: anti-NMDA receptor encephalitis, autoinmune psychosis y autoinmune encephalitis; y fue restringida de acuerdo con los idiomas inglés y español. La lista final de los artículos incluidos se obtuvo con base en la relevancia de los temas abordados en esta revisión. Asimismo, se ha incluido un caso clínico que ejemplifica la presentación clínica y el abordaje diagnóstico de la psicosis autoinmune.
Definición conceptual de la psicosis
En primer lugar, es importante ofrecer una definición del término psicosis. El manual diagnóstico y estadístico de las enfermedades mentales, en su quinta versión (DMS-5), define como psicosis a un síndrome que se presenta en un conjunto de trastornos mentales caracterizados por ideas delirantes, alucinaciones, síntomas negativos (abulia, alogia, anhedonia, etcétera), pensamiento desorganizado y síntomas motores anormales (DSM-5).10 Si bien dicha definición es un buen punto de partida, es demasiado amplia al incluir otros síndromes, como el catatónico y el de síntomas negativos, por lo cual supone el riesgo de un sobrediagnóstico. Una definición más estrecha aparece en el apartado correspondiente al “Trastorno psicótico secundario a una condición médica general” del propio DSM-5, donde la definición se limita a la constatación de que el paciente padece alucinaciones o delirios. Para los fines de este artículo, la definición conceptual que se propone del término psicosis es la siguiente: se designa así a un síndrome, es decir a un patrón reconocible de signos y síntomas que pueden deberse a etiologías diversas. Este patrón clínico tiene como elemento definitorio la demostración de una pérdida del juicio de realidad, a pesar de que el paciente se encuentra en un estado de alerta conservado. Esto se puede expresar mediante uno o más de los siguientes síntomas cardinales:11
Delirios: creencias falsas en su contenido, definidas con una gran convicción e irreductibles a la criticas o la evidencia.
Alucinaciones sensoriales: percepciones falsas de cualquier modalidad sensorial que no tienen su origen en estímulos reales del medio externo. Cuando las alucinaciones son reconocidas como falsas, generalmente se habla de “alucinosis”, pero cuando la interpretación de las alucinaciones es delirante, es decir, cuando el contenido de la alucinación es tomado como real y se proyecta al medio externo, las alucinaciones indican un estado de psicosis.
Desorganización conceptual: alteración en el proceso del pensamiento debido a una grave falla en la asociación de ideas, lo cual se expresa como discurso incoherente o incomprensible.
Bases neurobiológicas de las psicosis
En el síndrome psicótico están involucradas varias alteraciones en ciertos neurotransmisores y en sus vías. Algunos anticuerpos descritos en las encefalitis autoinmunes, que se presenta con síntomas psicóticos, están dirigidos a los receptores de esos neurotransmisores, por lo que es importante revisar brevemente la función de los principales neurotransmisores involucrados en la psicosis.
Existen diversos estudios que han apuntado a las alteraciones en la regulación del glutamato, serotonina y dopamina como factores involucrados en la fisiopatología de los síntomas psicóticos.12 Si bien hace algunos años la principal teoría que dominaba era la de la disfunción de la dopamina, varios estudios sugieren que varios sistemas se encuentran alterados:
Dopamina. La dopamina tiene diversas vías que se han involucrado en diferentes procesos cognitivos y motores. La motivación, sensación de recompensa, memoria visuoespacial, afecto y atención son algunos de los elementos en los que este neurotransmisor se ve involucrado.13 Existen cuatro sistemas dopaminérgicos bien caracterizados. El primero se origina del área tegmental ventral mesencefálica y proyecta a la corteza prefrontal por el sistema mesocortical. El segundo sistema es el mesolímbico y también tiene su origen en las neuronas del área tegmental ventral, pero llega a la región del núcleo accumbens. Ambas vías se han llegado a llamar sistema mesocorticolímbico y se encargan de conductas de recompensa y motivación.13 Neuronas de la sustancia negra proyectan al núcleo estriado mediante la vía nigroestriatal. Dicha vía se encarga de la regulación del movimiento, planeación, así como almacenamiento de movimientos y procedimientos aprendidos. Esto lo realiza mediante las proyecciones directa e indirecta que también involucran al globo pálido interno, tálamo y núcleo subtalámico.13 La última vía es la tuberoinfundibular, la cual consiste en neuronas que se originan en el núcleo arqueado y periventricular del hipotálamo a la glándula hipófisis. Su principal función es la regulación de la secreción de la dopamina.13 Se ha planteado que la disfunción de las vías mesolímbica y mesocortical se relaciona con la emergencia de alucinaciones y delirios en pacientes con psicosis.14 Esto se fundamenta en varios argumentos científicos: la acción de los medicamentos antipsicóticos como antagonistas del receptor D2 de dopamina, los estados de psicosis inducidos por fármacos estimulantes que incrementan la acción de la dopamina, así como estudios de neuroimagen funcional (principalmente tomografía por emisión de positrones) en pacientes con psicosis primaria (esquizofrenia), que muestran un incremento en la síntesis de dopamina, una liberación aumentada de dopamina en respuesta a un impulso y un incremento de dopamina en el espacio sináptico.14 Las anormalidades en el sistema dopaminérgico también se han observado en pacientes que cursan con alucinaciones y delirios como resultado de enfermedades neurológicas,15 por lo cual se ha planteado el concepto de “estados hiperdopaminérgicos” en pacientes con psicosis secundaria a causas neurológicas como las infecciones cerebrales y las encefalitis.16
Glutamato. En modelos animales se ha demostrado que con el uso de antagonistas del receptor N-metil-D-aspartato se pueden inducir algunos síntomas psicóticos e igualmente se muestra hipermetabolismo hipocampal (como en pacientes con esquizofrenia).17 Esta disminución de glutamato se cree que es la responsable de causar un aumento en la secreción de dopamina debido a que reduce su actividad sobre receptores de ácido gamma-aminobutírico,18 disminuyendo la inhibición de la secreción de dopamina y causando alucinaciones auditivas e ideas delirantes. Debido a la distribución en toda la corteza, es difícil identificar una única vía relacionada con el glutamato en pacientes con psicosis.
Serotonina. La serotonina es un neurotransmisor sintetizado a partir del aminoácido triptófano. Las proyecciones de los núcleos del rafé (ubicados en el tallo cerebral) a la corteza tienen efectos reguladores en regiones específicas y en la secreción de otros neurotransmisores.18 Se ha observado que el tratamiento con antipsicóticos atípicos con actividad sobre receptores de serotonina ayuda a aminorar los síntomas psicóticos. El aumento en la expresión de receptores 5-HT2A y 5-HT1A en regiones corticales prefrontales sugiere que esta vía se interconecta con la del glutamato fomentando síntomas delirantes y alucinatorios.19 La serotonina forma parte de un sistema interconectado entre los tres neurotransmisores. El aumento de la actividad serotoninérgica produce una disminución de la actividad del glutamato y esta a su vez disminuye la inhibición de la expresión dopaminérgica mesolímbica, creando un aumento en la actividad de dicha vía. Esta es la teoría más aceptada de la fisiopatología de la psicosis.
La desregulación en estos sistemas se ha traducido en diversas manifestaciones clínicas, sin embargo, aún hay mucho por dilucidar.
Psicosis y autoinmunidad: antecedentes históricos
El concepto autoinmunidad se conoce desde los primeros años del siglo XX. Hace alusión a la incompetencia de un organismo para reconocer sus partes como propias y al desarrollo subsecuente de respuestas inmunológicas que afectan las células y tejidos pertenecientes.2,3 En el contexto de los síntomas psicóticos y esquizofrenia, se han encontrado diversas asociaciones con infecciones en edades tempranas, trastornos autoinmunes y disbiosis, que señalan la posibilidad de que un subgrupo de estos pacientes tenga síntomas mediados por mecanismos autoinmunes.3 Por ejemplo, la exposición materna a influenza o toxoplasmosis se asocia a mayor riesgo de desarrollar esquizofrenia;20,21 las enfermedades autoinmunes de la infancia, como el asma, pueden asociarse a incremento en el número de experiencias psicóticas en la adolescencia y al aumento en la incidencia de esquizofrenia en la adultez temprana;22 algunas condiciones autoinmunes proveen mayor riesgo de desarrollar esquizofrenia, el cual se incrementa linealmente con el número de episodios de infecciones graves.23,24 Más recientemente, el descubrimiento de anticuerpos dirigidos a la superficie sináptica y su asociación con manifestaciones neuropsiquiátricas en el contexto de las encefalitis autoinmunes han dado un nuevo énfasis en la relación de la psicosis y la autoinmunidad.3,25
En 2005, Roberta Vitaliani et al. describieron cuatro mujeres jóvenes que desarrollaron síntomas neuropsiquiátricos agudos, crisis epilépticas, alteraciones de la memoria, disminución del nivel de conciencia e hipoventilación asociados a teratoma ovárico y cambios inflamatorios en el líquido cefalorraquídeo (LCR).26 Dos años más tarde, Dalmau et al. identificaron la producción de anticuerpos contra el receptor NMDA en 12 pacientes con características clínicas similares, dando espacio a una nueva enfermedad que denominaron encefalitis anti-NMDAr.27 La presencia de síntomas neuropsiquiátricos y los modelos biológicos de enfermedades neuropsiquiátricas como la esquizofrenia que involucraban la disfunción de los receptores NMDA, disparó el interés en esta nueva enfermedad, sus formas de presentación, mecanismos fisiopatológicos y sus modalidades de tratamiento. Muchos investigadores clínicos se preguntaron si se trataba de una forma potencialmente reversible de esquizofrenia.
A partir de las asociaciones mencionadas entre los síntomas psicóticos con infecciones tempranas y enfermedades autoinmunes, seguido del descubrimiento de la encefalitis anti-NMDAr y otras encefalitis mediadas por anticuerpos (LGI1, AMPAR, GABAa, GABAb, CASPR2) que presentan síntomas psicóticos, diversos autores proponen la autoinmunidad como el mecanismo fisiopatogénico subyacente en un subgrupo de pacientes con psicosis agudas, subagudas y crónicas, dando lugar al concepto de psicosis autoinmune.2,3,28
Epidemiología de la psicosis, enfermedades autoinmunes y su asociación
Previo al advenimiento de las descripciones de las psicosis relacionadas con encefalitis autoinmunes y el descubrimiento de los anticuerpos neuronales de superficie como mecanismo subyacente de estas patologías, en décadas anteriores se había observado en estudios epidemiológicos que la psicosis se asocia a enfermedades autoinmunes sistémicas. A continuación, se describen datos sobre la incidencia de la psicosis y enfermedades autoinmunes y su asociación epidemiológica.
La incidencia de la psicosis varía en los diferentes reportes. Un estudio describe que la incidencia de todo tipo de psicosis es de 31.7 casos por 100 000 personas al año (IC 95% = 24.6-40.9), 23.2 casos (IC 95% = 18.3-29.5) para psicosis no afectiva, 15.2 casos (IC 95% = 11.9-19.5) para esquizofrenia y 12.4 (IC 95% = 0.0-17.1) para psicosis afectiva.29 Otro estudio reporta una incidencia de psicosis no orgánica de inicio en el adulto de 26.6 casos por 100 000 personas al año; y que el sexo masculino tiene mayor riesgo, tanto en todos los trastornos psicóticos (RM = 1.44, IC 95% = 1.27-1.62) como en trastornos psicóticos no afectivos (RM = 1.6, IC 95% = 1.44-1.77).30
La incidencia de las enfermedades autoinmunes es de 7.6-9.4 casos por 100 000 habitantes, las cuales son frecuentes en pacientes jóvenes, tanto como en enfermedades autoinmunes sistémicas (como lupus eritematoso sistémico, LES) como primarias del sistema nervioso central (encefalitis autoinmune y esclerosis múltiple).31
La psicosis como las enfermedades autoinmunes se presentan en pacientes jóvenes, por lo que es frecuente que ambas condiciones coexistan o estén asociadas en un mismo paciente. Un metaanálisis reportó asociación entre psicosis y enfermedades autoinmunes no neurológicas (RM = 1.26, IC 95% = 1.12-1.41), así como asociación entre psicosis y ciertas enfermedades autoinmunes específicas, por ejemplo anemia perniciosa (RM = 1.91, IC 95% = 1.29-2.84), pénfigo (RM = 1.9, IC 95% = 1.62-2.24), psoriasis (RM = 1.7, IC 95% 1.51-1.91), enfermedad celiaca (RM = 1.53, IC 95% = 1.12-2.1) y enfermedad de Graves (RM = 1.33, IC 95% = 1.0-1.72).32
En algunas enfermedades autoinmunes sistémicas, la psicosis forma parte del inicio o de la evolución de la enfermedad. El caso más representativo es el LES. Están reconocidos 11 síndromes neuropsiquiátricos de afección de sistema nervioso central, otorgando el término de neurolupus cuando se presenta alguno de estos síndromes, entre ellos la psicosis. La frecuencia de presentación de algún síndrome de neurolupus es de 12 a 95%.33 En la actualidad no existe un biomarcador que sea patognomónico de neurolupus. Los anticuerpos más frecuentes reportados son anti-DNA doble cadena (81%), anti-P ribosomal (60%) y anti-receptor-NMDA tipo 2 (32%), pero estos anticuerpos también pueden estar presentes en pacientes con LES sin manifestaciones neuropsiquiátricas.34 Otra enfermedad autoinmune donde se presenta psicosis es la encefalopatía de Hashimoto debido a anticuerpos antiperoxidasa, que se acompaña frecuentemente con alteración en las hormonas tiroideas; esta entidad responde adecuadamente a esteroides, de ahí el termino de encefalopatía respondedora a esteroide.35
Actualmente se desconoce la incidencia de la psicosis autoinmune, pero según la epidemiologia de las encefalitis autoinmunes se cree que debe ser una entidad patológica frecuente. Un estudio reportó que en pacientes con encefalitis de causa no determinada, las encefalitis por anticuerpos son más frecuentes que algunos agentes virales (enterovirus, herpes simple, virus de la varicela zóster, entre otros).36
Algunos pacientes con encefalitis autoinmune (principalmente cuando se habla de anti-NMDAr) pueden cursar con síntomas psicóticos sin síntomas o signos neurológicos, por lo que es importante revisar las características epidemiológicas de esta población afectada. Usualmente son pacientes jóvenes con una edad media de presentación de 21 años; 40 % menores de 18 años y solo 5% mayores de 45 años.9 Existe predilección hacía el sexo femenino (4:1).9,37
Presencia de anticuerpos neuronales de superficie en pacientes con síntomas psiquiátricos
Dentro del gran conjunto de las encefalitis autoinmunes, la encefalitis anti-NMDAr tiene la mayor asociación con manifestaciones psiquiátricas. Por esto, el estudio de anticuerpos antineuronales en personas con trastornos psicóticos se ha concentrado en investigaciones dirigidas a anticuerpos contra dicho receptor.38 Desafortunadamente, la mayoría de estos estudios se han realizado en suero, condicionándolos a errores tipo I y II, y no en LCR. Un reciente estudio metaanalítico demostró que la prevalencia de los anticuerpos IgG contra el NMDAr en suero en personas con primer episodio de psicosis varía entre 0 y 12%.39 Por otra parte, Oviedo Salcedo et al. no encontraron anticuerpos en LCR, incluido el anticuerpo dirigido al NMDAr, en 124 pacientes con psicosis sin síntomas neurológicos relevantes.40
Psicosis autoinmune y encefalitis autoimune
Posterior al descubrimiento de la descripción de la encefalitis autoinmune por anticuerpos NMDAr, se han descrito otros anticuerpos en la EA. En conjunto con los síntomas psiquiátricos en pacientes con encefalitis autoinmune, existen más datos neurológicos (crisis epilépticas, disfunción cognitiva y trastornos del movimiento) que orientan al diagnóstico. Es frecuente encontrar algunas neoplasias asociadas a estos autoanticuerpos, aunque su presencia no es obligatoria para desarrollar la enfermedad. Los autoanticuerpos están dirigidos contra proteínas de superficie sinápticas o algunas otras asociadas.4
Los mecanismos por los cuales los autoanticuerpos producen síntomas psiquiátricos o disfunción cerebral no están muy bien definidos; sin embargo, existen diversas teorías que apoyan a fenómenos de estimulación, modulación antigénica, activación de complemento, inflamación y pérdida de contacto de proteínas asociadas a las bloqueadas por los anticuerpos.25
Existen algunas diferencias que clínicamente pueden hacernos orientar a un anticuerpo específico como causante del síndrome psiquiátrico (NMDAR, GABAb, GABAa, LGI1, entre otros).39,41,42,43,44,45,46,47,48,49,50,51,52,53,54,55,56 En el Cuadro 1, se resumen los principales anticuerpos involucrados en la encefalitis autoinmune, que se acompañan de síntomas psicóticos.
Cuadro 1 Principales anticuerpos neuronales relacionados con encefalitis autoinmune, que ocasionan síntomas psicóticos y alteraciones neurológicas
| Antígeno | Descripción de antígeno | Alteraciones neurológicas | Manifestaciones psiquiátricas | Asociaciones |
| Antígenos frecuentemente afectados | ||||
| NMDA40 | Canal iónico de apertura por ligando | Crisis epilépticas, alteraciones autonómicas, movimientos anormales, encefalopatía, discinesias orolinguales | Alucinaciones visuales y auditivas, episodios esquizoafectivos, manía, catatonia, insomnio, trastornos por abuso o alimentarios | Teratoma ovárico |
| LGI141,42 | Proteína 1 inactivada del glioma rica en leucina | Encefalitis límbica, síndrome de Morvan y crisis epilépticas | Apatía, desinhibición, egocentrismo, trastorno obsesivo compulsivo, pérdida del decoro social | HLA DRB1*07:01, timoma, tumores pancreáticos y mesotelioma abdominal. |
| CASPR243,44 | Proteína similar a la asociada por contactina tipo 2 | Encefalitis límbica, neuromiotonía, síndrome de Morvan | Agitación, deterioro cognitivo, delirium | Timona |
| AMPAR45,46 | Canal de glutamato ionotrópico | Crisis epilépticas, ataxia, encefalitis límbica | Confusión, desorientación, psicosis aislada | Tumores malignos de mama, pulmón y timoma |
| GABAa47 | Receptor iónico que facilita la actividad del ácido aminogama butírico | Estado epiléptico, crisis epilépticas, alteración del despierto | Cambios de la personalidad, ansiedad, depresión | Neoplasias hematológicas |
| GABAb48 | Receptor del ácido aminogama butírico | Epilepsia farmacorresistente, ataxia | Apatía, agresividad, problemas de memoria, tendencia a la depresión | Tumores pulmonares |
| CRMP549,50 | Proteína mediadora de respuesta de colapsina 5 | Corea, neuropatía óptica, neuronopatía sensitiva | Confusión, psicosis, pseudodemencia | Tumor de pulmón de células pequeñas, timoma |
| Anti- amfifisina51,52 | Partícula encargada de exocitosis | Síndrome de persona rígida, ganglionpatía sensitiva, mielopatía | ¿Depresión, ansiedad? | Tumor de mama y de pulmón de células pequeñas |
| Antígenos más recientes o poco afectados | ||||
| D2R53 | Receptor de dopamina D2 | Encefalitis de núcleos de la base, corea, parkinsonismo | Trastornos del sueño | Más prevalente en edades pediátricas |
| DPPX54 | Proteína similar a dipeptidilpeptidasa tipo 6 | Hipereplexia, temblor, crisis epilépticas, mioclonías | Depresión, cambios de ánimo | Se acompaña de pérdida de peso y diarrea, asociado con linfoma |
| MGlur555 | Receptor de glutamato unido a proteína G | Cefalea, síndrome de Ofelia, crisis epilépticas | Psicosis, labilidad emocional, agitación, amnesia, hipersomnia | Asocia con linfoma de Hodgkin |
| IgLON556 | Proteína de adhesión celular, se desconoce su función | Trastorno del sueño REM y no REM, síntomas bulbares, corea, síntomas bulbares, alteración de la marcha, alteración de movimientos oculares | Alteración de la atención y memoria episódica | Asociación con HLA DRB1*10:01, HLA-DQB1*05:01 |
Detección de las psicosis autoinmunes
El concepto de psicosis autoinmune se refiere a la presencia de las manifestaciones clínicas del síndrome psicótico como resultado de un desorden autoinmune.2 Pero, ¿qué síntomas, signos o historia puede sugerir autoinmunidad en pacientes con psicosis? Aunque la literatura continúa siendo heterogénea en este campo, algunos signos y síntomas asociados, además del curso de la enfermedad, pueden guiar al clínico a sospechar autoinmunidad.7,25
Najjar et al. utilizan el término para identificar o sospechar trastornos autoinmunes que se presentan primariamente como psicosis con características atípicas.57 Ejemplos de presentaciones de psicosis atípica sugerentes de causa orgánica son:
Edad atípica de inicio.
Síntomas particulares como confusión, desorientación y alteraciones del lenguaje.
Síndrome catatónico.
Predominio de alucinaciones visuales o táctiles.
Antecedente o concurrencia de enfermedad médica o manifestaciones sistémicas, incluyendo pérdida de peso.
Falta de factores de riesgo predisponentes para psicosis primaria como antecedentes familiares de esquizofrenia, personalidad esquizoide premórbida o estrés precipitante para trastorno mental.
En el examen físico, los hallazgos clínicos acompañantes que sugieren psicosis autoinmune son:
Alteraciones neurológicas como encefalopatía de rápida evolución, crisis epilépticas, movimientos anormales, inestabilidad autonómica, alteraciones del lenguaje y disminución del nivel de consciencia.
Antecedentes de síntomas sistémicos o infecciosos sugestivos de fase prodrómica de autoinmunidad.
Hallazgos neurológicos evidentes en el examen neurológico.57
Para su abordaje algunos autores prefieren clasificar los síntomas psicóticos secundarios a problemas de regulación inmune en tres grandes grupos:57
Psicosis asociada con autoanticuerpos neuronales o sinápticos (anti-NMDAr, GABAa, GABAb, etcétera).
Psicosis asociada a enfermedades autoinmunes o inflamatorias clásicas (ejemplo LES, encefalopatía de Hashimoto).
Psicosis en pacientes con probable encefalitis en la cual no se detectan anticuerpos (“seronegativa”), pero cuya presentación es altamente sugestiva de una etiología autoinmune por la presentación clínica (psicosis atípica, signos neurológicos, crisis epilépticas), la respuesta al tratamiento (por ejemplo, esteroides) y los estudios de laboratorio y gabinete (por ejemplo, determinación de bandas oligoclonales en el líquido cefalorraquídeo).
Abordaje diagnóstico de la psicosis y encefalitis autoinmunes
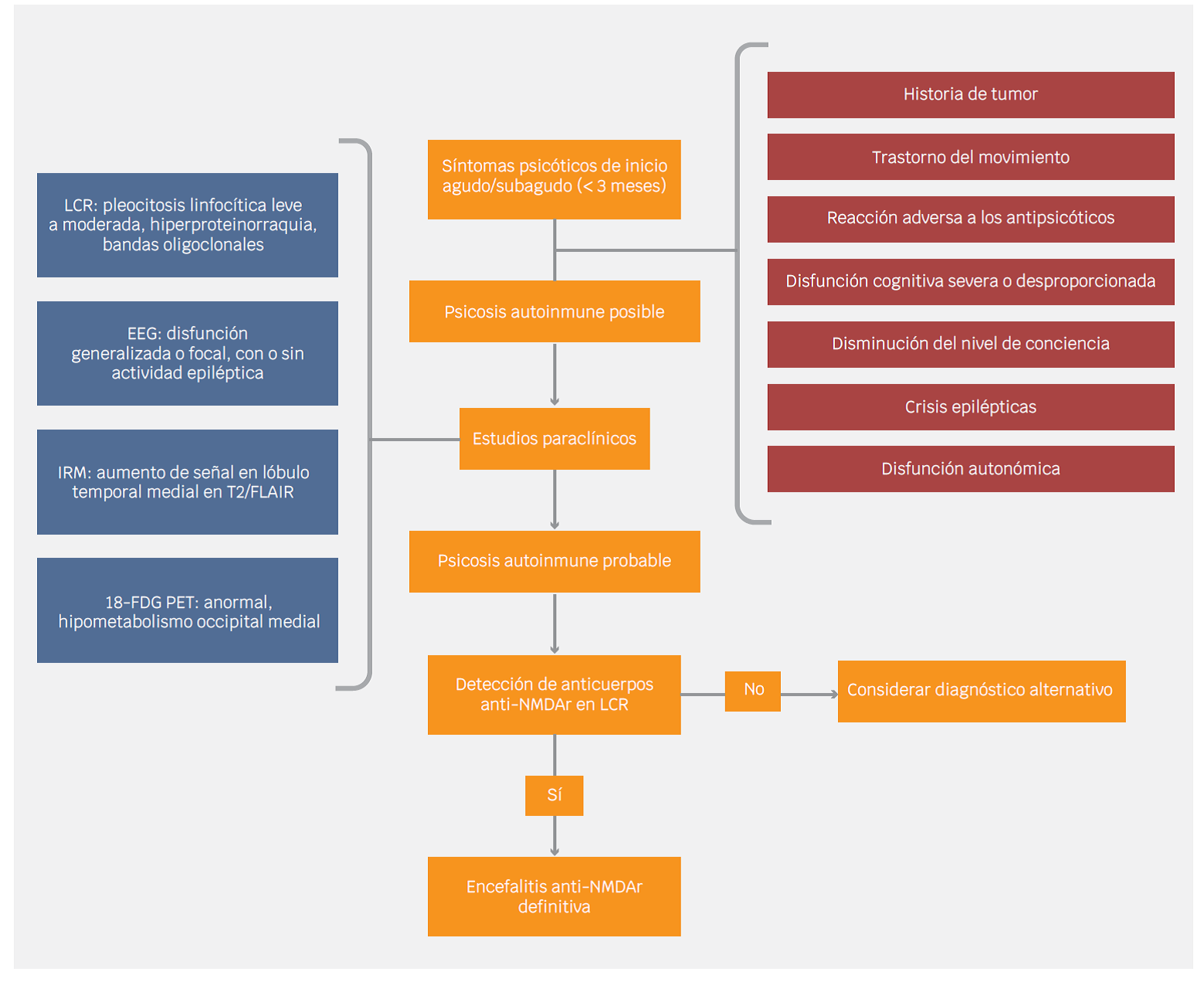
En 2016, Graus et al. desarrollaron un abordaje clínico para el diagnóstico de las encefalitis autoinmunes, orientado a la identificación y tratamiento de estas entidades. Estos criterios incluyen diferentes niveles de certeza (posible, probable y definitiva) para diferentes enfermedades inmunomediadas, incluyendo la encefalitis anti-NMDAr.58 Más recientemente, un consenso internacional desarrolló una propuesta de criterios diagnósticos para psicosis de presunto origen autoinmune, abogando por los pacientes con síntomas psicóticos en los que se identificaba una causa autoinmune y no cumplían cabalmente los criterios de Graus et al.28 También esta clasificación diagnóstica tiene diferentes niveles de certeza, empezando desde psicosis autoinmune posible hasta probable y definitiva. Un paciente cumple criterios de psicosis autoinmune posible cuando inicia con síntomas agudos/subagudos (menor a tres meses), acompañados de al menos uno de los siguientes: presencia de tumor, trastornos de movimiento (catatonia o discinesia), reacciones adversas graves con el uso de antipsicóticos, disfunción cognitiva grave o desproporcionada, disminución del nivel de consciencia, crisis epilépticas o disfunción autonómica significativa.28
Para los pacientes que cumplen con los criterios de psicosis autoinmune posible es necesario continuar hacia una evaluación mínima que incluye la realización de resonancia magnética cerebral, electroencefalograma y punción lumbar. La presencia de anormalidades en la resonancia magnética, el electroencefalograma o el LCR apoyarán o no el diagnóstico de psicosis autoinmune probable.28 Como se observa en el Cuadro 2, estos nuevos criterios se sobreponen con los de encefalitis autoinmunes en varios factores, especialmente con los de encefalitis anti-NMDAr probable.
Cuadro 2 Criterios diagnósticos de psicosis autoinmune y encefalitis anti-NMDAr
| Psicosis autoinmune posible* | |
| El paciente debe tener síntomas psicóticos de inicio abrupto (progresión rápida de < 3 meses) con al menos uno de los siguientes:
| |
| Encefalitis anti-NMDAR probable** | Probable psicosis autoinmune |
| El diagnóstico puede hacerse cuando se cumplen los siguientes tres criterios:
1. Inicio rápido (menos de tres meses) de por lo menos cuatro de seis de los siguientes grupos de síntomas:
2. Por lo menos uno de los siguientes resultados de laboratorio: 3. Exclusión razonable de otros trastornos. |
El paciente debe tener síntomas psicóticos actuales de inicio brusco (progresión rápida < 3 meses) con al menos uno de los siete criterios clínicos enumerados anteriormente para posible psicosis autoinmune y al menos uno de los siguientes: 1. Pleocitosis en LCR de >5 glóbulos blancos por μL. 2. Anomalías cerebrales bilaterales en la resonancia magnética de recuperación de inversión atenuada por líquido ponderada en T2 altamente restringido a los lóbulos temporales mediales. 3. O dos de los siguientes:
|
| Encefalitis anti-NMDAR definitiva*** | Psicosis autoinmune definitiva |
| Presencia de uno o más de los seis grupos mayores de síntomas y anticuerpos IgG anti-GluN1 en líquido cefalorraquídeo** | Debe cumplir los criterios de psicosis autoinmune probable con anticuerpos antineuronales IgG en LCR |
*Si un paciente cumple criterios para posible psicosis autoinmune, debe ser adecuadamente estudiado con electroencefalografía, resonancia magnética, análisis del líquido cefalorraquídeo (LCR, incluidos los autoanticuerpos). Los resultados deben conducir a un diagnóstico de psicosis no autoinmune o psicosis autoinmune probable/definitiva
**El diagnóstico de encefalitis anti-NMDAR probable también se puede realizar ante tres de los grupos de síntomas mencionados, asociados a un teratoma.
***La determinación de anticuerpos debe realizarse en el líquido cefalorraquídeo. Si solo se dispone de suero, deben realizarse pruebas confirmatorias (inmunohistoquímica de cerebro o sobre cultivos de neuronas).
Adaptado de Graus et al.3
En la encefalitis anti-NMDAr, la imagen por resonancia magnética (IRM) cerebral puede demostrar hiperintensidades en la secuencia FLAIR en el lóbulo temporal medial, ínsula, tallo cerebral, ganglios basales o corteza (Figura 1). Ahora bien, hasta 50% de los pacientes puede tener una IRM normal.58 El electroencefalograma es anormal en la mayoría de los pacientes (85 a 90%), no obstante, sus hallazgos suelen ser inespecíficos (actividad lenta y desorganizada). En algunos casos, los registros pueden mostrar actividad epiléptica, focal o generalizada.58 Hasta en 30% de los pacientes con encefalitis antiNMDAr se ha descrito un patrón conocido como delta brush extremo (inglés, extreme delta brush)59 (Figura 1). Por otra parte, el análisis de LCR es anormal en 80 % de los pacientes al inicio de la enfermedad y en cerca de 90% en etapas posteriores,58 porcentaje que podría ser menor: una revisión sistemática de casos reportados estimó que solo 58% de los pacientes tenía LCR anormal.29 La ausencia de hallazgos no excluye el diagnóstico de psicosis de origen autoinmune, que en casos difíciles dependerá de la astucia del clínico tratante para continuar los estudios y mantener un alto índice de sospecha de acuerdo con el fenotipo clínico.60
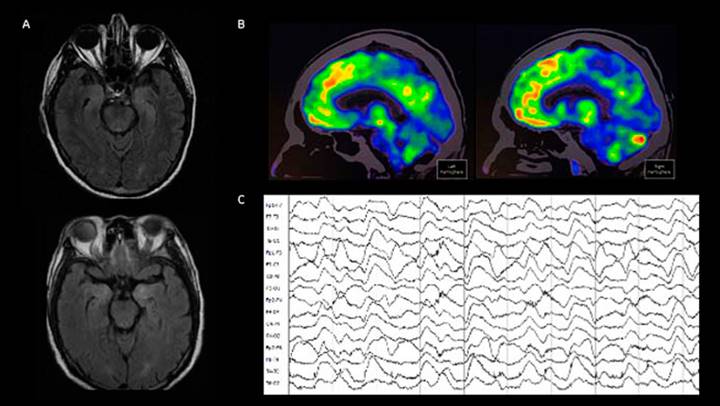
Figura 1 A) Resonancia magnética cerebral ponderada en T2 FLAIR con cortes axiales a nivel del lóbulo temporal medial. Se observa incremento en la intensidad de señal de las cabezas de los hipocampos bilateralmente. B) 18-FDG PET demuestra un hipometabolismo occipital medial. C) Electroencefalograma con patrón extreme delta brush. Las imágenes pertenece a una mujer de 16 años con cuadro grave de encefalitis anti-NMDAr.
La tomografía por emisión de positrones con tomografía con 18-fluorodesoxiglucosa (18-FDG PET) puede considerarse cuando el diagnóstico de encefalitis autoinmune por anti-NMDAr no ha sido apoyado por otros paraclínicos y la sospecha de esta persiste clínicamente.61,62 En 18-FDG PET, la presencia de un metabolismo cerebral con gradiente fronto-occipital disminuido en regiones mediales de los lóbulos occipitales apoya el diagnóstico de esta enfermedad.61,62,63 Esta herramienta puede ser útil para el manejo diagnóstico y, al mismo tiempo, ser una técnica importante en la búsqueda de posibles tumores asociados, además el hipometabolismo occipital medial puede ayudar en el manejo y seguimiento de los pacientes con encefalitis anti-NMDAr62,63 (Figura 1).
El diagnóstico definitivo de psicosis autoinmune se hace a través de la detección de algún anticuerpo en LCR. Si el anticuerpo es NMDAr, se tratará de encefalitis autoinmune definitiva por NMDAr. Tras el diagnóstico definitivo se sugieren que los pacientes sean evaluados para detectar tumores.28,58 Para la búsqueda de neoplasias ováricas se recomienda el uso de ultrasonido transvaginal seguido preferentemente de IRM o de tomografía abdominopélvica. Si el cribado tumoral inicial es negativo, se recomienda el seguimiento durante un plazo de dos a tres años, particularmente en mujeres jóvenes.28 En la Figura 2 se resume el abordaje diagnóstico de los pacientes con psicosis de presunto origen autoinmune y sospecha de encefalitis anti-NMDAr.
Diagnóstico diferencial
Al tratarse de un síndrome, la psicosis cuenta con diversas y múltiples etiologías y sus diagnósticos diferenciales transitan entre la neurología y la psiquiatría. Las alteraciones conductuales conducen a que los diagnósticos diferenciales psiquiátricos, como el trastorno afectivo bipolar y esquizofrenia, sean los primeros en considerarse.64 Los diagnósticos diferenciales neurológicos incluyen las encefalitis virales, vasculitis del sistema nervioso central, además de otras formas de encefalitis autoinmunes.64 Solo un subgrupo pequeño de psicosis será explicado por una causa autoinmune y deberá sospecharse cuando cumpla con los criterios de psicosis autoinmune posible o en presencia de las banderas rojas propuestas con anterioridad por diferentes autores (Cuadro 3).
Cuadro 3 Banderas rojas para sospechar psicosis autoinmune y encefalitis anti-NMDA
Manejo multidisciplinario en psicosis y encefalitis autoinmunes
El manejo de los pacientes con psicosis autoinmune secundaria a encefalitis autoinmune suele requerir de un equipo multidisciplinario donde la interacción entre psiquiatras y neurólogos es indispensable. El proceso terapéutico de estos pacientes puede dividirse en dos líneas paralelas, pero de aplicación simultánea:
Manejo sintomático de síntomas neuropsiquiátricos
Los síntomas neuropsiquiátricos de la EA suelen ser resistentes a tratamiento, lo que lleva a la necesidad de utilizar múltiples psicotrópicos para el control de estos y la de intervención de personal de enfermería experimentado.25 Ante la presencia de síntomas psicóticos se ha reportado el uso de antipsicóticos típicos como atípicos.65 Recientemente, Warren et al., analizaron 30 pacientes, de los cuales 83 % tuvieron síntomas psiquiátricos tempranos y fueron tratados con antipsicóticos (67 %) previa a la inmunoterapia, con una dosis equivalente diaria de olanzapina de 11.5 mg. Aunque este tratamiento disminuyó la agresividad en < 88 % de los casos, hubo poca mejoría de la psicosis, los síntomas afectivos y la catatonia, y no evidenciaron diferencias significativas en sensibilidad a antipsicóticos.66
Sin embargo, en otros escenarios, el uso de estos medicamentos se ha visto limitado por la intolerancia de los pacientes y el desarrollo efectos adversos importantes como síndrome neuroléptico maligno y alteraciones autonómicas.67 También se ha reportado empeoramiento de la agitación tras el uso de estos medicamentos, especialmente los de mayor bloqueo D2 (haloperidol). En casos de agitación severa, se ha descrito el uso de benzodiacepinas y antipsicóticos de segunda generación con diferentes tasas de éxito.65 Así mismo, el uso de dexmedetomidina es una opción para el manejo de agitación grave que no ha respondido a las opciones terapéuticas convencionales.68
Ante los síntomas catatónicos, las benzodiacepinas permanecen como la primera línea. El uso de antipsicóticos continúa siendo controversial, especialmente cuando se trata de antipsicóticos típicos.65 Ante respuesta inadecuada o parcial a otras opciones de tratamiento, el uso de terapia electroconvulsiva (TEC) ha tenido buenos desenlaces. De igual forma, la TEC ha resultado efectiva en diferentes reportes de casos en pacientes críticos con estados epilépticos refractarios.69
Manejo inmunológico dirigido a la enfermedad
En la actualidad, no existen guías de manejo inmunomodulador de la psicosis autoinmune. Las decisiones respecto al tratamiento se deben considerar ante un cuadro clínico de psicosis autoinmune probable o definida.28 Cuando la psicosis se presenta en un paciente conocido con LES o de reciente diagnóstico, las pautas terapéuticas serán enfocadas en el manejo de LES.33 Si se sospecha psicosis por enfermedad autoinmune primaria de sistema nervioso central, al igual que en la encefalitis autoinmune (NMDAr) se debe tomar en cuenta la edad del paciente, la presencia o ausencia de tumor y la gravedad de la enfermedad.9,28,58
Ante un cuadro clínico de psicosis probable por alteración en alguno de los estudios de gabinete sugeridos (EEG, punción lumbar, resonancia magnética de encéfalo) se puede considerar el inicio de bolos de metilprednisolona (1g cada 24 horas por cinco días en adultos).28 Esta observación de iniciar tratamiento inmunomodulador lo antes posible, se toma ante lo aprendido en la encefalitis autoinmune, el inicio temprano de tratamiento impacta directamente en el pronóstico funcional a corto y largo plazo de los pacientes.9 Por otra parte, el resultado de anticuerpos neuronales en LCR de superficie pueden tardar en su procesamiento y, como lo refiere Najjar et al., algunos pacientes pueden ser seronegativos a determinación de anticuerpos.57 De resultar psicosis autoinmune definida por la presencia de algún anticuerpo neuronal de superficie, como en NMDAr, se deben seguir las medidas terapéuticas inmunomediadas escalonadas sugeridas.58 El tratamiento involucra el uso precoz de bolos de metilprednisolona vía intravenosa durante cinco días, asociado a IgG vía intravenosa o terapia de recambio plasmático.58 La resección quirúrgica del tumor, cuando se considera el tratamiento definitivo de la enfermedad, debe hacerse en conjunto con las intervenciones inmunomoduladoras.28,58 De no obtener una respuesta favorable, se recomienda terapia inmunosupresora de segunda línea con rituximab o ciclofosfamida.58
Una vez que el paciente ha sido tratado efectivamente con inmunoterapia, los antipsicóticos o cualquier otro fármaco para el manejo sintomático deben retirarse lenta y cuidadosamente, vigilando la potencial reaparición de los síntomas psicóticos.4
Evolución y pronóstico
El pronóstico de la psicosis autoinmune depende a qué entidad autoinmune está ligada, y al ser una entidad recientemente descrita existe poca información. La mayor evidencia está concentrada en los casos de psicosis en el contexto de la encefalitis autoinmune por NDMAr. En estos casos, el pronóstico es favorable para los pacientes que responden a manejo inmunomodulador de primera línea.9 En el subgrupo de individuos con síntomas psicóticos o conductuales aislados, 83 % tiene una recuperación completa de los síntomas luego del tratamiento de primera línea.70 El inicio precoz de la inmunoterapia y la ausencia de ingreso a unidades de cuidados intensivos son factores de buen pronóstico. Por esto, la identificación temprana de los pacientes es la piedra angular en el manejo de la psicosis autoinmune y la encefalitis anti-NMDAr.4,71,72
Los síntomas cognitivos, relacionados con la interrupción de las funciones ejecutivas (atención, planeación y memoria de trabajo) y del comportamiento social (impulsividad, apatía y desinhibición), suelen ser los últimos en mejorar.73,74 Después del tratamiento y en la fase de recuperación los pacientes deben ser monitoreados en su nivel de funcionalidad y cognición periódicamente para la detección de recaídas.73,75 El riesgo estimado de recidiva, incluso años después de la resolución del primer episodio, es de 10 a 25%, siendo mayor para quienes no se detectan tumores y quienes reciben inmunoterapia de forma tardía.9
Caso clínico representativo de psicosis autoinmune
Se trata de un hombre de 23 años, con antecedentes heredofamiliares: primo paterno con dos intentos suicidas, tía paterna con cáncer de tiroides, abuelo paterno con tumoración cerebral no especificada, abuela paterna con diagnóstico de enfermedad de Alzheimer y abuela materna con antecedente de cáncer de piel; niega consumo de sustancias. Respecto a la salud mental previa niega episodios depresivos, de ansiedad, maniacos, hipomaníacos o psicóticos previos.
Inició dos meses previos a su ingreso con pérdida ponderal (11 kg) atribuida a la disminución de ingesta de alimentos, ya que realizaba únicamente una comida por día y aumento de la actividad física y corría hasta 10 km/día; además de alteraciones del sueño, con insomnio de conciliación, por lo que dormía 3hora/día. Un mes previo presentó indiferencia al medio, disminución de respuesta verbal cuando le hablaban sus familiares. Posteriormente se agregaron alucinaciones visuales al ver personas ajenas en su casa y alteraciones en la memoria reciente, sin recordar lo que había realizado. Presentaba ideas delirantes “de ser molestado en redes sociales, que lo habían hackeado”, y que “escuchaba que se reían y se burlaban de él”.
En la primera valoración neuropsiquiátrica, se encontró paciente despierto, poco cooperador, con psicomotricidad globalmente disminuida, mirada fija, disminución del parpadeo, desorientado en tiempo y circunstancia, con alteraciones en la atención, repitiendo únicamente series de tres dígitos, así como alteraciones en la memoria, con recuperación de una de cuatro palabras. No emitía habla espontáneamente ni respondía a la mayoría de las preguntas del entrevistador. Lenguaje no fluente, pero comprensible. En el discurso expresó ideas delirantes de daño y refirió que todos se rían de él y que le habían hackeado su celular.
Igualmente, se documentaron movimientos torácicos estereotipados y movimientos de flexión y abducción de miembros pélvicos. Se realizó escala de Bush y Francis para catatonia, con puntuación de screening de 7 y severidad de 16, a expensas de inmovilidad y estupor (1 punto), mutismo (1 punto), mirada fija (2 puntos), posturas fijas/catalepsia (1 punto), muecas (1 punto), ecopraxia (1 punto), estereotipias (2 puntos), obediencia automática (1 puntos), gegenhalten (3 puntos) y ambitendencia (3 puntos).
Ante esta primera valoración se integró síndrome psicótico con características atípicas (pérdida de peso, alteraciones mnésicas, orientación y catatonia), por lo que se abordó como psicosis autoinmune posible por criterios de Pollak.28 Se solicitaron exámenes de laboratorio y gabinete complementarios, reportándose examen citoquímico de punción lumbar de características normales (glucosa de 65mg/dL, proteínas de 26mg/dL y células 1 mm3); electroencefalograma anormal por brotes de ondas lentas polimorfas y monomorfas, no rítmicas, de mediana a gran amplitud en frecuencia delta-theta de 3 a 5Hz en región frontocentral bilateral. Se realizó resonancia magnética de encéfalo, en la que se presentó aumento de la intensidad de señal de manera bilateral en secuencia T2 FLAIR en lóbulos frontales, ínsulas y lóbulos temporales (Figura 3).
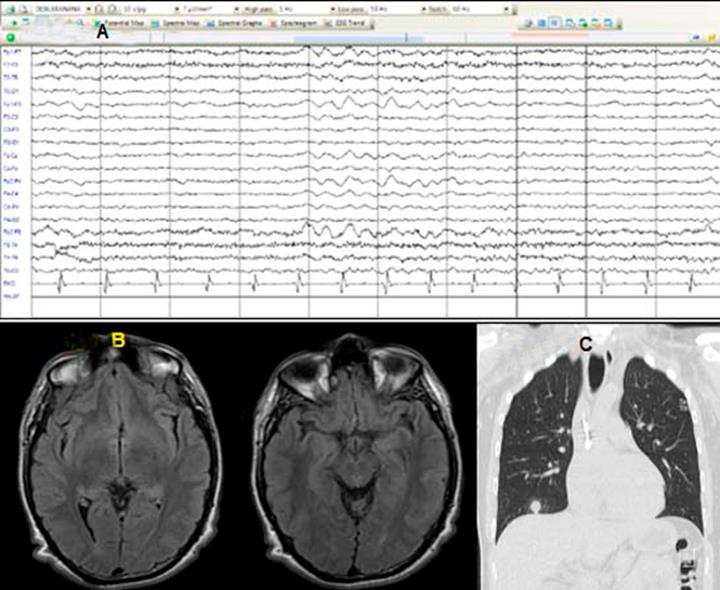
Figura 3 A) electroencefalograma anormal por ondas lentas polimorfas y monomorfas, no rítmicas, de mediana a gran amplitud en frecuencia delta theta de 3-5 Hz en región frontocentral bilateral. B) Resonancia magnética de encéfalo en secuencia T2 FLAIR corte axial, que presenta cambios de intensidad en lóbulos temporales. C) Tomografía axial computarizada de tórax corte sagital, que muestra nódulo pulmonar hacia la base derecha.
Por las alteraciones en los exámenes complementarios y cuadro clínico, el paciente cumplió criterios de psicosis autoinmune probable, por lo que se decidió dar maniobra inmunomoduladora con bolos de metilprednisolona y cinco sesiones de recambios plasmáticos, y tratamiento sintomático con 10 mg/día de olanzapina. El paciente evolucionó a mejoría clínica, con remisión de sintomatología psicótica y catatónica, así como mejoría de sintomatología cognitiva, por lo que se decidió su egreso.
Entre los estudios de extensión se reportaron bandas oligoclonales positivas y anti-NMDAr negativo en LCR, serologías negativas para virus de la inmunodeficiencia humana, panel de reacción en cadena de la polimerasa para encefalitis viral y para Mycobacterium tuberculosis en LCR negativos; el estudio tomográfico de tórax reveló nódulo pulmonar de características malignas (Figura 3). El paciente fue enviado a la institución correspondiente para diagnóstico y tratamiento de la lesión pulmonar.
Conclusiones
Diferentes líneas de evidencia sugieren que una proporción de los trastornos psicóticos tienen un componente autoinmune plausible. El principal problema es que estos pacientes con frecuencia son diagnosticados como trastornos psicóticos primarios y son privados del tratamiento inmunológico. Las señales de advertencia clínica como la progresión rápida, la presencia o antecedente de tumor, la catatonia, las discinesias, las reacciones adversas graves con el uso de antipsicóticos, la disfunción cognitiva grave o desproporcionada, la disminución del nivel de conciencia, las crisis epilépticas y la disfunción autonómica significativa deben obligar a la realización de exámenes complementarios (resonancia cerebral, electroencefalograma y LCR). Ante hallazgos compatibles con psicosis autoinmune probable, los anticuerpos en LCR deben solicitarse sin retrasar el inicio de la inmunoterapia.











 nueva página del texto (beta)
nueva página del texto (beta)