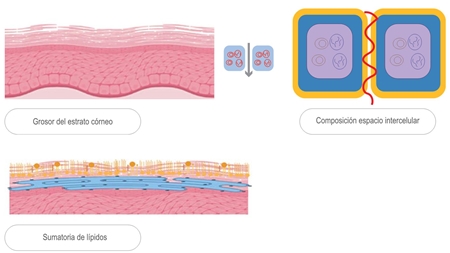
Composición la barrera cutánea y determinantes estructurales de su función
La barrera cutánea se compone de queratinocitos, corneocitos, lípidos, factor hidratante natural, elementos imprescindibles para la retención de humedad, elasticidad y nutrición de la piel.
Queratinocitos
El estrato córneo consta de 10 a 15 capas de queratinocitos, los cuales reposan en una matriz lipídica y están divididos en diferentes tipos:
Queratinocitos basales, que, como su nombre lo indica, descansan sobre la membrana basal.1
Queratinocitos espinosos, que reciben su nombre debido a los abundantes desmosomas que los unen, para proporcionar resistencia al estrés mecánico.2
Queratinocitos granulares, que en su interior engloban gránulos de queratohialina y cuerpos lamelares.
Los primeros contienen filamentos de profilagrina, loricrina y queratina; los segundos están formados por precursores del estrato córneo como ceramidas, esteroles, triglicéridos, glicoproteínas y enzimas, incluidas las lipasas, glicosidasas, proteasas, hidrolasas ácidas y fosfatasas.3 El contenido de los queratinocitos granulares se libera entre el estrato granuloso y el estrato córneo, lo que lleva a un cambio de su morfología, observando queratinocitos sin gránulos sin núcleo y rodeados de dos capas, una interna rica en proteínas y otra externa rica en lipidos.4
La conversión programada de queratinocitos granulares a queratinocitos cornificados implica la actividad de numerosas enzimas que descomponen los orgánulos y núcleos celulares e incluyen la proteólisis de profilagrina a subunidades monoméricas de filagrina, proteína fundamental en la matriz extracelular de la piel, debido a que promueve la agregación y formación de enlaces disulfuro entre los filamentos de queratina, cuyas funciones son esenciales para impedir la pérdida de agua5,6,7 (figura 1).
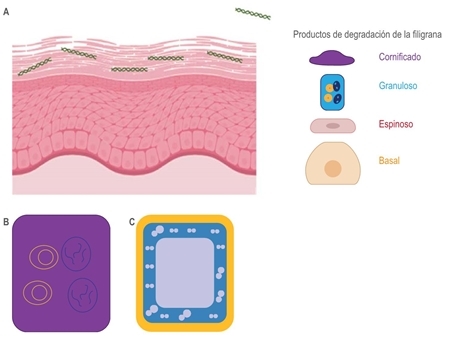
Figura 1 Queratinocitos. A) Representación esquemática de la capa epidérmica, donde se identifican los diferentes tipos de queratinocitos que conforman la barrera cutánea y sus productos de degradación. B) Representación esquemática de un queratinocito granuloso, con sus gránulos lamelares de color amarillo y gránulos de queratohialina de color azul. C) Queratinocito cornificado (corneocito) con pérdida de gránulos lamelares y de queratohialina, rodeado por una capa interna rica en proteínas (color azul) y una capa externa rica en lípidos (amarilla).
Lípidos
El estrato córneo entre muchas otras funciones impide la entrada de contaminantes ambientales, microorganismos patógenos y evita la pérdida excesiva de agua de las capas más profundas de la piel.8 Tras la pérdida del núcleo y el citoplasma, los queratinocitos granulares se transforman en estructuras muertas, que se distribuyen formando una estructura en ladrillo con capas celulares externas resistentes, embebidas en laminillas lipídicas compuestas de ceramidas, ácidos grasos y colesterol, producidos por los cuerpos lamelares. Finalmente, este tipo de estructura en cuanto a composición y distribución impide la pérdida de agua desde las capas más profundas y proporciona una adecuada nutrición, la cual se refleja en la apariencia hidratada y saludable de la piel.5,9,10
La organización estructural de los lípidos es ortorrómbica en la piel humana sana y esta configuración es esencial para la función de barrera, debido a que evita la pérdida activa de agua.11 Cuando se analiza por difracción de rayos X se pueden identificar dos fases de lípidos distintas a distancias repetidas de aproximadamente 6 y 13 nm, formando las fases de periodicidad corta y larga, esta última junto con la distribución ortorrómbica desempeñan un papel clave para la función de barrera adecuada en una piel sana e inhiben la migración de agua desde la dermis a la superficie epidérmica12,13,14 (figura 2).

Figura 2 Organización estructural de los lípidos. A) Representación esquemática de la matriz lipídica con distribución de fases cortas y largas. B) Distribución ortorrómbica de la estructura. C) esquema de ladrillo que permite una mayor cohesión y menor pérdida de agua.
La matriz lipídica en el estrato córneo bien estructurado contiene varios compuestos repartidos aproximadamente de la siguiente forma: 50 % de ceramidas, 25 % de colesterol, 15 % de ácidos grasos libres y 10 % de ésteres de colesterol.15,16 En la superficie de la piel esta mezcla de lípidos se combina con cierta cantidad de agua y componentes del sudor, la mayoría de los cuales tienen propiedades higroscópicas, es decir, atraen agua desde las estructuras más profundas (dermis) creando una emulsión más soluble en aceite que en agua, que dificulta la evaporación de la misma desde el estrato córneo.17
Factor de hidratación natural
El factor de hidratación natural está formado por compuestos higroscópicos resultantes de transformaciones enzimáticas de la filagrina y se compone principalmente de aminoácidos libres (40 %), ácido pirrolinocarboxilico (12 %), sales de ácido láctico (12 %), urea (7 %), sales inorgánicas (18.5 %) y pequeñas cantidades de amoniaco, creatina, ácido úrico, sales de ácido cítrico, azúcares y péptidos14,16,18,19 (figura 3).
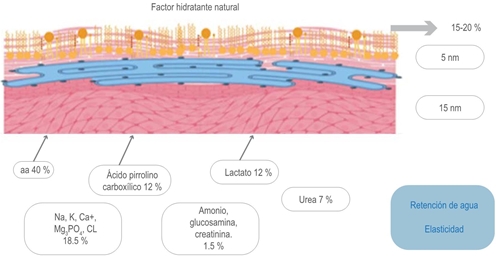
Figura 3 Representación esquemática de los porcentajes de distribución de las moléculas que constituyen el factor hidratante natural.
El factor hidratante natural representa de 15 a 20 % de la composición total del estrato córneo y actúa como un determinante de la elasticidad e hidratación; por esta razón es importante que se mantenga un equilibrio entre todos sus componentes sin dejar de lado el agua, que se requiere para procesos metabólicos, enzimáticos, descamación y degradación de desmosomas, pero que por sí sola no lograría mantener la hidratación en niveles adecuados.20 Cada uno de estos elementos sumados al microbioma, las glándulas endocrinas, la cantidad y tipo de lípidos van a determinar el pH de la piel, que en condiciones estables debe variar entre 5.4 y 5.9, cifra que condiciona la frecuencia de recambio celular, tan importante al determinar el adecuado estado de salud de la piel; es así como el recambio celular va a ser alto o más frecuente en presencia de un pH neutro o alcalino, concentración de calcio y sulfato de colesterol elevados y va a ser bajo o menos frecuente a un pH ácido, concentración de calcio y sulfato de colesterol bajos.21
En conclusión, los determinantes de la barrera de permeabilidad están constituidos por el espesor del estrato córneo, los componentes del factor hidratante natural, la formación de la matriz lipídica y la estructura tortuosa de los lípidos, que proporciona una distancia más larga de penetración y salida de las sustancias, además de disminución en la pérdida de agua desde las capas más profundas22 (figura 4).
Alteración de la barrera cutánea
La disfunción de la barrera cutánea se asocia a tres alteraciones básicas:
La primera, un mayor nivel de lípidos de longitud corta, tanto en las clases de ceramida como de ácidos grasos libres; esta longitud de la cadena lipídica se correlaciona con una organización menos densa, que genera mayor pérdida de agua, mientras que las cadenas más largas permiten fuerzas intermoleculares más fuertes y, en consecuencia, menor pérdida de esta.23
La segunda está definida por la organización de lípidos de una forma ortorrómbica a expensas de una forma hexagonal, que crea una mayor fuga de agua, con pérdida de la elasticidad y morfología del estrato córneo.
Finalmente, además de la organización y composición de los lípidos, si el contenido total de lípidos es bajo, se considera otra variable de alteración de la barrera cutánea que lleva a escape de agua desde las capas más profundas del estrato córneo.24
La xerosis es el resultado de la disminución del contenido de agua del estrato córneo, lo que conduce a descamación anormal de los corneocitos.25 Para que la piel parezca y se sienta hidratada firme y elástica, el contenido de agua en esta capa debe ser superior a 10 %. El agua se pierde por evaporación al medio ambiente en condiciones de baja humedad y debe reponerse desde las capas epidérmicas y dérmicas inferiores para restablecer las condiciones normales. La piel xerótica se debe más a un bajo contenido de agua que a evaporación de esta, lo cual se ve reflejado en los estudios de micrografía electrónica, que muestran un estrato córneo más grueso, fisurado y desorganizado.26
En las lesiones cutáneas de pacientes con dermatitis atópica, el contenido de ácidos grasos libres saturados con cadenas de carbono muy largas (≥ C24) se reduce significativamente, mientras que los ácidos grasos libres de cadena corta, en particular, el ácido palmítico y el ácido esteárico, se incrementan. Al mismo tiempo, el análisis de residuos de ceramidas muestra cantidades esencialmente aumentadas de ceramidas de cadena corta (< 42 átomos de carbono), especialmente ceramida C16 y ceramida C18; al contrario de las ceramidas de cadena larga (> 42 átomos de carbono, C24), que se reducen sustancialmente.27,28
La apoptosis es el elemento regulador más importante en el control de las poblaciones celulares, en este caso de la piel.29 Es por esto que observamos la ceramida C16 elevada en las lesiones y zonas vulnerables de la piel de pacientes con dermatitis atópica, elevación causada por apoptosis prematura que se observa en estas áreas, por lo que un alto porcentaje de queratinocitos en zonas de piel severamente afectada, irritada o inflamada no alcanza la madurez completa, incluido el contenido de ceramida requerido para establecer una barrera cutánea adecuada.27,30,31
Reparación de la barrera cutánea
Una vez que la barrera epidérmica ha sido dañada, las señales deben transmitirse a la maquinaria intracelular para iniciar la reparación. La señal fisiológica que inicia la reparación de la barrera es la pérdida de agua transepidérmica cuantificada en 10 %, cifra suficiente para desencadenar una reacción ordenada que tiene como objetivo el restablecimiento de la barrera cutánea, este proceso está conformado por los siguientes pasos:
Síntesis de lípidos intercelulares.
Difusión de humedad dermoepidérmica.
Cambios del coeficiente de reparto de humedad.
Estos pasos buscan generar oclusión del estrato córneo y también un aumento de retención de agua de entre 20 y 35 %, lo que lleva a que la piel exhiba la suavidad y flexibilidad apropiada y proporcione una apariencia sana hidratada y sin grietas en su superficie.20,32
La síntesis endógena de ceramidas es el primer paso en la reparación de barreras; una vez que se ha producido el daño, el reacondicionamiento solo puede ocurrir si se retrasa la pérdida de humedad y si se atrapa el agua en los sitios donde se ha perdido.Este es el objetivo de los emolientes y su mecanismo de acción permite la rehidratación de la piel por dos mecanismos principales; la oclusión que impide la fuga de agua y la hidratación por medio de la atracción de agua ubicada en las zonas más profundas de la epidermis y la dermis.33,34
Definición de emoliente
Un emoliente es un producto con la capacidad de ocupar los espacios entre los queratinocitos en condiciones de piel seca, que además debe tener la capacidad de hidratar y lubricar. La capacidad de hidratación se refiere a la atracción de moléculas de agua y la disminución de la pérdida de esta a través de los espacios intercelulares; la capacidad de lubricar es la propiedad de aumentar el deslizamiento sobre la piel y dar la apariencia de una piel lisa sin evidencia de fisuras; estas propiedades están determinadas por los tipos de componentes de los diferentes emolientes y son las que deben buscarse al elegir un emoliente para prescribirlo a los pacientes.33,35
Tipos de emolientes
En la actualidad existen diversos emolientes que se adaptan fácilmente a las necesidades de los pacientes de acuerdo con su capacidad adquisitiva y el estado de su piel. Podemos encontrar dos clases principales: los emolientes para uso durante o después de la ducha y los emolientes sin enjuague.
Los emolientes para uso durante o después de la ducha se dividen en los sustitutos de jabón, emolientes de lavado antiséptico y emolientes para uso después de la ducha. Los sustitutos de jabón contienen emulsionantes, no contienen detergentes y deben usarse junto con emolientes sin enjuague; los productos emolientes de lavado antiséptico, además de lo anterior, contienen agentes antibacterianos tópicamente activos y son un complemento en los pacientes con tendencia a desarrollar infecciones en la piel; finalmente, los aditivos de baño o emolientes para uso después de la ducha, pueden ser aceites de baño antiséptico o acetites de baño con componentes que evitan el prurito; estos aditivos de baño dejan una capa de aceite sobre la piel y ayudan a prevenir la pérdida excesiva de humedad.36,37,38
Los emolientes sin enjuague se encuentran en diferentes presentaciones que deben tenerse en cuenta: los ungüentos constituyen la consistencia más grasa y concentrada de todas las presentaciones y tiene menos aditivos;39 las cremas son emulsiones de aceite y agua y su consistencia es menos grasa; las lociones tienen un mayor contenido de agua que las cremas, lo que las hace más fáciles de aplicar, pero menos efectivas como emolientes; los aerosoles contienen lípidos como parafina líquida y al mismo tiempo poseen propulsores, como butano e isobuteno, para asegurar que el emoliente se expulse del recipiente en forma de aerosol sobre la piel. Los emolientes en presentación gel son productos de aceite y agua; sin embargo, la forma en que se emulsionan es diferente de las cremas y lociones: el agente carbómero mantiene el aceite y el agua juntos mientras están en la botella, sin embargo, cuando se aplica a en la piel, se disuelve y permite que el aceite y el agua se separen.40
El emoliente ideal debe contener un humectante de entre 200 y 300 Da, un ejemplo es la urea, que por su tamaño alcanza las capas más profundas, donde restaura el contenido de agua y la función de barrera, replicando el funcionamiento del factor hidratante natural; moléculas más grandes no penetran en las regiones más profundas sino que aumentan la hidratación de los corneocitos más externos. Los lípidos no fisiológicos como aceites minerales o vegetales actúan como un sustituto de los lípidos naturales y reducen la pérdida de agua transepidérmica (oclusión).41 Por otro lado, los lípidos fisiológicos como las ceramidas y el glicerol están implicados en el mantenimiento de los elementos estructurales del estrato córneo y pueden mediar los estímulos que desencadenan la diferenciación epidérmica.42,43,44
Principales mecanismos de hidratación
Los principales mecanismos de hidratación son la oclusión y la humectación.
Los agentes oclusivos funcionan formando una delgada película hidrofóbica en la superficie de la piel para retardar la pérdida transepidérmica de humedad, son similares a las bicapas lipídicas intercelulares de ceramida, colesterol y ácidos grasos libres; entre ellos se incluyen la lanolina, aceites minerales, ceramidas, parafina y silicona.45,46 La oclusión no es suficiente para generar una buena hidratación; solo impide que el agua ubicada en la región epidérmica no se pierda, por lo que se requiere, además, la participación de moléculas que atrapen agua dentro de la capa epidérmica, ocupando los espacios intercelulares para generar la apariencia de una superficie lisa y suave.47
Se dice que el agente más oclusivo y fisiológico es la vaselina, la cual reduce la pérdida de agua trasepidérmica en 99 %, permitiendo que suficiente vapor de agua salga de la piel para iniciar la reparación de la barrera.20,48 La vaselina es una sustancia inerte, no se une a proteínas ni sufre alteraciones químicas en la piel, reduce el prurito al crear una película protectora sobre las terminaciones nerviosas epidérmicas y penetra el espacio entre los corneocitos.49
La lanolina, también conocida como grasa de lana o cera de lana, se produce a partir de las glándulas sebáceas de las ovejas. Existen diferentes derivados de lanolina en el mercado, según el método de extracción y modificación. Aunque a menudo se agrega a los emolientes por su efecto de oclusión, se han realizado muy pocos estudios acerca de su eficacia en pacientes con dermatitis atópica.10
La silicona tópica es hipoalergénica, es un líquido inodoro, incoloro, no tóxico, insoluble en agua, pero permeable al vapor de agua, que ocupa los espacios entre los corneocitos descamativos.50
En cuanto a las ceramidas, se han identificado nueve diferentes y se han duplicado sintéticamente para su inclusión en formulaciones emolientes, teniendo en cuenta su importancia en la formación de una barrera cutánea.27,51,52
En relación con la humectación, los humectantes son sustancias que atraen el agua como esponjas sobre y en la piel; entre ellos se encuentran la glicerina, ácido hialurónico, lactato de sodio, urea, propilenglicol, sorbitol, ácido pirrolinocarboxílico, alfa hidroxiácidos. La mayoría de los humectantes extraen agua de la epidermis y la dermis más profundas, generando una ocupación de los espacios entre los queratinocitos, pero para que esto ocurra también es necesaria una humedad ambiental superior a 70 %; debido a este factor, la exposición a climas fríos implica el uso de emolientes con mayor frecuencia dada la falta de humedad que se presenta en las bajas temperaturas.53 La recuperación de la hidratación de la piel ocurre de adentro hacia afuera, por ello, la aplicación tópica de agua únicamente no es efectiva, a menos que se aplique inmediatamente un agente oclusivo para atrapar el agua en la superficie de la piel.43,54
Las cremas hidratantes que contienen solo humectantes en realidad aumentan la pérdida de agua transepidérmica cuando se aplican sobre la piel que posee una barrera defectuosa, por ejemplo, la aplicación de glicerina tópica aumenta la pérdida de agua transepidérmica en 29 % si no se formula en combinación con un ocluyente que impida la pérdida de agua del estrato córneo que ya está deshidratado.47
Se ha demostrado que la urea reduce la pérdida de agua, mejora la hidratación y la retención de agua; con una concentraciones de 10 % funciona como un humectante endógeno natural al reemplazar el agua en condiciones de baja humedad y mantener un estrato córneo fluido.19,55
Los alfa hidroxiácidos (AHA) incluyen tres categorías: los ácidos monocarboxílicos (ácido glicólico), ácidos dicarboxílicos (ácido málico) y ácidos tricarboxílicos (ácido cítrico). Los AHA de baja concentración (1 %) pueden alterar el pH de las tres capas externas del estrato córneo; por su parte, los AHA de mayor concentración (10 %) pueden afectar el pH del estrato córneo de 10 a 20 capas de profundidad. Cuando se usa en piel humana, las diferentes concentraciones de AHA tienen beneficios terapéuticos y cosméticos, como un sistema integrado que sirve como barrera física e inmunológica a factores externos dañinos y previene la ruptura del ADN.56
¿Qué debe considerarse al prescribir un emoliente?
Cuando se prescribe un emoliente es importante tener presente las preferencias del paciente, la consistencia y la concentración, el tipo de labor que desempeña, los factores económicos, la susceptibilidad a infecciones, el antecedente de dermatitis de contacto, la dermatitis atópica, las actividades de ocio y diferentes patologías que impliquen la alteración de la barrera cutánea. Además, es importante conocer que las presentaciones en loción y crema tiene una consistencia más delgada y menos grasa que permiten mayor absorción y cosméticamente son más aceptables; mientras que los geles y los ungüentos poseen una consistencia más gruesa, más grasa , tienen una mayor duración de acción , y debido a que contienen menos conservantes pueden causar menos irritación; también es de gran importancia informar al paciente el riesgo de caídas, irritación e incendio de acuerdo con los componentes de cada emoliente.57
Por lo tanto, es esencial que en pacientes con piel muy seca, el emoliente contenga una mayor proporción de grasa, en este caso, estaría indicado el uso de un emoliente tipo ungüento en lugar de una crema, loción o gel, pero del mismo modo debemos indagar las preferencias del paciente y de acuerdo con esta información complementar el manejo con aditivos de baño o emolientes que contengan antisépticos en el caso de pacientes susceptibles a infecciones cutáneas, para así lograr una adherencia adecuada. Igualmente debemos verificar con frecuencia en las consultas de seguimiento, el cumplimiento del régimen indicado al paciente, sus opiniones en relación con el mismo y el cambio o adición de otras presentaciones emolientes, lo que brindará la posibilidad de un tratamiento integral que permita la efectividad en el control de su enfermedad cutánea.
Se debe aplicar regularmente un emoliente tópico sin enjuague sobre la piel para mantenerla bien hidratada.58 Las cantidades variarán, entre 250 y 600 g por semana, dependiendo del grado de xerosis, extensión de esta y tamaño del individuo. Para un niño, 250 g a la semana es lo indicado y para un adulto, 500 a 600 g a la semana. La unidad de falange distal es la cantidad de ungüento, crema o gel, obtenida al presionar un tubo con un orificio de 5 mm de diámetro, aplicado desde la articulación interfalángica distal hasta la punta del dedo índice en su lado palmar, que corresponde a 0.5 g.59 Para cada segmento del cuerpo (región facial, brazos, tórax, abdomen, parte superior de la espalda, parte inferior de la espalda, muslos, genitales y miembros inferiores) una dosis baja correspondería a dos gramos al día; una dosis media, 5 g al día; y dosis alta, 10 g al día.59
Los sustitutos de jabón deben aplicarse en la piel con las manos y posteriormente enjuagarse; no poseen agentes tensoactivos, por lo tanto limpian la piel sin irritarla, resecarla y sin destruir los lípidos fisiológicos. Los aditivos de baño se aplican al finalizar la limpieza durante la ducha, dejan una capa de grasa en la piel impidiendo la pérdida de agua.60 Los emolientes sin enjuague deben aplicarse después de la ducha, la piel debe secarse suavemente, dejándola ligeramente húmeda y proceder a su aplicación; si se deben aplicar en otro momento del día, previamente realizar lavado de manos. Los emolientes se deben aplicar suavemente sobre la piel, no se deben frotar continuamente, se debe esperar que el producto se absorba para proceder con la aplicación de otras sustancias tópicas (por ejemplo, esteroides tópicos).
Lo que dice la evidencia científica
Las guías europeas de dermatitis atópica en sus recomendaciones indican que la hidratación de la piel se mantiene mediante la aplicación de humectantes al menos dos veces al día con una base hidrófila, por ejemplo, urea a 5 %; las bases lipofílicas también han demostrado ser útiles en el manejo de esta patología.61 Asimismo, recomiendan el uso de aceite de baño, gel de ducha, emulsiones o soluciones micelares que mejoren el defecto de barrera. El uso de productos de aceite puro como el aceite de coco en lugar de emolientes secará la piel, aumentará la pérdida de agua transepidérmica y, por lo tanto, no se recomienda.61,1
La urea puede causar irritación y disfunción renal en los bebés y debe evitarse; los niños pequeños deben tratarse con concentraciones más bajas que los adultos y en algunos estudios se ha observado que el glicerol es mejor tolerado.63,64
La recomendación es usar emolientes sin enjuague inmediatamente después del baño.60 Solo se deben usar preparaciones emolientes desprovistas de alérgenos proteicos y haptenos, los cuales con frecuencia causan alergia de contacto (como la lanolina, el alcohol de cera de lana, o metilisotiazolinona, y el propilenglicol), especialmente en el grupo de edad más vulnerable, como los menores de dos años.65
Algunos emolientes pueden contener, además de un agente oclusivo e hidratante, saponinas, flavonoides, extractos de plántulas de avena libres de proteínas, o lisados bacterianos de Aquaphilus dolomiae o Vitreoscilla filiformis, que mejoran las lesiones de dermatitis atópica e influyen en el microbioma de la piel. Los datos de investigación in vitro y clínica han proporcionado información alentadora, pero aún limitada respecto a su uso.66,67,68,69,70
Algunos humectantes mejoran la xerosis y función de barrera de la piel en la dermatitis atópica.71 Estudios limitados han demostrado que la aplicación de emolientes durante una semana puede mejorar la dermatitis atópica leve a moderada. Al comparar el uso de emolientes de venta libre con emolientes de alto costo, se observó que poseen una eficacia similar en el tratamiento de la de dermatitis atópica infantil leve a moderada.72 Además, el uso diario de emolientes desde el nacimiento puede reducir significativamente la incidencia de dermatitis atópica en la población de alto riesgo.73,74 La principal limitación de los estudios es su duración relativamente corta. Actualmente se realizan ensayos más largos que posiblemente proporcionarán información más exacta de los beneficios del uso del uso de emolientes en un futuro próximo.75
Los ensayos comparativos entre productos hidratantes son pocos y los realizados no han demostrado que uno sea superior a otro. Un estudio de 39 sujetos con dermatitis atópica leve a moderada no encontró diferencias en la eficacia entre la crema hidrolipídica que contiene ácido glicirretínico, ceramidas, colesterol, ácidos grasos libres y una crema hidratante protectora de la piel con base en petrolato cuando se usa por tres semanas.74 Otro estudio no mostró diferencias con el uso de una crema hidratante con base en petrolato y un emoliente que contiene palmitoiletanolamida, durante un periodo de aplicación de cuatro semanas.76
El emoliente correcto debe ser seguro, efectivo, económico y libre de aditivos, fragancias y agentes potencialmente sensibilizantes.51 Una revisión sistemática de Cochrane de 2017 en la que se evaluó emolientes e hidratantes para el manejo del eccema, concluyó que, en general, teniendo en cuenta los resultados de diversos estudios y comparaciones, la eficacia de los humectantes y emolientes en el restablecimiento de la barrera cutánea no fue estadísticamente significativa.77
Un ensayo controlado aleatorizado de niños con eccema entre uno y 11 años no encontró evidencia de un beneficio clínicamente significativo de los aditivos de baño emolientes, cuando se usa además del manejo emoliente sin enjuague.78 Un estudio que comparó el cambio en los puntuaciones entre cinco medidas de severidad del eccema -medida de eccema orientada al paciente (POEM), área de eccema e índice de gravedad (EASI), seis áreas, seis signos de dermatitis atópica (SASSAD) e hidratación de la piel (corneometría)- con cuatro tipos de emolientes en niños hasta cinco años de edad durante 12 semanas concluyó que la severidad del eccema mejoró en todos los grupos con el uso de cualquier emoliente independientemente del tipo de ingredientes y presentación (en crema, loción gel o ungüento).79
Actualmente está en curso una investigación sobre el uso profiláctico de un emoliente con ceramida en el desarrollo de dermatitis atópica, más allá del periodo de tratamiento activo y el desarrollo de alergias alimentarias y sensibilización alérgica. Los resultados de este ensayo ayudarán a aclarar el papel de la barrera cutánea como una ruta de sensibilización alérgica que desencadena una enfermedad alérgica posterior.80
Puntos clave
La hidratación de la piel del paciente alérgico es fundamental en el manejo integral de su padecimiento.
El emoliente debe contener un agente oclusivo y un agente hidratante.
El emoliente ideal no solo deberá ser un agente oclusivo, como la vaselina, si no que es necesario que aporte un producto higroscópico como la urea o el lactato.
Es clave que el paciente entienda la importancia de usar este tipo de productos para mejorar su barrera cutánea.











 nueva página del texto (beta)
nueva página del texto (beta)