INTRODUCCIÓN
A nivel mundial se enlistan un total de 10 507 especies de aves (Pulido et al., 2020). Sin embargo, por intervención del hombre se han alterado diferentes nichos ecológicos que afectan el hábitat de estas especies, forzando procesos ambientales que ponen en punto crítico la supervivencia y ocasionan segregación de nichos y competencia por alimento y nuevos espacios (Ramírez-Albores, 2010).
En México se registran un total de 1,076 especies de aves (con 106 especies endémicas; Ortega-Álvarez et al., 2021); no obstante, debido a diversas alteraciones ambientales cerca del 26% están al margen de la extinción. Se reconocen 294 especies y 98 subespecies en alguna categoría de riesgo y otras 429 que han disminuido su población (Ortiz-Pulido, 2018). El conocimiento de como dicha perturbación impresiona a diferentes especies de aves es aún incipiente (Alessio et al., 2005). Sin embargo, se reconoce que bajo estas circunstancias las aves presentan una serie de fluctuaciones, producto de la estacionalidad de insectos; viéndose a recurrir a tres posibles acciones: cambiar su dieta, alimentarse de insectos inactivos o renunciar a su hábitat y salir en busca de nuevo nicho alimenticio (Pineda-Pérez et al., 2014; Ortiz-Pulido et al., 2016; Ortiz-Pulido, 2018).
La técnica que algunas aves utilizan para garantizar su proporción energética, se describe como alimentación óptima (Elgin et al., 2020). Esta teoría señala que los diferentes organismos utilizan métodos de captura que demandan un mínimo gasto energético y les recompensa con mayor aporte nutricional (González & Osbahr, 2013). Dicho comportamiento es el resultado de diferentes coacciones y eventos de selección natural que determinan la supervivencia y éxito reproductivo. Bajo este principio la hipótesis del gasto de crianza menciona que durante el periodo reproductivo las aves atrapan presas de talla grande que les permite el almacenamiento de energía para lograr su función reproductiva (Tellez-Farfán & Sánchez, 2016).
Si bien la riqueza de insectos en cada uno de sus estadios de vida, es aparentemente alta, se carece de pruebas que demuestren el impacto en la diferenciación espacio temporal de este recurso (García et al., 2020). Por ello, evaluar la ecología trófica en función del recurso disponible y el hábitat es un tema de interés global para el estudio de ecosistemas y conservación de las especies. Bajo tal tenor diferentes investigadores han evaluado la relación entre aves y su hábitat, ingesta trófica y captura de sus presas; esto mediante observación en campo, análisis de contenido estomacal, regurgitación, vómito o excretas (Alessio et al., 2005). Todo ello con el fin de conocer el recurso y las condiciones óptimas que garanticen la conservación de las especies.
Actualmente como mecanismo de producción sustentable y conservación de las especies, se han retomado métodos de producción ancestral (sistemas agroforestales; González-Valdivia et al., 2016). En estos sistemas interactúan una serie de factores que favorecen a la conservación de especies en donde las aves podrían disponer de un nuevo hábitat que le proporcione alimento y refugio, desempeñando funciones importantes como control biológico de plagas, dispersoras de semillas, polinizadoras y vindicadoras del ambiente (Cipriano-Anastasio et al., 2020).
Un sistema de producción tradicional de café (sistema agroforestal) inmerso en un Bosque Mesófilo de Montaña, se ubica en el municipio de Huatusco, Veracruz. En este sistema las aves podrían desempeñar funciones en el desarrollo óptimo de este modelo productivo. Sin embargo, a pesar de ser un sistema multiestrato, favorable para el mantenimiento y conservación de aves insectívoras. No se tienen estudios que aborden la ecología trófica de estos organismos e inferir la estabilidad de estas especies a partir de patrones de alimentación.
El objetivo de esta investigación fue determinar la diversidad de componentes entomológicos que determinan la dieta de aves mediante el análisis de heces fecales en Huatusco, Veracruz, México.
MATERIAL Y MÉTODOS
El área de estudio se ubica en el municipio de Huatusco, Veracruz, México (19º 09’ N y 96º 57’ W a 1933 msnm). Para dicho estudio se contemplaron tres condiciones a evaluar: Café tradicional (CT), Potrero (PT), y Bosque Mesófilo de Montaña (BMM), en una superficie total de 32.42 ha (figura 1). En cada condición evaluada se desarrolló un muestreo sistemático a conveniencia con distancias lineales de 150 m entre cada punto. El seguimiento de aves se realizó mensualmente de agosto 2018 a enero 2019, empleando captura con redes de niebla, recuento en puntos con radio fijo (Bayne et al., 2016; Morales-Martínez et al., 2018) y búsqueda intensiva (Alonso et al., 2017; Parra Castillo & Cafiel Cuello, 2020). Cabe señalar que ambos esquemas fueron empleados conjuntamente con el objetivo de reducir el error por identificación de aves de comportamiento quieto y silencioso (Lavariega et al., 2016; Travez & Yánez, 2017). Las redes empleadas fueron de un tamaño de 12 m de largo por 2.5 m de ancho y luz de malla de 36 mm de diámetro; éstas fueron colocadas en un horario de 07:00 a 16:00 h, horario en que las aves presentan mayor actividad forrajera (Sánchez-Jasso et al., 2013; Sánchez-Guzmán et al., 2018). Los ejemplares capturados fueron colocados en cajas de cartón con la finalidad de estresarlas y obtener su excreta, los cuales fueron colocados en frascos con alcohol al 70 % para su posterior análisis (Whitaker, 1988). Los artículos (fragmentos de insectos) encontrados fueron identificados mediante claves taxonómicas propuestas por Borror et al. (1989) y Sterhr (1987); mientras que a las aves se identificaron a partir de guías de campo estándar (Peterson & Chalif, 1989; Peterson & Peterson, 2002). El registro de las aves fue desarrollado a partir de la generación de un ID, el cual consistió en colocar las primeras tres letras del género, seguidas de las tres letras de la especie (p. ej. Volatinia jacarina = VolJac).
El seguimiento de insectos se aplicó paralelamente al método de recuento en puntos con radio fijo y búsqueda intensiva, empleando corte y sacudida de ramas; dicho esquema consistió en ubicar a las aves que se encontraban alimentando, para posteriormente colocar una bolsa de plástico sobre la rama en la cual se encontraba el ave y sacudir con la finalidad de colectar a los insectos de los que potencialmente se pudiera estar alimentando. La identificación de los insectos se realizó con las claves taxonómicas antes señaladas.
Se determinó Frecuencia de Observación (FO) e Índice de Abundancia Relativa (IAR) de los insectos colectados. La riqueza de insectos fue determinada mediante el índice de Jacknife1 (cabe señalar que por requerimientos del proyecto la riqueza de insectos se obtuvo a nivel de familia), la similitud con el índice de Jaccard y diversidad mediante Shannon-Wiener; dichos índices se obtuvieron a partir del software Estimates versión 9.0. Con el fin de establecer posibles diferencias estadísticamente significativas entre los índices evaluados e inferir si los datos registrados son los que potencialmente se encuentran en el área, se aplicaron pruebas de Kruskal-Wallis y X2, esto en virtud de no cumplirse los supuestos de la estadística paramétrica; tales análisis se obtuvieron mediante el software estadístico JMP en SAS versión 8.0.
Para determinar la posible asociación entre la abundancia de aves y los insectos registrados, se aplicaron análisis de regresión poisson (ARP) empleando un modelo lineal generalizado (GML); esto mediante un procedimiento de selección de variables polinómica stepwise, asumiendo una distribución de tipo Poisson en la frecuencia de los datos, por lo cual se aplicó un logaritmo como función de liga (determinando el error estándar, valor de z y códigos de significancia), el ajuste de los modelos se realizó con el criterio del mínimo akaike en el programa R.13.0 (Akaike, 1969). Con la finalidad de determinar el grado de asociación entre la abundancia de aves con respecto a los órdenes, familias, tipos de insectos y artículos registrados se aplicaron análisis de correspondencia canónica (ACC) en el software estadístico XLSTAT versión 2018.7.
Cabe señalar que para todos los análisis estadísticos se aplicó un nivel de significancia α=0.05 con un intervalo de confianza del 95 %.
RESULTADOS
De los insectos colectados mediante corte y sacudida de ramas, se registraron 53 especies, 9 órdenes, 40 familias y 51 géneros. Del total de insectos colectados 41 fueron plaga, 37 no plaga, 61 predador y 8 parásitos; 3 huevos, 20 larvas, 2 ninfas y 140 adultos.
Por su parte se registraron 77 muestras de excretas de las aves capturadas (37 de CT, 18 de PT y 22 en BMM).
De acuerdo con la FO, las familias de insectos con mayor frecuencia registrada (mediante corte y sacudida de ramas) fueron: Chrysomelidae (16.66 %), Cicadellidae (6.66 %) y Miridae (5.86 %), el resto mostraron valores mas bajos.
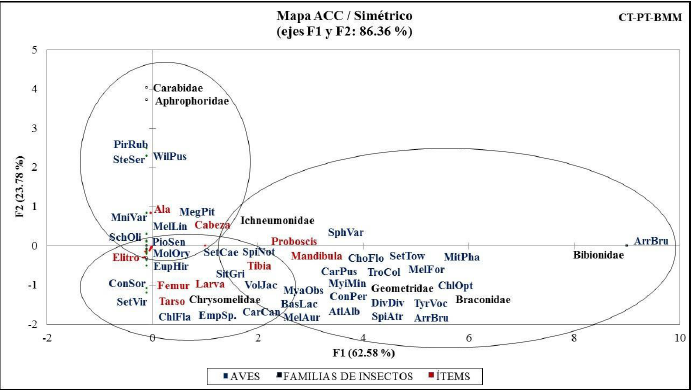
Los resultados de Jacknife1 presentaron valores promedio de: CT = 27; PT = 18; BMM = 10 y CT-PT-BMM = 39 familias. Se conoce el 26 %; 26 %; 17 % y 30 %, respectivamente de las familias de insectos teoricamente presentes en el área de estudio (figura 2).
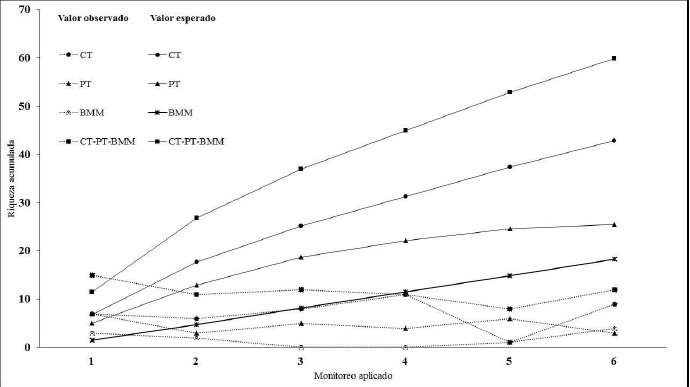
Figura 2 Jacknife1 para la riqueza de familias de insectos registrados mediante corte y sacudida de ramas
El índice de abundancia relativa presenta valores promedio de: CT = 0.03; PT = 0.05; BMM = 0.10 y CT-PT-BMM = 0.025 para las familias de insectos registrados mediante corte y sacudida de ramas.
Kruskal-Wallis muestra diferencias significativas en riqueza (p = 0.0423*) y diversidad (p = 0.01*) registrada, no así en abundancia (p = 0.52).
Por su parte X2 muestra que la abundancia (p = 0.33) y diversidad (p = 0.37) son los teóricamente presentes en el área evaluada, no así para la riqueza registrada (p = 0.02*).
El estimador de Jaccard presenta porcentajes de similitud del: CT = 11.55 %; PT = 11.12 %; BMM = 0 % y CT-PT-BMM = 19.88 % para las familias de insectos registrados mediante corte y sacudida de ramas.
Shannon-Wiener presenta valores mínimos de H´ = 1.65; H´ = 1.56; H´ = 1.28; H´ = 2.41 y máximos de H´ = 3.13; H´ = 2.81; H´ = 2.3; H´ = 3.46; con valores promedio de H´ = 2.65; H´ = 2.37; H´ = 1.67 y H´ = 3.09, respectivamente para la diversidad de insectos registrados mediante corte y sacudida de ramas.
El análisis de regresión poisson para la abundancia de órdenes, familias y tipos de insecto registrados en corte y sacudida de ramas presentan valores de AIC = 76.68, 76 y 119.23 (Cuadro 1); para ordenes, familias y artículos registrados en excretas muestran valores de AIC = 98.67, 98.65 y 98.67, respectivamente (cuadro 2). Dichos GML evidencian que sólo seis ordenes, dos familias, dos tipos de insectos (corte y sacudida); un orden, una familia y un artículo (excretas) tienen un efecto sobre la abundancia de aves en las condiciones bajo estudio.
Cuadro 1 Regresión Poisson para los insectos registrados mediante corte y sacudida de ramas
| Coeficiente | Valor estimado | Error estándar | Valor de Z | Pr(>|z|) |
|---|---|---|---|---|
| Órdenes | ||||
| (Intercepto) | 0.98 | 0.25 | 3.88 | 0 *** |
| Araneae | 0.13 | 0.03 | 3.99 | 0.0000646 *** |
| Coleóptera | -0.56 | 0.21 | -2.61 | 0 ** |
| Himenóptera | 0.71 | 0.16 | 4.42 | 9.61E-06 *** |
| Lepidóptera | 0.25 | 0.1 | 2.35 | 0.01 * |
| Orthoptera | 0.46 | 0.07 | 6.48 | 8.94E-11 *** |
| Psocóptera | -0.51 | 0.1 | -5.12 | 3.01E-07 *** |
| Familias | ||||
| (Intercepto) | 1.57 | 0.13 | 11.44 | < 2e-16 *** |
| Apidae | 1.64 | 0.24 | 6.78 | 1.15E-11 *** |
| Curculionidae | 1.61 | 0.18 | 8.97 | < 2e-16 *** |
| Tippos de insectos | ||||
| (Intercepto) | 1.47 | 0.16 | 8.76 | < 2e-16 *** |
| Parasito | 0.14 | 0.03 | 4.72 | 0 *** |
| Plaga | 0.09 | 0.02 | 4.31 | 0 *** |
Códigos de significancia: 0 '***' 0.001 '**' 0.01 '*' 0.05 '.' 0.1 ' ' 1
Cuadro 2 Regresión Poisson para los insectos registrados mediante el análisis de excretas
| Coeficiente | Valor estimado | Error estándar | Valor de Z | Pr(>|z|) |
|---|---|---|---|---|
| Órdenes | ||||
| (Intercepto) | -0.15 | 0.2 | -0.74 | 0.45 |
| Coleóptera | 0.33 | 0.05 | 0.05 | 9.52E-11 *** |
| Familias | ||||
| (Intercepto) | -0.13 | 0.2 | -0.69 | 0.49 |
| Chrysomelidae | 0.32 | 0.05 | 6.46 | 1.04E-10 *** |
| ítems | ||||
| (Intercepto) | -0.15 | 0.2 | -0.74 | 0.45 |
| Élitro | 0.33 | 0.05 | 6.47 | 9.52E-11 *** |
Códigos de significancia: 0 '***' 0.001 '**' 0.01 '*' 0.05 '.' 0.1 ' ' 1
El ACC para órdenes, familias, tipo de insectos y artículos registrados, confirman porcentajes de inercia acumulada en sus dos primeros ejes del: 88.28 % (figura 3); 62.89 % (figura 4); 95.40 % (figura 5); y 86.36 % (figura 6), respectivamente.
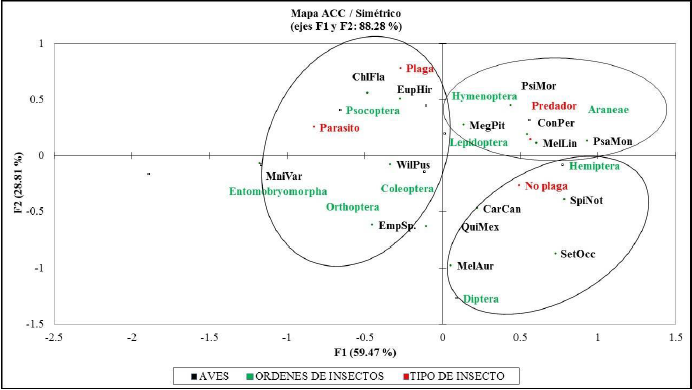
Figura 3 Inercia registrada entre las aves, órdenes y tipos de insectos registrados mediante corte y sacudida de ramas
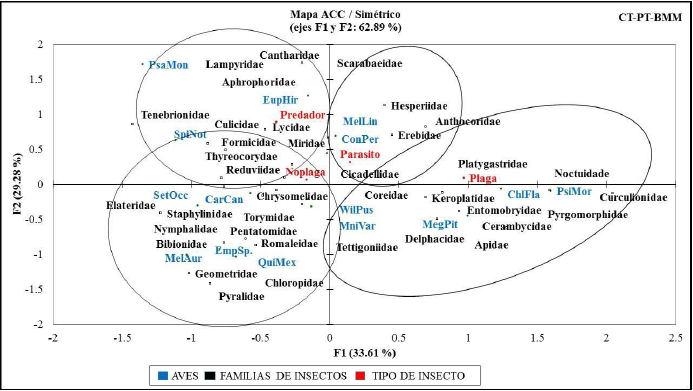
Figura 4 Inercia entre la avifauna y su relación con familias y tipos de insectos registrados mediante corte y sacudida de ramas
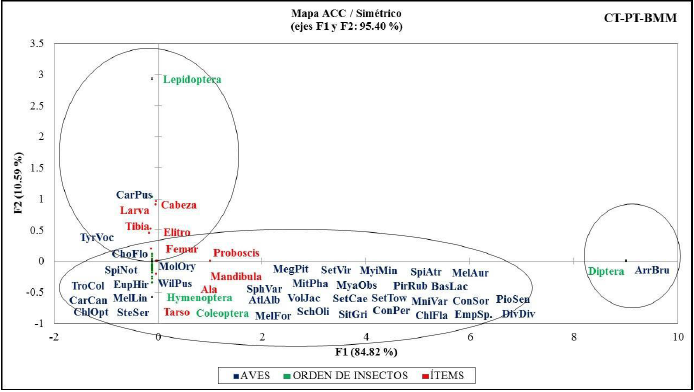
Figura 5 Inercia entre aves y su relación con órdenes y artículos (ítems) de insectos registrados en las excretas analizadas
DISCUSIÓN
La tendencia registrada para la alimentación de las aves del presente estudio (heces fecales e insectos colectados) concuerda con lo reportado por Martínez et al., (2019), Soto-Huaira et al., (2019) y Liébana et al. (2020) quienes exhiben resultados similares en otros medios de producción agroforestal, señalando como principal recurso trófico insectos del orden Coleóptera, seguido de organismos del orden Araneae e Himenóptera; de igual manera se concuerda con lo reportado por Hurtado-Giraldo et al. (2016) y Jedlicka et al. (2021) quienes determinaron la dieta de aves insectívoras inmersas en sistemas agroforestales de Colombia y México, respectivamente. Sus resultados exhiben sobreuso de coleópteros por parte de la comunidad avifaunística; no obstante dichos organismos fueron del tipo plaga; esto último también se mostró en los resultados del presente estudio y resulta contundente con lo exhibido por García et al. (2018), Mosch et al. (2018), Escobar-Ramírez et al. (2019) y Rebollo et al. (2019) quienes de igual manera han desarrollado estudios en diferentes sistemas agroforestales, señalando que las aves insectívoras funcionan como control biológico en cultivos agrícolas y forestales, reduciendo hasta un 95% de esta incidencia. Dicho comportamiento fue corroborado en el presente trabajo a partir del avistamiento de aves del estrato arbóreo, alimentándose de insectos de los que posteriormente se detectaron plaga; asimismo se puede evidenciar como ciertos individuos de Megarhynchus pitangua e Icterus auratus capturaban presas en PT y CT controlando plagas forestales y frutales (cítricos, plátanos, aguacates, nueces, entre otros). Todo lo anterior es una muestra de cómo los sistemas agroforestales disponen de recursos alimenticios y nichos de utilización que permiten la coexistencia de diversos taxones, tal como lo señalan Figueroa-Sandoval et al. (2019) quienes aplicaron un estudio avifauníistico en sistemas de producción agrísilvícola con labranza de conservación y Jarrett et al. (2021) quienes evaluaron la incidencia de aves insectívoras y otros grupos tróficos en sistemas agroforestales de cierta región de África.
Se corrobora como la avifauna de estos SAF, que contribuye a regular la incidencia de insectos plaga tal como se observó en ciertos individuos (Euphonia hirundinaceae, Cardellina pusilla y Mniotilta varia) del estrato bajo, alimentándose de larvas y adultos de Hypothenemus hampei (broca de café) quien de acuerdo con Bagny et al. (2020) y Olvera-Vargas et al. (2020) representa un problema que puede mermar hasta un 50 % de la producción nacional de café; de esta manera se corrobora la importancia de los resultados expuestos por Karp et al. (2013), Karp y Daily (2014), Martínez-Salinas et al. (2016), Milligan et al. (2016) y Jedlicka et al. (2021) quienes muestran como las aves insectívoras de México (Chiapas), Costa Rica y África inmersas en sistemas agroforestales de café, coadyuvan al control biológico de Hypothenemus hampei . No obstante, la presente investigación es pionera en abordar esta temática incorporando a la ecología trófica de aves y su potencial en el equilibrio ecológico de insectos de SAF inmersos en Bosque Mesófilo de Montaña, de la región particular de Huatusco, Veracruz, México.
En contraste Miñarro Prado (2014), Newell et al. (2014a), Boesing et al. (2017), Olguín et al. (2017) y Hernández Guanche et al. (2020) señalan que la mayor disponibilidad de insectos del estrato arbóreo son del orden Araneae, Formicidae y Lepidóptera; favorecido al sostenimiento trófico de aves que coadyuvan al control de plagas en árboles frutales y cultivos agrícolas mermando la incidencia hasta en un 49%; esto debido a su habilidad de vuelo y baja sensibilidad a barreras vivas que permiten el desplazamiento entre diferentes sitios que proveen de recursos alimenticios, favoreciendo a la resiliencia de ecosistemas por la dispersión de semillas en sitios degradados; así en este estudio se observó a ciertos individuos de Pionus senillis, Psilorhinus morio y algunos carpinteros (Melanerpes formicivorus; Melanerpes aurifrons) en el estrato arbóreo colectando frutos que transportaban a otros lugares para consumir su pulpa y dispersar sus semillas, contribuyendo a la resiliencia de estos agroecosistemas; de esta forma Newell et al. (2014b), Leverkus & Castro (2017) y Banks-Leite et al. (2020) explican como las aves son un elemento clave en la resiliencia de ecosistemas y áreas fragmentadas (similares a los SAF) puntualizan que gracias a la capacidad de vuelo estos organismos se consideran especies de enlace de alta movilidad (HMLS por sus siglas en inglés) que cumplen el papel de enlace entre remanentes fragmentados y la conexión entre áreas fuente y resumidero; de tal manera que Vaugoyeau et al. (2016) y Bateman et al. (2020) señalan como la distancia recorrida por las aves estará en función de su capacidad para adquirir alimento y volver a su ámbito hogareño; por ello existen especies que solo presentan nichos de utilización en zonas consideradas efecto de borde tal como se observó en algunas especies que se alimentaban en PT, volviendo a su nicho ecológico una vez adquirido su proporción energética (BMM condición conservada). Se considera el PT como nicho de utilización en donde las aves adquieren alimento y permite suministrar los requerimientos nutricionales que garantizan la supervivencia de estas especies, concordando con lo reportado por Montagnini (2020) y Morales Rozo et al. (2021) quienes señalan que sistemas silvopastoriles (similares a los PT evaluados) bien planificados pueden coadyuvar a la conservación de aves, ofreciendo nichos de oportunidad en donde encuentran alimento y recursos que permiten su coexistencia.
CONCLUSIONES
Se logró determinar la diversidad de componentes entomológicos que integran la dieta de aves insectívoras, mediante el análisis de excretas en la región particular de Huatusco, Veracruz, México. Se exhibe simpatría trófica para ciertas especies de aves, favoreciendo al control biológico de insectos del tipo plaga y parásitos. Se destaca el rol fundamental que desempeñan las aves en el interior de los sistemas agroforestales manteniendo la estabilidad ecológica y el buen funcionamiento de estos medios de producción.











 texto en
texto en