INTRODUCCIÓN
Las emisiones de gases de efecto invernadero (GEI) y el calentamiento global son temas de actualidad que enfrentan las organizaciones ambientales y la población en general. Los gases emitidos a la atmosfera por el hombre incluyen el 82.5% de dióxido de carbono (CO2), 9.5% de metano (CH4), 5.3% de óxidos de nitrógeno (NXO) y el 2.7% de gases halogenados. Las emisiones de CH4, han generado gran interés en organizaciones de impacto ambiental ya que posee un potencial de calentamiento global 25 veces mayor que el CO2 (IPCC, 2015).
Dentro de las fuentes antropogénicas, la actividad agropecuaria es responsable de aproximadamente el 26% del total de las emisiones de CH4, debido a la fermentación entérica anaerobia de los alimentos (USEPA, 2015). metano producido por el ganado bovino (especialmente lechero y de engorda) representa una pérdida de energía aproximadamente del 2 al 12% de la ingesta (Ingale et al., 2013; Vargas, 2012; Benchaar y Greathead, 2011), siendo esto una de las ineficiencias más importantes en los sistemas de nutrición de los rumiantes, por lo que, la mitigación en la producción de este gas puede ser de beneficio socio-económico (uso adecuado de la eficiencia energética del alimento para mayor obtención de carne y leche) y ambiental (disminución en la emisión de CH4) (Moss et al., 2000).
En el rumen, la materia orgánica (carbohidratos y proteínas) es degradada por microrganismos simbióticos, donde los productos finales son ácidos grasos volátiles (AGVs) (acético, propiónico y butírico), así como dióxido de carbono (CO2) e hidrógeno (H2). La formación de acetato y butirato da como resultado la producción de H2, un sustrato que las bacterias archaeas (comúnmente llamadas metanógenicas) usan para reducir el dióxido de carbono y producir metano (Li et al., 2014; Attwood et al., 2008), por otro lado, la producción de propionato sirve como una vía competitiva para la utilización de H2 lo que conlleva a una disminución en la producción total de metano (Li et al., 2014; Attwood et al., 2008), por lo tanto, cuando diferentes tipos de alimento se fermentan en rumen, la proporción molar de los componentes de AGVs (acetato, propionato, butirato) es diferente.
En la actualidad existen metodologías y/o tecnologías que se utilizan para reducir la cantidad de CH4 producido por los rumiantes (Moumen et al., 2016); entre ellas la implementación de aditivos químicos como los ionóforos (p.e monensina) en la alimentación del ganado (Crossland et al., 2017), sin embargo, el uso de estos químicos se ha visto limitado por la presencia residual de metabolitos secundarios en los productos de consumo humano o por la resistencia que han generado ciertos microorganismos por el uso no terapéutico de antibióticos (ionóforos); por lo que estos hechos originaron su prohibición en algunas legislaciones como la Unión Europea desde enero de 2006 (Estévez y Cutuli, 2011). Estas medidas dieron origen a la búsqueda de nuevas estrategias y alternativas orientadas al uso de aditivos naturales como los “extractos de plantas”, los cuales son una opción en la alimentación del ganado para modificar su fermentación ruminal de manera positiva y mitigar las emisiones de CH4 entérico (Wang et al., 2016; Kim et al., 2015; Durmic et al., 2014). Los extractos de plantas, contienen compuestos bioactivos que han sido investigados como alternativa en nutrición animal para manipular la degradabilidad y fermentación del alimento, este efecto está relacionado a su composición química y/o propiedades antimicrobianas (Irshaid et al., 2014; Ramdani et al., 2013; Patra y Saxena, 2010).
Investigaciones enfocadas en explorar los efectos de diferentes aceites esenciales, extractos de plantas y compuestos bioactivos en la fermentación ruminal in vitro e in vivo (Friedman 2014; Khiaosa y Zebeli, 2013; Klevenhusena et al., 2012), han encontrado que el orégano (Origanum vulgare) puede servir como una planta alternativa por su alta capacidad antioxidante y su potencial antimicrobiano. Los principales constituyentes químicos del orégano, son el carvacrol, ρ-cimeno, linalol, terpineno y timol (Rodriguez-Garcia et al., 2015;Grondona et al., 2014; Acevedo et al., 2013; Teixeira et al., 2013); estos compuestos tienen efectos antimicrobianos que pueden afectar el desarrollo y crecimiento de las bacterias ruminales e inhibir la metanogénesis; es por ello que el extracto de orégano ha sido considerado como una opción con fines de mitigar las emisiones de metano entérico y mejorar la fermentación ruminal con la producción de AGVs (Durmic et al., 2014; Hristov et al., 2013; Kim et al., 2013 Bodas et al., 2008). En este trabajo se evaluaron diferentes extractos del orégano (acuoso, alcohólico y oleoso) mediante la técnica de producción de gas in vitro, como alternativa para reducir las emisiones de CH4 ruminal, así como el efecto en la producción de gas y AGVs.
MATERIAL Y MÉTODOS
La planta de orégano (Lippia graveolens) perteneciente a la familia Verbenaceae, se recolectó en el mes de septiembre del año 2015 en el municipio de Valparaíso, Zacatecas, México, ubicado a 23° 10’ de latitud norte y 104° 22’ de longitud oeste, localizado a una altitud entre 700 y 3000 msnm, la temperatura promedio anual es de 12 a 24 °C y una precipitación anual de 500 a 1000 mm (INEGI, 2015). La planta se dejó secar a temperatura ambiente durante 2 semanas después del corte. Posteriormente se deshidrató a 45 °C en un horno Thermo Scientific® durante 24 h para eliminar completamente la humedad.
Los extractos se obtuvieron a partir de la planta deshidratada y triturada (mezcla de hojas, flores y tallos). Los extractos se prepararon en tres medios diferentes; acuoso, alcohólico y oleoso.
Para un medio acuoso se obtuvieron dos extracciones: cocción e infusión. La relación utilizada fue 25:200 (gramos de muestra molida por cada 200 mililitros de agua tridestilada). Para el proceso de extracción determinado cocción, 250 g de la planta deshidratada junto con 2 L de agua tridestilada se colocaron en un matraz de vidrio marca Pyrex y se llevaron a punto de ebullición durante 30 min en una placa de calentamiento Lab Tech ®, al término de este tiempo el matraz fue retirado de la fuente de calor, se dejó reposar durante 10 minutos y se filtró a través de papel Whatman no. 4. En la preparación de extracción de infusión, el agua tridestilada (2 L) se llevó a ebullición durante 5 minutos, se retiró el matraz de la fuente de calor e inmediatamente se añadió la muestra de orégano (250 g), se dejó reposar durante 10 minutos y se filtró en papel Whatman no. 4 (Martins et al., 2014; Teixeira et al., 2013); durante todo el proceso de preparación de ambos extractos los matraces se mantuvieron tapados para evitar la pérdida de vapor de agua. Todos los extractos fueron almacenados en frascos ámbar.
La extracción alcohólica se realizó utilizado 250 g de muestra molida en 2 L de etanol absoluto (J.T.Baker) y agua tridestilada (80:20, v/v); la mezcla se colocó en un frasco ámbar y se maceró durante un mes con agitación cada tercer día, se filtró a través de papel Whatman no. 4 y finalmente, el 70% del volumen total del solvente se vaporizó en un extractor tipo Soxtec System HT (Fisher Scientific 1043) a 85°C por 45 min (Pesewu et al., 2008).
El extracto oleoso se obtuvo a partir de la muestra seca (250 g) por hidrodestilación durante una hora en un sistema Clevenger modificado de vidrio marca Pyrex utilizando agua tridestilada (Grondona et al., 2014). Durante el proceso de ebullición, el material seco absorbe el agua y el aceite esencial difunde a través de las paredes celulares por medio de ósmosis, luego es vaporizado y arrastrado por la corriente de vapor de agua hasta ser condensado y finalmente es recuperado (Teixeira et al., 2013). Previamente se realizaron hidrodestilaciones con lapsos de diferentes horas para establecer el tiempo óptimo de operación, concluyendo que una hora fue suficiente para una buena extracción del aceite.
La concentración de principios activos en cada uno de los extractos de orégano se determinó por cromatografía de gases (CG) en un equipo Agilent Tecnologies serie 6890N, empleando una columna polar DB_WAX (J&W Scientific) marca Agilent Technologies con las siguientes especificaciones: largo 30 m, I.D. 0.320 mm, film 0.50 µm y límites de temperatura de 20 °C a 240 °C (250 °C). Previamente a la prueba, se realizó una curva de calibración con estándares de carvacrol, timol, limoneno, linalol y terpineno grado reactivo marca Sigma Aldrich con un porcentaje de pureza de 98, 99.5, 98, 97 y 85 % respectivamente; a partir de los cromatogramas obtenidos por el análisis de CG se graficaron los datos empleando una regresión lineal para cada uno de los estándares utilizados, observando un valor de R>0.999 para cada uno de los compuestos.
La técnica de producción de gas in vitro se realizó según lo indicado por Theodorou et al., (1994); como sustrato molido se utilizó alfalfa, para mantener un medio anaeróbico se utilizó CO2, la temperatura de incubación fue de 39 °C. El inoculo ruminal se obtuvo a partir de dos borregos machos canulados de la raza Rambouillet con un año de edad (peso 45 ± 3 Kg) y una dieta de adaptación de 30 días la cual contenía 83% de heno (alfalfa y paja de trigo) y 17% de concentrado (maíz molido, harinolina, macrominerales y microminerales). El tratamiento y cuidado de los borregos se realizó de acuerdo a los protocolos de salud y bienestar animal de la Unidad Académica de Medicina Veterinaria y Zootecnia de la Universidad Autónoma de Zacatecas.
Los extractos fueron adicionados de manera individual en cada una de las jarras de digestibilidad en diferente volumen (Agarwal et al., 2009); para un volumen bajo y alto se adicionaron 0.1 y 1 mL del extracto de orégano respectivamente por cada 100 mL de medio ruminal artificial, como control se utilizó el sustrato de alfalfa sin la adición de aditivos. En el registro de gas producido, se utilizó un medidor de presión marca Sper Scientific. La presión de gas fue acumulativa y determinada en unidades de presión (Psi), el tiempo de medición fue a las 3, 6, 9, 12, 24 y 48 h. Para cada volumen de los diferentes extractos, se realizaron tres repeticiones.
Los AGVs (acético, propiónico y butírico) se cuantificaron por cromatografía de gases. Las condiciones de trabajo fueron: temperatura de entrada después de la inyección de la muestra es de 50 °C a una presión de 12.13 psi con un flujo de He 36.5 mL min-1. Las condiciones para la columna fueron: temperatura inicial 50 °C, de cero a dos minutos con un aumento de 10 °C por minuto hasta llegar a 250 °C manteniendo esta temperatura constante por 5 minutos para luego descender a 50 °C manteniendo por dos minutos con un flujo de He de 1.6 mL min-1 a una presión de 12.13 psi y una velocidad promedio de 25 cm s-1. Se utilizó un detector de flama ionizante (FID) a una temperatura de 210 °C con un flujo de H2.de 40 mL min-1y un flujo de aire de 450 mL min-1. Previamente se realizó una curva de calibración con los estándares de ácido acético, propiónico y butírico marca Sigma Aldrich. Cada una de las determinaciones se realizó por triplicado.
La determinación de metano fue inferida a partir de la concentración de AGVs, mediante la aplicación de modelos matemáticos no lineales establecido por Moss et al. (2000), donde señalan que la producción de CH4 puede ser calculada de forma estequiométrica, como se muestra en la ecuación 1
El análisis estadístico para la producción de gas, ácidos grasos volátiles y metano se realizó mediante un análisis de varianza utilizando un diseño completamente al azar y la prueba de medias de Tukey, utilizando el paquete estadístico SAS 9.3 (SAS, 2011) para evaluar las diferencias estadísticas (p < 0.05). La fuente de variación considerada fue el extracto de orégano (control, cocción, infusión, alcohólico y oleoso); para ácidos grasos volátiles se consideraron como variables: ácido acético, propiónico y butírico.
RESULTADOS Y DISCUSIÓN
A partir de la mezcla de hojas, flores y tallos de orégano (Lippia graveolens), se obtuvieron los siguientes rendimientos mostrados en la tabla 1. El rendimiento para los cuatro extractos (cocción, infusión, alcohólico y oleoso) se obtuvo a partir de la relación volumen del extracto/ volumen del solvente (Metoui et al., 2015). El mayor rendimiento se presentó en los extractos acuosos; cocción e infusión con un 75% y 87% respectivamente, seguido del alcohólico (33%). Pesewu et al. (2008), reportaron que los rendimientos para extractos acuosos fue de 2.6 a 16.4%, mientras que para los alcohólicos se encuentra entre un 3.2 y 16%. Metoui et al. (2015), reportaron rendimientos para extractos acuosos y alcohólicos de 17.1 y 18.3% respectivamente, en la tabla 1, se muestran rendimientos superiores a los reportados con la metodología empleada. Para el extracto oleoso, Aligiannis et al. (2001) reportaron rendimientos para la planta del genero Origanum de 0.6% usando un aparato tipo Clevenger modificado por 3 hr y Metoui et al. (2015), obtuvieron 0.56% de rendimiento. Para el extracto oleoso por hidrodeslilacion por una hora se obtuvo un rendimiento de 0.33%.
Tabla 1 Rendimiento de extractos de orégano
| Extracto de orégano | Peso (g) | Solvente (mL) | Vol. extracto (mL) | Porciento Rendimiento (%) |
|---|---|---|---|---|
| Cocción | 250 | 2000 | 1500 | 75 |
| Infusión | 250 | 2000 | 1750 | 87.5 |
| Alcohólico | 250 | 2000 | 673 | 33.6 |
| Oleoso | 250 | 2000 | 6.5 | 0.33 |
La acción biológica de los extractos de orégano, dependen de la composición química y concentración de principios activos, el tipo de planta y especie, lugar de origen y el método de preparación de los mismos (Vokou et al., 1993). En la tabla 2, se puede evidenciar que de acuerdo al método de extracción se obtuvieron diferentes concentraciones de cada uno de los estándares analizados, mostrando que la infusión fue el método en el que se extrajo la menor cantidad de principios activos, con la presencia de solo dos de ellos (limoneno y timol), sin embargo, la concentración de limoneno (65.984 mg/mL) fue mayor en la infusión que en el resto de los otros extractos. El carvacrol fue dominante en el extracto oleoso seguido del alcohólico, pero no existe presencia de este compuesto para los extractos acuosos. El principio activo más elevado fue el terpineno con 15,700 mg/mL, presentado en el extracto alcohólico.
Tabla 2 Concentración y composición química de los extractos de orégano (Lippia graveolens).
| Extracto | Terpineno (mg/mL) |
Limoneno (mg/mL) |
Linalol (mg/mL) |
Timol (mg/mL) |
Carvacrol (mg/mL) |
|---|---|---|---|---|---|
| Cocción | 71.746 | 0 | 1.828 | 4.893 | 0 |
| Infusión | 0 | 65.984 | 0 | 8.749 | 0 |
| Alcohólico | 15,700 | 0 | 10.545 | 26.713 | 3.235 |
| Oleoso | 0 | 14.494 | 8.788 | 24.741 | 165.201 |
Estudios previos han reportado que los mayores componentes en los extractos de orégano (Origanum vulgare) son el carvacrol y su isómero timol, seguido de su precursor el terpineno (Rodríguez-García et al., 2015;Grondona et al., 2014; Béjaoui et al., 2013a). De acuerdo a los resultados obtenidos, la cantidad de carvacrol más alta se encontró en el extracto oleoso con 165.201 mg/mL. El timol, se encontró en todas las preparaciones de orégano, mostrando la mayor concentración el alcohólico con 26.713 mg/mL, mientras que la segunda más alta la presentó el oleoso con 24.741 mg/mL; esto deja en claro una vez más que de acuerdo al método de extracción se obtendrán diferentes compuestos bioactivos así como diferentes concentraciones.
Acevedo et al. (2013), reportaron la composición química del aceite esencial de la especie Origanum vulgare, encontrando como compuesto mayoritario al timol con el 67.51%, seguido del terpineno con el 5.51%. En el presente estudio, se encontró que, para el extracto oleoso, el carvacrol fue el compuesto de mayor concentración, siendo diferente a lo reportado por Acevedo et al. (2013), esta variante puede deberse al tipo de planta de orégano empleada, ya que la especie utilizada para este trabajo de investigación fue Lippia graveolens.Wogiatzi et al. (2009), analizaron la especie de Origanum vulgare recolectada de dos regiones diferentes en Grecia; encontrando que existe diferencia en la composición de principios activos de acuerdo al lugar de origen de la planta, ya que en la región de Leptokaria, la presencia de carvacrol fue alta mientras que en otro lugar este compuesto fue muy bajo. Con la finalidad de hacer una comparación con trabajos donde se analiza la composición química del mismo género de orégano en el mismo país de origen, se tiene el trabajo de Ortega et al. (2011), donde ellos analizaron el aceite esencial de la especie Lippia palmeri S. de la región de Hermosillo Sonora, México y encontraron que el compuesto de mayor concentración fue el compuesto p-cimeno (22.3%), seguido por timol (21.3%), carvacrol (8.8%), terpinene (6.7%), y limoneno (1.2%), entre otros compuestos. De acuerdo a los resultados obtenidos de la tabla 2, para Lippia graveolens recolectada en Valparaíso Zacatecas, México; se encontró que para el extracto oleoso el principal compuesto encontrado fue carvacrol, seguido de timol, limoneno y linalol, con esto se deja claro que la composición química y concentración de principios activos depende del tipo de planta y especie, lugar de origen y el método de preparación de los mismos.
Una vez realizada la técnica de producción de gas in vitro con cada uno de los extractos de orégano (cocción, infusión, alcohólico y oleoso) en una relación volumen del extracto por cada 100 mL de medio ruminal artificial (Agarwal et al., 2009), se determinó la producción de gas, AGVs y CH4.
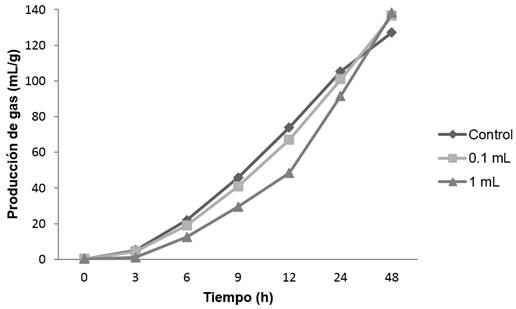
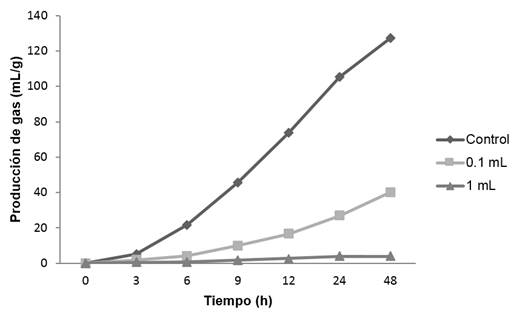
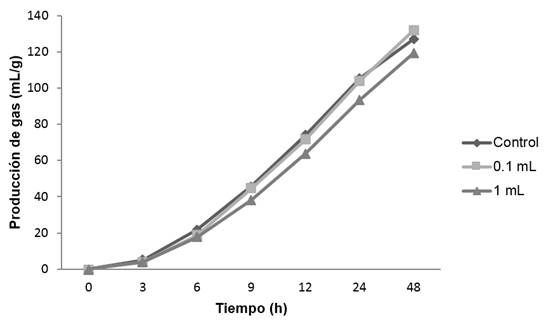
El efecto de los diferentes extractos de orégano en la producción de gas (mL/g) in vitro en un lapso de 48 h, se muestra en las gráficas 1, 2, 3 y 4; observándose que para los extractos acuosos; cocción (gráfica 1) e infusión (gráfica 2) se tiene un comportamiento similar con el control. Para el alcohólico (gráfica 3), con un volumen alto (1 mL de extracto/100 mL de medio ruminal) se presentó una pequeña disminución a las 12 h en la formación de gas, sin embargo, al término de las 48 h alcanzó la misma producción de gas que el control. En lo que se refiere al extracto oleoso (gráfica 4), la producción de gas se redujo considerablemente en ambos volúmenes (0.1 y 1 mL). En los extractos de cocción, infusión y alcohólico, se observó que la fase exponencial en la producción de gas ocurre desde las 6 h, en tanto que para el extracto oleoso, esta fase aparece hasta las 9 h en 0.1 mL de extracto, sin embargo para 1 mL, la producción de gas es mínima, permaneciendo así durante las 48 h.
Gráfica 1 Producción de gas durante la fermentación in vitro adicionando extracto acuoso de cocción.
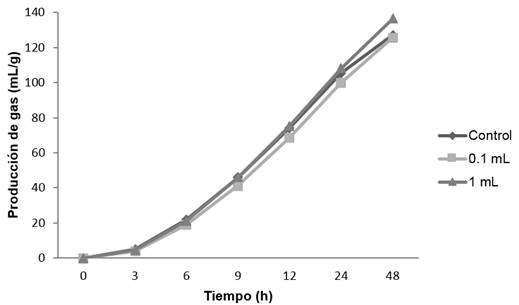
Gráfica 2 Producción de gas durante la fermentación in vitro adicionando extracto acuoso de infusión.
Los principales compuestos bioactivos del orégano que poseen efectos antimicrobianos, son el carvacrol y timol, para los cuales se conoce que el mecanismo de acción antimicrobiano, se produce principalmente por incrustarse en la membrana de la célula bacteriana, lo que provoca la desintegración de esta estructura favoreciendo la fuga de iones y provocando lisis celular (Rodríguez-García et al., 2015; Friedman, 2014; García-García et al., 2011). Como ya se reportó en la tabla 2, el extracto oleoso fue el que mayor concentración de carvacrol y timol exhibió, es por ello que en la gráfica 4 se observa una marcada disminución en la producción de gas, y se infiere que el efecto de estos compuestos como antimicrobianos fue unirse a la membrana celular de las bacterias ruminales encargadas de llevar acabo la fermentación, controlando la población de estos microrganismos y con ello la baja producción de gas. Cirino et al. (2014), evaluaron el efecto antibacteriano del aceite de orégano (Origanum vulgare) y los principios activos carvacrol y timol individualmente, encontrando que el mayor efecto antimicrobiano se presentó con el aceite en comparación con el efecto individual de los principios activos, por lo tanto existe sinergia de los compuestos activos presentes en los aceites, por lo que su actividad antibacterial aumenta. Para los extractos acuosos (gráfica 1 y 2), se tiene una tendencia en la producción de gas similar al control, este comportamiento fue ocasionado debido a que los principales compuestos antimicrobianos (tabla 2) no están presentes (carvacrol) o están en baja concentración (timol). Teixeira et al. (2013), evaluaron la actividad antibacterial de extractos acuosos, etanólicos y aceite esencial de Origanum vulgare, encontrando que los extractos acuosos no tienen efecto sobre los microorganismos evaluados ya que la concentración de principios activos fue menor en comparación con el extracto etanólico y aceite esencial. Por lo tanto, con base en los resultados obtenidos, se sustenta aún más que el carvacrol y timol son los principales compuestos con mayor efecto antimicrobiano sobre las bacterias del rumen, lo cual podría deberse a sus altas concentraciones.
Al finalizar la técnica de producción de gas o fermentación ruminal in vitro, se cuantificó la producción de ácidos grasos volátiles (AGVs) y se estimó la concentración de metano. En la tabla 3, se muestra el promedio de la producción de gas que se generó durante la fermentación in vitro al termino de las 48 h en unidades de mg/mL y su desviación estándar (DE), el promedio de la producción de AGVs (acético, propiónico y butírico) en mM/L y DE, así como la concentración de metano en mM/L y DE.
Tabla 3 Producción de gas (mL/g) y ácidos grasos volátiles (mM/L) in vitro en los diferentes extractos de orégano.
| Extracto Orégano |
Dosis (mL) |
Gas (mL/g) ± *DE |
Ácidos Grasos Volátiles (mM/L) ± *DE | Metano (mM/L) ± *DE |
||
|---|---|---|---|---|---|---|
| Acético | Propiónico | Butírico | ||||
| Control | ----- | 127.24 ± 1.35bc |
1,346.30 ± 0.05d |
573.12 ± 0.18c | 38.77 ± 0.22b |
463.73 ± 0.06d |
| Cocción | 0.1 | 132.12 ± 1.49ab |
1,297.53 ± 0.06e |
0 ± 0f | 546.63 ± 0.13a |
802.54 ± 0.01a |
| 1 | 119.31 ± 3.48d |
1,375.39 ± 0.05c |
590.18 ± 0.18b | 38.46 ± 0.22b |
472.01 ± 0.06d |
|
| Infusión | 0.1 | 125.53 ± 4.94c |
0 ± 0h | 0 ± 0f | 577.37 ± 0.29a |
230.95 ± 60.28e |
| 1 | 136.41 ± 0.14a |
944.86 ± 0.30f |
0 ± 0f | 434.70 ± 0.15a |
599.07 ± 0.05c |
|
| Alcohólico | 0.1 | 136.38 ± 3.02a |
1,782.83 ± 0.02b |
601.27 ± 0.17a | 41.81 ± 0.22b |
653.65 ± 0.05bc |
| 1 | 138.12 ± 3.20a |
1,806.41 ± 0.02a |
543.30 ± 0.18d | 24.44 ± 0.22b |
673.26 ± 0.04b |
|
| Oleoso | 0.1 | 40.07 ± 1.14e |
358.46 ± 0.11g |
3.77 ± 0.21e | 0 ± 0b | 160.27 ± 0.01f |
| 1 | 3.81 ± 0.45f | 0 ± 0h | 0 ± 0f | 16.46 ± 0.22b |
6.59 ± 0.09g | |
* DE: Desviación estándar, valores de medias con letras distintas en la misma columna difieren estadisticamente (p<0.05).
Para la formación de gas, los extractos acuosos (cocción e infusión) y alcohólico, en cada uno de sus volúmenes, mantuvieron una producción de gas similar al control (127.24 mL/g). La preparación oleosa, mostró la menor producción de gas; lo anterior se confirmó de forma estadística (p<0.05) ya que el gas (mL/g) que se produjo no mostró diferencias entre las preparaciones acuosas y alcohólica. Para infusión en un volumen de 0.1 mL no hubo diferencia con respecto al control (127.24 mL/g); el oleoso, mostró la menor producción de gas siendo estos valores diferentes al resto de los extractos. Wang et al. (2016), evaluaron extractos etanólicos de plantas medicinales donde reportan que no existe una tendencia en aumentar la producción de gas (mL/g) al usar extractos; ya que algunos de ellos disminuyeron la producción de gas y otros la aumentaron con respecto al control (110.54 mL/g). Como se muestra en la tabla 3, las diferentes preparaciones de orégano fueron desiguales en la producción de gas, además de obtener un valor de gas del control (127.24 mL/g) muy similar al reportado por Wang et al.
Lo que respecta a la concentración de ácidos grasos volátiles, en la tabla 3, se muestra que la producción de ácido propiónico se inhibió completamente en ambas preparaciones acuosas, sin embargo, la producción de ácido butírico en infusión en un volumen de 0.1 mL aumentó su concentración hasta 10 veces más con respecto al control. El oleoso, inhibió la producción de AGVs. Para el extracto alcohólico, se presentó aumento de AGVs (acético, propiónico y butírico) con un volumen bajo (0.1 mL), por lo que esta preparación es la que mejor efecto positivo tuvo en la fermentación ruminal in vitro. Por lo tanto, un cambio en las proporciones o crecimiento de los microorganismos ruminales generados por la adición de extractos de orégano, resulta en modificaciones en el perfil de la fermentación para la producción de AGVs. Estadísticamente la producción de ácidos grasos volátiles; para el caso del acético no existen diferencias significativas (p>0.05) entre infusión y oleoso. La preparación alcohólica fue el mejor extracto donde la concentración de ácido acético fue más alta (p<0.05), seguido de cocción. El efecto anterior también se presentó para el ácido graso propiónico, ya que no hubo diferencias estadísticas (p>0.05) entre las preparaciones de infusión y oleosa, mostrando que el mejor extracto fue el alcohólico. Con respecto a la producción del ácido graso butírico, este fue mejor en infusión (p<0.05) en ambos volúmenes (0.1 y 1 mL) seguido de cocción en un volumen de 0.1 mL. Con las preparaciones alcohólica y oleosa no hubo diferencias significativas (p>0.05) con respecto al control. Para el caso de este ácido graso, existieron menos diferencias entre los extractos y las dosis evaluadas, existen investigaciones donde reportan que el uso de aditivos en la dieta de rumiantes no afecta de manera negativa la producción de ácidos grasos volátiles, Hristov et al. (2013), reportaron que la concentración de AGVs no se vio afectada después de la adición de hojas de orégano in vivo en la dieta de bovinos. Rajabi et al. (2017), realizaron la técnica de digestibilidad in vitro con extracto acuoso de cascara de granada, dentro de los parámetros analizados están los AGVs, reportando que dichos ácidos no fueron afectados (p>0.05) por la adición de estos extractos en la experimentación in vitro. Otros estudios reportan que la modificación en la producción de AGVs disminuye al usar aditivos de plantas ricas en taninios (Leucaena leucocephala, Gliricidia sepium y Manihot esculenta) en ovinos (Rira et al., 2015). Por lo tanto, no existe una predisposición que indique que el uso de aditivos de plantas aumentara o disminuirá la producción de AGVs; todo depende del modelo experimental, tipo de material vegetal, preparación del extracto y concentración, así como la técnica de fermentación in vitro.
Con respecto a la determinación de metano (CH4), esta fue inferida a partir de la concentración de ácidos grasos volátiles; en la tabla 3 se muestra el resultado de la formación de metano (mM/L) calculada a partir de la ecuación 1 propuesta por Moss et al. (2000). La producción de metano fue diferente estadísticamente (p<0.05) para los extractos de cocción, infusión (0.1 mL) y oleoso, los extractos alcohólico e infusión (1 mL) fueron similares estadísticamente. El oleoso disminuyó considerablemente el CH4 en los dos volúmenes (0.1 y 1 mL), en tanto para la dosis de 1 mL la producción de este gas (6.58 mM/L) se redujo hasta 70 veces con respecto al control (463.73 mM/L). La máxima producción de CH4 fue con el extracto de cocción en un volumen de 0.1 mL. Agarwal et al. (2009) reportaron que la adición de aceite de menta en una relación de 0.1 µL/1mL de líquido ruminal, con la técnica de producción de gas in vitro disminuyó la concentración de ácidos grasos volátiles y de metano; aunque en ese trabajo la planta utilizada fue menta (Mentha piperita), tiene el mismo comportamiento que el extracto oleoso de orégano (Lippia graveolens), ya que este último también disminuyó los AGVs y metano. Las modificaciones en el total y proporción de los AGVs impactan sobre los perfiles de producción de metano, sobre todo si reduce la proporción de acetato y se incrementa la de propionato, por lo tanto, cambios en estos repercutirán positiva o negativamente en la producción de metano.
El extracto de orégano se ha utilizado con fines de disminuir las emisiones de metano en ganado y de mejorar la fermentación ruminal. Los resultados presentados tienen similitud con los reportados por de Wang et al. (2009). Ellos probaron una preparación comercial de aceites esenciales de orégano (ropadiar) utilizado en veterinaria y la compararon con un producto sintético (flavomicina), reportando que la producción media de CH4 expresada en base a materia orgánica (MO) digestible disminuyó en comparación al control, sin embargo, la producción de AGVs disminuyó al igual que la proporción de propionato en el líquido ruminal.
Evans y Martin (2000) observaron que el compuesto timol (0.4 mg/mL) derivado de las plantas Thymus y Origanum, es un fuerte inhibidor de metano in vitro, pero las concentraciones de acetato y propionato también disminuyeron. Las concentraciones obtenidas de timol (tabla 2) para cada uno de los extractos de orégano son superiores a las usadas por estos investigadores, sin embargo, la preparación alcohólica no presentó el comportamiento señalado por Evans y Martins ya que en este se obtuvo un aumento de AGVs. Kumar et al. (2009) utilizaron el aceite de eucalipto para disminuir el metano ruminal, encontrando que la producción de metano se reduce hasta un 58% usando una relación de 1.66 mL de aceite por cada 100 mL de líquido ruminal. Para el extracto de infusión (0.1 mL/100 mL de líquido ruminal) se encontró una disminución de metano del 50.2%, mientras que, en el oleoso para esa misma relación, el metano disminuyó hasta un 65.4% y en una relación de (1 mL/100 mL) la disminución fue de 98.5%. Ding et al. (2012) evaluaron el efecto del aceite de coco sobre las emisiones de metano y la comunidad microbiana en ovinos, reportando que el aceite de coco fue particularmente efectivo para reducir las emisiones de este gas hasta un 61.2% con respecto al control, en los resultados con extracto de orégano se tiene un porcentaje similar (65.4%) al reportado por Ding, el cual es registrado en el extracto oleoso (0.1 mL).
Los resultados de los extractos de orégano muestran un efecto diferencial entre ellos en cada uno de los parámetros evaluados (composición química, producción de gas, AGVs y metano), esto atribuido a los métodos de preparación, también se debe considerar la técnica in vitro utilizada, la dosis administrada y otros factores biológicos, tales como el pH del líquido ruminal y la dieta proporcionada (Patra y Saxena, 2010). Es necesario considerar la relación acético:propiónico y la producción de cada uno de los AGVs, según el objetivo que se busque en nutrición animal para la mejora del ganado; ya sea para la producción de carne (el AGVs deseado es el propiónico) y para la producción de leche (el AGVs deseado es el butírico). Es por ello la importancia de determinar previamente un método de preparación y una dosis optima in vitro para ser utilizada in vivo con mejoras en la fermentación ruminal y la eficiencia de la alimentación.
CONCLUSIONES
El mejor método de extracción para obtener la mayor concentración de compuestos antimicrobianos fue el oleoso. El extracto de orégano con mayor producción de gas y AGVs fue el alcohólico mientras que el extracto que presentó la mayor mitigación de metano de un 65.4 % hasta un 98.5 % fue el oleoso, estos resultados hacen de los extractos de plantas alternativas al uso de aditivos químicos para modificar la fermentación en rumiantes. Por lo tanto, el uso de nuevas estrategias en nutrición animal con la finalidad de modificar la fermentación ruminal de manera positiva y disminuir las emisiones de CH4 entérico, deben ser diseñadas y analizadas in vitro antes de su aplicación; ya que existe una gran cantidad de factores que pueden afectar la fermentación ruminal, de modo que el uso de los extractos permita su aplicación en modelos in vivo.











 texto en
texto en