Introducción
El carcinoma hepatocelular (CHC) es la sexta neoplasia maligna más frecuente en el mundo y la tercera más mortal1,2. Ocurre generalmente en pacientes con distintos grados de daño hepático crónico3. La cirrosis hepática producida por las hepatitis B y C, o por el alcohol, es la enfermedad más asociada al CHC, aunque en la última década la obesidad y la diabetes mellitus han emergido como importantes factores de riesgo4,5.
El trasplante hepático (TH) es la única opción terapéutica que permite tratar el tumor y la cirrosis hepática al mismo tiempo6,7. En este escenario, el TH ofrece buenos resultados en términos de sobrevida global y de sobrevida libre de enfermedad a largo plazo en pacientes seleccionados4,8,9. En el año 1996 fueron creados los criterios de Milán (CM) con el fin de seleccionar aquellos pacientes que pueden beneficiarse del TH con buena sobrevida y baja tasa de recidiva. Estos criterios son los siguientes: CHC único de 5 centímetros de diámetro o menos, o no más de tres tumores de 3 centímetros de diámetro o menos cada uno. Siguiendo estos criterios se ha obtenido una sobrevida a 4 años del 85% y una sobrevida libre de enfermedad del 92%8. En los pacientes que reciben un TH y la biopsia del explante cumple los CM, la sobrevida a 5 años es similar a la de aquellos que reciben un TH por causas no oncológicas1,4.
En el mundo en general, y en Chile en especial, la disponibilidad de donantes es escasa, por lo cual es indispensable tener criterios restrictivos con el fin de maximizar la utilización de órganos para trasplante. A partir del año 2002, en los EE.UU. se establece el puntaje Model for End Stage Liver Disease (MELD) como predictor para determinar la gravedad de los pacientes y su prioridad para el TH10, hecho que fue replicado en nuestro país en 200911. En Chile, los pacientes con CHC que cumplen los CM ingresan a la lista de espera de TH con un puntaje MELD de 20 o el propio si este es mayor por la gravedad de la cirrosis.
En pacientes con CHC mayores de 2 cm, la recomendación es realizar algún tratamiento previo al TH en caso de que este se demore más de 6 meses en lista de espera, con el fin de evitar la progresión y, por ende, la salida de los CM12. Dentro de estas terapias, las más utilizadas son la ablación tumoral, ya sea por radiofrecuencia o microondas, y la quimioembolización arterial. No existe clara evidencia de cuál de los procedimientos nombrados previamente es el más efectivo como terapia puente, pero su uso es bastante extendido13-15.
En nuestro país existe solo un reporte de los resultados del TH por CHC. Este estudio se realizó sobre una muestra de 29 pacientes, compuesta por enfermos del Hospital Clínico de la Pontificia Universidad Católica y la Clínica Alemana de Santiago4. Sin embargo, no existen reportes actualizados sobre esta patología, ni información de cómo ha variado la sobrevida de los pacientes sometidos a TH por CHC, dados los prolongados tiempos de espera para TH y el aumento en el número de TH realizados por esta causa en nuestro centro desde la aplicación del puntaje MELD para la priorización del TH.
El objetivo del presente estudio es determinar la sobrevida global de los pacientes sometidos a TH por CHC siguiendo los CM, y analizar los factores asociados a la sobrevida.
Método
Estudio de cohorte no concurrente. Se analizaron los pacientes sometidos a TH por CHC en el Hospital Clínico de la Pontificia Universidad Católica de Chile entre los años 2000 y 2016.
Los criterios de inclusión fueron: pacientes mayores de 15 años en que se realizó el TH por CHC que cumplieran los CM en los estudios imagenológicos preoperatorios y enfermos en los que se realizó el TH por razones distintas a CHC, pero que en la biopsia del explante apareció incidentalmente un CHC. Todos los TH fueron realizados mediante injertos obtenidos de donantes en muerte encefálica. Se excluyeron los pacientes que presentaban registros incompletos en las fichas clínicas o en los informes de anatomía patológica.
El diagnóstico de CHC se basó en la realización de dos pruebas imagenológicas (tomografía computada y resonancia magnética) y la determinación de las concentraciones plasmáticas de alfa-fetoproteína o la realización de biopsia. Mientras los pacientes se encontraban en lista de espera para TH se efectuaron exámenes imagenológicos cada 3 meses, para confirmar que siguieran cumpliendo los CM. Además, se realizaron terapias puente al TH según decisión individualizada del comité de TH.
Se realizó una revisión de las fichas clínicas, electrónicas y de papel, de los informes de anatomía patológica y de los certificados en línea del Servicio de Registro Civil e Identificación. Se diseñó una base de datos en el software Microsoft® Excel para el registro de los datos demográficos y clínicos, los informes de anatomía patológica, la mortalidad perioperatoria y la sobrevida de los pacientes en el seguimiento. El tiempo en lista de espera se consideró solo para pacientes sometidos a TH electivo. Se analizó la distribución de las variables continuas en estudio mediante el test de Shapiro-Wilk. Para la descripción de las variables continuas se utilizaron los estadígrafos media, desviación estándar, mediana y rango, según correspondiera. La descripción de las variables cualitativas se realizó mediante frecuencias absolutas y porcentajes.
Se realizó un análisis univariable de los factores asociados a la sobrevida mediante el método de Kaplan-Meier, comparando entre los grupos mediante el test de log-rank. Aquellos factores que en el análisis univariable presentaran un valor de p < 0.2 fueron ingresados a un análisis multivariable mediante regresión de Cox para modelar los riesgos que afectaban la supervivencia de la población en estudio. Se consideró significativo un valor de p < 0.05. Se utilizó el programa SPSS 22.0 para el análisis estadístico.
El presente estudio fue aprobado por el Comité de Ética de la Pontificia Universidad Católica de Chile. Ningún dato obtenido permitió la identificación de los pacientes en estudio.
Resultados
Durante el periodo en estudio se realizaron 50 TH por CHC. El promedio de edad fue de 60.8 ± 6.1 años, y 38 pacientes (76%) fueron de sexo masculino. Las causas del daño hepático crónico más frecuentes fueron la esteatohepatitis no alcohólica y la ingesta de alcohol en 17 pacientes (34%), cada una como se detalla en la tabla 1.
Tabla 1 Etiología del daño hepático crónico en los pacientes en estudio
| Etiología | n | % |
|---|---|---|
| Esteatohepatitis no alcohólica | 17 | 34 |
| Consumo de alcohol | 17 | 34 |
| Virus de la hepatitis C | 8 | 16 |
| Cirrosis biliar primaria | 3 | 6 |
| Criptogénico | 2 | 4 |
| Hepatitis autoinmunitaria | 1 | 2 |
| Virus de la hepatitis B | 1 | 2 |
| Hemocromatosis | 1 | 2 |
| Total | 50 | 100 |
Cuarenta y siete pacientes (94%) fueron sometidos a TH electivo; los restantes fueron sometidos a un TH de urgencia. De la totalidad de los pacientes, en 40 (80%) la cirugía tuvo indicación por el diagnostico preoperatorio de CHC, mientras que en 10 (20%) se indicó por progresión de la enfermedad de base y el CHC se diagnosticó incidentalmente en la biopsia del explante. Todos los pacientes con CHC conocido cumplieron con los CM en el estudio imagenológico en el momento del TH. Cabe destacar que en 2 (4%) enfermos se realizó una reducción de estadio del CHC mediante terapias puente hasta lograr completar los CM.
De los pacientes en que se conocía el diagnóstico de CHC en el preoperatorio, en 34 (85%) se realizó alguna terapia puente al TH. La terapia más frecuente fue la quimioembolización transarterial en 19 (56.1%) casos, seguida por la radiofrecuencia en 5 (14,7%). En algunos pacientes se utilizó más de una terapia, como se detalla en la tabla 2.
Tabla 2 Terapias puente realizadas previamente al trasplante hepático
| Terapia | n | % |
|---|---|---|
| Quimioembolización transarterial | 19 | 56.1 |
| Radiofrecuencia | 5 | 14.7 |
| Radiofrecuencia más quimioembolización transarterial | 4 | 11.7 |
| Radiofrecuencia más alcoholización | 3 | 8.8 |
| Alcoholización | 2 | 5.8 |
| Resección más quimioembolización transarterial | 1 | 2.9 |
| Total | 34 | 100 |
La mediana del puntaje MELD en el momento del TH fue de 12 (9-15), como puede verse en la tabla 3. Fallecieron 2 (4%) pacientes en el posoperatorio, uno debido a un hemoperitoneo masivo y otro por una disfunción primaria del injerto. La mediana de la estadía hospitalaria fue de 13 días (3-71).
Tabla 3 Características de los pacientes en estudio
| Variables | N = 50 |
|---|---|
| Tiempo en lista de espera (meses) | 9 (1-46) |
| MELD real en el momento del trasplante hepático (puntaje) | 9 (12-15) |
| Índice de masa corporal del receptor (kg/m2) | 27.7 (21.3-39) |
| Edad del donante (años) | 42.5 ± 12.6 |
| Tiempo operatorio (minutos) | 352 (150-840) |
| Isquemia fría (minutos) | 506 (187-840) |
| Isquemia caliente (minutos) | 31 (17-79) |
| Glóbulos rojos transfundidos (unidades) | 3 (2-5) |
En la biopsia del explante, 44 (88%) pacientes cumplieron los CM. Las características de los hallazgos histopatológicos se resumen en la tabla 4.
Tabla 4 Características histopatológicas
| Variable | N = 50 |
|---|---|
| Número de tumores: | |
| - Uno | 35 (70%) |
| - Dos | 10 (20%) |
| - Tres | 2 (4%) |
| - Cuatro | 2 (4%) |
| - Seis | 1 (2%) |
| Diámetro del tumor más grande (cm) | 2.3 (0.8-9) |
| Suma de diámetros máximos (cm) | 2.9 (0.8-9) |
| Nódulos satélites (sí) | 6 (12%) |
| Invasión vascular | 2 (4%) |
En el seguimiento, 2 (4%) pacientes presentaron recidiva del CHC, en un promedio de 18 meses tras el TH. Un paciente (2%) presentó recidiva pulmonar y cerebral, mientras que el otro enfermo (2%) presentó recidiva pulmonar y suprarrenal, siendo en ambos casos la causa de su posterior fallecimiento.
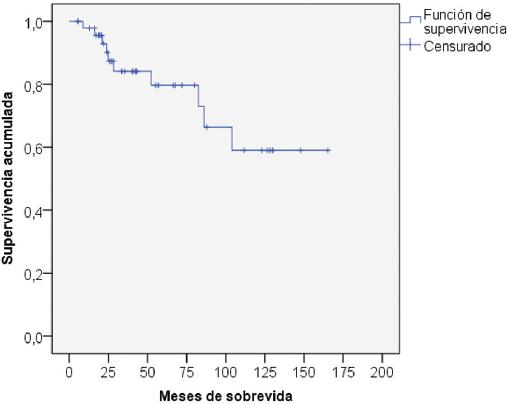
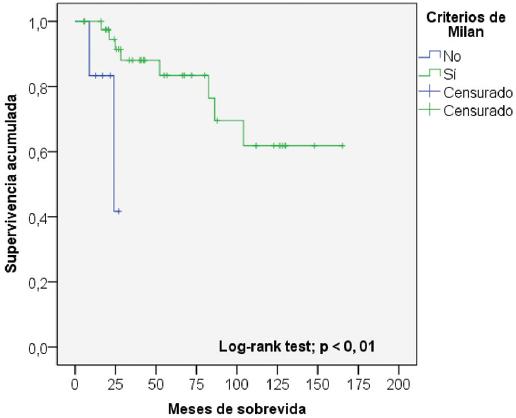
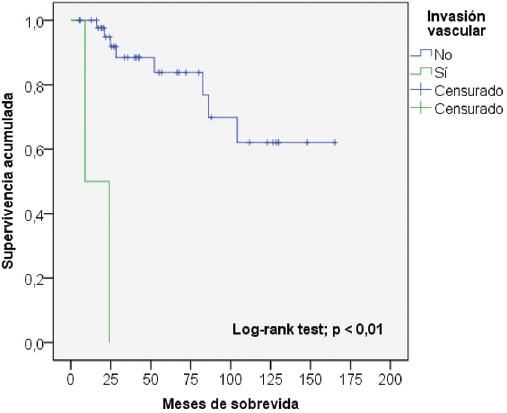
La sobrevida de los pacientes al año y a los 5 años fue del 93.9 y el 76.5%, respectivamente (Fig. 1). La tabla 5 muestra el análisis univariable de los factores asociados a la sobrevida. Las variables que resultaron con un valor de p < 0.2 fueron el puntaje MELD en el momento del TH (p = 0.11), el cumplimiento de los CM en la biopsia del explante (p < 0.01) (Fig. 2) y la ausencia de invasión vascular en la biopsia (p < 0.01) (Fig. 3). En la regresión de Cox (tabla 6), las únicas variables asociadas a una mayor sobrevida fueron el cumplimiento de los CM (hazard ratio [HR]: 0.104; intervalo de confianza del 95% [IC 95%]: 0.017-0.637; p = 0.01) y la ausencia de invasión vascular (HR: 0.050; IC 95%: 0.008-0.306; p < 0.01) en la biopsia del explante.
Tabla 5 Análisis univariable de los factores asociados a la sobrevida
| Variable | Categoría | Número (%) | Sobrevida (meses) | p |
|---|---|---|---|---|
| Edad | < 60 años | 23 (46%) | 129.9 ± 15.2 | 0.61 |
| ≥ 60 años | 27 (54%) | 96.3 ± 10.7 | ||
| Sexo | Masculino | 38 (76%) | 123.8 ± 15.2 | 0.58 |
| Femenino | 12 (24%) | 96.6 ± 15.2 | ||
| Alfa-fetoproteína | < 10 ng/ml | 43 (86%) | 115.2 ± 13.8 | 0.48 |
| ≥ 10 ng/ml | 7 (14%) | 103.7 ± 15 | ||
| CHC conocido | No | 10 (20%) | 110.8 ± 11.7 | 0.62 |
| Sí | 40 (80%) | 118.2 ± 13.6 | ||
| Tratamiento puente* | Sí | 34 (85%) | 114.6 ± 17 | 0.93 |
| No | 6 (15%) | 104.8 ± 23.8 | ||
| Lista de espera | < 9 meses | 25 (50%) | 138.9 ± 14.5 | 0.35 |
| ≥ 9 meses | 25 (50%) | 95.2 ± 10 | ||
| MELD al TH | < 13 | 25 (50%) | 141.4 ± 14.7 | 0.11 |
| ≥ 13 | 25 (50%) | 98.2 ± 13.2 | ||
| IMC receptor | < 28 kg/m2 | 25 (50%) | 114.5 ± 17.1 | 0.32 |
| ≥ 28 kg/m2 | 25 (50%) | 118.9 ± 12 | ||
| Edad del donante | < 44 años | 25 (50%) | 119.2 ± 15.5 | 0.52 |
| ≥ 44 años | 25 (50%) | 106.6 ± 9.9 | ||
| Tiempo operatorio | < 360 minutos | 31 (62%) | 107.8 ± 9.2 | 0.95 |
| ≥ 360 minutos | 19 (38%) | 121.7 ± 14 | ||
| Isquemia fría | < 500 minutos | 18 (36%) | 120.5 ± 12.5 | 0.87 |
| ≥ 500 minutos | 32 (64%) | 77.4 ± 6.8 | ||
| Isquemia caliente | < 30 minutos | 25 (50%) | 120.1 ± 14.6 | 0.86 |
| ≥ 30 minutos | 25 (50%) | 98.7 ± 10.6 | ||
| Unidades de GR | < 3 unidades | 23 (46%) | 125.7 ± 13.2 | 0.55 |
| ≥ 3 unidades | 27 (54%) | 91.2 ± 14.9 | ||
| CM en explante | Sí | 44 (88%) | 126.9 ± 11.2 | < 0.01 |
| No | 6 (12%) | 22.6 ± 2.6 | ||
| Nódulos satélites | Sí | 44 (88%) | 25.8 ± 0.7 | 0.46 |
| No | 6 (12%) | 123.7 ± 11.3 | ||
| Suma de diámetros mayores | < 2.9 cm | 25 (50%) | 128.6 ± 14.1 | 0.36 |
| ≥ 2.9 cm | 25 (50%) | 87.7 ± 11.5 | ||
| Número de tumores | 1 | 35 (70%) | 112.6 ± 12.9 | 0.47 |
| ≥ 2 | 15 (30%) | 108.2 ± 14.2 | ||
| Invasión vascular | No | 48 (96%) | 122.1 ± 11.2 | < 0.01 |
| Sí | 2 (4%) | 16.4 ± 7.5 |
*Solo considera pacientes con CHC conocido en el preoperatorio.
CHC: carcinoma hepatocelular; CM: criterios de Milán; GR: glóbulos rojos; IMC: índice de masa corporal; MELD: Model for End Stage Liver Disease; TH: trasplante hepático.
Tabla 6 Análisis multivariable de los factores asociados a la sobrevida
| Variable | Categoría | HR | IC 95% | p |
|---|---|---|---|---|
| MELD al TH | < 13 | 0.269 | 0.056-1.291 | 0.10 |
| ≥ 13 | ||||
| CM en explante | Sí | 0.104 | 0.017-0.637 | 0.01 |
| No | ||||
| Invasión vascular | No | 0.050 | 0.008-0.306 | < 0.01 |
| Sí |
CM: criterios de Milán; HR: hazard ratio; IC 95%: intervalo de confianza del 95%; MELD: Model for End Stage Liver Disease; TH: trasplante hepático.
Discusión
En el presente estudio, la sobrevida global de los pacientes sometidos a TH es prácticamente idéntica a lo reportado en la literatura nacional e internacional1,4. El cumplimiento de los CM y la ausencia de invasión vascular en la biopsia del explante se asociaron a una mayor sobrevida a largo plazo, como ha sido informado previamente8,16,17.
Las características demográficas y clínicas de los pacientes son similares a las señaladas en estudios previos18. En la mayoría de los pacientes se conocía el diagnostico de CHC en el preoperatorio, y en casi la totalidad de ellos se realizó alguna terapia puente al TH. Esta wse recomienda en casos en que el TH se demorará probablemente más de 6 meses12,13. En el presente estudio, la mediana de tiempo en lista de espera para TH fue de 9 meses, cifra superior a la presentada en otros estudios16 y a la recomendada en la literatura internacional, debido a la escasa cantidad de donantes en nuestro país. El cumplimiento de los CM se produjo en un 87.2% de los pacientes en estudio, lo que es mayor que lo obtenido en el estudio chileno previamente señalado4. Esto podría deberse a que el presente estudio se basa en una muestra homogénea de pacientes de un solo centro clínico, mientras que el estudio previo combinaba pacientes de dos centros distintos, con diferentes profesionales tratantes. Además, debe considerarse la probable influencia de la realización de exámenes imagenológicos seriados; en nuestro centro se realizaron cada 3 meses, lo que permitió excluir del TH a los pacientes que dejaran de cumplir los CM. Otro factor que cabe mencionar es la realización de terapias puente, que ayudaron a mantener a los pacientes cumpliendo los CM mientras se encontraban en lista de espera para TH.
En el presente estudio, un 20% de los pacientes presentó el CHC como hallazgo incidental en la biopsia. Esta situación no es infrecuente; la incidencia reportada varía entre un 4 y un 40% de los pacientes sometidos a TH por indicación no neoplásica19,20. La detección de CHC pequeños (< 3 cm) es difícil debido a que el parénquima hepático del paciente cirrótico presenta fibrosis, nódulos regenerativos o displásicos, infiltración grasa y necrosis19. Los estudios previos señalan que la sobrevida de los pacientes con CHC incidental es similar a la de aquellos con CHC conocido en el preoperatorio21,22, lo cual fue confirmado por la presente investigación. Por lo tanto, es correcto reunir ambos grupos de pacientes para su estudio en conjunto.
En el presente estudio se realizó reducción del estadio tumoral para lograr cumplir con los CM en solo dos pacientes. La evidencia disponible señala que la sobrevida de los pacientes sometidos a TH en que se realizó reducción del estadio preoperatorio es similar a la de aquellos que se someten a TH cumpliendo los CM desde el inicio2,12,23.
En el presente estudio no se encontró asociación entre la sobrevida a largo plazo y factores como los valores de alfa-fetoproteína y la transfusión de glóbulos rojos, lo cual difiere de investigaciones previas24,25. En cuanto a la transfusión de glóbulos rojos, podría deberse a la escasa cantidad de transfusiones realizadas en nuestros pacientes, pues la mediana fue de tres unidades.
Las limitaciones del presente estudio son su carácter observacional, retrospectivo y un tamaño muestral menor si se compara con series internacionales.
En conclusión, la sobrevida de los pacientes sometidos a TH por CHC en nuestro centro es similar a la reportada en la literatura internacional, y se encuentra determinada por el cumplimiento de los CM y la ausencia de invasión en la biopsia del explante.











 nova página do texto(beta)
nova página do texto(beta)