Introducción
La fusión vertebral lumbar es un procedimiento en continuo auge, se estima que aproximadamente se realizan alrededor de 400,000 intervenciones anuales en Estados Unidos.1,2 A los cinco años de una cirugía de artrodesis lumbar hasta 40% de los pacientes comienzan a desarrollar cambios radiológicos de enfermedad del segmento adyacente (ESA) y casi la mitad de estos pacientes volverán a consulta de cirugía de columna por empeoramiento clínico.3,4,5,6 Un porcentaje importante será reintervenido por aumento de dolor radicular, claudicación neurógena o dolor mecánico lumbar.7,8 Según la progresión de la ESA, será necesario la descompresión (laminectomía, foraminotomía, facectomía) y/o extensión de la fusión vertebral (anterior (ALIF), transforaminal (TLIF) o posterior (PLIF)).3,8,9,10,11 La cirugía de revisión presenta una alta tasa de complicaciones debidas a los tiempos quirúrgicos prolongados, a las grandes pérdidas hemáticas y a las largas estancias hospitalarias con un riesgo de lesión neurológica (lesión del saco dural)12,13 y con tasas de reintervención que oscilan alrededor de 25%.14
Las publicaciones acerca del tratamiento de la ESA que utiliza el abordaje transpoas mínimamente invasivo para realizar la fusión lateral (LLIF) presentan menor porcentaje de complicaciones y resultados similares en cuanto a tasa de artrodesis y mejoría clínica. Con esta cirugía se obtiene una fusión vertebral anterior y una descompresión indirecta de los elementos neurológicos con menor daño en las partes blandas, tiempo quirúrgico más corto y movilización precoz del paciente.15,16
Un aspecto clave en el tratamiento de la ESA es la realización de una fusión intersomática, con ella se busca la estabilidad de la columna anterior, la mejoría en el perfil sagital lumbar y una descompresión indirecta neural por distracción de las partes blandas.17,18,19 Para conseguir la fusión vertebral se utilizan implantes metálicos de titanio (Ti) desde 1940 e implantes plásticos de Poly-ether-ether-ketone (PEEK) desde 1990.20 Se han publicado múltiples estudios que evalúan los resultados de estos implantes a pesar de lo cual no hay consenso en cuanto a su uso.21,22 Por todos estos motivos hemos realizado un estudio clínico de los pacientes intervenidos mediante LLIF para tratamiento de la ESA utilizando dispositivos intersomáticos de Ti y de PEEK.
Material y métodos
Se han analizado y comparado los resultados clínicos y radiológicos, las complicaciones y la calidad de vida de un total de 32 pacientes intervenidos desde Septiembre de 2015 hasta Septiembre de 2018, con un seguimiento medio de 25 meses (máximo 46 meses y mínimo 18 meses).
Se recogieron las características médicas, situación clínica preoperatoria (escala visual analógica (EVA) lumbar y ciático; Owestry Disability Score (ODI)), la calidad de vida (EuroQol-5D (EQ5D)) y los parámetros radiológicos prequirúrgicos (lordosis lumbar (LL): medición angulación sagital desde el platillo superior L1 a platillo inferior L5; lordosis nivel (LN): medición angulación sagital desde el platillo superior vértebra superior a platillo inferior de la vértebra inferior; Cobb nivel (CN): angulación frontal platillo superior vértebra superior a platillo inferior de la vértebra inferior; y la altura del disco intervenido (ADI): platillo inferior vértebra superior a platillo superior de la vértebra inferior (medido en radiología anteroposterior y lateral) de todos los pacientes. La edad media en el momento de la cirugía fue de 66 años (39-89). Del total de pacientes, 68% fueron mujeres. La patología médica más frecuente fue la HTA (21%). Todos los pacientes presentaban como patología a tratar enfermedad del segmento adyacente: clínicamente sufrían de dolor lumbar crónico e irradiado por miembros inferiores con una discopatía lumbar con artrosis facetaria que condiciona estenosis foraminal proximal a una instrumentación lumbar previa, sin mejoría clínica tras terapia médica, física y rehabilitadora durante un período mínimo de seis meses.
Técnica quirúrgica
Las cirugías se han realizado con el paciente colocado en decúbito lateral, en mesa radiotransparente y quebrada en la zona lumbosacra. Todas las intervenciones se efectuaron con monitorización por neurofisiólogo. Se han utilizado cuatro técnicas de control neurofisiológico intraoperatorio: potenciales evocados motores tras estímulo transcraneal (TcMP), potenciales evocados somatosensoriales (SSEP), EMG-libre (Free Running-EMG) y EMG-estimulado (Triggered-EMG). Mediante este control neurofisiológico todos los pasos quirúrgicos son controlados y mediante la detección de cambios en el registro y la modificación de la técnica para recuperar la actividad fisiológica pueden evitarse las complicaciones derivadas de esta técnica quirúrgica. En los casos en los que la anatomía de la columna lumbosacra, de los grandes vasos y de la pelvis nos lo permitió, posicionamos al paciente con el lado doloroso hacia arriba, es decir, el abordaje fue por el mismo lado donde se presentaba la clínica radicular. Con ayuda del intensificador de imágenes se realizó la localización del nivel a intervenir y se hizo una incisión de aproximadamente 3 cm. Tras la piel y el tejido celular subcutáneo se abrió la fascia de la musculatura oblicua abdominal hasta el retroperitoneo. Mediante disección roma con el dedo se identificó la apófisis transversa de la vértebra superior, el músculo psoas y el disco intervertebral. Bajo control radioscópico se colocó la aguja guía en la posición adecuada y se hizo un primer control neurofisiológico. Mediante una serie de dilatadores se obtuvo una ventana de trabajo a través del músculo psoas. Este gesto se realizó siempre bajo un estricto control neurofisiológico intraoperatorio. El separador se introdujo a través de la aguja situada en el disco intervertebral y se inició su apertura. Bajo control radioscópico se localizó el lugar para fijar las valvas en los cuerpos vertebrales. Una vez localizado el disco intervertebral se abrió con el bisturí y se realizó la discectomía. Se procedió a preparar los platillos vertebrales hasta hueso subcondral y a introducir dilatadores que nos dieron una idea del tamaño, longitud y anchura del implante. Una vez decididas las medidas se introduce una caja de prueba y se comprueba su colocación bajo control radioscópico así como la estabilidad primaria de la misma.
El tipo del dispositivo (PEEK o titanio) fue elegido a criterio del cirujano. La caja se introdujo rellenada de matriz ósea desmineralizada (MOD) para facilitar la artrodesis intersomática (Figura 1). Los implantes utilizados tienen una altura desde 8 mm con incrementos de 2 en 2 mm hasta 14 mm; una longitud desde 45 mm con incrementos de 5 en 5 mm hasta 60 mm y una anchura de 18 y 22 mm. La caja intersomática se implantó con placa lateral atornillada, en los casos en los que la anatomía no lo permitió (por encontrarse el nervio femoral sobre la zona de trabajo) la caja se colocó stand-alone.
Período postquirúrgico
Se autorizó la marcha al día siguiente de la cirugía. Todos los pacientes utilizaron corsé termoplástico rígido a medida durante tres meses. La limitación de actividades físicas (laborales o deportivas) se mantuvo durante cuatro meses. No se autorizó hacer esfuerzos intensos hasta los seis meses de la intervención.
Las variables postquirúrgicas (resultados clínicos, de calidad de vida y los parámetros radiológicos) se recogieron tras la cirugía al primer, sexto y décimo segundo mes. Se realizó TC lumbar al año de la inntervención en búsqueda de tasa fusión, distinguiendo: fusión completa (formación de puentes óseos a través y alrededor del implante), fusión incompleta (puentes óseos a través o alrededor del implante) y falta de fusión (seudoartrosis) (Figura 2).23 Se registraron todas las complicaciones locales y sistémicas, intraoperatorias y postoperatorias durante el período hospitalario y durante el seguimiento. A su vez en cada grupo se distinguieron las complicaciones menores (recibieron tratamiento médico para su curación) y mayores (precisaron tratamiento quirúrgico para su resolución).
Métodos estadísticos
Se ha realizado un estudio estadístico comparativo de todos los parámetros recogidos analizando los resultados de la serie y de cada grupo comparándolos en búsqueda de diferencias. Para ello se ha llevado a cabo un estudio comparativo mediante SPSS 17.0 (SPSS Inc. Chicago USA). Las variables cualitativas se presentarán con su distribución de frecuencias e intervalo de confianza al 95% y las variables cuantitativas se resumieron con su media y desviación estándar (DE) o mediana y rango intercuartílico (RIQ = P25-P75) en caso de asimetría de la distribución de la variable.
Para la comparación de variables cualitativas recogidas utilizaremos el test de χ2 o la prueba exacta de Fisher en el caso de que más de 25% de lo esperado sean menores de cinco.
Para la comparación de variables cuantitativas recogidas del cuestionario general con las subescalas de desgaste profesional como variable cualitativa utilizaremos el test ANOVA o de Kruskal-Wallis, previa realización del test de homogeneidad de varianzas de Levene, si las variables siguen una distribución normal en los grupos a comparar y el test no paramétrico de la U de Mann-Whitney si no se ajustan a la distribución normal. El estudio de la normalidad se realizará mediante el test de bondad de ajuste de Kolmogorov-Smirnov. Para todas las pruebas se aceptará un valor de significación de 5% (p < 0.05).
Resultados
Inicialmente se incluyeron 32 pacientes con ESA tratados mediante LIF. Se implantaron 16 cajas de PEEK y 16 de titanio. Durante el período postoperatorio tres pacientes fueron excluidos del estudio por pérdida de seguimiento (tres pacientes del grupo PEEK), por lo que se analizaron 29 pacientes que pueden separarse en dos grupos (16 PEEK/13 titanio). La edad media de nuestros pacientes fue 66 años y en su mayoría fueron mujeres (68%). El dolor irradiado recogido con más frecuencia fue por la pierna derecha (86%). El EVA lumbar prequirúrgico medio fue de 6.2, el EVA pierna prequirúrgico medio fue de 5.3, el ODI 50.2 ± 18.9 y el EQ5D fue 0.52. Ambos grupos presentaban características preoperatorias similares, no se encontraron diferencias estadísticamente significativas en la distribución de las variables analizadas en ambos grupos (Tabla 1).
Tabla 1: Distribución de variables preoperatorias.
| General (N = 29) | PEEK (n = 16) | Titanio (n = 13) | ||
|---|---|---|---|---|
| n (%) | n (%) | n (%) | p | |
| Edad | 66 (39-85) | 64 (39-85) | 68 (47-80) | 0.541 |
| Sexo | ||||
| Mujeres | 18 (68) | 10 | 8 | 0.871 |
| Varones | 11(32) | 7 | 4 | |
| Fumador | ||||
| Sí | 14 (47) | 8 | 6 | 0.737 |
| No | 12 (53) | 6 | 6 | |
| Patología endocrina | ||||
| Diabetes mellitus | 4 (16) | 3 | 1 | 0.362 |
| Obesidad | 2 (11) | 1 | 1 | 0.368 |
| Dislipidemia | 8 (32) | 4 | 4 | 0.376 |
| Hipotiroidismo | 4 (16) | 3 | 1 | 0.386 |
| Patología cardíaca | ||||
| HTA | 6 (21) | 3 | 3 | 0.073 |
| ICC | 1 (5) | 0 | 1 | 0.98 |
| FA | 1 (5) | 1 | 0 | 0.063 |
| Valvulopatía | 1 (5) | 1 | 0 | 0.187 |
| Patología pulmonar | ||||
| EPOC | 1 (5) | 1 | 0 | 0.023 |
| Patología neurológica | ||||
| AIT | 1 (5) | 1 | 1 | 0.020 |
| Vértigos | 1 (5) | 1 | 0 | |
| Patología digestiva | ||||
| Gastritis crónica | 1 (5) | 0 | 1 | 0.030 |
| Patología infecciosa | ||||
| VIH | 1 (5) | 1 | 0 | 0.025 |
| Patología gine-urológica | ||||
| Patología prostática | 3 (11) | 2 | 1 | |
| Patología uterina | 3 (11) | 1 | 2 | |
| Patología siquiátrica | ||||
| Depresión | 6 (21) | 3 | 3 | |
| EVA lumbar | 6.2 ± 2.12 | 6.1 ± 1.78 | 6.4 ± 2.02 | |
| EVA pierna | 5.3 ± 2.26 | 5.1 ± 2.26 | 5.5 ± 1.65 | |
| ODI | 50.2 ± 18.9 | 50.9 ±11.32 | 48.5 ± 17.4 | 0.042 |
| EQ5D | 0.52 | 0.51 | 0.57 | 0.021 |
Comparativa PEEK vs. titanio.
PEEK = poly-ether-ether-ketone, HTA = hipertensión arterial, ICC = insuficiencia cardíaca crónica, FA = fibrilación auricular, EPOC = enfermedad pulmonar obstructiva crónica, AIT = ataque isquémico transitorio, VIH = virus de la inmunodeficiencia humana, ODI = Oswestry Disability Index, EQ5D = EuroQol-5D.
Con respecto a las variables quirúrgicas, el segmento intervenido con más frecuencia fue L3-L4 (62%) mediante abordaje retroperitoneal derecho 86%. El tamaño del implante que con más frecuencia se utilizó fue 10 × 22 × 50 mm (36.8%). Los implantes empleados presentan una altura de 10, 12 y 14 mm; longitud de 45, 50 y 55 mm y anchura de 18 y 22 mm. En 66% de los casos19 se asoció fijación con placa lateral y tornillos (13 PEEK y 6 titanio) y en 10 (34%) no fue posible implantarla debido a la presencia del nervio femoral en la zona de trabajo (cinco cajas stand alone por grupo). El tiempo de cirugía medio fue 49 minutos, la pérdida de sangre estimada fue de 40 ml. Durante la cirugía se registraron varios cambios en la señal neurofisiológica, cuando aparecieron estas alarmas se realizaron modificaciones técnicas (cambio de colocación del separador o valvas) que permitieron que durante la cirugía las alteraciones desaparecieran y que el control neurofisiológico final fuera normal.
Con respecto al análisis del postoperatorio inmediato (hospitalario), la estancia media fue 2.9 días;2,3,4 28% de los pacientes precisaron transfusión de sangre, la necesidad de transfusión de sangre requerida media fue de 0.8 cm3 de hematies (0-2) sin diferencias entre ambos grupos (p = 0.15). Con respecto a las complicaciones inmediatas menores (precisaron de tratamiento médico para su curación), se encontraron locales menores en 6.9%: una celulitis de la herida (3.45%), una plexopatía femoral (3.45%) (afectación motora del nervio femoral (paresia): un caso de neuroapraxia del femoral ipsilateral al lado de abordaje en el nivel L2-L3. Esta alteración no fue detectada durante el control neurofisiólogo intraoperatorio y se recuperó completamente antes de los seis meses de la intervención con tratamiento médico), ninguna lesión radicular, lesión visceral ni infección). Con respecto a las complicaciones sistémicas menores se encontraron 12 eventos (41.4%), el más frecuente fue la anemización (siete), infección del tracto urinario (ITU) (dos), íleo paralítico (tres). No se registraron complicaciones inmediatas mayores locales (ninguna lesión de la duramadre, lesión vascular mayor, sangrado retroperitoneal ni infección profunda) ni sistémicas (TVP, TEP fallecimiento). En consecuencia, no se registró ninguna reintervención durante el postoperatorio inmediato. Estas variables presentaron una distribución similar en ambos grupos sin diferencias estadísticamente significativas (Tabla 2). Merece un comentario aparte la presencia de dolor leve-moderado (parestesias) en el tercio proximal del muslo del lado de la vía de abordaje. En nuestra serie estos acontecimientos se observaron en 27.6% de los casos.7 Todos ellos se resolvieron en menos de seis meses. No se han encontrado diferencias estadísticas entre los grupos (p = 0.563).
Tabla 2: Distribución de complicaciones inmediatas.
| General (N = 29) | PEEK (n = 16) | Titanio (n = 13) | p | |
|---|---|---|---|---|
| Menores | 12 | 6 | 6 | |
| Sistémicas | ||||
| Anemización | 7 | 3 | 4 | 0.618 |
| Íleo paralítico | 3 | 2 | 1 | |
| ITU | 2 | 1 | 1 | |
| Hernia abdominal | 0 | 0 | 0 | |
| Locales | ||||
| Celulitis herida | 1 | 1 | 0 | 0.129 |
| Plexopatía femoral | 1 | 1 | 0 | 0.129 |
| Mayores | 1 | 1 | 0 | 0.129 |
| Sistémicas | ||||
| Exitus | 0 | 0 | 0 | |
| Lesión radicular | 0 | 0 | 0 | |
| Lesión vascular | 0 | 0 | 0 | |
| Hematoma retroperitoneal | 0 | 0 | 0 | |
| Locales | ||||
| Infección profunda | 0 | 0 | 0 |
Comparativa PEEK vs. titanio.
PEEK = poly-ether-ether-ketone, ITU = infección del tracto urinario.
Desde el punto de vista del resultado radiológico: Se han analizado los cambios de los parámetros prequirúrgicos con los valores al mes, a los seis meses y a los 12 meses (lordosis lumbar (LL), lordosis nivel (LN), Cobb nivel (CN) y la altura del disco intervenido (ADI (AP y LAT)): como hallazgos significativos se evidenció aumento de la LL y LN, disminución del CN y aumento de la ADI en AP y lateral (Tabla 3). Por otra parte, se han comparado los resultados según el tipo de implante: en el inicio el aumento de la LL fue significativamente mayor en el grupo PEEK (p = 0.029). La disminución del CN fue mayor en el grupo PEEK a los seis meses (p = 0.030). Estos cambios fueron igualándose a lo largo del seguimiento, a los 12 meses no se observaron diferencias significativas en ambos grupos (LL p = 0.367 y CN p = 0.474) (Tabla 3).
Tabla 3: Distribución de variables radiológicas (preoperatorio, uno, seis y 12 meses).
| Evolución parámetros radiológicos | Comparación por grupos | ||||
|---|---|---|---|---|---|
| Media (mm) | Significación evolución | PEEK | Titanio | Significación comparación | |
| Altura disco AP (meses) | |||||
| Pre | 7.61 ± 3.31 | 6.50 ± 3.5 | 9.41 ± 1.84 | 0.048 | |
| 1 | 12.81 ± 2.36 | 0.000 | 12.36 ± 2.55 | 13.56 ± 1.95 | 0.269 |
| 6 | 11.28 ± 2.92 | 0.006 | 10.24 ± 2.61 | 12.72 ± 2.84 | 0.065 |
| 12 | 11.825 ± 2.25 | 0.023 | 10.88 ± 1.28 | 13.40 ± 2.74 | 0.024 |
| Altura disco LAT | |||||
| Pre | 7.64 ± 3.55 | 6.61 ± 4.01 | 9.41 ± 1.81 | 0.091 | |
| 1 | 13.47 ± 2.05 | 0.001 | 13.18 ± 2.31 | 13.96 ± 1.59 | 0.410 |
| 6 | 11.41 ± 2.70 | 0.010 | 10.66 ± 2.33 | 12.45 ± 2.74 | 0.159 |
| 12 | 11.82 ± 3.28 | 0.010 | 10.73 ± 2.11 | 13.65 ± 4.23 | 0.084 |
| Lordosis lumbar | |||||
| Pre | 28.58 ± 10.14 | 28.12 ± 9.70 | 29.32 ± 11.42 | 0.800 | |
| 1 | 32.619 ± 8.83 | 0.000 | 33.96 ± 8.95 | 30.44 ± 8.75 | 0.388 |
| 6 | 33.13 ± 10.30 | 0.000 | 32.42 ± 11.40 | 34.11 ± 9.24 | 0.734 |
| 12 | 31.81 ± 8.925 | 0.000 | 33.66 ± 10.20 | 29.44 ± 6.99 | 0.367 |
| Lordosis segmentaria | |||||
| Pre | 5.88 ± 4.8 | 5.892 ± 3.87 | 5.863 ± 3,02 | 0.985 | |
| 1 | 10.74 ± 4.12 | 0.014 | 11.13 ± 4.60 | 10.11 ± 3.2 | 0.596 |
| 6 | 10.41 ± 2.70 | 0.010 | 10.78 ± 1.1 | 9.85 ± 2.1 | 0.747 |
| 12 | 9.82 ± 3.28 | 0.023 | 10.31 ± 4.5 | 9.71 ± 1.1 | 0.311 |
| Cobb | |||||
| Pre | 7.57 ± 3.50 | 7.29 ± 2.20 | 8.01 ± 5.10 | 0.683 | |
| 1 | 4.61 ± 2.63 | 0.000 | 4.24 ± 1.76 | 5.20 ± 3.70 | 0.465 |
| 6 | 4.20 ± 3.64 | 0.000 | 3.60 ± 1.55 | 5.30 ± 5.95 | 0.523 |
| 12 | 3.90 ± 3.31 | 0.000 | 3.40 ± 1.77 | 4.70 ± 5.12 | 0.474 |
PEEK = poly-ether-ether-ketone, AP = anteroposterior, LAT = lateral.
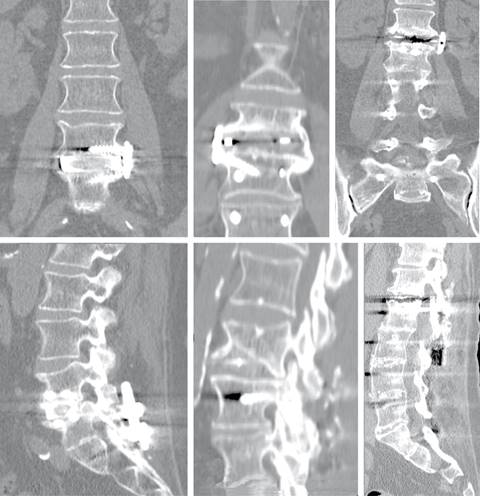
Con respecto a la tasa de fusión, con el TC lumbar al año de la cirugía se encontraron puentes óseos con fusión completa en 16 pacientes (55.2%), con fusión incompleta en ocho pacientes (27.6%) y falta de fusión en cinco pacientes (17.25%) de la serie, sin evidencias significativas entre los grupos (Figura 3). Considerando la tasa de fusión global (total y parcial) analizada mediante TC es de 84.3%24 y distinguiendo los grupos de estudio: 88% Ti y 82% PEEK (p = 0.53) (Tabla 4).

Figura 3: Evolución radiológica de una artrodesis intersomática lateral durante el seguimiento a los tres, seis y 12 meses.
Tabla 4: Grado de fusión.
| Grado | Global (N = 29) | PEEK (n = 16) | Titanio (n = 13) | Significación |
|---|---|---|---|---|
| 1 | 5 | 2 | 3 | 0.798 |
| 2 | 8 | 5 | 3 | 0.325 |
| 3 | 16 | 9 | 7 | 0.568 |
Comparación grado de fusión PEEK vs. titanio.
PEEK = poly-ether-ether-ketone.
Respecto a las complicaciones tardías sistémicas, no se ha recogido ninguna complicación menor ni mayor (ningún caso de fallecimiento).
Como complicaciones tardías locales menores se registró un caso de síndrome facetario lumbar: paciente varón de 47 años con artrodesis lumbar L5-S1 PLIF, hace años que fue intervenido en Diciembre de 2016 realizándose LLIF L4-L5 (titanio), presenta dolor lumbar persistente sin dolor radicular, por lo que en Diciembre de 2017 fue tratado por la unidad de dolor mediante rizólisis.
Como complicaciones tardías locales mayores, cabe señalar que no se encontró ningún caso de fístula de líquido cefalorraquídeo o seudomeningocele, ninguna fibrosis perirradicular, hernia abdominal ni infección. Pero se recogieron dos casos de fractura vertebral, una recidiva clínica y una movilización de caja, sin encontrarse diferencias estadísticas entre los grupos. Fractura L4: paciente varón de 85 años con artrodesis lumbar L4-L5 TLIF, hace años que fue intervenido en Noviembre de 2016 realizándose LLIF L3-L4 (PEEK), presenta fractura de L4 en Enero de 2017 (dos meses postquirúgicos) realizándose mediante abordaje bilateral de Wistle retirada de material TLIF previo y artrodesis con tornillos pediculares L2 a L5 (Figura 4). Fractura L3: Paciente mujer 67 años con artrodesis lumbosacra L4-S1 previa que fue intervenida en julio de 2017 realizándose LLIF L3-L4 (titanio), presenta fractura de L3 en Marzo de 2018 que fue intervenida realizándose en un primer tiempo lateral colocación de caja de corrección hiperlordótica. En un segundo tiempo mediante abordaje posterior, extracción de tornillos y barras y se amplía la artrodesis posterior D11-S1 (Figura 5). Movilización caja: mujer de 48 años con antecedentes de artrodesis L5-S1 se intervino en Julio de 2017 realizándose LLIF L4-L5 (PEEK) mediante técnica stand-alone, a las cinco semanas de la cirugía comenzó con un importante dolor lumbar irradiado a miembro inferior izquierdo. El estudio de imagen demostró una movilización mayor de 10 mm. Como tratamiento quirúrgico se procedió a la retirada de la caja por la misma vía transpsoas y ante la imposibilidad de colocar nuevo implante debido a la rotura parcial de la caja y al alto riesgo de lesionar el nervio femoral se decidió rellenar el espacio intersomático mediante injerto con DBM (Figura 6). Recidiva: paciente varón de 82 años con artrodesis lumbar L4-L5 PLIF, hace años que fue intervenido en Julio de 2017 realizándose LLIF L3-L4 (PEEK), presenta recidiva clínica (dolor lumbar y radicular) en Diciembre de 2017 (cinco meses postquirúrgicos), se realizó mediante abordaje posterior descompresión mediante laminectomía L3. Cuatro pacientes (13.8%) fueron reintervenidos (con retirada del implante (movilización y una fractura) y se añadió cirugía de fijación posterior (con descompresión en el caso de la recidiva). El estudio comparativo de las complicaciones no evidenció diferencias respecto al tipo de caja (p = 0.33) ni con respecto a la necesidad de reintervención (p = 0.624) ni a la de retirada de la caja (p = 0.523) (Tabla 5).
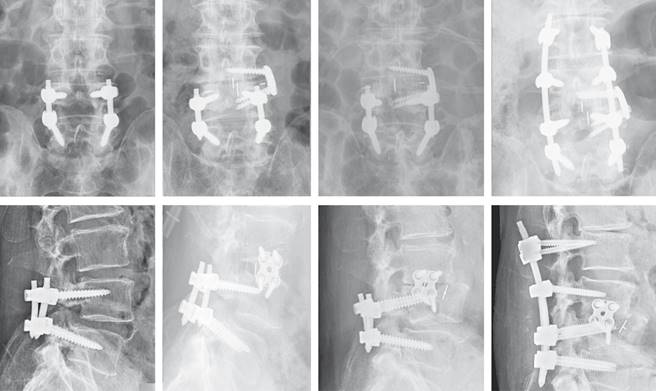
Figura 4: Evolución radiológica de la fractura L4. Imágenes de izquierda a derecha: pre-LLIF, control a los tres meses, complicación y resultado de la revisión.
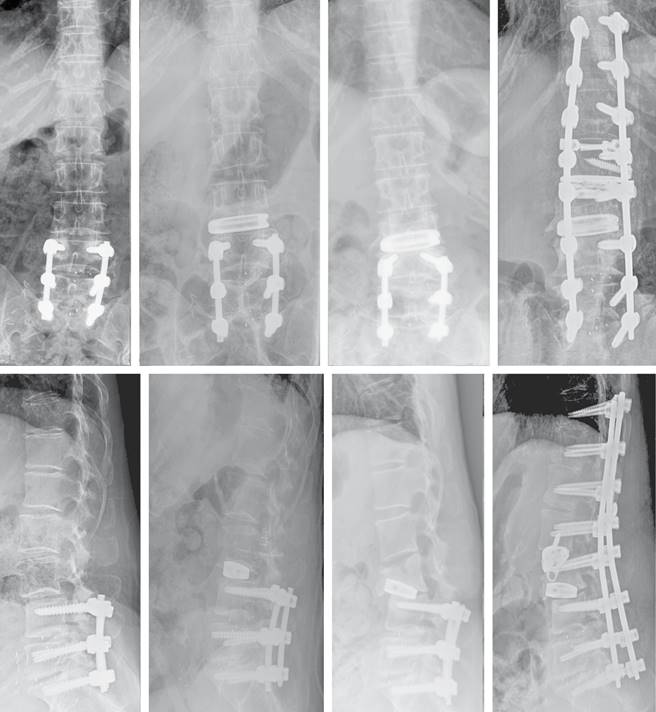
Figura 5: Evolución radiológica de la fractura L3. Imágenes de izquierda a derecha: pre-LLIF, control a los tres meses, complicación y resultado de la revisión.

Figura 6: Evolución radiológica de la movilización. Imágenes de izquierda a derecha: pre-LLIF, control a los tres meses, complicación y resultado de la revisión.
Tabla 5: Distribución de las complicaciones tardías.
| General (n = 29) | Titanio (n = 13) | PEEK (n = 16) | Significación | |
|---|---|---|---|---|
| Mayores | Movilización caja (1) | Fractura-hundimiento (1) | Movilización caja (1) | |
| Fractura-hundimiento (2) | Fractura-hundimiento (1) | |||
| Menores | Recidiva (1) | 0.400 | ||
| Síndrome facetario (1) | Síndrome facetario (1) | Recidiva (1) |
Analizando los resultados clínicos de la serie con respecto al dolor, la puntuación de la escala analógica visual (EVA) lumbar preoperatoria pasó de 6.2 ± 2.12 a 4.1 ± 1.71 al año (p = 0.028). La EVA de la pierna descendió de 5.3 ± 2.26 en el preoperatorio a 1.9 ± 1.58 al año (p = 0.02). Esta mejoría clínica presentó una distribución similar en ambos grupos sin diferencias estadísticamente significativas. Con respecto a la escala ODI mejoró de 50.2 ± 18.9 prequirúrgico al final del seguimiento 33.3 ± 10.2 (p = 0025). Esta mejoría fue similar en ambos grupos (p = 0.181). La puntuación en la escala de calidad de vida EQ5D obtuvo al final del seguimiento un valor de 0.73, siendo en el inicio de 0.52 (p = 0.039), aunque sin diferencias estadísticamente significativas entre ambos grupos (p = 0.293) (Tabla 6).
Tabla 6: Distribución de la evolución clínica y calidad de vida.
| Precirugía | Postcirugía | Significación | |
|---|---|---|---|
| EVA Lumbar | |||
| Global | 6.2 ± 2.12 | 4.1 ± 1.71 | 0.028 |
| Titanio | 6.1 ± 1.78 | 3.9 ± 1.58 | 0.020 |
| PEEK | 6.4 ± 2.02 | 4.6 ± 1.63 | 0.030 |
| Significación | 0.756 | 0.236 | |
| EVA Pierna | |||
| Global | 5.3 ± 2.26 | 1.9 ± 1.58 | 0.021 |
| Titanio | 5.1 ± 2.26 | 1.9 ± 2.13 | 0. 023 |
| PEEK | 5.5 ± 1.65 | 2.4 ± 1.56 | 0.013 |
| Significación | 0.874 | 0.154 | |
| ODI | |||
| Global | 50.2 ± 18.9 | 33.3 ± 10.2 | 0.025 |
| Titanio | 48.5 ± 17.4 | 31.2 ± 8.8 | 0.042 |
| PEEK | 50.9 ± 11.32 | 34.6 ± 6.2 | 0.021 |
| Significación | 0.181 | 0.293 | |
| EQ5D | |||
| Global | 0.52 ± 0.2 | 0.73 ± 0.4 | 0.039 |
| Titanio | 0.51 ± 0.7 | 0.73 ± 0.8 | 0.181 |
| PEEK | 0.53 ± 0.3 | 0.76 ± 0.2 | 0.293 |
| Significación | 0.182 | 0.293 |
EVA = escala visual analógica, PEEK = poly-ether-ether-ketone, ODI = owestry disability score.
Discusión
En este estudio clínico prospectivo aleatorizado se han analizado los resultados clínicos y radiológicos, las complicaciones y la calidad de vida de los pacientes con ESA intervenidos mediante LLIF. Además, se ha estudiado si hay diferencias distinguiendo el tipo de dispositivos intersomáticos utilizado (Ti/PEEK).
El tratamiento habitual para la ESA es la descompresión posterior y/o extensión de la fusión vertebral,3,8,9,10,11 lo cual muestra una tasa de complicaciones importante con una tasa de morbimortalidad significativa.12,13,14 La cirugía LLIF provoca menos daño en las partes blandas en un tiempo quirúrgico más corto y una movilización temprana del paciente, con lo que se ha conseguido menor porcentaje de complicaciones y resultados similares en cuanto a tasa de artrodesis y mejoría clínica.15,16
En primer lugar hay que señalar que nuestra serie es similar a las publicadas por otros autores que analizan el tratamiento de la ESA. Las series publicadas van desde series cortas de dos a tres casos24,25 hasta estudios de cerca de 40 pacientes.20,22,26,27 Nuestro estudio analiza un mismo procedimiento en un período de tiempo de dos años con un seguimiento medio de 25 meses. Nuestros grupos se formaron mediante la selección del tipo de implante (Ti o PEEK). Con respecto a las características preoperatorias, quirúrgicas y del postoperatorio inmediato no se encontraron diferencias estadísticamente significativas entre los grupos y todas las variables fueron similares a las publicaciones recientes.24,26,28
Con respecto a los resultados clínicos, centrándonos en las publicaciones sobre ESA tratada mediante LLIF, Malham y colaboradores publicaron una mejoría del dolor lumbar de 63%28 y del dolor irradiado por miembro inferior de 56% al año de la cirugía. Jain y su equipo publicaron en su serie de ESA tratadas con LLIF una mejoría de una EVA lumbar prequirúrgica de 5.1 ± 3.1 a 3.3 ± 2.5 (p = 0.049) y una mejoría de EVA pierna prequirúrgico de 4 ± 2.4 a 1.6 ± 1.9 (p = 0.041).26 De forma similar, nuestros pacientes mostraron una mejoría de la puntuación de la escala analógica visual (EVA) lumbar preoperatoria de 6.2 ± 2.12 a 4.1 ± 1.71 al año (p = 0.028) y la EVA de la pierna descendió de 5.3 ± 2.26 en el preoperatorio a 1.9 ± 1.58 al año (p = 0.02).
La puntuación en las escalas de discapacidad ODI y de calidad de vida EQ5D mejoraron al final del seguimiento de 50.2 ± 18.9 a 33.3 ± 10.2 (p = 0.025) y de 0.52 a 0.73 (p = 0.039), aunque sin diferencias estadísticamente significativas entre ambos grupos (ODI p = 0.18 EQ5D p = 0.293). Similar a lo publicado por Jain: ODI mejoría 14.4 ± 16.9 (p = 0.028) y EQ5D 0.21 ± 0.23 (p = 0.041).26 Cabe señalar que esta mejoría clínica fue similar en los dos grupos estudiados, sin diferencias estadísticamente significativas.
Con respecto al análisis de las reintervenciones, la mayoría de los artículos publicados sobre las complicaciones de la cirugía LLIF oscilan alrededor de 20-25%.14,26,27,28 Estos porcentajes coinciden con nuestra experiencia: 13.8% sin diferencias entre los grupos de estudio.
Analizando el resultado radiológico en nuestra serie se evidenció aumento de la LL (5.8 p = 0.00) y aumento de la ADI en anteroposterior (4.2 mm p = 0.023) y lateral (4.1 mm p = 0.01). Esto es similar a lo publicado por Jain y colaboradores en su serie en la que se recoge un aumento de la lordosis de 5.6 mm (p = 0.001) y un aumento de la altura del disco de 4.8 mm (p = 0.001). Comparable con lo publicado en la revisión de Cho y su equipo29 con mejoría de la lordosis de 4.7.
Nuestra tasa de fusión analizada mediante TC es de 84.3%24 y distinguiendo los grupos de estudio: 88% Ti y 82% PEEK (p = 0.53). Similar a las cifras publicadas en la literatura sobre fusión lumbar intersomática lumbar por Tanida 82.8% Ti/80.4% PEEK, Nemoto 100% Ti/76% PEEK, Chen 100% Ti/100% PEEK, Cabraja 93.2% Ti 88.1/PEEK, Niu 86.5% Ti/100 PEEK, Chou 46.5%/100% PEEK.20 Malham y colaboradores publicaron una tasa de 85% de fusión completa al año de la cirugía.28
Nuestro estudio presenta como limitación principal el número de pacientes estudiados, al tratar de determinar diferencias entre el material del implante serían necesarios estudios con mayor poder estadístico. La ESA es una patología poco frecuente en comparación con la cirugía primaria, por lo que es difícil obtener una muestra mayor. Se necesitan estudios con un seguimiento clínico más amplio para poder estudiar la evolución a largo plazo.
Conclusiones
La cirugía LLIF es un método eficaz para el tratamiento de la ESA.
Se evidencia mejoría clínica y radiológica y en la calidad de vida de los pacientes intervenidos estadísticamente significativa.
Las complicaciones presentadas son menores que otras vías de abordaje de la ESA y son similares a la literatura publicada; es posible resolverlas y obtener su curación.
No se han encontrado diferencias estadísticamente significativas entre las variables analizadas en ambos grupos a estudio.
En el momento actual consideramos la LLIF la técnica ideal para el tratamiento quirúrgico de la ESA.











 nueva página del texto (beta)
nueva página del texto (beta)