INTRODUCCIÓN
Los hongos micorrízicos arbusculares (HMA) son uno de los grupos de microorganismos más importantes para el desarrollo y sobrevivencia de las plantas (Ferlian y col., 2018). Esta asociación es la principal vía de obtención de nutrientes del suelo, como nitrógeno, potasio, calcio, zinc, magnesio, fósforo y agua. Asimismo, actúan como una barrera física que impide la pérdida de agua y el ingreso de patógenos (Noda, 2009). Las micorrizas se clasifican en 7 diferentes tipos, sin embargo, las endomicorrizas o micorrizas arbusculares son las más frecuentes y abundantes en algunos ecosistemas (Kumar y col., 2015; Barman y col., 2016; Brundrett y Tedersoo, 2018). Los HMA se caracterizan por el desarrollo de estructuras fúngicas al interior de las células del córtex de la raíz denominadas arbúsculos, especializadas en el intercambio de nutrientes y en la formación de estructuras de almacenamiento conocidas como vesículas en algunas especies de HMA (Oehl y col., 2011). Los HMA pertenecen exclusivamente al phylum Glomeromycota (Schüβler y col., 2001; Oehl y col., 2011), el cual se caracteriza por su micelio cenocítico (carente de septos), ausencia de reproducción sexual (Schüβler y col., 2001) y distribución cosmopolita (Sturmer y col., 2018), además de ser simbiontes obligados de organismos fotosintéticos (Schüβler y col., 2001). La mayoría de las especies de plantas, exceptuando las acuáticas estrictas y algunas familias de plantas terrestres (Chimal-Sánchez y col., 2016), han sido documentadas como formadoras de HMA. Debido a su importancia ecológica (Ferlian y col., 2018) y sus múltiples aplicaciones en el sector agropecuario (Rodriguez y Sanders, 2014; Oliveira y col., 2016) desde hace varias décadas los HMA han generado gran interés en la investigación científica.
El phylum Glomeromycota se ha mantenido con pocas variaciones evolutivas desde su origen en el periodo Ordovícico debido a la eficiencia en sus adaptaciones (Davison y col., 2015). Por ello, posiblemente la diversidad de especies a nivel mundial es menor que la de otros grupos de hongos (Davison y col., 2015), limitándose aproximadamente a poco más de 300 especies (Crossay y col., 2017; Álvarez-Lopeztello y col., 2018) repartidas en 29 géneros, 14 familias, 5 órdenes y 3 clases (Oehl y col., 2011). En México se han registrado 105 especies de HMA, principalmente en zonas áridas, semiáridas y tropicales (Chimal-Sánchez y col., 2016; Álvarez-Lopeztello y col., 2018; 2019), sin embargo, la representatividad geográfica de ecosistemas y de grupos de plantas aún es escasa, considerando la gran diversidad biológica del país (Chimal-Sánchez y col., 2016; Álvarez-Lopeztello y col., 2019). Por ello, los trabajos relacionados con la diversidad de HMA son indispensables en México, principalmente en los grupos de plantas más diversos y dominantes en los ecosistemas, como es el caso de la familia Euphorbiaceae, la cual se aprecia como la sexta más diversa de Angiospermas a nivel mundial, después de Orchidaceae, Asteraceae, Fabaceae, Poaceae y Rubiaceae (Steinmann, 2002; Villaseñor, 2016). Su riqueza específica va desde las 6 600 especies en sensu stricto (ThePlantList, 2020), hasta las 8 700 en sensu lato (Webster, 1994; Steinmann y Ramírez-Amezcua, 2016).
En la actualidad, Euphorbiaceae sensu lato (Webster, 1994) es considerada como 5 familias distintas (Euphorbiaceae sensu stricto, Phyllanthaceae, Pandaceae, Picrodendraceae y Putranjivaceae) englobadas dentro del orden Malpighiales (Steinmann y Ramírez-Amezcua, 2016). Este grupo de plantas, bajo ambos criterios de clasificación, posee una gran variedad de formas de vida y una distribución cosmopolita tanto geográfica como a nivel de ecosistemas, siendo con frecuencia al menos una especie de dicha familia co-dominante dentro de las comunidades (Steinmann, 2002). Además, Euphorbiaceae es sumamente importante a nivel económico, ya que muchas especies se cultivan para su uso medicinal, industrial, alimenticio y ornamental (Steinmann, 2002). Por todo ello, a nivel mundial la familia Euphorbiaceae ha sido utilizada como modelo biológico en el estudio de las micorrizas tanto con fines ecológicos como económicos (Ramanankierana y col., 2007; Callejas-Ruiz y col., 2009; Díaz-Hernández y col., 2013). Partiendo de que esta familia representa uno de los principales componentes de los ecosistemas por su diversidad y abundancia, así como la derrama económica que genera en algunas regiones (Steinmann, 2002), precisar las asociaciones que determinan su resiliencia, como las micorrizas, es indispensable para su conservación (Liu y col., 2010). Sin embargo, las asociaciones micorrízicas de dicha familia en el estado de Tamaulipas se desconocen por completo, ya que las especies regionales no han sido objeto de estudio.
El conocimiento de las micorrizas en Tamaulipas se limitó por mucho tiempo a la diversidad e inoculación de macromicetos ectomicorrízicos (García-Jiménez y col., 2014), muchos de ellos de hábitos hipogeos (Guevara y col., 2013). Actualmente las observaciones sobre las micorrizas han girado su atención a la aplicación de los HMA comerciales para favorecer el crecimiento, fructificación y resistencia a las sequías en los principales cultivos del estado, como la col (Díaz-Franco y col., 2017), el sorgo (Díaz-Franco y col., 2016a; Díaz-Franco y col., 2016b; Díaz-Franco y col., 2019), el maíz, la soya y el algodón (Díaz-Franco y col., 2019), aunque han ignorado la diversidad de especies de HMA nativos. Por otra parte, existen pequeñas contribuciones sobre diferentes HMA asociados al maguey tequilero (Almaguer-Sierra y col., 2004) y algunas especies de cactáceas del altiplano tamaulipeco (Guevara-Guerrero y col., 2011). Así mismo, se han desarrollado algunas tesis respecto al tema, si bien aún no han sido publicadas (Guevara-Guerrero y col., 2011; 2014). La gama de especies de HMA de Tamaulipas se desconoce en un gran porcentaje, incluyendo a los sitios prioritarios de conservación como lo es el Área Natural Protegida Altas Cumbres (ANPAC), localizada en la zona centro de Tamaulipas en una sección de la Sierra Madre Oriental, caracterizada por una alta diversidad de plantas vasculares (1 164 especies), ecosistemas y ambientes (García-Morales y col., 2014). Esas características hacen del ANPAC un sitio óptimo para la exploración de los HMA, siendo el presente análisis el primero al grupo Glomeromycota en la región de la Sierra Madre Oriental tamaulipeca.
El objetivo de este trabajo fue identificar en el Área Natural Protegida Altas Cumbres el estatus micorrízico, el tipo de micorriza y las especies de hongos micorrízicos arbusculares asociados a las raíces y al área rizosférica de plantas de la familia Euphorbiaceae (sensu lato).
MATERIALES Y MÉTODOS
Área de estudio
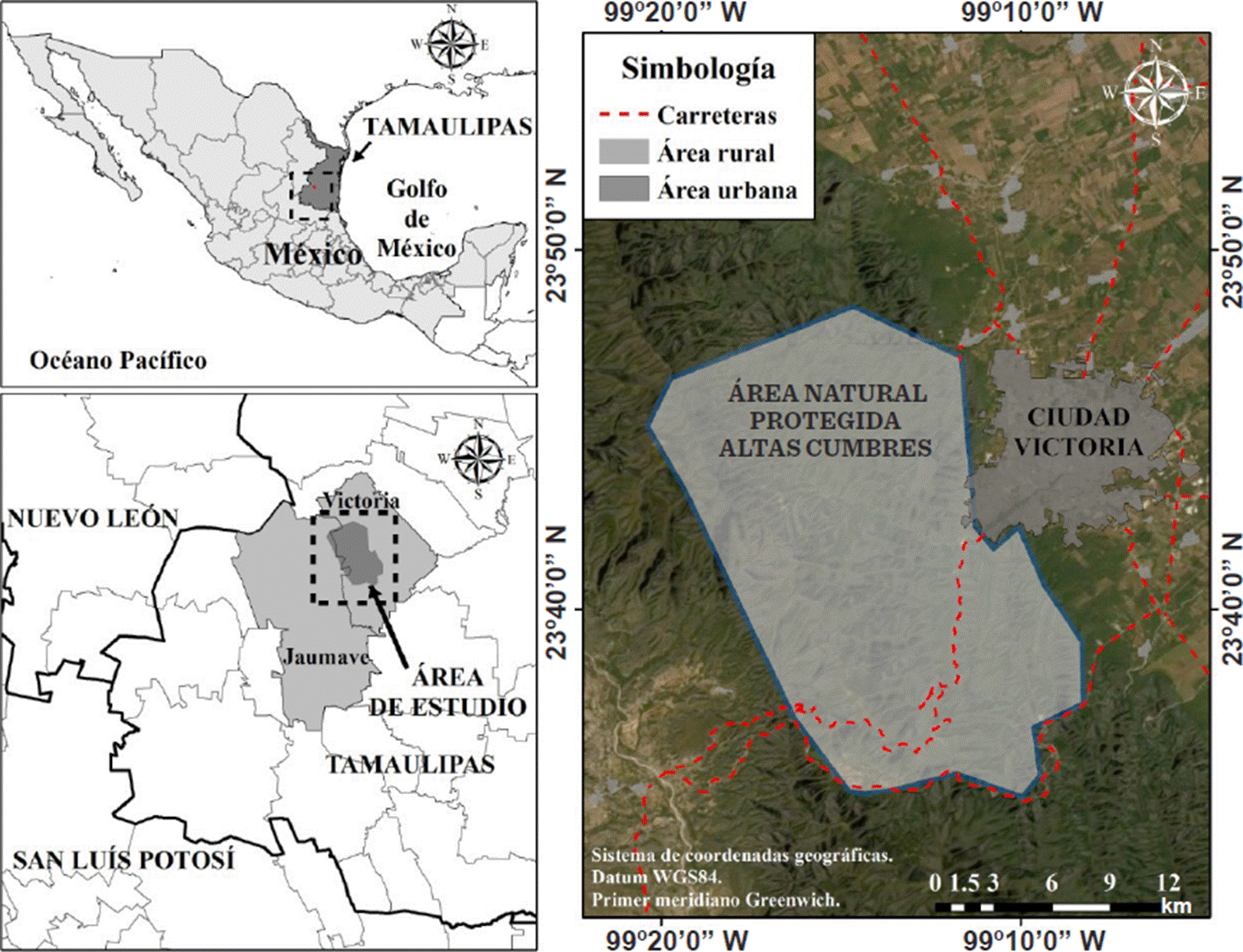
El ANPAC, decretada como tal el 19 de noviembre de 1997, con una superficie total de 31 251.23 ha, se localiza en los municipios de Jaumave y Victoria (Figura 1) dentro de la región de la Sierra Madre Oriental de la zona centro del estado de Tamaulipas, noreste de México, de acuerdo con la Comisión Nacional para el Conocimiento y Uso de la Biodiversidad (CONABIO, 2020). Su topografía es diversa debido a la presencia de la Sierra Madre Oriental, y va desde zonas de lomas y lomeríos hasta altas montañas y profundos cañones, con un rango de elevación de 350 msnm a 2 200 msnm, de acuerdo con el Instituto Nacional de Estadística y Geografía (INEGI, 2013). De igual manera, sus suelos son variados, siendo los principales: litosoles, vertisoles pélicos salinos, regosoles éutricos, así como rendzinas petrocálcica y pedregosa (Batjes y col., 2020). Los climas son semicálido templado subhúmedo ((A)C(w1) y (A)C(w0)), cálido subhúmedo (Aw1) y semiárido templado (BS1hw) (Cuervo-Robayo y col., 2019). Los tipos de vegetación donde se realizaron los muestreos abarcan matorral submontano, matorral desértico micrófilo, matorral espinoso tamaulipeco, selva baja caducifolia, bosque de encino, bosque de pinoencino, bosque de encino-pino, vegetación secundaria, bosque de pino, bosque ripario y áreas de cultivo (García-Morales y col., 2014).
Muestreo
Se realizó previamente un inventario florístico de las especies de plantas pertenecientes a la familia Euphorbiaceae considerando un muestreo aleatorio estratificado. Para ello, primeramente se generaron sobre un mapa temático puntos al azar dentro del área de estudio, seleccionando los cuatro con mayor acceso para cada combinación de variables, con base en los estratos elevacionales (cada 200 msnm, desde los 350 msnm hasta los 2 200 msnm) y los 11 tipos de vegetación (INEGI, 2013; García-Morales y col., 2014). Este proceso fue realizado con el software de sistema de información geográfica (ArcGIS, por sus siglas en inglés: arc geographic information system) versión 10.6 (ESRI®, 2018). Las visitas se efectuaron en el periodo comprendido de septiembre de 2012 a octubre de 2013, con un total de 24 salidas y 200 puntos de colecta, donde los individuos de las especies de euforbiáceas fueron ubicados en un radio de 5 m, obteniendo una muestra de material botánico, raíces y suelo del área rizosférica de un ejemplar de cada especie. Se hizo presencia en los sitios una vez en cada estación del año, durante el periodo de evaluación, con la finalidad considerar el efecto de la estacionalidad en la composición florística y con ello asegurar la representatividad de todas las especies locales de euforbiáceas. Para cada especie encontrada se seleccionó un único individuo, del cual solo se tomó una única muestra por parcela circular, independientemente de que se hayan encontrado la misma especie en otras parcelas. Esto último considerando tener repeticiones, ya que no es completamente probable encontrar micorrizas en todas las raíces, por ello, deben revisarse la mayor cantidad de raíces posibles para poder aceptar o descartar la presencia de micorrizas en una especie. En la mayoría de estas parcelas solo se encontró una especie (y por eso solo se tomó una porción de un ejemplar), aunque en algunas parcelas llegaron a encontrarse hasta un máximo de 5 especies (y por ende se tomaron 5 porciones). Por la naturaleza de estas especies, el número de individuos analizados para cada especie fue muy contrastante entre ellas. Un ejemplo de especies encontradas en diversas parcelas estudiadas fueron Croton ciliatoglandulifer (la más abundante, frecuente y ampliamente distribuida) con 31 muestras, Croton cortesianus con 24, Euphorbia hirta con 15, Euphorbia graminea con 13, Phyllanthus carolinensis y Cnidoscolus multilobus con 10 cada una y Euphorbia dentata con 7 muestras. Estas 7 especies representaron 110 muestras, es decir el 27.5 % del total. En contraste, Euphorbia subpeltata y Euphorbia macropus fueron algunas de las especies de las cuales en todo el estudio (incluso hasta la fecha) solo se lograron encontrar un solo ejemplar.
El suelo utilizado en los análisis fue extraído del cepellón formado por las raíces con apoyo de una cuchara para jardín GTS-SH (Truper®, México, D.F.), cuidando de tomar solo el perteneciente a la rizósfera, considerando un radio de 15 cm a partir del centro de la raíz y una profundidad también de 15 cm. Las raíces se tomaron directamente de la planta con tijeras y una pala, evitando que se mezclaran con raíces de otras plantas. Ambas muestras se depositaron en bolsas de papel estraza. El material botánico fue procesado y conservado a través del método clásico de prensado y herborizado (Lot y Chiang, 1986), para su posterior identificación y corroboración taxonómica. Enseguida fue depositado en el herbario del Instituto de Ecología Aplicada de la Universidad Autónoma de Tamaulipas (UAT).
Estatus micorrízico
La determinación del estatus micorrízico se efectuó mediante la búsqueda de estructuras fúngicas (micelio cenocítico, vesículas y arbúsculos) en el córtex de las raíces, teñidas por el método de Phillips y Hayman (1970). Para ello se utilizaron las raíces finas (de aproximadamente 2 mm de diámetro), revisando un total de 400 muestras, las cuales se limpiaron con agua corriente, se colocaron en cápsulas de tinción de tejidos, se aclararon (10 % de KOH y 5 % de H2O2, en baño María por 1 h) y se acidificaron con 1 % de HCl por 30 min. Posteriormente se tiñeron con azul tripano (0.05 %) (Brundrett y col., 1996). Con esta técnica, las células de la raíz se aclaran, coloreando de azul intenso las células de los HMA (Castillo-Agüero y col., 2003). Las raíces teñidas fueron montadas en laminillas, en fragmentos de 2 cm de longitud, y analizadas a través de un microscopio modelo Stemi 2000-C (Carl Zeiss®, Gottingen, Alemania) y una cámara modelo PowerShot G5 (Canon®, Tokio, Japón). Este proceso se realizó en cada una de las muestras en el laboratorio inmediatamente después de cada visita a campo para evitar daños al material biológico.
Propagación, aislamiento e identificación de esporas
Las muestras de suelo y las de raíces restantes del proceso de tinción se mantuvieron en refrigeración a 4 °C, para preservarlas durante el muestreo en campo. Al culminar la fase de campo, tanto el suelo como las raíces secundarias mencionadas fueron utilizadas para propagar las esporas a través de cultivos con plantas trampa mixtas. Las propagaciones se hicieron en recipientes de unicel de 1 L, utilizando como sustrato un compuesto de arena, grava delgada, tierra para maceta comercial y tezontle pulverizado en proporción 1: 1: 1: 1, el cual fue esterilizado previamente a la inoculación para evitar la contaminación por microorganismos antagonistas. Se le agregaron, para cada especie de euforbiácea, 50 g de la muestra de suelo y algunas raíces secundarias. Las especies trampa fueron sorgo (Sorghum vulgare), guajillo (Leucaena pulverulenta), hierba de la golondrina (E. hirta), lecheroncilla (E. graminea), catalina (E. heterophylla) y polocote (Helianthus annuus), seleccionadas por ser micotróficas. Los cultivos se mantuvieron en el invernadero del Tecnológico Nacional de México, campus Ciudad Victoria, con un riego de aproximadamente 350 mL cada 72 h durante 10 meses
Después de 10 meses de desarrollo de las plantas trampa, las muestras fueron procesadas mediante decantación (tamices de 1 mm, 100 µm y 44 µm de apertura) y centrifugado en una solución de sacarosa al 44 % y un lavado con apoyo de una membrana filtro de 22 µm. Las esporas fueron aisladas del material procesado de manera manual utilizando una pipeta Pasteur modificada y un microscopio estereoscópico modelo SMZ-2b (Nikon®, Tokio, Japón), y posteriormente montadas en un portaobjetos con 0.1 mL de reactivo de PVLG-Melzer (1:1) (Castillo-Agüero y col., 2003; Hernández-Cuevas y col., 2003; Martínez y col., 2009; Álvarez-Lopeztello y col., 2019).
La identidad taxonómica de las especies se realizó con base en bibliografía taxonómica especializada en Glomeromycota (Schenck y Pérez, 1990; Hernández-Cuevas y col., 2003), por comparación y contrastación de las características morfológicas de las esporas, observadas con un microscopio óptico con contraste de interferencia de Nomarski modelo Optiphot-2 (Nikon®, Tokio, Japón). Las esporas identificadas fueron fotografiadas con una cámara Toupcam modelo UCMOS02000KPB y el software ToupView x86 (ToupTek®, Hangzhou, China) adaptada a un microscopio óptico modelo IRONC-58 (Iroscope®, Ciudad de México, México). Las preparaciones permanentes se depositaron en la colección del Herbario Micológico “José Castillo Tovar” del Tecnológico Nacional de México, campus Ciudad Victoria.
RESULTADOS Y DISCUSIÓN
Los muestreos florísticos permitieron registrar 400 individuos pertenecientes a 74 taxones, dentro de 17 géneros y 62 especies, además de una subespecie y 11 morfotipos sin identificar (Tabla 1), los cuales representan el 45 % de las especies de la familia, estimadas para el estado de Tamaulipas (Villaseñor, 2016). Las raíces de todos los ejemplares presentaron micelio cenocítico al interior de las células del córtex. También se observaron algunas células con arbúsculos y con menor frecuencia, vesículas (Figura 2). Estos indicios demuestran que las especies de euforbiáceas del ANPAC presentan HMA, los cuales han sido registrados anteriormente entre las especies de euforbiáceas sudamericanas de los géneros Acalypha (Urcelay y Battistella, 2007), Adelia, Croton (Ramos-Montaño y col., 2010), Ricinus (Zhang y col., 2018; Beltrame y col., 2019), Ditaxis, Drypetes, Euphorbia, Jatropha, Manihot y Phyllanthus (Wang y Qiu, 2006; Santhoshkumar y col., 2018; Su-Kyi y Tin, 2019).
Tabla 1 Especies y estatus micorrízico (EM) de la familia Euphorbiaceae sensu lato (incluyendo la familia en la que se ubican en la clasificación actual) del Área Natural Protegida Altas Cumbres.
Table 1 Species and mycorrhizal status (EM) of the Euphorbiaceae family sensu lato (including the family in which they are located in the current classification) from the Altas Cumbres Protected Area.
| Especie | Familia | Estatus micorrízico |
|---|---|---|
| Acalypha lindheimeri | Euphorbiaceae | V |
| Acalypha monostachya | Euphorbiaceae | V |
| Acalypha ostryifolia | Euphorbiaceae | V |
| Acalypha polystachya | Euphorbiaceae | V |
| Acalypha schiedeana | Euphorbiaceae | V |
| Acalypha sp. 1 | Euphorbiaceae | V |
| Acalypha sp. 2 | Euphorbiaceae | V |
| Acalypha sp. 3 | Euphorbiaceae | V |
| Acalypha sp. 4 | Euphorbiaceae | V |
| Acalypha sp. 5 | Euphorbiaceae | V |
| Acalypha sp. 6 | Euphorbiaceae | V |
| Acalypha sp. 7 | Euphorbiaceae | V |
| Acalypha sp. 8 | Euphorbiaceae | V |
| Acalypha sp. 9 | Euphorbiaceae | V |
| Adelia barbinervis | Euphorbiaceae | V |
| Adelia oaxacana | Euphorbiaceae | V |
| Adelia vaseyi | Euphorbiaceae | V |
| Bernardia mexicana | Euphorbiaceae | V |
| Bernardia myricifolia | Euphorbiaceae | V |
| Cnidoscolus multilobus | Euphorbiaceae | V |
| Cnidoscolus rotundifolius | Euphorbiaceae | V |
| Croton argenteus | Euphorbiaceae | V |
| Croton capitatus | Euphorbiaceae | V |
| Croton ciliatoglandulifer | Euphorbiaceae | W; CR |
| Croton cortesianus | Euphorbiaceae | V |
| Croton humilis | Euphorbiaceae | V |
| Croton hypoleucus | Euphorbiaceae | V |
| Croton incanus | Euphorbiaceae | V |
| Croton lobatus | Euphorbiaceae | V |
| Croton niveus | Euphorbiaceae | V |
| Croton pottsii | Euphorbiaceae | V |
| Croton sp. 1 | Euphorbiaceae | V |
| Croton sp. 2 | Euphorbiaceae | V |
| Dalechampia scandens | Euphorbiaceae | V |
| Ditaxis humilis | V | |
| Euphorbia antisyphilitica | Euphorbiaceae | V |
| Euphorbia berteroana | Euphorbiaceae | V |
| Euphorbia colletioides | Euphorbiaceae | V |
| Euphorbia cuphosperma | Euphorbiaceae | V |
| Euphorbia cyatophora | Euphorbiaceae | V |
| Euphorbia dentata | Euphorbiaceae | C |
| Euphorbia furcillata | Euphorbiaceae | V |
| Euphorbia graminea | Euphorbiaceae | C |
| Euphorbia heterophylla | Euphorbiaceae | W |
| Euphorbia hirta | Euphorbiaceae | T, W, C |
| Euphorbia hormorrhiza | Euphorbiaceae | V |
| Euphorbia hypericifolia | Euphorbiaceae | W |
| Euphorbia hyssopifolia | Euphorbiaceae | V |
| Euphorbia indivisa | Euphorbiaceae | C |
| Euphorbia macropus | Euphorbiaceae | C |
| Euphorbia nutans | Euphorbiaceae | C |
| Euphorbia ophthalmica | Euphorbiaceae | V |
| Euphorbia prostrata | Euphorbiaceae | V |
| Euphorbia serpens | Euphorbiaceae | C |
| Euphorbia subpeltata | Euphorbiaceae | V |
| Euphorbia velleriflora | Euphorbiaceae | V |
| Euphorbia villifera | Euphorbiaceae | V |
| Euphorbia villifera var. nuda | Euphorbiaceae | V |
| Jatropha dioica | Euphorbiaceae | V |
| Jatropha gossypofolia | Euphorbiaceae | V |
| Manihot pringlei | Euphorbiaceae | V |
| Ricinus communis | Euphorbiaceae | W, C |
| Sebastiana pavonia | Euphorbiaceae | V |
| Tragia brevispica | Euphorbiaceae | V |
| Tragia glanduligera | Euphorbiaceae | V |
| Tragia nepetifolia | Euphorbiaceae | V |
| Tragia ramosa | Euphorbiaceae | V |
| Tragia volubilis | Euphorbiaceae | V |
| Andrachne phyllanthoides | Phyllanthaceae | V |
| Astrocasia neurocarpa | Phyllanthaceae | V |
| Phyllanthus carolinensis | Phyllanthaceae | V |
| Phyllanthus niruri | Phyllanthaceae | W |
| Phyllanthus polygonoides | Phyllanthaceae | V |
| Drypetes laeterifolia | Putranjivaceae | V |
Estatus micorrízico: V = Reportado solo en este trabajo; T = Thoen (1986); CR = Camargo-Ricalde y col. (2003); C = Castillo-Argüero y col. (2003); W = Wang y Qiu (2006).
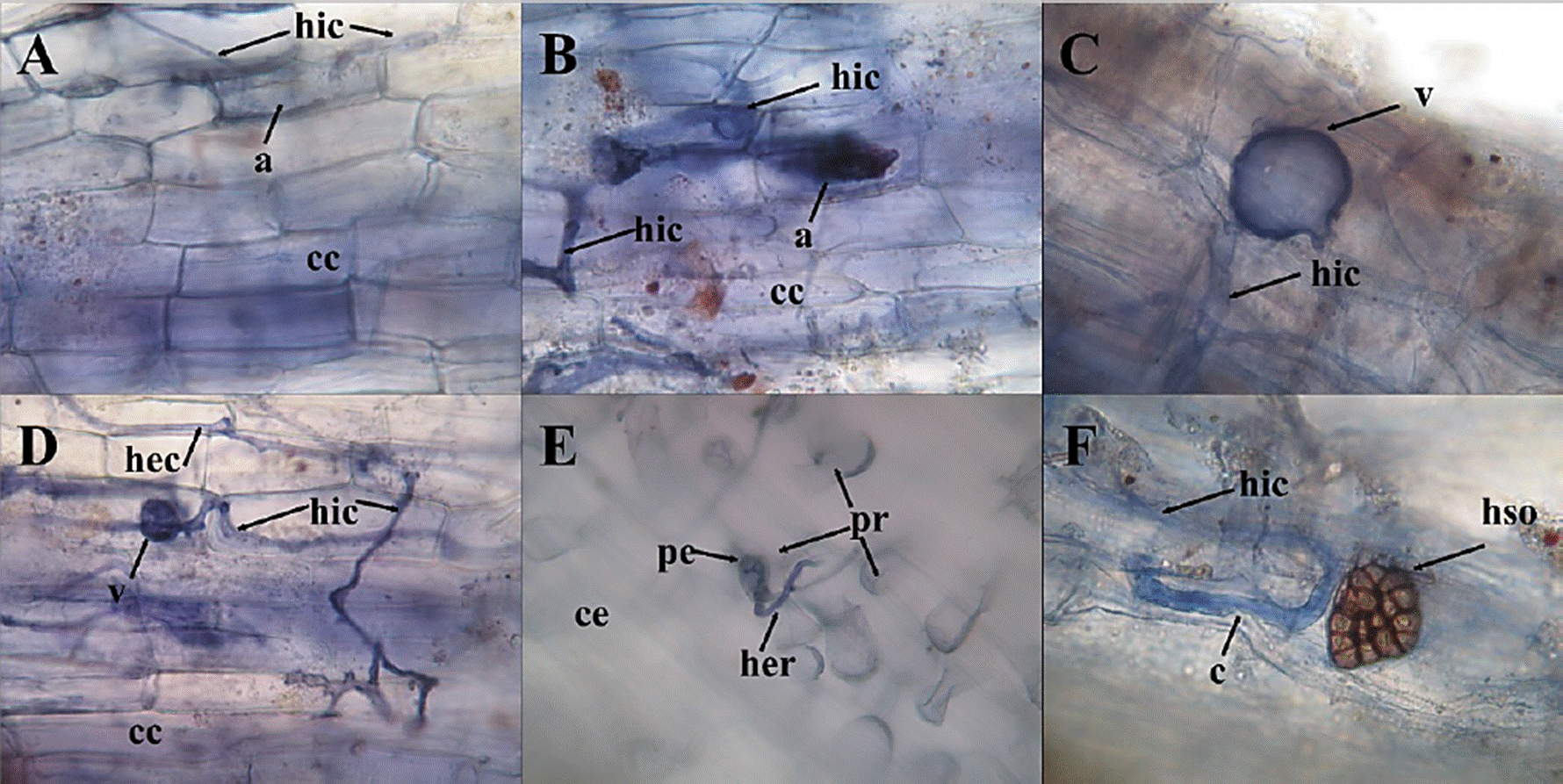
Figura 2 Imágenes (40x) de algunas de las raíces micorrizadas de euforbiáceas. A) Euphorbia cyathophora; B) Croton ciliatoglandulifer; C) E. heterophylla; D) E. hirta; E) Ricinus communis; F) Phyllanthus niruri. a = arbúsculo; hic = hifa intracelular; cc = célula del córtex; v = vesícula; hec = hifa extracelular; ce = célula epidérmica; pe = poro epidérmico; pr = pelo radicular; her = hifa extrarradical; c = codón; hso = hongo septado oscuro.
Figure 2 Images (40x) of some Euphorbiaceae mycorrhizal roots. A) Euphorbia cyathophora; B) Croton ciliatoglandulifer; C) E. heterophylla; D) E. hirta; E) Ricinus communis; F) Phyllanthus niruri. a = arbuscule; hic = intracellular hypha; cc = cortex cell; v = vesicle; hec = extracellular hypha; ce = epidermal cell; ep = epidermal pore; pr = root hair; her = extraradical hypha; c = codon; hso = dark septate fungi.
En México se han explorado las relaciones micorrízicas en plantas de nochebuena (Euphorbia pulcherrima) debido a su importancia ornamental (Callejas-Ruiz y col., 2009). En específico, algunas de las euforbiáceas encontradas en esta investigación han sido reportadas con presencia de HMA en otras regiones geográficas. En los matorrales xerófilos y selvas bajas del Valle de México y el Valle de TehuacánCuicatlán se han localizado HMA asociados a C. ciliatoglandulifer, E. dentata y R. communis (Camargo-Ricalde y col., 2003; Castillo-Agüero y col., 2003; Wang y Qiu, 2006). Esta última especie también cuenta con registros de micorrización en cultivos de Israel y China (Zhang y col., 2018; Beltrame y col., 2019). Mientras que en las sabanas del sureste de China se han identificado asociadas con HMA a las especies E. heterophylla y E. hirta (Tao y col., 2003). En el caso específico de E. hirta, su asociación con los HMA ha sido documentada en cultivos de suelo arenoso de Senegal (Thoen, 1986), en ambientes antropizados de China (Muthukumar y col., 2003) y entre vegetación secundaria y dentro de instalaciones nucleares de la India (Ganesan y col., 1991, Thangaswamy y col., 2004). Por su parte, Phyllanthus niruri ha sido ubicada como una especie asociada a los HMA en algunos cultivos de Israel (Thangaswamy y col., 2004) y en condiciones antropizadas de regiones aledañas a una central nuclear de la India (Wang y Qiu, 2006). También se destaca la presencia de HMA asociados a Euphorbia hypericifolia, ambos como colonizadores primarios, en rocas volcánicas en islas de Hawaii (Gemma y Koske, 1990). Aunque la familia Euphorbiaceae se encuentra asociada con mayor frecuencia a HMA, también pueden presentarse otros tipos de micorrizas en este grupo. Tal es el caso de la especie africana Uapaca bojeri, que desarrolla ectomicorrizas con especies de macromicetos de la división Basidiomycota, de los géneros Amanita, Boletus, Cantharellus, Lactarius y Leccinum (Ramanankierana y col., 2007).
De igual manera, las asociaciones ectomicorrizógenas han sido localizadas en otras 4 especies del género Uapaca, así como en Amperea xiphoclada (Wang y Qiu, 2006). Sin embargo, en el presente estudio no se registraron características externas representativas de las ectomicorrizas, como la formación de un manto en las raicillas o la red de Harting, lo que sugiere que, al menos en los sitios de muestreo, en las especies estudiadas, la asociación MA tiene una mayor representatividad que las ectomicorrizas.
Entre las esporas extraídas de las muestras de suelo rizosférico se detectaron 9 taxones, distribuidos en 6 géneros, 4 familias y 3 órdenes (Tabla 2). Sin embargo, las condiciones de deterioro de algunas esporas durante la realización del análisis microscópico fueron desfavorables, por ello 4 taxones únicamente pudieron ser determinados hasta nivel de género (Figura 3). El género con mayor riqueza específica fue Glomus, con 4 especies; el resto (Acaulospora, Entrophospora, Funneliformis, Rhizophagus y Gigaspora) estuvieron representados por solo 1 especie. Los géneros Glomus y Gigaspora habían sido situados como especies asociadas a la familia Euphorbiaceae en México (Callejas-Ruiz y col., 2009) y en Senegal (Thoen, 1986), destacando esta última localidad debido a que coincide con el registro micorrízico para E. hirta. Mientras que Entrophospora infrequens y Funneliformis geosporus han sido reportadas en la Reserva del Pedregal de San Ángel, asociadas a plantas xerófilas. Para México, E. infrequens también se ha localizado asociada a otras especies de plantas, como aguacate (Raya-Montaño y col., 2019), café (Bertolini y col., 2020) y maguey mezcalero (Trinidad-Cruz y col., 2017). Para Tamaulipas, los géneros Acaulospora, Glomus y Gigaspora han sido reconocidos como presentes de manera natural en cultivos de Agave tequilana (Almaguer-Sierra y col., 2004) y de cítricos (Garza-Ocañas y col., 2005). Por otra parte, los géneros Glomus, Scutellospora y Sclerocystis fueron anteriormente ubicados en Tamaulipas asociados naturalmente a especies de cactáceas nativas de la región del altiplano tamaulipeco (Guevara-Guerrero y col., 2011). Cabe mencionar que los HMA de Tamaulipas reportados previamente se detectaron a nivel de género. Esta es la primera investigación donde se lograron identificaciones a nivel de especie. Aunque los géneros Scutelospora y Sclerocistys no fueron encontrados en este trabajo, la presencia de Entrophospora, Funneliformis y Rhizophagus se registra por primera vez en Tamaulipas, dando así una riqueza total de 8 géneros para el estado hasta el momento.
Tabla 2 Arbuscular mycorrhizal fungi species found in the rhizosphere of the plant species of the Euphorbiaceae family from the Altas Cumbres Protected Area.
Table 2 Especies de hongos micorrízicos arbusculares encontrados en la rizósfera de las especies de plantas de la familia Euphorbiaceae del Área Natural Protegida Altas Cumbres.
| Especie | Familia | Orden |
|---|---|---|
| Acaulospora sp. | Acaulosporaceae | Diversisporales |
| Gigaspora aff. decipiens | Gigasporaceae | Gigasporales |
| Entrophospora infrequens | Entrophosporaceae | Glomerales |
| Funneliformis geosporus | Glomeraceae | Glomerales |
| Glomus spinuliferum | Glomeraceae | Glomerales |
| Glomus sp. 1 | Glomeraceae | Glomerales |
| Glomus sp. 2 | Glomeraceae | Glomerales |
| Glomus sp. 3 | Glomeraceae | Glomerales |
| Rhizophagus fasciculatus | Glomeraceae | Glomerales |
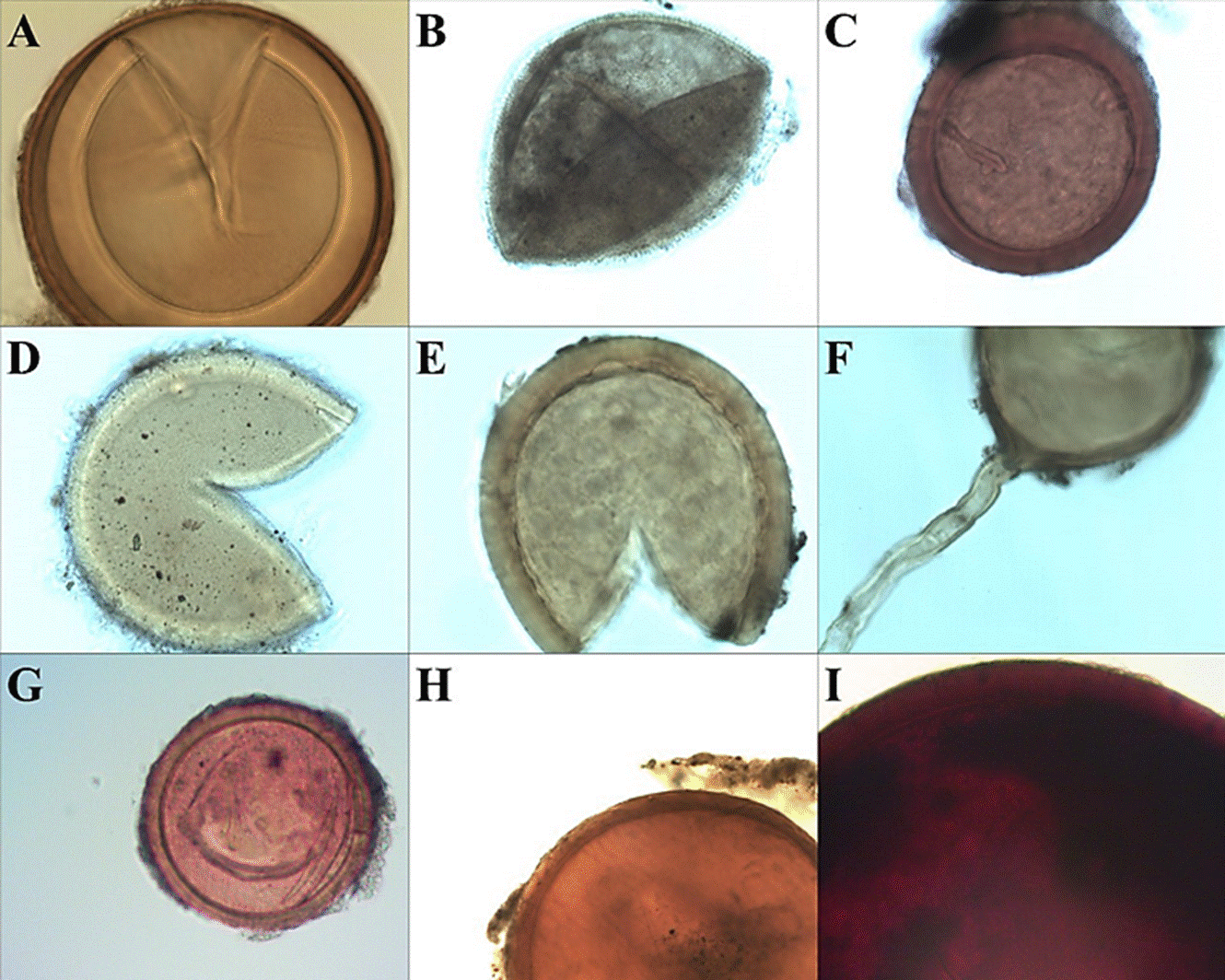
Figura 3 Riqueza de especies de hongos micorrízicos arbusculares encontradas en el estudio: a) Acaulospora sp.; b) Entrophospora infrequens; c) Funneliformis geosporus; d) Glomus spinuliferum; Glomus sp. 1; f) Glomus sp. 2; g) Glomus sp. 3; h) Rhizophagus fasciculatus; i) Gigaspora aff. decipiens (20x).
Por su adaptación a las condiciones climatológicas, las especies de HMA nativas documentadas en la presente investigación tienen un uso potencial como biofertilizantes. El desarrollo en los cultivos de maguey mezcalero, cítricos y maíz ha sido estimulado experimentalmente a través de la síntesis micorrícica con especies de los géneros Acaulospora, Gigaspora, Glomus (Almaguer-Sierra y col., 2004; Garza-Ocañas y col., 2005; Hoang-Yen y col., 2018) y Entrophospora (Trinidad-Cruz y col., 2017). Esta última también ha demostrado ser una opción para los cultivos de aguacate (Raya-Montaño y col., 2019) y café (Bertolini y col., 2020). Por otra parte, F. geosporus es una especie cuyo efecto positivo en el desarrollo de los cultivos de trigo ha sido comprobado (Abu-Elsaoud y col., 2017). Finalmente, el uso de Rhizophagus fasciculatus podría ser explorado, dado que otra especie del mismo género, R. intraradices, ha sido utilizada favorablemente para estimular el desarrollo de plantas de soya (Díaz-Franco y col., 2015), sorgo (Díaz-Franco y col., 2016b) y de col (Díaz-Franco y col., 2017) en cultivos experimentales de Tamaulipas. Estas posibles aplicaciones denotan la importancia del conocimiento de la composición y de la riqueza específica local como plataformas para el desarrollo de futuras investigaciones.
El método de cultivo trampa, utilizado en este estudio, tuvo resultados desfavorables debido a la baja densidad y diversidad de esporas encontradas. Quizás el aislamiento de esporas directamente del suelo de la rizósfera sea una mejor opción, puesto que requiere menor inversión de tiempo y registra mejores resultados (Castillo-Agüero y col., 2003; Hernández-Cuevas y col., 2003; 2008). Por ello, se recomienda que en nuevas investigaciones en la región se utilice el método de aislamiento directo, considerando el tiempo máximo de almacenamiento que pueden tener las muestras (Hernández-Cuevas y col., 2003).
Los resultados del presente trabajo exponen una panorámica de los HMA en condiciones naturales, así como de la diversidad de la división Glomeromycota en una de las familias vegetales mejor representadas en el estado de Tamaulipas. Sin embargo, aún falta profundizar en el conocimiento del papel ecológico y el potencial biotecnológico de las especies nativas tamaulipecas. Por ello, el incremento de estudios similares a éste resulta necesario.
CONCLUSIONES
Los 74 taxones de la familia Euphorbiaceae sensu lato analizados presentaron micorrizas arbusculares, lo que indica que esta familia tiene una estrecha asociación con los hongos micorrízicos arbusculares (HMA), al menos dentro del Área Natural Protegida Altas Cumbres (ANPAC). Las especies de hongos identificadas pertenecen a nueve taxones del grupo phylum Glomeromycota, distribuidos en 6 géneros, 4 familias y 3 órdenes. De estos, la presencia de los géneros Entrophospora, Funneliformis y Rhizophagus se reporta por primera vez para el estado de Tamaulipas. La información obtenida podía ser útil en la elaboración de biofertilizantes para los cultivos de la región noreste de México. Esta aportación remarca la necesidad de continuar con estudios sobre micorrizas en general y en particular con las especies de HMA, las cuales se encuentran ampliamente distribuidas en las plantas de la familia Euphorbiaceae del ANPAC, tal y como se comprobó en el presente trabajo.











 nova página do texto(beta)
nova página do texto(beta)