Los humedales son definidos como zonas de transición entre sistemas terrestres y acuáticos, donde el suelo está cubierto por una columna de agua poco profunda o el agua se encuentra a nivel del suelo, la inundación puede ser permanente o temporal, pero debe de ser suficientemente larga para permitir el desarrollo de vegetación acuática (Mitsch & Gosselink 2015). Una parte importante de la vegetación de humedales es conocida como macrófitas (Malvárez & Fabían 2004), y se definen como plantas acuáticas capaces de adaptarse a condiciones anaerobias y/o aerobias. Las macrófitas requieren un periodo de anegación para completar su ciclo de vida y subsisten en el agua, por lo tanto ellas pueden vivir en lugares con inundación permanente o temporal (Travieso-Bello et al., 2005). Las plantas de humedales cumplen un papel importante para el ecosistema porque colaboran con la producción primaria, regulan la calidad del agua, absorben y liberan nutrientes, y diversifican los hábitats y alimento faunístico (Brix, 2004)
La inundación por largos periodos produce suelos anaerobios, es decir, suelos sin oxígeno. Las raíces de las plantas necesitan oxígeno para respirar, por lo que en un ambiente inundando como lo es un humedal, se requiere que la vegetación desarrolle varias adaptaciones (Cronk & Fenessy 2001). Una de las adaptaciones es la modificación de la estructura de la raíz, con la producción de un tejido lleno de espacios vacíos, el cual es llamado aerénquima, y permite el transporte de oxígeno de las partes aéreas a la raíz, permitiendo la respiración de las mismas (Armstrong 1972, Keeley 1979). El oxígeno que entra por la planta a través del tejido esponjoso se difunde de las raíces hasta el suelo adyacente a esta (rizósfera), lo que se conoce como liberación radial de oxígeno (ROL por sus siglas en inglés) y a su vez provee condiciones aerobias a la zona de la rizósfera para que la raíz pueda respirar y llevar a cabo sus funciones (Armstrong 1971). La liberación de oxígeno radial tiene gran relevancia para los servicios ambientales que prestan los ecosistemas de humedales, ya que permite gradientes de óxido reducción en los sedimentos de humedales que permiten la actividad de bacterias aerobias y anaerobias en los sedimentos. La actividad de estas bacterias tiene grandes repercusiones en la depuración de agua y en el ciclamiento del carbono (Hernández 2016).
Desde hace ya varias décadas se inició el estudio de la medición de la liberación de oxígeno radial en macrófitas, mediante el establecimiento de varias técnicas, algunas utilizando métodos espectrofotométricos y otros utilizando microsensores de oxígeno (Armstrong & Armstrong 1988, Matsui & Tsuchiya 2006, Zhang et al. 2014, Han et al. 2016). Algunos estudios han incluido una larga lista de especies en sus estudios, encontrando diferentes tasas de ROL entre ellas, indicando que este fenómeno es característico de cada planta (Lai et al. 2012). Sin embargo, hasta la fecha, las especies estudiadas son características de humedales templados, pocas de ellas encontrados en los humedales costeros, por lo que de la mayoría de las especies de macrófitas nativas de los humedales tropicales de México, no se sabe cuál es la tasa de liberación de oxígeno radial. Los estudios sobre ROL, han indicado que la ausencia de oxígeno en el agua o suelo, incrementa la liberación de oxígeno en algunas especies como respuesta al estrés, pero no en todos los casos (Sorrell 1999, Sasikala et al. 2009). El cambio climático está causando cambios en los hidroperiodos de los humedales costeros de México, con periodos de sequía más largos o inundaciones más profundas por las lluvias intensas (Díaz-Cordero 2012). Por lo que es pertinente estudiar cómo los cambios en los hidroperiodos de los humedales tropicales pudieran afectar las funciones fisiológicas de las macrófitas. Este estudio tuvo como objetivo cuantificar la liberación de oxígeno en las macrófitas nativas más abundantes de los humedales costeros de Veracruz, crecidas bajo diferentes hidroperiodos, simulando las condiciones de inundación en diferentes temporadas climáticas de la costa. Las preguntas de investigación que se buscaron responder fueron: ¿Cuál de las macrófitas más abundantes de los humedales de Veracruz, presenta la mayor liberación de oxígeno radial? y ¿Las condiciones de inundación tienen algún efecto en la liberación de oxígeno radial de las macrófitas nativas de los humedales costeros?
Las hipótesis planteadas fueron: a) La liberación de oxígeno radial será diferente en las macrófitas nativas de humedales tropicales, ya que ellas difieren en sus características fenológicas; b) Las condiciones de inundación y saturación ocasionarán más altas tasas de liberación de oxígeno que las condiciones de capilaridad, debido a una repuesta al estrés causado por la inundación.
Materiales y métodos
Selección y colecta de plantas. Para el estudio se seleccionaron 7 especies de plantas acuáticas emergentes (Sagittaria lancifolia L., Typha domingensis, Pontederia sagittata C. Presi, Cyperus articulatus L., Cyperus giganteus Vahl, Leersia ligularis Trin. y Thalia geniculata L.) por ser las especies más abundantes en humedales herbáceos de Veracruz, en base al valor de importancia y frecuencia descritos por Moreno-Casasola et al. (2010). En marzo de 2017, se colectaron 10 individuos adultos sin floración de cada especie, la altura de las plantas varió de acuerdo a la fenología de las mismas entre 90 y 150 cm de alto. Las plantas se colectaron cuidadosamente con la mano y la ayuda de una pala para no dañar la raíz. Los individuos de Sagittaria lancifolia, Typha domingensis y Pontederia sagittata se colectaron en humedales de la localidad de La Mancha Mpio. de Actopan (19º 35’ 48’’N, 96º 22’ 54’’O). Cyperus articulatus se colectó en un humedal de la localidad de Cansaburros en el municipio de Actopan (19º 33’ 09.3’’N, 96º 22’ 35.3’’O). En el complejo de humedales de Ciénega del Fuerte perteneciente al municipio de Tecolutla (20º 18’ 49’’N, 96º 55’ 22’’O), se colectaron los individuos de Cyperus giganteus y Leersia ligularis. Finalmente, Thalia geniculata fue colectada en un humedal de Pinoltepec (19º 26’ 45’’N, 96º 45’ 18’’O), donde se habían plantado 3 años atrás individuos de esta especie que venía de humedales perilacustres de la laguna de San Julián (19º 15’ 27.7’’N, 96º 15’ 47.8’’O), Mpio. del puerto de Veracruz.
Las plantas se transportaron sumergidas en agua a las instalaciones del Instituto de Ecología, A.C. en la Ciudad de Xalapa (19º 32’31’’ N, 95º 54’ 35’’O), en donde se llevaron a cabo su propagación y la medición de la liberación de oxígeno.
Propagación y crecimiento de las plantas. La propagación y el crecimiento de las plantas se llevó a cabo en un invernadero rustico en el campus III del Instituto de Ecología A.C. en la Ciudad de Xalapa, Ver. El invernadero tiene una cubierta de plástico de una altura de 3 m en forma de túnel, las paredes del invernadero (1.5 m) de alto están cubiertas por malla mosquitera. En el invernadero no había control de temperatura ni humedad relativa. La temperatura ambiente dentro del invernadero se registró diariamente y la media durante la propagación y crecimiento de las plantas fue de 23 °C y el fotoperiodo de luz de día y obscuridad durante la noche. Cinco individuos de cada especie se sembraron en contenedores de plástico de 60 × 40 × 34 cm, que contenían una columna de suelo de 40 cm, el cual se inundó completamente con agua de la llave El suelo provenía de los primeros 30 cm de los humedales herbáceos de Ciénega del Fuerte municipio de Tecolutla (20º 18’ 49’’N, 96º 55’ 22’’O), este sitio fue elegido por cuestiones logísticas de apoyo de campo para la colecta del suelo y el permiso de los locales para recolectarlo. La composición química del suelo se caracterizó para otro proyecto (Cruz-Zamora 2018) y tenía la siguiente composición: C (21 %) N (1.8 %), PO4 (0.9 mg/kg), NO3 (10 mg/kg), pH (7.50). Se utilizó suelo de humedales para tener las plantas en condiciones lo más similares a los ecosistemas en el que crecen. A pesar de ser este suelo rico en materia orgánica y nutrientes se decidió fertilizar las tinas de las plantas madres, con el fin de acelerar la aparición de rebrotes y asegurar el crecimiento de las plantas en 20 días para la medición de la liberación de oxígeno por las raíces. Todas las plantas se mantuvieron bajo las mismas condiciones de suelo y nutrientes independientemente del lugar en donde fueron colectadas, lo anterior, con el fin de estandarizar las condiciones de propagación y crecimiento, para que la única variable fuese las condiciones de inundación.
Cada semana se añadía 1. 5 L de solución de nutrientes preparada con el fertilizante comercial Triple 17 marca “nutrigarden”, que contenía N, P y K a una concentración de 5 mg L−1. Una vez obtenidos los rebrotes de cada especie (entre 10 y 15 días), se sembró un individuo (de entre 20 y 30 cm de altura, media 24.2 cm) en bolsas de plástico negro (13 × 25 cm) con suelo de humedal del mismo lote del puesto en las tinas con las plantas madre. A las bolsas se les hicieron 10 agujeros de 2 cm para permitir el contacto con el agua. Las bolsas con suelo y plantas se colocaron en contenedores de plástico de 60 × 40 × 34 cm que contenían agua. Se colocaron 8 plantas por cada especie en cada contenedor bajo tres diferentes condiciones hídricas (24 plantas en total por cada especie). Las condiciones hídricas fueron: capilaridad (las bolsas estaban sumergidas 10 cm), saturación (las bolsas estaban sumergidas 30 cm hasta la base de la planta) e inundación (las bolsas estaban sumergidas 40 cm, con una columna de agua de 10 cm arriba de la base de la planta). Los contenedores que contenían las plantas se enriquecieron al día cero y el día 14 con fertilizante Triple 17 (5 mg L−1 de NPK), en los tres tipos de inundación.
Las plantas se dejaron crecer bajo las diferentes condiciones de inundación durante 20 días, se midió su altura al inicio y al día 20. Después, se sacaron de las bolsas y se retiró la tierra adherida a las raíces, se lavaron para eliminar materia extraña y se pusieron en solución nutritiva (fertilizante triple 17 a una concentración de 5 mg L−1) en frascos de 212 ml, con tapón de rosca que tenía un orificio por donde la parte área de la planta se sacó del frasco, solo la raíz estuvo completamente sumergida en la solución. Este tapón también tenía un septo de goma (utiryl gris) para extraer o inyectar solución en el frasco sin necesidad de abrirlo. La base de la planta se fijó al tapón de plástico con parafina, para que quedara fija y se evitará la entrada de aire al frasco. Las plantas se dejaron en la solución nutritiva por 24 horas antes de realizar la medición de liberación de oxígeno, con el fin de que cualquier traza de suelo adherida a la raíz se quedará en la solución nutritiva y las plantas se aclimataran a la solución antes de la medición. Se utilizaron 5 réplicas por cada especie en cada condición de inundación para la medición de liberación de oxígeno. Las plantas sobrantes de las 8 crecidas en cada condición de inundación se utilizaron para medir la porosidad de la raíz.
Medición de liberación de oxígeno. La tasa de liberación de oxígeno se determinó de acuerdo con el método de citrato de titanio (Ti3+) descrito por Kludze et al. (1994) y Mei et al. (2009). La preparación de la solución de citrato de titanio se realizó bajo condiciones reducidas en una cámara libre de oxígeno. Se añadieron 270 ml de agua destilada previamente burbujeada con N2 a 15.88 gr de citrato de sodio para dar solución a citrato sódico 0.2 M. Después se agregaron 27 ml de cloruro de titanio (Aldrich Chemical Co.) a la solución de citrato sódico, se ajustó la solución a un pH = 5 con carbonato de sodio saturado (25 gr de NaCO3 y 100 ml de agua).
Se preparó solución nutritiva (fertilizante triple 17 a una concentración de 5 mg L−1) y se colocaron 170 ml en frascos con tapón de rosca hermético con un volumen total de 212 ml los cuales se burbujearon con N2 durante 2 min para eliminar el O2 disuelto. Los frascos herméticamente cerrados, se colocaron dentro de la cámara libre de oxígeno y allí se cambió el tapón del frasco por el tapón con la planta fijada con parafina que había estado en solución nutritiva por 24 h. La raíz de la planta quedó sumergida en la solución nutritiva libre de oxígeno. Los frascos con planta sellados herméticamente se sacaron de la cámara y a través del septo se inyectaron 20 ml de la solución de citrato de titanio y se agitaron manualmente con cuidado de no dañar la parte aérea de las plantas. Inmediatamente después de la agitación, se tomó a través de septo una muestra de 2 ml de la solución nutritiva con citrato de sodio y se colocó en un vial previamente evacuado al vacío y sellado herméticamente. Las plantas se colocaron en una mesa a temperatura ambiente donde les llegaba luz natural a través de una ventana en el laboratorio y a las seis horas se volvió a tomar otra muestra de la solución nutritiva con citrato de sodio. La absorbancia de las muestras de citrato de titanio tomadas a diferentes tiempos se midió a 527 nm en un espectrofotómetro Jenway UV. La cantidad de O2 en las muestras de citrato de titanio se calculó a partir de una curva de calibración que se realizó inyectando concentraciones conocidas de oxígeno a una solución de citrato de Titanio 0.1 M. En cada medición se utilizaron 5 réplicas para cada planta y tipo de inundación, y un control, que no contenía plantas. Después de medir el ROL, las plantas se sacaron de la solución de citrato de titanio, se lavaron y se les midió el volumen de raíz, posteriormente se dividieron entre biomasa aérea y raíz y ambas partes se pusieron a secar para calcular el peso seco. Para calcular la liberación de oxígeno (ROL) por las raíces se utilizó la siguiente fórmula:
donde ROL = liberación de oxígeno, µmol O2 planta−1 día−1; z = concentración de oxígeno en la solución de citrato de titanio con planta después de 6 h de tratamiento con planta, µmol O2; y = concentración inicial de oxígeno en la solución de citrato de titanio en la solución con planta, µmol O2, t = tiempo del experimento (6 h) y 24 = factor de conversión de horas por día.
Medición de la porosidad. A tres individuos de cada especie, crecidas bajo las condiciones de inundación, se les midió la porosidad de la raíz, mediante el método descrito por Van-Noordwijk & Brouwer (1988). Las muestras de raíces se cortaron en trozos de 5 cm de longitud, con un total de 3 gr por cada muestra. La primera medida que se tomó fue el peso del picnómetro lleno con agua. La segunda medida fue la del picnómetro lleno con los 3 g de raíz aforados con agua. Después se retiraron las raíces del picnómetro y se secaron delicadamente con papel absorbente con el objetivo de retirar el agua adherida y se pesaron las raíces; posteriormente para retirar el agua absorbida se molieron las raíces en mortero y se introdujeron al picnómetro con agua, y se pesó el picnómetro. Cabe señalar que antes de cada medición el picnómetro se introdujo en un baño de agua para mantener la temperatura a 20 °C. La fórmula para calcular la porosidad es la siguiente:
donde:
POR = |
Porosidad de la raíz %. |
PR = |
Peso picnómetro con raíces con poros llenos de aire y agua, g. |
PR′ = |
Peso picnómetro con raíces sin poros llenos de aire y agua, g. |
P = |
Peso picnómetro lleno de agua, g. |
a = |
Peso fresco de las raíces, g. |
Medición de volumen de raíces. El volumen de raíz se midió por el método de desplazamiento del volumen de agua. Primero se eligió un frasco cuyo volumen era de 212 ml, en él se colocaban las raíces de las plantas de tal modo que el final del tallo quedara sobre el borde del frasco, después en un vaso de precipitados se colocaban los 212 ml de agua, y poco a poco se introducía el agua al frasco donde estaban las raíces hasta que el agua rebosara, sin que se tirara líquido, finalmente se medía el agua sobrante, la cual era el volumen de raíz.
Medición de peso seco. Se cortaron las plantas en dos partes, la parte aérea que contempla los tallos y las hojas, y la otra parte son las raíces. Ambas partes se colocan en papel y se introducen en una estufa a 105 °C de laboratorio hasta peso constante.
Análisis estadísticos. Los análisis estadísticos fueron realizados con PAST (Paleontogical Statistics Software Package for Education and Data Analysis) versión 3.16 para Windows. Se realizó el análisis de normalidad a los datos con la prueba Levene’s test. Para los datos que fueron normarlos se aplicó un análisis de varianza (ANOVA) de una vía para evaluar si había un efecto en la liberación de oxígeno por gramo de raíz, liberación de oxígeno por planta, porosidad, y peso seco de raíz de las plantas de humedal de acuerdo a su nivel de inundación. La prueba poshoc de tukey´s se utilizó para detectar diferencias significativas entre los tratamientos. Si los datos no eran normales, entonces realizaba una prueba Kruskal-Wallis. Un valor de p ≤ 0.05 fue utilizado para revelar la significancia estadística en todas las estimaciones.
Resultados
Producción de raíz en peso y volumen. Bajo condiciones de inundación, L. ligularis, produjo significativamente (p ˂ 0.05) menor peso seco (0.175 g) que P. sagittata, S. lancifolia, T. geniculata, C. giganteus y T. domingensis (Figura 1A). Sin embargo, no fue significativamente (p = 0.0627) diferente del peso seco de raíz de C. articulatus (0.326 g) y este fue significativamente (p ≤ 0.05) menor del peso seco de T. geniculata (1.52 g) y T. domingensis (0.88 g). En la condición de saturación L. ligularis tuvo significativamente (p ˂ 0.05) menor peso seco de raíz (0.25 g) que P. sagittata (0.92 g), T. geniculata (1.16 g) y C. giganteus (0.81 g).
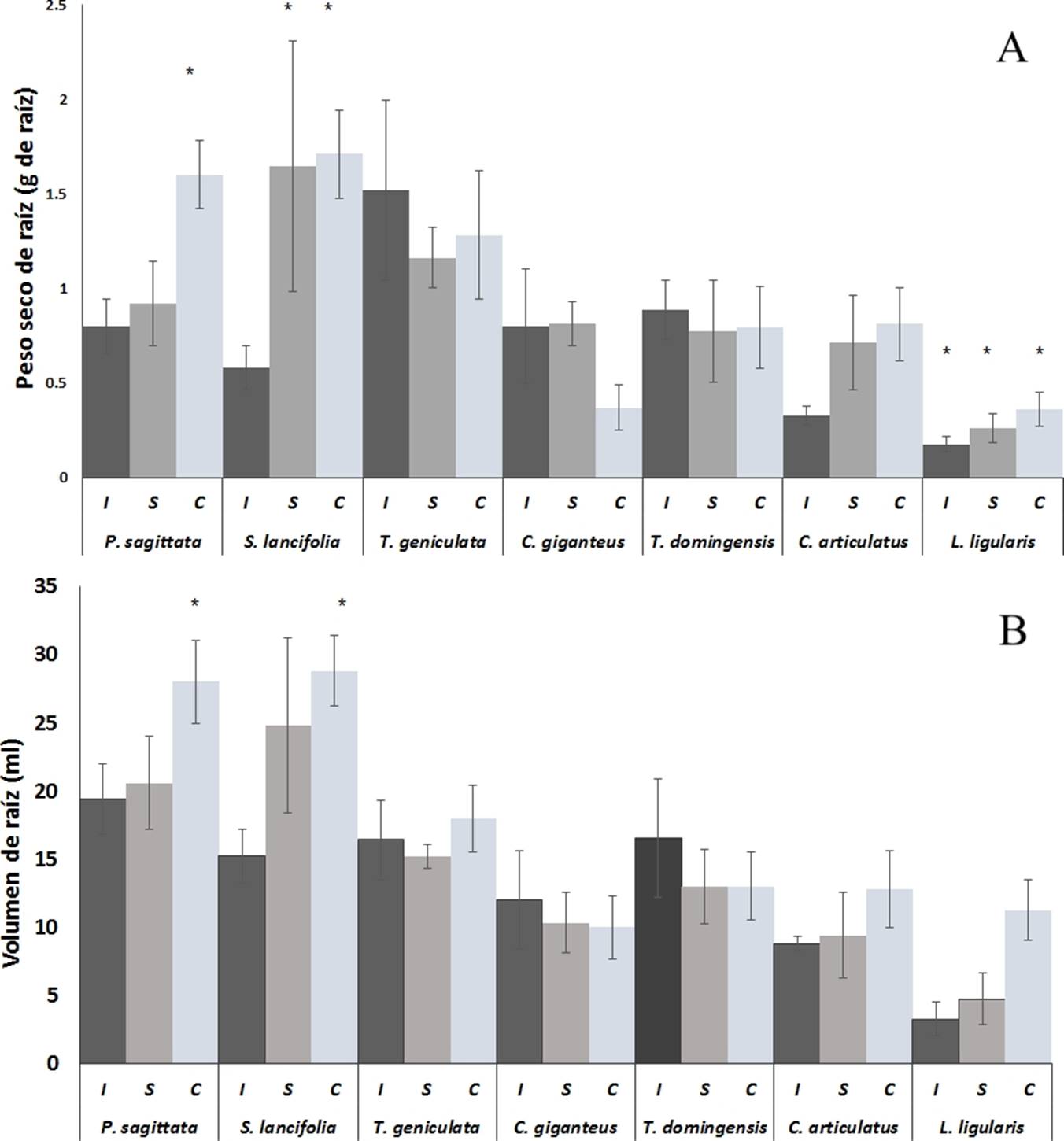
Figura 1 Producción de raíz con base en peso seco (A) y volumen (B) de las macrófitas más abundantes de los humedales costeros de Veracruz, crecidas bajo diferentes condiciones de inundación. I = Inundación, S = Saturación, C = capilaridad. Los valores son promedios (n = 5), las barras representan el error estándar. * indica diferencias significativas.
En capilaridad, P. sagittata y S. lancifolia produjeron significativamente (p ˂ 0.05) mayor peso seco de raíz (1.6 y 1.7 g respectivamente) que C. articulatus, L. ligularis, C. giganteus y T. domingensis. Sin embargo, no fueron estadísticamente significativas (p ˃ 0.05) del peso seco de raíz de T. geniculata (1.28 g).
El volumen de la raíz tuvo un comportamiento similar al peso seco (Figura 1B). Bajo condiciones de inundación P. sagittata (19.4 ± 2.56 ml), S. lancifolia (15.2 ± 1.9 ml), T. geniculata (16.4 ± 2.9 ml) tuvieron significativamente (p ˂ 0.05) mayor volumen de raíz que C. articulatus (8.8 ± 0.4 ml) y L. ligularis (3.2 ± 1.2 ml). A su vez C. giganteus (12 ± 3.6 ml), T. domingensis (16.5 ± 4.3 ml) y C. articulatus (8.8 ± 0.4 ml) tuvieron mayor volumen de raíz con respecto L. ligularis, pero no significativamente mayor que C. articulatus. En condiciones de saturación, P. sagittata (20.6 ± 3.4 ml), S. lancifolia (24.8 ± 6.4 ml), T. geniculata (15.2 ± 0.8 ml) y T. domingensis (13 ± 2.7 ml) tuvieron significativamente (p ˂ 0.05) mayor volumen de raíz que L. ligularis (4.7 ± 1.8 ml). También se observó que P. sagittata generó significativamente (p = 0.0353) mayor volumen de raíz que C. articulatus (9.4 ± 3.1 ml), y C. giganteus (10.3 ± 2 ml) que T. geniculata con p = 0.0480. Por otra parte, P. sagittata (28 ± 3.8 ml), S. lancifolia (28.8 ± 2.5 ml) mostraron significativamente (p ˂ 0.05) mayor volumen de raíz que T. geniculata (18 ± 2.4 ml), C. giganteus (10 ± 2.3 ml), T. domingensis (13 ± 2.4 ml), C. articulatus (12.8 ± 2.8 ml) y L. ligularis (11.25 ± 2.21 ml).
Porosidad de las raíces. Para la porosidad, se encontraron patrones diferentes a los de producción de raíz, especies con alta producción de raíz, como P. sagittata y T. geniculata, presentaron porosidades entre 20 y 30 %, mientras especies con producción intermedia de raíz como C. giganteus T. domingensis y C. articulatus presentaron porosidades entre 37-57 % (Figura 2). L. ligularis al igual que el peso seco, fue la especie que presentó la porosidad más baja (19.9 ± 2.9 %).
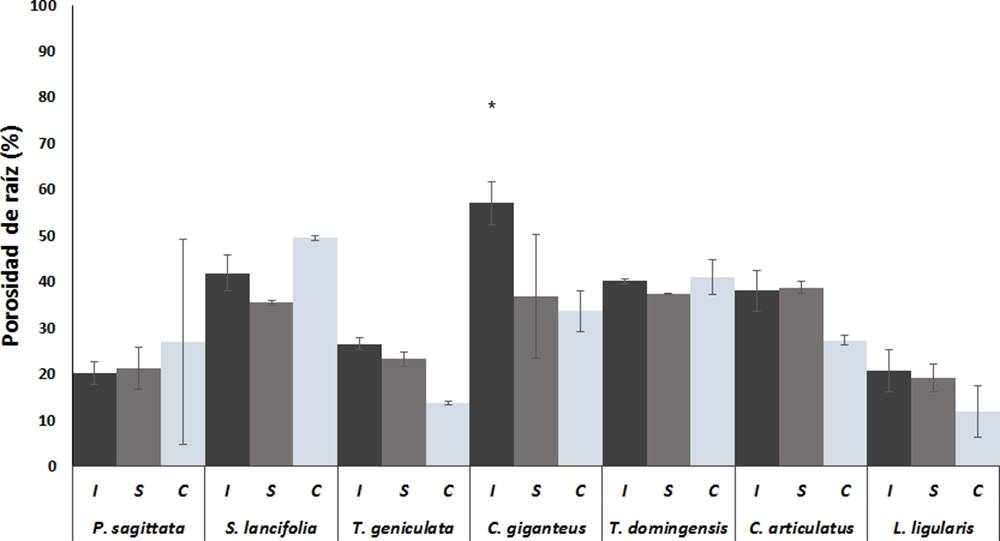
Figura 2 Porosidad de las raíces las macrófitas más abundantes de los humedales costeros de Veracruz, crecidas bajo diferentes condiciones de inundación. I = Inundación, S = Saturación, C = capilaridad. Valores son promedios (n = 5), barras representan el error estándar. * indica diferencias significativas.
Liberación de oxígeno por gramo de raíz. Excepto para C. gigantus y L ligularis , la liberación de oxígeno por las raíces de las plantas de humedales mostraron mayores valores en condicones de inundación y saturación, sin embargo las diferencias no fueron estadisticamente significativas (p > 0.05) ( Figura 3). Las especies con mayores valores de liberación de oxígeno fueron T. domingensis, C. articulatus y L. ligularis con valores en el rango de 140 a 180 µmol O2 g−1 y especies como P. sagitatta, S lancifolia y T. geniculata, mostarron menores valores de liberación de oxígeno en el rango de 40 a 100 µmol O2 g−1d−1.
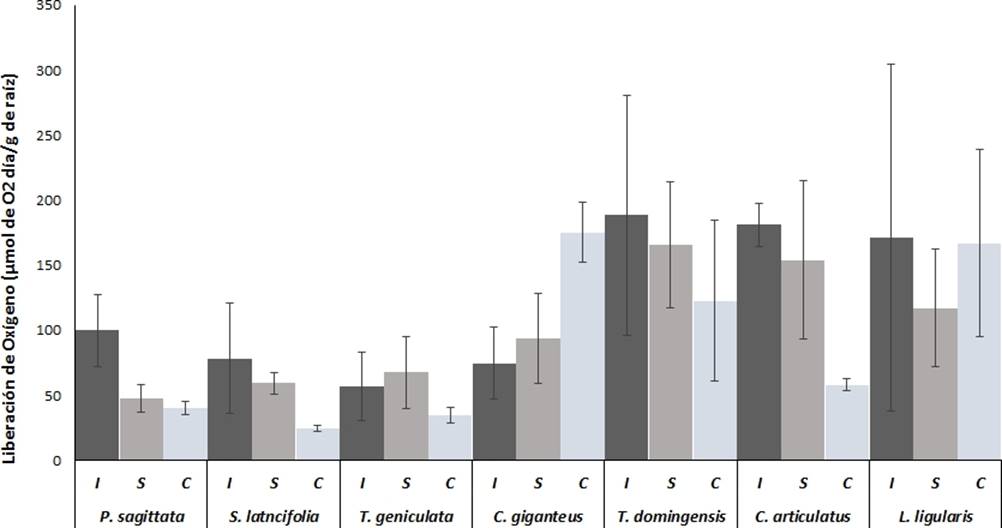
Figura 3 Liberación de oxígeno radial en base a peso seco de las raíces de las macrófitas más abundantes de los humedales costeros de Veracruz, crecidas bajo diferentes condiciones de inundación. I = Inundación, S = Saturación, C = capilaridad. Valores son promedios (n = 5), barras representan el error estándar. * indica diferencias significativas
Liberación de oxígeno por planta. Cuando analizamos la liberación de oxígeno sin tomar en cuenta el peso de la raíz, esto es la liberación de oxígeno por planta (Figura 4) observamos que T. geniculata, T. dominguensis y C. articulatus mostraron mayor liberación de oxígeno en condiciones de inundación que en capilaridad, sin embrago las diferencias no fueron estadísticamente significativas (p ˂ 0.05). El valor más alto de liberación de oxígeno (148 ± 46 µmol O2 d−1) se observó para T. dominguensis en condiciones de inundación y fue significativamente más alto (p ˂ 0.05) que los valores más bajos observados en L. ligularis (22 ± 46 µmol O2 d−1 ) y S. lancifolia, (37 ± 12 µmol O2 d−1), en las otras dos condiciones de inundación, no hubo diferencias significativas (p ≥ 0.05) entre las distintas especies estudiadas.
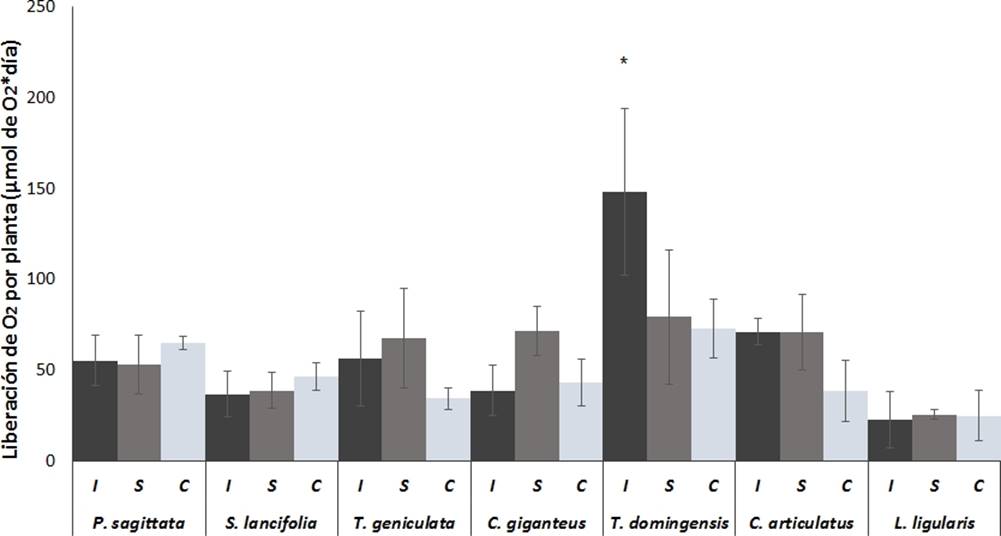
Figura 4 Liberación de oxígeno radial por planta de las raíces de las macrófitas más abundantes de los humedales costeros de Veracruz, crecidas bajo diferentes condiciones de inundación. I = Inundación, S = Saturación, C = capilaridad. Valores son promedios (n = 5), barras representan el error estándar. * indica diferencias significativas.
Discusión
En este estudio se observó que para algunas especies nativas de los humedales tropicales de Veracruz, la producción de raíz se ve disminuida bajo condiciones de inundación, esto se debe a una respuesta al estrés hídrico (Jackson & Colmer 2005). Esto coincide con los resultados observados por Sasikala et al. (2009), quienes observaron en mesocosmos de humedales que Thypha orientalis produjo menos peso de raíz en condiciones permanentemente inundados en comparación con plantas crecidas con inundación intermitente. Se encontró que especies con mayor producción de biomasa de raíz (P. sagittata, S. lancifolia y T. geniculata), fueron las especies con menor liberación de oxígeno. Estos resultados concuerdan con lo observado por Sorrell (1999), quien encontró que J. inflexus produjo mayor peso seco de raíz que J. effusus y la liberación de oxígeno fue menor en la primera especie. Los autores explican que la liberación de oxígeno no sólo está relacionada con el peso seco de la raíz si no con la morfología de la raíz. Sin embrago, otros estudios han encontrado una correlación positiva entre el peso seco de la raíz y la liberación de oxígeno (Lai et al. 2012).
En este estudio sólo observamos diferencias significativas entre la liberación de oxígeno por planta bajo condiciones de inundación, por lo que aceptamos la hipótesis a). Sin embargo, para las condiciones de saturación y capilaridad no observamos diferencias significativas entre las especies, por lo que para estas condiciones rechazamos la hipótesis a). Lo anterior pudiera explicarse porque bajo la condición de capilaridad hay más disponibilidad de oxígeno en el sedimento y bajo condiciones de saturación, aunque más limitado aún pudiera haber cierta difusión de oxígeno de la atmósfera al sedimento, por lo que bajo dichas condiciones las especies de macrófitas estudiadas están bien habilitadas para transportar el poco oxígeno que haga falta sin maximizar su capacidad como lo tuvieron que hacer bajo condiciones de inundación. Se ha reportado que cuando el sedimento está seco disminuye la producción de aerénquima, que es el tejido por el que se transporta el oxígeno de las partes aéreas a la raíz (Sorrell 1999). Lo anterior pudiera explicar la respuesta observada en algunas especies de disminución de la liberación de oxígeno por la raíz bajo la condición de capilaridad.
Con excepción de P. sagittata y S. lancifolia, las demás especies estudiadas mostraron una tendencia a aumentar su porosidad bajo condiciones de inundación; esto ha sido observado en otras especies nativas de humedales templados (Sasikala et al. 2009). Las porosidades encontradas en este estudio estuvieron en el rango de 19 a 57 %, las cuales se encuentran dentro del rango reportado para otras especies de plantas acuáticas (Tabla 1). Los valores de liberación de oxígeno radial en base a peso seco, observados en este estudio estuvieron en el rango de 24 a 188 µmol O2 g−1d−1, los cuales se compararon con los reportados en la literatura para otras plantas nativas de humedales templados utilizando el mismo método de citrato de Ti (Tabla 1). En este estudio encontramos que Typha dominguensis presentó la mayor liberación de oxigeno radial por planta, en comparación con los otros géneros estudiados. Debido a la amplia distribución geográfica del género Typha, este ha sido uno de los más estudiados en cuanto la liberación de oxígeno radial (Matsui & Tsuchiya 2006, Matsui & Tsuchiya 2008, Sasikala et al. 2009). En otros estudios donde se comparó la liberación de oxígeno por las raíces de Typha con otras plantas como Juncus effusus y Cladium jamicense , también se encontró que Typha presento mayor liberación de oxígeno por las raíces (Weissner et al, 2002, Chabbi et al. 2000). Lo anterior fue explicado por los autores, debido al mayor contenido de tejido de aerénquima en Typha , en comparación con las otras plantas.
Tabla 1 Comparación de la liberación de oxígeno por varias plantas de humedales
| Especie | Liberación de Oxígeno (µmol O2 d−1 g−1seco de raíz) |
Liberación de Oxígeno (µmol O2 d−1) |
Porosidad de la raíz (%) | Peso seco de raíz (g base seca) |
Referencia |
|---|---|---|---|---|---|
| Juncus effusus | 348 | 386.4 | 39 | 0.11 | Sorrell 1999 |
| Juncus ingens | 348 | NR | NR | NR | Sorrell 1999 |
| Juncus inflexus | 194 | 163 | 51 | 0.203 | Sorrell 1999 |
| Juncus bulbosus | 36 | NR | Chabbi 1999 | ||
| Cladium sp | 40.8 | NR | 9-15 | NR | Chabbi et al. 2000 |
| Typha sp | 45.6 | NR | 10-28 | NR |
Chabbi et al. 2000 Mei et al. 2009 |
| Typha orientalis | 60-180 | NR | 30-40 | 3.14-12.56 | Sasikala et al. 2009 |
| Potamogeton coloratus | 36 | NR | 10-20 | NR | Lemoine et al. 2012 |
| Sparganium emersum | 43 | NR | 12-18 | NR | Lemoine et al. 2012 |
| Elodea canadensis | 60 | NR | 12-18 | NR | Lemoine et al. 2012 |
| Thalia geniculata | 34-56 | 34-67 | 15-28 | 0.6-1.6 | Este estudio |
| Sagitaria lancifolia | 23-160 | 38-46 | 42-50 | 0.5-1.5 | Este estudio |
| Thypa domingensis | 122-188 | 72-148 | 35-40 | 0.7-0.9 | Este estudio |
| Cyperus giganteus | 74-175 | 39-71 | 38-55 | 0.4-0.8 | Este estudio |
| Pontederia sagittata | 39-99 | 53-65 | 20-24 | 0.6-1.5 | Este estudio |
| Cyperus articulatus | 58-181 | 38-71 | 25-34 | 0.3-0.7 | Este estudio |
| Leersia ligularis | 117-171 | 22-25 | 12-19 | 0.1-0.7 | Este estudio |
NR= No reportado











 nueva página del texto (beta)
nueva página del texto (beta)


