Los caracteres anatómicos del tallo de una especie pueden presentar variación estructural individual o poblacional (Anderegg & Meinzer 2015) y por ende adaptativa. En este sentido, los tallos de las plantas vasculares han diversificado sus patrones anatómicos como respuesta a diferentes presiones de selección en el medio terrestre; sin embargo, no todos han sido explicados a la luz de la taxonomía y adaptación ecológica (Pittermann et al. 2015). Entre las plantas con menos observaciones al respecto se encuentran las que pertenecen a Selaginella P. Beauv., representante actual de las primeras plantas vasculares (Ambrose 2013). En las especies de este género, cuyos tejidos de conducción en el tallo presentan un arreglo ancestral (haploesteles exarcos), se ha visto que algunos caracteres de las células del xilema pueden variar en función del ambiente (Schneider & Carlquist 2000a, b). En general, se han descrito en diferentes especies de Selaginella una amplia diversidad en el arreglo de los tejidos caulinares, supuestamente como resultado del abanico de medios contrastantes en los que habitan (Gibson 1894, DeVol 1967, Uphof 1920). Recientemente, los estudios sistemáticos de Weststrand & Korall (2016a a, b) incluyen, aparte del análisis del ADN, el arreglo general del estele de aproximadamente 250 especies de Selaginella; sin embargo, en ninguno de ellos hace referencia a la variación intraespecífica en la anatomía del tallo para alguna de las especies de este género. De las 80 especies de Selaginella con distribución en México (Mickel & Smith 2004), Selaginella pallescens (C. Presl) Spring es una de las que muestra una amplia distribución ambiental. De acuerdo con Weststrand & Korall (2016b), es una especie que corresponde a Selaginella subg. Stachygynandrum (P.Beauv. ex Mirb.) Baker; se caracteriza por presentar, además de rizóforos ventrales, rizomas haplostélicos y tallos aéreos monostélicos. Sus poblaciones pueden tener los tallos dispuestos laxamente y ser erectos en ambientes húmedos, o ser compactos y formar rosetas en lugares secos (Gregory & Ribas 1979). En el estudio filogenético de Selaginella que realizaron Zhou et al. (2015), para quienes S. pallescens es el tipo de Selaginella secc. Pallescentes Li Bing Zhang & X.M. Zhou, se indica que por la gran variación en el hábito (roseta a erecta) existe una serie de relaciones filogenéticas complicadas para la delimitación de la especie dentro del complejo al cual pertenece. Esos autores puntualizan la necesidad de llevar a cabo más observaciones morfológicas y estudios citológicos en S. pallescens. Con respecto a los estudios realizados en la membrana de la punteadura (MP) de los elementos traqueales, sólo se han realizado en pocos grupos de pteridobiontes (Schneider & Carlquist 2000a, b, c, d, Luján-Luna et al. 2010, Brodersen et al. 2014); todos ellos llevados a cabo con fines comparativos, fisiológicos o para esclarecer aspectos evolutivos. Para el caso de Selaginella, se han encontrado diferencias en la porosidad de la MP entre S. arbuscula, S. braunii Baker, S. lepidophylla (Hook. & Grev.) Spring, S. pallescens (C. Presl) Spring y S. pulcherrima Liebm. (Schneider & Carlquist 2000a); pero la variación dentro de cada especie ha sido poco trabajada.
Selaginella es uno de los géneros más exitosos en el mundo, puesto que muestra una elevada riqueza específica, con 750 especies (sensuJermy 1990) y abundancia poblacional en sus ambientes locales (naturales y secundarios). Sin embargo, se ha generado escasa información sobre las características anatómicas y ultraestructurales de sus tallos aéreos y los de variación intraespecífica prácticamente no existen. Además, la carencia de datos estructurales finos como las membranas de las punteaduras (MPs) en traqueofitas inferiores, así como su posible variación, es una importante laguna en el entendimiento de la evolución del transporte de agua en este grupo de plantas con una larga historia geológica y amplitud ecológica (Pittermann et al. 2013, Brodersen et al. 2014). En consecuencia, S. pallescens es un buen modelo, ya que pertenece a un linaje antiguo de plantas vasculares (Ambrose 2013). Por lo tanto, el objetivo en este estudio es describir la variación anatómica en tallos aéreos de Selaginella pallescens, con énfasis en los elementos traqueales y en la membrana de la punteadura y evaluar si existen diferencias en los rasgos anatómicos con respecto al sustrato, forma de crecimiento y tipo de vegetación.
Materiales y métodos
Se recolectaron individuos de Selaginella pallescens en 10 microambientes pertenecientes a cinco tipos de vegetación (Tabla 1). Como en algunos de los mismos sitios se localizaron a Selaginella lepidophylla y S. porphyrospora A. Braun, los ejemplares de S. pallescens se identificaron por su hábito de crecimiento (tallos en roseta/erectos) y tipo de hojas, mediante las claves taxonómicas de Mickel & Smith (2004). Los especímenes se depositaron como material de referencia en el herbario IZTA.
Tabla 1 Individuos de Selaginella pallescens. DG: Números de colectas de Dalia Grego; DT: Números de colecta de Daniel Tejero. CT: Cañada los amates, Tonatico; SA: “San Alejo” Ixtapan de la Sal y Coatepec Harinas; CX: “Cerrada” y San Miguel Xoltepec, Valle de Bravo. BR: Bosque ripario; BTC y J: Bosque tropical caducifolio y de Juniperus; BQg: Bosque de Quercus magnoliifolia; BPE: Bosque de pino-encino.
| Ind./No. de colecta | Coordenadas | Altitud (msnm) |
Localidades | Forma de crecimiento |
Vegetación | Sustrato | |
|---|---|---|---|---|---|---|---|
| N | O | ||||||
| 1/1DG | 18° 46' 49.1" | 99°40'54.2" | 1522 | CT | erecta | BR | Suelo |
| 2/2DG | 18° 46' 49.1" | 99°40'54.2" | 1522 | CT | erecta | BR | Roca |
| 3/3DG | 18° 46' 50.1" | 99°40'53.3" | 1554 | CT | erecta | BTC | Suelo |
| 4/4DG | 18° 46' 50.9" | 99°40'40.4" | 1613 | CT | erecta | BTC y J | Suelo |
| 5/5DG | 18° 49' 44.7" | 99°43'11.8" | 1782 | SA | erecta | BTC y J | Roca |
| 6/6DG | 18° 49' 44.7" | 99°43'11.8" | 1782 | SA | roseta | BTC y J | Roca |
| 7/7DG | 18° 53' 13.8" | 99°45'17.5" | 1992 | SA | erecta | BQg | Suelo |
| 8/8DG | 18° 53' 14.4" | 99°45'17.7" | 1992 | SA | roseta | BQg | Suelo |
| 9/9DG | 18° 53' 10.5" | 99°45'18.7" | 1990 | SA | roseta | BQg | Suelo |
| 10/DT s/n | 19° 30' 34.5" | 100°17'50.8" | 2300 | CX | roseta | BPE | Roca |
Estudio anatómico. Inmediatamente después de la recolecta, de cada uno de los ejemplares se eligieron los tallos aéreos maduros con estróbilos que se ubicaron en la región media de una roseta o grupo de tallos. Se cortaron muestras, que consistieron en fragmentos de la base de los tallos, de aproximadamente 1-10 mm de longitud y se fijaron en una solución FAA estándar (Formol-ácido acético-alcohol) para posteriormente deshidratarse con diferentes concentraciones de etanol (del 30 % hasta el 100 %). Estas muestras se analizaron en microscopía fotónica y de barrido. Para microscopía electrónica de transmisión, otras muestras de 1 mm3 aproximadamente se fijaron en una mezcla de glutaraldehído-paraformaldehído en buffer de fosfatos (PBS) al 0.1M y pH 7.2 (4:6:90).
Microscopía fotónica y material disociado. Las muestras fijadas se incluyeron en parafina. Se obtuvieron cortes transversales y tangenciales, de 8-12 µm, que posteriormente se tiñeron con safranina-verde rápido (Johansen 1940). Finalmente se montaron en resina sintética. Para obtener los disociados, a las muestras fijadas en FAA, se les separó manualmente el sistema vascular con la ayuda del microscopio estereoscópico. El cordón del sistema vascular aislado se colocó en tubos eppendorf con solución Jeffrey (Ruzin 1999) y se incubaron a 50 °C. Posteriormente, el tejido disociado se lavó con agua destilada y se montó en gelatina glicerinada con safranina.
Microscopía Electrónica de Barrido. Las muestras de 10 mm de largo previamente fijadas durante 24 horas, se lavaron y deshidrataron en concentraciones graduales de alcohol (30 % hasta 100 %). Se realizaron cortes longitudinales del estele y una vez secos (en estufa de laboratorio a 58 °C durante una noche), se montaron en portamuestras de aluminio con cinta de carbón de doble cara. Se cubrieron con oro en un ionizador marca Quórum modelo 150R ES. Las muestras se observaron a través de un microscopio electrónico de barrido Hitachi modelo SU1510.
Microscopía Electrónica de Transmisión. Las muestras fijadas en la mezcla de glutaraldehído-paraformaldehído, se postfijaron con tetraóxido de osmio. Los tallos se deshidrataron con etanol en concentraciones graduales (30 al 100 %). Se realizó una preinclusión en concentraciones graduales de resina-oxido de propileno hasta llegar a resina pura y se polimerizaron. Se obtuvieron cortes semifinos transversales de 300 nm de grosor con cuchillas de vidrio en un ultramicrótomo (Leica modelo Ultracut R); finalmente se tiñeron con azul de toluidina. De estos cortes, se eligieron zonas de interés para obtener cortes ultrafinos de 40 a 60 nm de grosor, los cuales se recogieron en rejillas 50 Mesh. Como contrastantes en estos últimos cortes, se utilizó acetato de uranilo (10 min) y citrato de plomo (20 min). Las observaciones se realizaron a través del microscopio electrónico de transmisión JEM-1010 y las imágenes se capturaron con una cámara CCD modelo Gatan Orius SC600 y el software Digital Micrograph.
Descripción anatómica. Se describen los tejidos dérmico, fundamental y vascular. Los términos referentes a la descripción anatómica del tallo se formalizaron considerando a Gibson (1894) y a la IAPT (1962). En vistas transversales se midieron las áreas que corresponden al córtex, parénquima-floema y xilema. Del córtex se obtuvo el porcentaje de esclerénquima y parénquima presente. De cada cilindro vascular se midió el diámetro mayor y menor de los elementos traqueales del proto y metaxilema; en material disociado se midió su longitud. Las mediciones y fotomicrografías se realizaron con ayuda del software NIS Elements BR 2.33 (Nikon Corporation 1991-2006).
Descripción de la ultraestructura de las MPs. Se describieron características cualitativas de las MPs con base en los términos de Jansen et al. (2009). De las imágenes obtenidas con MET se midió el grosor de las membranas de la punteadura de los elementos proto y metaxilemáticos con el software Image J. En todos los casos se obtuvieron los valores de la estadística descriptiva y se presentan los valores mínimos y máximos.
Análisis estadísticos. De cada individuo se obtuvieron los parámetros de la estadística descriptiva de cuatro caracteres anatómicos de los tejidos del tallo y nueve caracteres del xilema. Para detectar si existen diferencias significativas en dichos rasgos morfo-anatómicos por el sustrato (suelo-roca), la forma de crecimiento (erecta-roseta) o el tipo de vegetación donde crecen los individuos muestreados (Tabla 1), se realizaron análisis de varianza del modelo general lineal, seguidos de un análisis de comparación de medias para detectar diferencias entre pares (P < 0.05, Tukey). Todos los análisis se realizaron con los procedimientos en SAS (SAS Institute 2014). Además, se presentan las áreas de cada tejido expresadas también en porcentajes. El total no suma el 100 % en cada individuo, debido a que el espacio aéreo ocupado por la endodermis no se midió.
Resultados
Morfología del hábito. Selaginella pallescens es una hierba cespitosa, en ocasiones roseticaule. Crece en taludes de tierra y como saxícola, principalmente como fisurícola y en menor medida epipétrica. Los individuos en todos los casos presentan rizomas que crecen apretadamente, sin dirección o de forma centrípeta. Los rizóforos nacen de la porción ventral en la base de los tallos aéreos y presentan tricomas en la porción distal en contacto con el sustrato. Los tallos aéreos están 2-3 veces ramificados, en forma pinnada con las ramas alternas, dísticas y algo ascendentes; están cubiertos con cuatro hileras de micrófilas anisomorfas: dos laterales, dísticas, tienen las bases redondeadas, margen largo a corto ciliado y ápice aristado y dos hileras dorsales, alternadas, caracterizadas por una aurícula corta en su base, margen hialino corto ciliado y ápice aristado, excepto la axilar a la bifurcación de las ramas que es lanceolada, sin aurículas y margen de largo a corto ciliado en la base. Se observó una gradación entre dos diferentes formas de crecimiento: cespitosa roseticaule y cespitosa de tallos erectos (también llamado fascicular; Tabla 1). Los tallos aéreos pueden ser claramente erectos, a partir de rizomas multidireccionales (Figura 1A, C) o presentarse en forma de roseta a partir de rizomas con crecimiento centrífugo (Figura 1B, D). Los tallos juveniles del primer grupo se localizan al centro de la planta, suelen ser más altos que el resto de los tallos y presentan las ramificaciones en el tercio apical. Los individuos con forma de roseta también presentan sus tallos juveniles al centro de la planta, pero éstos son de menor tamaño con respecto a los maduros periféricos que generalmente se ramifican desde la base.

Figura 1 Selaginella pallescens. A, C. Individuo 2DG; B, D. Individuo 9DG. A. Tallos aéreos erectos; B. Tallos aéreos en forma de roseta; C. Rizoma de forma de crecimiento erecta; D. Rizoma de forma de crecimiento arrosetada.
Anatomía y ultraestructura. La anatomía del tallo se detalla con base en la microscopia de luz, de barrido y de transmisión y se ilustra en las figuras 2-4; además los valores de la estadística descriptiva para los individuos se sintetizan en los Apéndices 1, 2.
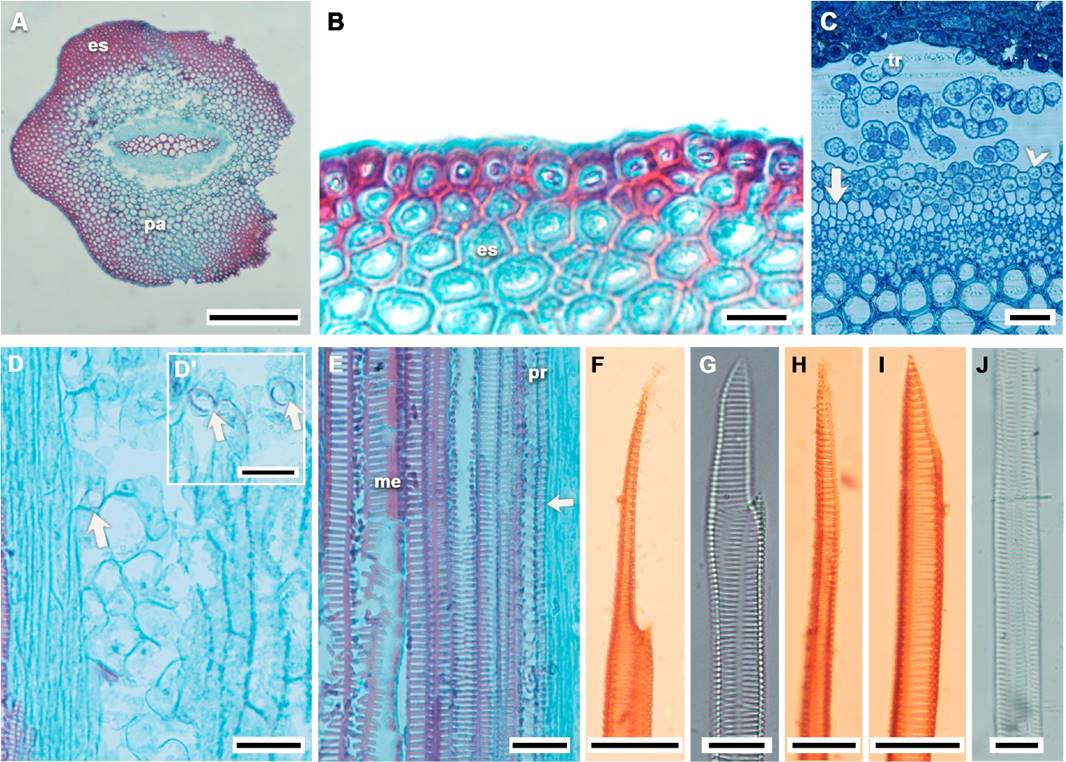
Figura 2 Caracteres anatómicos del tallo aéreo y elementos xilemáticos de Selaginella pallescens. A-C. Vista transversal; D-E, Vista tangencial; A. Vista general de tallo aéreo; B. Epidermis; C. Periciclo (cabeza de flecha), estrato unicelular de floema (flecha); D. Trabéculas; D’. Bandas de Caspari; E. Arreglo anular y helicoidal de pared secundaria en protoxilema (flecha), punteaduras reticulares y escalariformes en metaxilema; F-J. Material disociado; F, G. Elementos de vaso; H-J. Traqueidas; es = esclerénquima, me = metaxilema, pa = parénquima, pr = protoxilema, tr = trabécula; Barras A = 250 µm, B = 10 µm, C-J = 25 µm.

Figura 3 Características de los elementos traqueales del tallo aéreo de Selaginella pallescens, MEB. A. Caras de elementos xilemáticos y punteaduras escalariformes; B. Pared secundaria anular de elementos xilemáticos; C. Punteaduras interrumpidas por puentes (flechas); D. Placa de perforación escalariforme; E, F. Membrana de la punteadura (flechas); Barras A = 40 µm; B, D = 5 µm, C, E, F = 2.5 µm.
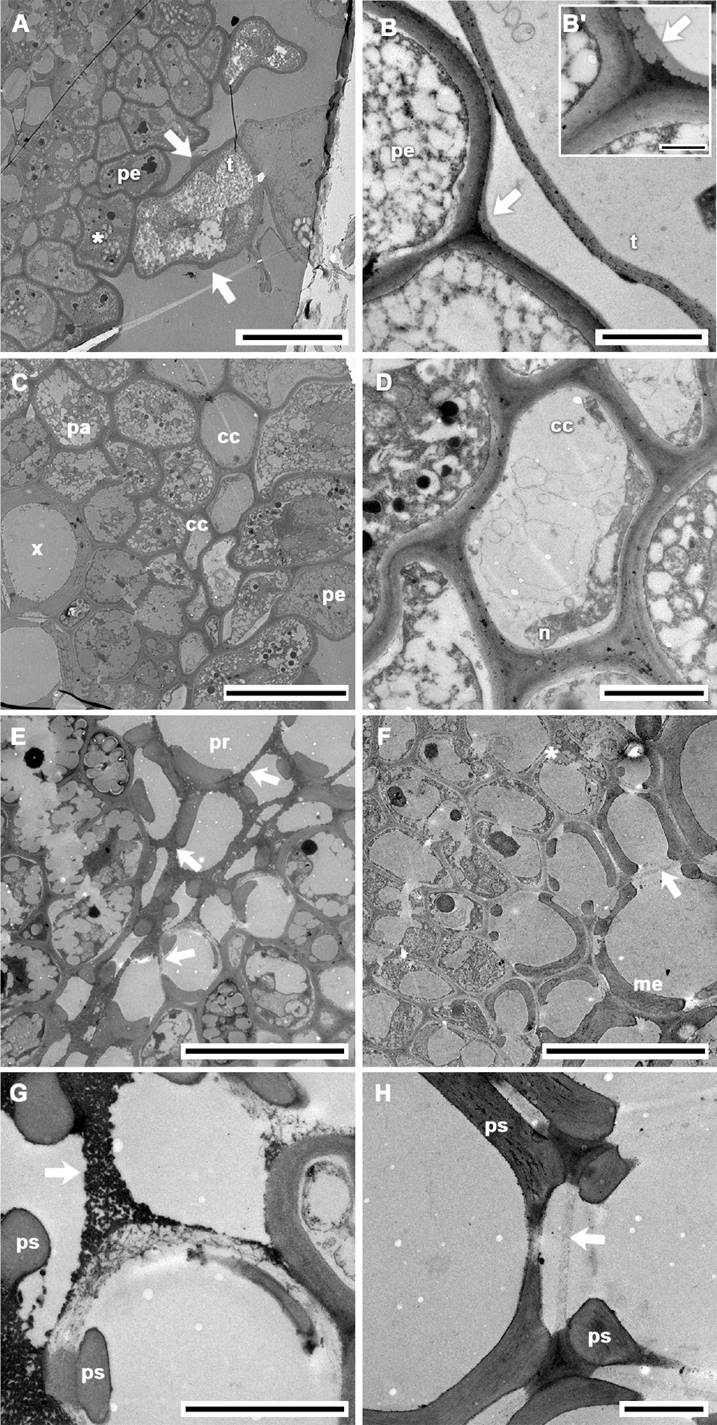
Figura 4 Ultraestructura del tejido vascular del tallo aéreo de Selaginella pallescens, MET. A-H. Vista transversal. A. Trabécula con banda de Caspari (flechas), granos de almidón en periciclo (*); B. Cuticularización del periciclo (flecha); B’. Acercamiento; C. Tejidos circundantes al xilema; D. Acercamiento de floema; E, G. Protoxilema; E. Punteaduras entre elementos traqueales (flechas); F, H. Metaxilema; F. Punteaduras entre elementos traqueales de metaxilema, cloroplastos en parénquima (*); G. Membrana de la punteadura electrodensa y granulosa (flecha); H. Membrana de la punteadura poco electrodensa (flecha). cc = célula cribosa; me = metaxilema, n = núcleo, pa = parénquima, pe = periciclo, pr = protoxilema, ps = pared secundaria, t = trabécula, x = xilema; Barras A, C, E-F, H = 10 µm; B, D, G = 2 µm; B’ = 0.5 µm.
Anatomía en la base del tallo aéreo. En vista transversal se diferenciaron las zonas y tejidos que conforman el tallo (Figura 2A).
Contorno del tallo aéreo.- Es de circular a elíptico, con un área total de 0.249 - 0.794 mm2.
Epidermis.- Simple, con un solo tipo celular, las células son pequeñas, de forma elíptica por sus paredes gruesas, lignificadas y de lumen casi cerrado (Figura 2B), cutícula gruesa; carece de estomas.
Córtex.- En vista transversal se distinguen dos zonas que varían en proporción; la más externa se reconoce como esclerénquima, formada por fibras con protoplasto, con lúmenes pequeños, paredes engrosadas y lignificadas de contorno redondeado; mientras que en la zona interna existen células de parénquima de forma isodiamétrica, con paredes primarias de contorno anguloso, sin espacios intercelulares (Figura 2A). El esclerénquima llega a ocupar entre el 31 y 82 % del córtex y presenta diferencias significativas con el tipo de vegetación donde crecen los individuos (Apéndice 1, Tabla 2).
Tabla 2 Media de las variables con diferencias significativas para el sustrato, forma de crecimiento y tipo de vegetación (n = 10; P < 0.05, Tukey). Para las variables que no se muestran no hay diferencias significativas en los GLM (P > 0.05).
| Variable dependiente | variables | independientes | |||
|---|---|---|---|---|---|
| sustrato | |||||
| suelo | roca | ||||
| Diámetro mayor metaxilema (µm) | 21 | 24 | F = 5.86, P < 0.04 | ||
| Grosor de la MP protoxilema | 0.33 | 0.24 | F = 14.82, P < 0.005 | ||
| Forma de crecimiento | |||||
| erecta | roseta | ||||
| Longitud elemento traqueal (µm) | 1269 | 6.966 | 6.641 | 1194 | F = 9.30, P < 0.02 |
| Tipo de vegetación | |||||
| BTC-J | BQG | ||||
| Diámetro mayor metaxilema (µm) | 24.7 | 18.8 | F = 6.72, P < 0.03 | ||
| BR | BQG | BTCYJ | BPE | ||
| Área esclerénquima (mm2) | 0.36 | 0.23 | 0.21 | 0.15 | F = 16.22, P < 0.005 |
| BTC | BTCYJ | BPE | |||
| Área esclerénquima (mm2) | 0.36 | 0.21 | 0.15 | ||
En la zona más interna del córtex se encuentra un espacio aéreo ocupado por células de la endodermis llamadas trabéculas; son de forma estrechamente ovalada a circular, que se organizan de manera laxa (Figura 2C). En algunas células se observan anillos de color rojo que corresponden a la banda de Caspari (Figura 2D, D’).
Cilindro central.- Es monoestélico con un haplostele de simetría bilateral dorsiventral (relación largo:ancho de 6:1; Figura 2A). En el estele se distingue externamente un anillo con 2-3(4) estratos de células de forma ovalada a poligonal que corresponden al periciclo (Figura 2C). El perímetro externo de este anillo celular se caracteriza por tener una ligera capa semejante a una cutícula (Figura 4B). Al interior del periciclo y rodeando completamente al xilema se observan dos zonas de células no lignificadas. La zona externa corresponde al floema, formado por un estrato de células poligonales (Figura 2C); las de menor diámetro se encuentran en los polos más angostos del cilindro. La zona interna, en contacto con el xilema, consiste de células de parénquima, son de forma isodiamétrica y de paredes delgadas, con protoplasto. Este anillo de floema-parénquima ocupa entre el 3 y el 8 % del tallo. La porción central está ocupada por el xilema; muestra maduración exarca, las células de protoxilema de menor diámetro se localizan en los extremos angostos y las de metaxilema de mayor diámetro al centro. Son células de paredes lignificadas. Los elementos traqueales presentan forma circular a ovalada angulosa. El diámetro del protoxilema y del metaxilema son variables (Apéndice 2; Figura 4E, F). Se detectaron diferencias en el diámetro mayor de los elementos metaxilematicos (diamame) entre individuos que crecen en diferente sustrato y entre aquellos que crecen en el BTCyJ y BQg (Tabla 2).
En vista longitudinal, los elementos traqueales son alargados fusiformes. Las paredes secundarias del protoxilema muestran un arreglo predominantemente helicoidal y anular, mientras que en los elementos del metaxilema son comunes las escalariformes a reticuladas (Figura 2E). En el material disociado, algunos elementos del metaxilema presentan sus extremos alargados y fusiformes, en ocasiones se aprecian con extremos distales puntiagudos, semejante a la lígula propia de algunos elementos de vaso, con un borde o saliente en su base (Figura 2F, G). En otros elementos proto y metaxilemáticos existe una gradación a lo largo de las paredes terminales, en éstos no se distinguen los extremos semejantes a la lígula descrita (Figura 2H, I). En las paredes longitudinales de los elementos del metaxilema se distinguen varias caras (Figura 2J), así como punteaduras de la pared secundaria, escalariformes y alternas a lo largo de una sola cara en un mismo elemento. La longitud promedio de estos elementos traqueales varía entre 834.6 µm y 1,808.11 µm (Apéndice 2). Se encontraron diferencias significativas en la longitud de los elementos traqueales con la forma de crecimiento, siendo más cortos en los individuos arrosetados (Tabla 2).
Microestructura de los elementos traqueales. A través de MEB, se observaron los elementos traqueales, así como el arreglo de las paredes secundarias de los mismos y las MPs. Los elementos traqueales presentan caras en sus paredes longitudinales (Figura 3A); con paredes secundarias escalariformes y anulares (Figura 3A, B). En algunos elementos traqueales, el arreglo escalariforme presenta una interrupción de la punteadura, debido a que la pared secundaria forma un puente con la punteadura siguiente (Figura 3C). Entre algunas punteaduras escalariformes se llegan a apreciar MPs, sin porosidad aparente (Figura 3E, F); es posible que se necesite mayor nivel de resolución para más detalle. En algunos casos se logró observar el extremo de ciertos elementos traqueales, en donde se aprecian las barras sin MPs o con éstas parcialmente hidrolizadas, por lo que corresponden a placas de perforación escalariformes (Figura 3D).
Ultraestructura del estele. El uso de la microscopia de transmisión (MET), permitió reconocer caracteres de las diferentes células que componen a la endodermis, el periciclo y los tejidos de conducción; además de mostrar detalles de las MPs de los elementos traqueales en el tallo aéreo. Las células del periciclo contienen almidones y en algunas trabéculas existen pequeños engrosamientos que corresponden a la banda de Caspari (Figura 4A). En el cilindro vascular el perímetro externo de la zona definida como periciclo, muestra una capa de tipo cuticular con ramificaciones electrodensas incluidas en dicha capa (Figura 4B, B’). En el floema, las células cribosas pueden presentar retículo endoplásmico en lisis o atrofiado, así como un núcleo replegado hacia la pared celular (Figura 4C, D). Adyacente al floema se presenta un anillo de células parenquimáticas con numerosas vacuolas, cloroplastos y almidones que rodean al xilema. Las punteaduras traqueida-traqueida del proto y metaxilema se muestran en la Figura 4E, F, G, H. En el protoxilema la MP es compacta y electrodensa, con apariencia granulosa (Figura 4G), con un grosor promedio entre los individuos de 179 ± 0.029 nm y 460 ± 0.18 nm. En contraste, en el metaxilema la MP es menos electrodensa y pequeños puntos se arreglan laxamente; su grosor varía entre 192 ± 0.15 nm y 467 ± 0.59 nm (Figura 4H; Apéndice 2). Solamente se detectaron diferencias significativas para grosor de la MP en protoxilema con respecto al sustrato donde se desarrollan los individuos (Tabla 2).
Discusión
Los individuos estudiados de Selaginella pallescens presentan dos formas de crecimiento, arrosetada y erecta, no relacionadas con el sustrato ni con el tipo de vegetación donde se desarrollan. Anatómicamente existen diferencias en la proporción de esclerénquima del córtex y son evidentes los contrastes en los caracteres cuantitativos y/o cualitativos de las MPs entre protoxilema y metaxilema entre individuos.
Morfología. En este estudio se reconocen las dos formas de crecimiento para Selaginella pallescens ya descritas por otros autores (Gregory & Ribas 1979, Weststrand & Korall 2016b). Gregory & Ribas (1979) señalan que la forma de roseta es propia de sitios secos, mientras que en sitios húmedos y sombreados, las ramas son erectas y más largas. En este estudio, se observa que el hábito cespitoso erecto con rizomas multidireccionales está asociado con los sitios cálidos estacionales de bosque tropical caducifolio (btc), mientras que el cespitoso roseticaule con rizomas centrípetos, se encuentra preferentemente en los sitios donde puede existir una humedad elevada más constante a lo largo del año y heladas invernales. La forma de crecimiento parece no tener correspondencia con las observaciones de Gregory & Ribas (1979), ya que ellos encuentran la forma compacta en sitios semiáridos y la forma laxa en sitios húmedos y sombreados. Por otro lado, el tipo de sustrato tampoco influye en la forma de crecimiento de S. pallescens, pues formas arrosetadas o erectas suelen crecer sobre tierra, sobre rocas o entre las fisuras de éstas. Estudios donde se evalúen las características microambientales son necesarios para entender mejor los cambios en la forma de crecimiento de esta especie.
Anatomía. Anatómicamente, el tallo de S. pallescens muestra el patrón general descrito para otras especies de Selaginella (Gibson 1894, Gifford & Foster 1989). La forma de crecimiento, en roseta o erecta, parece no intervenir en dicho patrón, pues los individuos muestran anatómicamente en todos los casos un arreglo similar. Esto coincide con lo que se observa en otras especies que tienen formas postradas y erectas, como lo reporta Dahlen (1988), quien describe la anatomía de 11 especies asiáticas de Selaginella.
Epidermis con cutícula y ausencia de estomas se han reportado en diferentes especies de Selaginella (Gibson 1894, Bold 1973, Dahlen 1988, Maideen et al. 2013). Sin embargo, en este estudio, observamos que las paredes de las células epidérmicas se tiñen rojas con la safranina, con la misma intensidad y tonalidad que las del esclerénquima y xilema, por lo que inferimos que la composición química entre todas ellas es parecida. Células epidérmicas con las paredes engrosadas y lignificadas se han observado en hojas de otros grupos taxonómicos como las gimnospermas (Lukjanova & Mandre, 2008). Por su parte, Uphof (1920) reporta paredes secundarias en las células epidérmicas de S. rupestris (L.) Spring y S. sanguinolenta (L.) Spring; en otras especies sólo se describen a las células epidérmicas con lúmenes pequeños y paredes gruesas (Gibson 1894, Dahlen 1988, Maideen et al. 2013).
A diferencia de las características epidérmicas, el córtex puede mostrar cierta diversidad en su estructura, que lleva a interpretaciones diversas (Gibson 1894, Wan & Wang 2008). Inicialmente, Gibson (1894) y Uphof (1920) mencionan la presencia de una hipodermis que puede estar formada de varias capas de células de esclerénquima. Sin embargo, Dahlen (1988) hace alusión a la presencia de colénquima en esta zona más externa del córtex. En este trabajo dicha zona se reconoce como la más externa y lignificada del córtex, que corresponde a esclerénquima constituido por fibras. Lo que es evidente en Selaginella pallescens, es que la cantidad de esclerénquima en el córtex varía significativamente entre individuos y dicha proporción se modifica de manera inversa al parénquima; es decir, conforme aumenta el esclerénquima, el parénquima (la segunda zona más interna del córtex) disminuye. Las diferencias en la proporción de esclerénquima observada en S. pallescens, abarca la variación reconocida en el género (Gibson 1894, Uphof 1920, DeVol 1967, Maideen et al. 2013). Sin embargo, en este estudio dicha diferencia se asocia con el tipo de vegetación, pues los individuos que se desarrollan en BR y BTC son los que muestran mayor área de esclerénquima; debido a que presentan los mayores diámetros en sus tallos.
La parte más interna del córtex se encuentra unida al periciclo por medio de las trabéculas y en diferentes especies del género éstas establecen puentes, alargándose radialmente (Wan & Wang 2008). A pesar de que en S. pallescens las trabéculas también se organizan de manera laxa, existen diferencias notables en su forma y disposición con respecto a otras especies, pues son redondeadas a ovaladas y ocupan casi todo el espacio aéreo sin formar puentes. Diferentes autores les han atribuido a las trabéculas la función conductora y de soporte (Gibson 1894), mientras que Stewart & Rotwell (1993) le atribuyen al espacio trabecular un papel en el transporte de gas; por lo que se podría interpretar como un aerénquima. Esta última hipótesis estaría de acuerdo con grupos adaptados a medios húmedos que han desarrollado aerénquimas tal como los equisetales y otras plantas superiores paludícolas. Green (2010) indica que esta zona trabecular tiene su símil en el córtex del eje de licopodiopsidas arborescentes extintas como Lepidodendron, de hábitat palúdico. De acuerdo con Bower (1893) y Gibson (1894), el desarrollo trabecular en Selaginella es un ejemplo especializado y más definido de ese desarrollo lagunar que aparece en formas y posiciones diversas en los tejidos corticales de Selaginella y de Lepidostrobus. La observación en este estudio y otros (Barclay 1931) de que algunas de las células trabeculares presentan bandas de Caspari, permiten suponer que tanto el espacio como las células pertenecen a la endodermis; así como el papel fisiológico reconocido en general para la endodermis; es decir, como un tejido que regula el paso de solutos entre el córtex y el cilindro central (Barberon 2017). En cuanto a la ontogenia de este espacio cortico-estelar, se dice que se debe a un crecimiento diferencial entre la longitud del paquete vascular central, la longitud y diámetro del cilindro cortical y las células madre endodérmicas (Barclay 1931); eso es lo que ocasionaría el alargamiento de las células trabeculares. Falta entender la modificación y estructura de este tejido en Selaginella y pensamos que aún no se ha explicado bajo un contexto funcional ecofisiológico.
El estele en Selaginella pallescens muestra el patrón monoestélico de simetría dorsiventral descrito para la mayoría de las especies de Selaginella; principalmente las heterofilicas (Gibson 1894) y especialmente para el subgénero Stachygynandrum (Weststrand & Korall 2016a). Este patrón ocurre independientemente de las distintas formas de crecimiento descritas, tal como Dahlen (1988) lo confirmó en otras especies con la misma variación en el hábito. Generalmente en la literatura se usa el término de “banda” para describir la forma del estele en vista transversal (Gibson 1894, Maideen et al. 2013); sin embargo, de acuerdo con la IAPT (1962), en este estudio la forma del estele se describe como una “elipse angosta”. En un acercamiento hacia las partes que conforman el estele de S. pallescens, las células del periciclo se observan altamente vacuolarizadas y presentan gránulos de almidón. Además, dicho estrato celular forma una capa externa de tipo cuticular con ramificaciones internas, tal como se ha mencionado para otras especies del género (Gibson 1894, McLean & Juniper 1979). No obstante, en el periciclo no observamos cloroplastos, como se reporta en otros trabajos, de los cuales sólo se tiene registro para Selaginella hasta los años 70 (Barclay 1931, Gibson 1894, McLean & Juniper 1979).
De acuerdo a Gifford & Foster (1989), las capas celulares que se encuentran entre el periciclo y el xilema en Selaginella, corresponden al parénquima-floema y consiste de células cribosas y parénquima; esta presentación es común en el género (Gibson 1894) y así se presentan en S. pallescens. Con respecto a la zona floemática, estudios detallados sobre la ontogenia y estructura de las células cribosas muestran diferencias entre plantas vasculares sin semilla. Para el caso del núcleo, remanentes de éste se observan en células cribosas de S. pallescens, como lo describe Evert (1990) para S. kraussiana. Ese autor detalla la degeneración nuclear en diferentes especies de pteridobiontes y menciona que dicho proceso difiere notablemente entre grupos de especies. Para el caso de S. pallescens se observan similitudes morfológicas del núcleo con S. kraussiana. Estudios de las características de las células cribosas en este grupo de plantas, pueden robustecer la separación filogenética entre los licopodiofitos y los helechos (Pryer et al. 2001, Smith et al. 2006). El estrato celular de floema forma un anillo, que puede o no estar interrumpido a nivel de los polos del protoestele (en el área del protoxilema). Esta característica es reportada por Gibson (1894), quien describe una ligera interrupción de la continuidad del floema en otras selaginelas, salvo en S. spinosa P. Beauv. (de tallo rastrero). El xilema es exarco en desarrollo y, de acuerdo con Gifford & Foster (1989), tienen más de un polo protoxilemático; dos antagónicos se observaron en Selaginella pallescens, pues el protoxilema aparece en ambos polos de la elipse en todos los individuos.
Se observó que los elementos traqueales corresponden a elementos de vaso y traqueidas (dimorfismo). Dicho dimorfismo se describió por primera vez en el helecho acuático Ceratopteris thalictroides (L.) Brongn. (Schneider & Carlquist 2000a). En tallos aéreos de Selaginella pallescens éste es el primer reporte de dimorfismo; pues Schneider & Carlquist (2000b) no observan verdaderas placas de perforación en los elementos traqueales en el rizoma de esta especie. En general, Carlquist & Schneider (2007) mencionan que cuando existe un 50 % de hidrólisis en las MPs de las paredes terminales de elementos traqueales, podría resultar en la formación de vasos. Esto refuerza nuestra interpretación sobre la presencia de vasos en S. pallescens, además de las lígulas, que se asemejan a los elementos de vaso de las dicotiledóneas. En este trabajo se aprecia que la mayor proporción de las células de xilema corresponden a lo que comúnmente se denomina traqueidas. Éstas tienen una amplia variación en longitud, pues llegan a medir de 276 µm hasta 18 veces más ese valor (5,125 µm). Esta variación incluye a todos los elementos tanto de protoxilema como de metaxilema pues no se hizo distinción entre traqueidas y elementos de vaso; sin embargo, dicho intervalo resulta muy amplio respecto a lo que se ha reportado en helechos; por ejemplo, Luján-Luna et al. (2015) han registrado longitudes de elementos xilemáticos entre 880-1,050 en raíces y entre 1,047-2,180 µm en rizomas. En un espécimen del devónico inferior de Röragen, Noruega, la longitud de las traqueidas fue de 650 μm la cual representa el valor mínimo de la longitud máxima de una traqueida en ese fósil (Edwards et al. 2006). Los resultados mostraron que, a pesar de la amplia variación, la longitud de los elementos traqueales es mayor en los individuos con forma de crecimiento erecta, ya que sus tallos aéreos alcanzan más tamaño que aquellos de los individuos arrosetados. Esto refleja una relación alométrica, como se ha comprobado en diversos grupos de plantas (Bailey & Tupper 1918, Vázquez-Sánchez & Terrazas 2011). Una posible explicación funcional es que los elementos traqueales largos en los tallos erectos pueden contribuir a que éstos sean flexibles y regresen a su posición original (Bailey 1953); además, un aumento en la longitud del conducto reduce la resistencia de fricción a la conductividad del agua (Pittermann et al. 2011). Con respecto al diámetro mayor de los elementos metaxilemáticos (diamame), el valor más alto se presenta en los individuos que crecen sobre roca y a su vez son los que predominan en el BTCyJ. Aparentemente éstos serían los más vulnerables a la cavitación; sin embargo, crecen en las fisuras de las rocas, donde la concentración de humedad se puede mantener aún en condiciones de sequía.
Las características cualitativas de la MP, fueron diferentes entre el proto y metaxilema, siendo más electrodensas y granulosas en las MPs del protoxilema. Esta diferencia en electrodensidad también fue registrada por Li et al. (2016) en ramas de algunas angiospermas. Esos autores, observaron en Liriodendron tulipifera L. que las MPs son electrodensas en elementos de vaso inmaduros; pero después de la autolisis celular dichas membranas llegan a ser más electrotransparentes. De acuerdo con Schmitz et al.,(2007) el contraste de electrodensidad entre las MPs, podría deberse a diferencias en la composición química.
Respecto al grosor de la MP en Selaginella pallescens, pueden o no presentarse diferencias entre los elementos de protoxilema y metaxilema (Apéndice 2); pero cuando éstas existen se observa que las MPs son más delgadas en el metaxilema. La variación de este último carácter, la observaron Li et al. (2016) en angiospermas y Luján-Luna et al. (2015) en el rizoma de Blechnum yungense Ramos Giacosa; aunque estos últimos no dejan claro si es proto o metaxilema, le atribuyen la variación a la etapa de desarrollo de la MP. Para el caso de Liriodendron tulipifera, Li et al. (2016) mencionan que el grosor no cambia considerablemente en las MPs de vasos en desarrollo versus los maduros, pero sí son diferencialmente más delgadas entre células formadas en años consecutivos. Funcionalmente, de acuerdo con algunos trabajos (Jansen et al. 2009, Brodersen et al. 2014) las MPs gruesas evitan los embolismos en mayor medida que las MPs delgadas; tanto en angiospermas como en helechos. Jansen et al. (2009) mencionan que el grosor de la MP tiene un papel importante en la resistencia a la formación de burbujas; por lo tanto, inferimos que las diferencias en el grosor de la MP del protoxilema relacionadas al tipo de sustrato, pueden deberse a que estos elementos traqueales necesitan mayor protección para evitar embolismos cuando se desarrollan en tierra debido a que quedan más expuestos a las condiciones de sequía respecto a los individuos desarrollados en fisuras de rocas. Además de que el protoxilema sigue siendo funcional ya que su diámetro no se ve modificado. Futuros estudios sobre la longevidad de los elementos del protoxilema son necesarios para entender su contribución a la hidráulica de este grupo de plantas.
Con este trabajo concluimos que Selaginella pallescens, representante de un linaje antiguo y terminal, tiene plasticidad fenotípica en su crecimiento, así como variación en los tejidos de los tallos aéreos, principalmente en el córtex y en el tejido vascular; ello seguramente como respuesta adaptativa al ocupar diferentes ambientes, aunque deberá evaluarse a nivel microambiental. La organización de la zona trabecular y la ultraestructura del protoestele muestra variantes con respecto a otros licopodiofitos; además, los hallazgos de las características de las células cribosas apoyan la separación taxonómica entre este grupo (licopodios) y los helechos, con quienes solo comparten el tipo de ciclo biológico. La presencia de elementos de vaso y traqueidas en el tallo aéreo de Selaginella pallescens, así como las diferencias en las MPs entre protoxilema y metaxilema son observaciones que interpretamos a la luz de la seguridad en la conducción hidráulica de esta especie.











 nueva página del texto (beta)
nueva página del texto (beta)


