Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista bio ciencias
versión On-line ISSN 2007-3380
Revista bio ciencias vol.7 Tepic 2020 Epub 24-Jul-2020
https://doi.org/10.15741/revbio.07.e698
Artículos Originales
Uso de filtración por membrana para la recuperación de Campylobacter de muestras de pollo crudo provenientes de supermercados locales en Culiacán, Sinaloa, México
1 Facultad de Ciencias Químico Biológicas, Universidad Autónoma de Sinaloa, Ciudad Universitaria S/N, Ciudad Universitaria, C.P.80040, Culiacán, México.
2 United States Department of Agriculture/Agricultural Research Service, Western Regional Research Center, Produce Safety and Microbiology Research Unit, Albany, CA 94710 USA.
Campylobacter jejuni y Campylobacter coli son responsables del mayor número de gastroenteritis humana a nivel mundial, y el consumo de carne de pollo crudo y poco cocido contribuye al mayor número de infecciones humanas. El objetivo del presente estudio fue determinar la presencia de C. jejuni y C. coli en pollos crudos provenientes de supermercados locales en el Municipio de Culiacán, Sinaloa, México. Para incrementar la recuperación de Campylobacter, se utilizó el líquido contenido en el paquete de pollo crudo y se sometió a filtración por membrana seguido de enriquecimiento durante toda la noche en condiciones microaerófilas. La presencia de C. jejuni y C. coli se determinó mediante la amplificación por PCR del gen lpxA. Colonias presuntivas de Campylobacter fueron aisladas del 43 % (13/30) de las muestras analizadas, las cuales fueron adquiridas del 64 % (7/11) de los supermercados seleccionados. Los estudios de genotipificación detectaron C. jejuni en el 33.3 % (10/30) de las muestras. Este estudio identificó por primera vez la presencia de C. jejuni en pollo crudo en el Noroeste de México y proporcionó información valiosa para el monitoreo de Campylobacter en muestras de carnes.
Palabras clave: Campylobacter jejuni; Campylobacter coli; aves de corral; patógenos trasmitidos por alimentos; seguridad alimentaria
Campylobacter jejuni and Campylobacter coli are responsible for human gastroenteritis worldwide, and the consumption of raw and undercooked poultry contributes to human infections. The present study examined the presence of C. jejuni and C. coli from retail chicken carcasses, purchased from local markets in the Culiacan Municipality in Sinaloa, Mexico. To improve the recovery of Campylobacter, the package liquid from the raw chicken carcasses was subjected to membrane filtration after an overnight enrichment under microaerophilic conditions. The presence of C. jejuni and C. coli was further determined by PCR amplification of the lpxA gene. Presumptive Campylobacter colonies were recovered from 43 % (13/30) of the chicken carcasses purchased from 64 % (7/11) of the retail markets examined. Genotyping assays detected C. jejuni in 33.3 % (10/30) of the carcasses examined. This study identified for the first time C. jejuni in raw chicken carcasses in Northwestern Mexico and provided valuable information for monitoring Campylobacter in retail meats.
Key words: Campylobacter jejuni; Campylobacter coli; poultry; foodborne pathogen; food safety
Introducción
Las especies de Campylobacter son responsables del mayor porcentaje de gastroenteritis en todo el mundo y se encuentran en la vía intestinal de los animales domésticos (Silva et al., 2011; Kaakoush et al., 2015; Pintar et al., 2015; Scallan et al., 2015). Las especies aisladas y reportadas con mayor frecuencia en humanos con gastroenteritis son Campylobacter jejuni y Campylobacter coli (Silva et al., 2011; Noormohamed & Fakhr, 2013; Kaakoush et al., 2015). La capacidad de ambas especies para colonizar y sobrevivir en una amplia variedad de especies y hábitats animales dificulta el control de estos patógenos transmitidos por alimentos (Epps et al., 2013). Una gran parte de las infecciones por Campylobacter se ha atribuido al consumo de aves de corral contaminadas, crudas o poco cocidas, leche no pasteurizada o productos lácteos, agua no tratada, así como el contacto directo con animales de granja (Smole Možina & Uzunović-Kamberović, 2005; Domingues et al., 2012; Pintar et al., 2015). Además, las malas prácticas durante el manejo, la cocción o el almacenamiento posterior a la cocción de productos cárnicos de aves de corral pueden contribuir a la campilobacteriosis. C. jejuni y C. coli pueden desarrollar campilobacteriosis, una infección caracterizada por diarrea, calambres, dolor abdominal y fiebre. La diarrea puede ser sanguinolenta y puede ir acompañada de náuseas y vómitos (Domingues et al., 2012; CDC (Centers for Disease Control & Prevention), 2015; Kaakoush et al., 2015; Skarp et al., 2016). La infección generalmente dura aproximadamente una semana. En casos severos de infecciones por C. jejuni, algunas personas pueden desarrollar neuropatías autoinmunes, síndromes de Guillain-Barré o Miller Fischer, y en algunos casos artritis reactiva (Epps et al., 2013; Kaakoush et al., 2015; Skarp et al., 2016).
Se ha documentado la importancia de algunos mecanismos de virulencia implicados en conferir a Campylobacter la capacidad de causar enfermedades en humanos. En particular, la motilidad mediada por flagelos, la adherencia bacteriana a la mucosa intestinal y la capacidad de producir toxinas han sido identificados como fenotipos clínicamente relevantes (van Vliet et al., 2001; Dasti et al., 2010; Silva et al., 2011). Los genes que codifican la toxina distendida de flagelina y citoletal se consideran los principales factores determinantes en la virulencia y toxicidad que contribuye a la campilobacteriosis (van Vliet et al., 2001; Poly & Guerry, 2008; Silva et al., 2011).
La carne de pollo es un alimento nutritivo y saludable, ya que es una excelente fuente de proteínas, vitaminas y minerales, y también es baja en grasas y colesterol en comparación con otras carnes (Skarp et al., 2016). En México, la popularidad de la carne de pollo se debe a razones sensoriales y dietéticas, así como a consideraciones económicas. El pollo sigue siendo una de las proteínas animales preferidas y más accesibles en México por la población de bajos y medianos ingresos (Hernández & Parrish, 2017). Entre los principales estados productores de pollo en el Norte y Centro de México, el sector avícola ha aumentado significativamente en las últimas décadas y se espera que continúe creciendo (Salazar et al., 2005; Hernández & Parrish, 2017). Este aumento en el consumo de productos avícolas ha contribuido con un aumento en las enfermedades transmitidas por los alimentos en humanos (Corry & Atabay, 2001; Hussain et al., 2007; Zaidi et al., 2012; Miri et al., 2014).
Un número limitado de estudios publicados determinó la presencia de Campylobacter spp. en carne cruda de aves de corral en México. En particular, un estudio realizado en Guadalajara, en el Centro de México, demostró que el 33 % de los muslos de pollo crudos resultaron positivos para Campylobacter spp., y los análisis de genotipificación confirmaron que el 50 % de los aislamientos fueron C. coli (Castillo-Ayala et al., 1993). La encuesta más extensa en determinar la presencia de Campylobacter spp. en muestras de mercados municipales y carnicerías de varias ciudades de México, demostró la presencia de este patógeno alimentario en el 58.3 % de la carne de pollo cruda y en el 93.6 % de las muestras de intestino de pollo, lo que indica un porcentaje más alto en comparación con otros carnes, como carne de cerdo o de res (Zaidi et al., 2012). Recientemente, Campylobacter spp. se detectó en el 74 % y el 89 % de pollo fresco y congelado al por menor, respectivamente, los cuales fueron adquiridos en mercados locales en el estado de Durango, Norte de México (Rodríguez Ceniceros et al., 2016).
Para aumentar la eficiencia en el aislamiento y la detección de Campylobacter en alimentos y/o muestras ambientales, las metodologías han empleado una variedad de medios de enriquecimiento adicionados con antibióticos para disminuir la flora microbiana presente en la muestra y promover el crecimiento y aislamiento de Campylobacter cuando están presentes en cantidades bajas (Man, 2011; Kaakoush et al., 2015). Tomando en cuenta la movilidad de las campilobacterias, los protocolos de filtración por membrana han demostrado ser eficientes en la recuperación de las campilobacterias provenientes de muestras clínicas, ambientales y de alimentos (Lastovica & Le Roux, 2000; Quiñones et al., 2007; Speegle et al., 2009; Miller et al., 2014; Miller et al., 2017).
Dado que el consumo de carne de aves de corral y sus productos procesados son de importancia para la salud pública, el objetivo del presente estudio fue identificar la presencia de C. jejuni y C. coli en carne de pollo que se vende en los mercados minoristas en el municipio de Culiacán, Sinaloa, uno de los estados con una importante industria en la producción de pollo en México (Hernández & Parrish, 2017). Para lograr este objetivo, se empleó el método de filtración por membrana para incrementar la eficiencia en la recuperación de Campylobacter spp. a partir de muestras de alimentos. Actualmente, hay información muy limitada sobre los niveles de C. jejuni y C. coli en los productos de carne de pollo que se venden en los mercados minoristas de esta región en el Noroeste de México; por lo tanto, los resultados de este estudio ayudarán en el desarrollo de medidas de vigilancia para mejorar la seguridad y calidad de los alimentos entre los consumidores de esta región agrícola en Sinaloa, México.
Material y Métodos
Toma de muestra
Un total de treinta muestras de pollo crudo se adquirieron de once mercados minoristas diferentes en la parte central de la ciudad de Culiacán, en el estado de Sinaloa, Noroeste de México, entre Febrero y Abril del 2016 (Figura 1). Los mercados minoristas venden pollo crudo procesados por uno de los mayores distribuidores de carne de pollo en el estado de Sinaloa. Después de la compra, las muestras de pollo crudo se transportaron inmediatamente a los laboratorios de la Universidad Autónoma de Sinaloa, México, para los análisis microbiológicos y las muestras se mantuvieron a 4 °C hasta su procesamiento dentro de un lapso de 24 h.
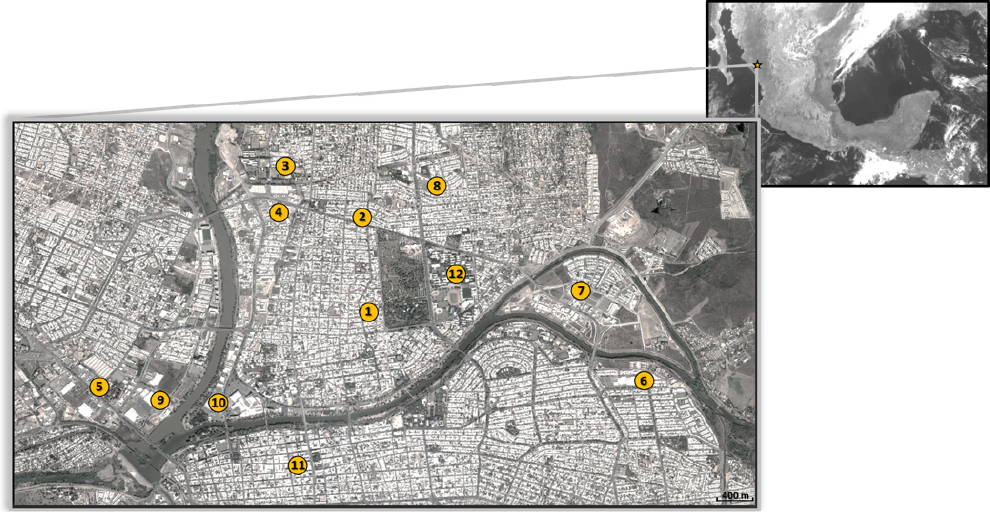
Las muestras de pollo crudo se compraron en once mercados de alimentos (círculos amarillos con números del 1 al 11), representativos de los principales minoristas de carne de pollo crudo en la parte Norte de la ciudad de Culiacán. Las muestras de carne de pollo crudo fueron transportados inmediatamente a los laboratorios para investigación microbiológica en la Universidad Autónoma de Sinaloa (círculo amarillo número 12) para su posterior procesamiento como se describe en Materiales y Métodos. La barra de escala corresponde a 400 metros.
Figura 1 Ubicación de los mercados minoristas muestreados en Culiacán, Sinaloa, México.
Análisis microbiológico
Antes de abrir la envoltura de plástico exterior de las muestras de pollo crudo, ésta se desinfectó con una solución de etanol al 70 %. El líquido del paquete de cada muestra se recuperó y se mantuvo a 4 °C durante 30 min, y se añadieron 5 mL del líquido del paquete a 45 mL de caldo basal anaeróbico Oxoid™ [(Thermo Fisher Scientific, Waltham, MA, USA), con el suplemento Oxoid™ CAT] cefoperazona (8 µg/ml), teicoplanina (4 µg/mL), anfotericina B (10 µg/mL); Thermo Fisher Scientific] en un matraz de cultivo celular estéril con una tapa ventilada de 0.2 µm. El matraz se incubó a 42 °C durante 24 h con agitación suave (30 rpm) en condiciones microaerofílicas generadas con el sistema de bolsas GasPak™ EZ Campy (Becton, Dickinson and Company, Franklin Lakes, NJ, USA). Posteriormente, se empleó el método de filtración por membrana para incrementar la recuperación de los aislamientos bacterianos del caldo de enriquecimiento (Quiñones et al., 2007; Lastovica & Le Roux, 2000). Se añadió una muestra de 250 µL de caldo de enriquecimiento en pequeñas gotas sobre un filtro de membrana de éster de celulosa mixta estéril Whatman® de 0.65 µm (Millipore Corporation, Billerica, MA, USA) la cual se colocó en la superficie de las placas de agar basal anaeróbico Oxoid™ (ABA) (Thermo Fisher Scientific) con el suplemento Oxoid™ CAT (Thermo Fisher Scientific) y 5 % de sangre de caballo. Las muestras se filtraron pasivamente durante 30 min. a temperatura ambiente en una campana de flujo laminar. Posteriormente, los filtros se retiraron cuidadosamente, y las placas de ABA se incubaron durante 48 h a 42 °C en condiciones microaerófilas. Se seleccionaron los aislamientos presuntivos de Campylobacter, tomando en cuenta la morfología de una colonias típica (colonias de color naranja pálido en placas ABA), se almacenaron utilizando microbank™ (Pro-Lab Diagnostics, Round Rock, TX, USA) y se preservaron a -80 °C. Las células de cada colonia se visualizaron adicionalmente con un microscopio binocular LABOMED CXL (Labo America Inc., Fremont, CA, USA) para examinar la morfología en espiral típica de células individuales de Campylobacter spp., como se ha reportado en estudios previos (Quiñones et al., 2007).
Identificación de especies de Campylobacter
Los aislamientos de Campylobacter se colocaron en placas de agar basal anaeróbico Oxoid™ (Thermo Fisher Scientific) a 42 °C durante 48 h y se incubaron en condiciones microaerófilas utilizando el sistema de bolsa GasPak™ EZ Campy (Becton, Dickinson and Company). El DNA molde de cada aislado se preparó a partir de lisados crudos después de resuspender las células de Campylobacter de las placas ABA en 100 µL de agua grado biológico molecular HyPure™ (HyClone Laboratories, Inc., Logan, UT, USA) con una incubación adicional de 95 °C durante 20 min (Amézquita-López et al., 2014). Los lisados se centrifugaron a 2000 × g durante 5 min y los sobrenadantes se recolectaron. Los lisados crudos se almacenaron a -20 °C hasta su posterior uso como molde para la amplificación por PCR.
Se realizó un ensayo de PCR múltiple para la identificación simultánea de especies de Campylobacter basado en la amplificación del gen lpxA, que codifica la enzima LpxA, una UDP-N-acetilglucosamina aciltransferasa (Klena et al., 2004). Todos los oligonucleótidos se compraron de Eurofins Genomics (Huntsville, AL, USA). La amplificación por PCR múltiple consistió en una mezcla de reacción de 50 µL, cada una con 50 ng de DNA genómico (5 µL de lisado crudo), 10 pmol/µL de cada cebador directo (lpxAC. Jejuni) 5’-ACAACTTGGTGACGATGTTGTA-3’, (lpxAC. coli) 5’-AGACAAATAAGAGAGAATCAG-3’, 30 pmol/µL del cebador inverso (lpxARRK2m) 5’-CAATCATGDGCDATATGASAATAHGCCAT-3’ y 22.5 µL de 2× GoTaq® Green Master Mix (Promega Corporation, Madison, WI, USA). Las mezclas de reacción se colocaron en un termociclador Eppendorf 5331 (Eppendorf Latin America, São Paulo, Brasil) utilizando las siguientes condiciones de PCR: 94 °C durante 1 min, 50 °C durante 1 min y 72 °C durante 1 min, seguido de un tiempo de extensión final de 5 min a 72 °C (30 ciclos en total). Los productos amplificados se analizaron en geles de agarosa al 2 % que contenían una tinción de ácido nucleico GelRed de 0.04 μL/mL (Phenix Research, Candler, NC, USA). Como controles positivos para el ensayo de PCR, se utilizaron la cepa C. jejuni RM3145 (HB93-13) y la cepa C. coli RM4661 (Nachamkin et al., 2001; Zautner et al., 2015). Las muestras positivas se analizaron en función de los tamaños esperados de los fragmentos amplificados de lpxA, que correspondían a 330 pb para C. jejuni y 390 pb para C. coli, como se describe en estudios anteriores (Klena et al., 2004; Quiñones et al., 2007).
Análisis estádistico
Se realizó un análisis descriptivo para determinar la presencia de Campylobacter spp., en muestras de pollos enteros crudo de las distintas ubicaciones de muestreo, utilizando Microsoft Excel con el complemento de análisis Toolpak (Office 365, Version 1808; Microsoft Corporation, Redmond, WA, USA).
Resultados y Discusión
El objetivo del presente estudio fue determinar la presencia de Campylobacter spp. de muestras de pollo crudo en Culiacán, Sinaloa, una importante región agrícola en el Noroeste de México. Se tomaron muestras de pollo entero crudo de los mercados minoristas en once sitios de muestreo en la parte central de la ciudad de Culiacán (Figura 1). Los mercados minoristas seleccionados para el presente estudio venden pollo crudo, los cuales son procesados por grandes distribuidores de carne de pollo en el estado de Sinaloa. Durante los tres meses del muestreo (Febrero a Abril de 2016), se emplearon metodologías de enriquecimiento selectivo y filtración por membrana para recuperar eficazmente Campylobacter spp. de un total de 30 muestras de pollo crudo compradas de 11 mercados minoristas.
Los resultados indicaron la presencia de colonias presuntivas de Campylobacter spp. en el 43 % (13/30) de las muestras analizadas después de realizar la filtración por membrana y la siembra en medios de cultivos selectivos, y las muestras positivas para Campylobacter fueron identificadas en el 64 % (7/11) de los mercados analizados (Tabla 1). Un análisis posterior por microscopía de contraste de fase de las colonias recuperadas reveló una morfología de célula única de sacacorchos en espiral (datos no mostrados), lo cual es típico de las especies de Campylobacter (Quiñones et al., 2007). Las colonias presuntivas de Campylobacter spp. fueron analizadas por genotipificación por PCR amplificando la región específica del gen lpxA, y el análisis mostró que el 33.3 % (10/30) de las muestras de pollo dieron positivo para C. jejuni (Tabla 1). De los aislamientos presuntivos de Campylobacter, un total de 28.7 % (27/94) de las colonias se tipificaron como C. jejuni. No se detectó C. coli en ninguna de las muestras de pollo examinadas (Tabla 1). Nuestro estudio también mostró que las muestras de pollo del mercado minorista 1 tenían la presencia más alta de C. jejuni con 54.5 % (12/22). Los mercados restantes tenían una prevalencia que oscilaba entre el 8.3 % y el 25 %, y cuatro mercados dieron resultados negativos para la presencia de Campylobacter spp. Curiosamente, el mercado 9 tenía el mayor número de aislados presuntivos; sin embargo, solo el 20.8 % (5/24) de los aislamientos se tipificaron como C. jejuni, lo que sugiere la presencia de otros miembros de la familia Campylobacteraceae en estas muestras.
Tabla 1 Presencia de Campylobacter spp. en muestras de pollo crudo adquiridas en mercados minoristas en Culiacan, Sinaloa, México.
| Retail market (n=11) |
Chicken carcass (n=30) |
No. of presumptive Campylobacter isolates (n=94) |
No. of positive C. jejuni isolates (%) |
No. of positive C. coli isolates (%) |
|---|---|---|---|---|
| 1 | 3 | 22 | 12 (54.5) | ND |
| 2 | 3 | 8 | 2 (25) | ND |
| 3 | 3 | ND† | ND | ND |
| 4 | 3 | 4 | 1 (25) | ND |
| 5 | 2 | ND | ND | ND |
| 6 | 2 | 12 | 3 (25) | ND |
| 7 | 3 | 12 | 3 (25) | ND |
| 8 | 2 | 12 | 1 (8.3) | ND |
| 9 | 4 | 24 | 5 (20.8) | ND |
| 10 | 1 | ND | ND | ND |
| 11 | 4 | ND | ND | ND |
†ND, no detectado.
Campylobacter es una de las principales causas de enfermedades transmitidas por los alimentos en todo el mundo, y se estima una carga global de 166 millones de enfermedades diarreicas (Kaakoush et al., 2015; Devleesschauwer et al., 2016). Dado que las aves de corral son el principal reservorio de Campylobacter termofílicos en la cadena de alimentos (Corry & Atabay, 2001; Kaakoush et al., 2015; Skarp et al., 2016), el presente estudio utilizó un método de filtración por membrana para analizar la presencia de Campylobacter spp. en muestras de pollo crudo de los mercados minoristas locales en la ciudad de Culiacán, Sinaloa, en el Noroeste de México. Sinaloa es conocido como uno de los principales estados productores de pollo en México (Hernández & Parrish, 2017), y se espera que el consumo interno de carne de pollo por parte de los consumidores continúe aumentando, ya que se considera una fuente preferida y accesible de proteína animal (Salazar et al., 2005; Hernández & Parrish, 2017).
Debido a la dificultad para detectar Campylobacter spp. a partir de muestras de alimentos por los altos niveles de flora microbiana presentes, se utilizó el método de filtración por membrana de celulosa, así como el uso de medios de enriquecimiento y medios selectivos para incrementar la eficiencia en el aislamiento de Campylobacter. El método se conoce como el “Cape Town Protocol” CTP (por sus siglas en inglés) e inicialmente se desarrolló para el aislamiento de Campylobacter a partir de muestras de heces humanas (Lastovica & Le Roux, 2000). Diversos estudios han adaptado esta metodología de filtración por membrana para el aislamiento de múltiples miembros de la familia Campylobacteraceae en muestras de pollo crudos, así como en muestras ambientales ( Quiñones et al., 2007; Speegle et al., 2009; Miller et al., 2014; Miller et al., 2017). El presente estudio, utilizó un tamaño de poro de membrana de 0.65 µm, porque se ha demostrado su eficacia en la recuperación de Campylobacter en muestras de líquido de pollo crudo empaquetado (Quiñones et al., 2007; Speegle et al., 2009; Miller et al., 2014; Berrang et al., 2017). Durante el sacrificio de animales, el contenido gastrointestinal de las aves puede contaminar la piel del canal de pollo, lo que resulta en la presencia de Campylobacter en el líquido del paquete (Quiñones et al., 2007; Speegle et al., 2009; Berrang et al., 2017). La manipulación inadecuada de este líquido del paquete de pollo crudo con otros productos frescos o fomites y la contaminación cruzada pueden darse durante la preparación de alimentos, ya sea en los hogares o en los comercios minoristas que sirven alimentos listos para el consumo. Por lo tanto, es importante desarrollar métodos precisos y confiables para evaluar la presencia de Campylobacter en productos alimenticios crudos.
El uso de esta técnica de filtración por membrana en el presente estudio demostró por primera vez la recuperación de aislamientos de C. jejuni en 33.3 % (10/30) de muestras de pollo crudo de 64 % de los mercados minoristas examinados en Culiacán, Sinaloa, Noroeste de México. La presencia de C. jejuni en muestras de pollo crudo de los mercados minoristas en Culiacán, México, es similar a lo demostrado en estudios anteriores realizados en diferentes ubicaciones geográficas (Hussain et al., 2007; EFSA (European Food Safety Authority), 2010; Williams et al., 2012; Hungaro et al., 2015; Lopes et al., 2018). Sin embargo, el 36 % de los mercados minoristas examinados no mostraron presencia de Campylobacter spp. Una posible explicación de esta ausencia puede ser debido a la presencia de comunidades microbianas nativas en las muestras de pollo crudo que impeden la recuperación de Campylobacter (Ae Kim et al., 2017). Interesantemente, aislamientos presuntivos de Campylobacter que no eran C. jejuni y/o C. coli se obtuvieron de las muestras de pollo crudo de la mayoría de los mercados examinados en este estudio. Estas observaciones sugieren la presencia de otros miembros de la familia Campylobacteraceae como Arcobacter butzleri, Campylobacter lari, Campylobacter upsaliensis o Campylobacter concisus, los cuales han sido reportado en productos avícolas y se consideran patógenos humanos emergentes (Skovgaard, 2007; Kaakoush & Mitchell, 2012; Ferreira et al., 2016).
La transmisión horizontal de Campylobacter en granjas avícolas representa la ruta más probable de transmisión a los pollos de engorda. Una vez que los pollos han sido colonizados, éstos permanecen colonizados hasta que son sacrificados, y se ha demostrado que la contaminación de carne cruda y la diseminación ocurren en el matadero (Keener et al., 2004). C. jejuni tiene una gran importancia en la salud pública, ya que solo 300 unidades formadoras de colonias pueden causar una infección en humanos (Hara-Kudo & Takatori, 2011), por lo que más estudios enfocados en el desarrollo de nuevas metodologías y en el monitoreo de genes de virulencia de Campylobacter proporcionará información relacionada con la presencia de éste patógeno en muestras ambientales, clínicas y de otros alimentos.
Conclusiones
Las especies de Campylobacter son el principal agente causal de gastroenteritis humana en todo el mundo. En México, un número limitado de estudios ha documentado la presencia de Campylobacter spp., en carne de pollo crudo. Este es el primer informe que documenta el aislamiento de C. jejuni en muestras de pollo crudo en mercados minoristas de Culiacán, Sinaloa. Dado el aumento en el consumo de productos avícolas en México, y la importancia como un problema de salud pública, el desarrollo de metodologías efectivas para detectar Campylobacter en muestras de pollo compradas en los mercados minoristas locales ayudará en el desarrollo de estrategias de control que garanticen un suministro seguro de los alimentos a los consumidores.
Agradecimientos
El material del presente trabajo fue apoyado en parte por la Universidad Autónoma de Sinaloa, el Programa de Fomento y Apoyo a Proyectos de Investigación No. PROFAPI2014/208 y PROFAPI2015/277 y por Servicio de Investigación Agrícola (ARS, por sus siglas en inglés) del Departamento de Agricultura de EE.UU. (USDA), Proyecto CRIS No. 2030-42000-051-00D. Los autores agradecen a Jaszemyn Yambao y Bertram Lee (USDA-ARS, Albany, CA) y a Hilary Arim Beltrán Sauceda y Manuel Castillo Olea (Universidad Autónoma de Sinaloa) por su excelente asistencia técnica, así como al Dr. Cristóbal Chaidez (Laboratorio Nacional para la Investigación en Inocuidad Alimentaria (LANIIA), Centro de Investigación en Alimentación y Desarrollo AC, Culiacán, Sinaloa, México) por permitir el uso de las instalaciones e instrumentos de LANIIA para esta investigación.
REFERENCIAS
Ae Kim, S., Hong Park, S., In Lee, S., Owens, C. M. and Ricke, S. C. (2017). Assessment of chicken carcass microbiome responses during processing in the presence of commercial antimicrobials using a next generation sequencing approach. Scientific Reports, 7. https://doi.org/10.1038/srep43354 [ Links ]
Amézquita-López, B. A., Quiñones, B., Lee, B. G. and Chaidez, C. (2014). Virulence profiling of Shiga toxin-producing Escherichia coli recovered from domestic farm animals in Northwestern Mexico. Frontiers in Cellular and Infection Microbiology, 4: 7. https://doi.org/10.3389/fcimb.2014.00007 [ Links ]
Berrang, M. E., Meinersmann, R. J. and Cox, N. A. (2017). Passage of Campylobacter jejuni and Campylobacter coli subtypes through 0.45- and 0.65-micrometer-pore-size nitrocellulose filters. Journal of Food Protection, 80(12): 2029-2032. https://doi.org/10.4315/0362-028X.JFP-17-211 [ Links ]
Castillo-Ayala, A., Salas-Ubiarco, M. G., Márquez-Padilla, M. L. and Osorio-Hernández, M. D. (1993). Incidence of Campylobacter spp. and Salmonella spp. in raw and roasted chicken in Guadalajara, Mexico. Revista Latinoamericana de Microbiologia, 35(4): 371-375. https://europepmc.org/abstract/med/8066332 [ Links ]
CDC (Centers for Disease Control and Prevention). (2015). Foodborne diseases active surveillance network (FoodNet): FoodNet surveillance report for 2015 (Final report). Atlanta, Georgia: US Department of Health and Human Services, CDC, 2015. [ Links ]
Corry, J. E. L. & Atabay, H. I. (2001). Poultry as a source of Campylobacter and related organisms. Journal of Applied Microbiology Symposium Supplement, 90: 96S-114S. https://doi.org/10.1046/j.1365-2672.2001.01358.x [ Links ]
Dasti, J. I., Tareen, A. M., Lugert, R., Zautner, A. E. and Groß, U. (2010). Campylobacter jejuni: A brief overview on pathogenicity-associated factors and disease-mediating mechanisms. International Journal of Medical Microbiology, 300(4): 205-211. https://doi.org/10.1016/j.ijmm.2009.07.002 [ Links ]
Devleesschauwer, B., Bouwknegt, M., Mangen, M. J. J. and Havelaar, A. H. (2016). Health and economic burden of Campylobacter. In G. Klein (Ed.), Campylobacter: Features, detection, and prevention of foodborne disease (pp. 27-40). Hannover, Germany: Academic Press. https://doi.org/10.1016/B978-0-12-803623-5.00002-2 [ Links ]
Domingues, A. R., Pires, S. M., Halasa, T. and Hald, T. (2012). Source attribution of human campylobacteriosis using a meta-analysis of case-control studies of sporadic infections. Epidemiology and Infection, 140: 970-981. https://doi.org/10.1017/S0950268811002676 [ Links ]
EFSA (European Food Safety Authority). (2010). Analysis of the baseline survey on the prevalence of Campylobacter in broiler batches and of Campylobacter and Salmonella on broiler carcasses in the EU, 2008. EFSA Journal, 8: 1503. https://doi.org/10.2903/j.efsa.2010.1503 [ Links ]
Epps, S. V. R., Harvey, R. B., Hume, M. E., Phillips, T. D., Anderson, R. C. and Nisbet, D. J. (2013). Foodborne Campylobacter: Infections, metabolism, pathogenesis and reservoirs. International Journal of Environmental Research and Public Health, 10: 6292-6304. https://doi.org/10.3390/ijerph10126292 [ Links ]
Ferreira, S., Queiroz, J. A., Oleastro, M. and Domingues, F. C. (2016). Insights in the pathogenesis and resistance of Arcobacter: A review. Critical Reviews in Microbiology, 42(3): 364-383. https://doi.org/10.3109/1040841X.2014.954523 [ Links ]
Hara-Kudo, Y. & Takatori, K. (2011). Contamination level and ingestion dose of foodborne pathogens associated with infections. Epidemiology and Infection, 139(10): 1505-1510. https://doi.org/10.1017/S095026881000292X [ Links ]
Hernández, G. & Parrish, M. R. (2017). Poultry and eggs are pillars of production. (MX7034). Retrieved from USDA Global Agriculture Information Network: https://gain.fas.usda.gov/Recent%20GAIN%20Publications/Poultry%20and%20Products%20Annual_Mexico%20City_Mexico_9-20-2017.pdf [ Links ]
Hungaro, H. M., Mendonça, R. C. S., Rosa, V. O., Badaró, A. C. L., Moreira, M. A. S. and Chaves, J. B. P. (2015). Low contamination of Campylobacter spp. on chicken carcasses in Minas Gerais state, Brazil: Molecular characterization and antimicrobial resistance. Food Control, 51: 15-22. https://doi.org/10.1016/j.foodcont.2014.11.001 [ Links ]
Hussain, I., Shahid Mahmood, M., Akhtar, M. and Khan, A. (2007). Prevalence of Campylobacter species in meat, milk and other food commodities in Pakistan. Food Microbiology, 24(3): 219-222. https://doi.org/10.1016/j.fm.2006.06.001 [ Links ]
Kaakoush, N. O., Castaño-Rodríguez, N., Mitchell, H. M. and Man, S. M. (2015). Global epidemiology of Campylobacter infection. Clinical Microbiology Reviews, 28: 687-720. https://doi.org/10.1128/CMR.00006-15 [ Links ]
Kaakoush, N. O. & Mitchell, H. M. (2012). Campylobacter concisus - A new player in intestinal disease. Frontiers in Cellular and Infection Microbiology, 2: 4. https://doi.org/10.3389/fcimb.2012.00004 [ Links ]
Keener, K. M., Bashor, P. A., Sheldon, B. W. and Kathariou, S. (2004). Comprehensive review of Campylobacter and poultry processing. Comprehensive Reviews in Food Science and Food Safety, 3: 105-116. https://doi.org/10.1111/j.1541-4337.2004.tb00060.x [ Links ]
Klena, J. D., Parker, C. T., Knibb, K., Claire Ibbitt, J., Devane, P. M. L., Horn, S. T., Miller, W. G. and Konkel, M. E. (2004). Differentiation of Campylobacter coli, Campylobacter jejuni, Campylobacter lari, and Campylobacter upsaliensis by a multiplex PCR developed from the nucleotide sequence of the lipid A gene lpxA. Journal of Clinical Microbiology, 42: 5549-5557. https://doi.org/10.1128/JCM.42.12.5549-5557.2004 [ Links ]
Lastovica, A. J. & Le Roux, E. (2000). Efficient isolation of campylobacteria from stools. Journal of Clinical Microbiology, 38(7): 2798-2799. [ Links ]
Lopes, G. V., Landgraf, M. and Destro, M. T. (2018). Occurrence of Campylobacter in raw chicken and beef from retail outlets in São Paulo, Brazil. Journal of Food Safety, 38(3). https://doi.org/10.1111/jfs.12442 [ Links ]
Man, S. M. (2011). The clinical importance of emerging Campylobacter species. Nature Reviews Gastroenterology and Hepatology, 8: 669-685. https://doi.org/10.1038/nrgastro.2011.191 [ Links ]
Miller, W. G., Yee, E., Chapman, M. H., Smith, T. P. L., Bono, J. L., Huynh, S., Parker, C. T., Vandamme, P., Luong, K. and Korlach, J. (2014). Comparative genomics of the Campylobacter lari group. Genome Biology and Evolution, 6(12): 3252-3266. https://doi.org/10.1093/gbe/evu249 [ Links ]
Miller, W. G., Yee, E., Lopes, B. S., Chapman, M. H., Huynh, S., Bono, J. L., Parker, C. T., Strachan, N. J. C. and Forbes, K. J. (2017). Comparative genomic analysis identifies a Campylobacter clade deficient in selenium metabolism. Genome Biology and Evolution, 9(7): 1843-1858. https://doi.org/10.1093/gbe/evx093 [ Links ]
Miri, A., Rahimi, E., Mirlohi, M., Mahaki, B., Jalali, M. and Safaei, H. G. (2014). Isolation of Shiga toxin-producing Escherichia coli O157:H7/NM from hamburger and chicken nugget. International Journal of Environmental Health Engineering, 3: 19-23. https://doi.org/10.4103/2277-9183.138414 [ Links ]
Nachamkin, I., Engberg, J., Gutacker, M., Meinersman, R. J., Li, C. Y., Arzate, P., Teeple, E., Fussing, V., Ho, T. W., Asbury, A. K., Griffin, J. W., McKhann, G. M. and Piffaretti, J. C. (2001). Molecular population genetic analysis of Campylobacter jejuni HS:19 associated with Guillain-Barré syndrome and gastroenteritis. Journal of Infectious Diseases, 184(2): 221-226. https://doi.org/10.1086/322008 [ Links ]
Noormohamed, A. & Fakhr, M. K. (2013). A higher prevalence rate of Campylobacter in retail beef livers compared to other beef and pork meat cuts. International Journal of Environmental Research and Public Health, 10: 2058-2068. https://doi.org/10.3390/ijerph10052058 [ Links ]
Pintar, K. D. M., Christidis, T., Kate Thomas, M., Anderson, M., Nesbitt, A., Keithlin, J., Marshall, B. and Pollari, F. (2015). A systematic review and meta-analysis of the Campylobacter spp. prevalence and concentration in household pets and petting zoo animals for use in exposure assessments. PLoS ONE, 10(12). https://doi.org/10.1371/journal.pone.0144976 [ Links ]
Poly, F. & Guerry, P. (2008). Pathogenesis of Campylobacter. Current Opinion in Gastroenterology, 24(1): 27-31. https://doi.org/10.1097/MOG.0b013e3282f1dcb1 [ Links ]
Quiñones, B., Parker, C. T., Janda Jr, J. M., Miller, W. G. and Mandrell, R. E. (2007). Detection and genotyping of Arcobacter and Campylobacter isolates from retail chicken samples by use of DNA oligonucleotide arrays. Applied and Environmental Microbiology, 73: 3645-3655. https://doi.org/10.1128/AEM.02984-06 [ Links ]
Rodríguez Ceniceros, R., Gómez Hernández, F. and Vázquez Sandoval, H. (2016). Campylobacter and Salmonella present in poultry on sale at Gómez Palacio Durango, México. Revista Electronica de Veterinaria, 17(6). [ Links ]
Salazar, A., Mohanty, S. and Malaga, J. (2005). 2025 vision for Mexican chicken consumption. International Journal of Poultry Science, 4(5): 292-295. https://doi.org/10.3923/ijps.2005.292.295 [ Links ]
Scallan, E., Hoekstra, R. M., Mahon, B. E., Jones, T. F. and Griffin, P. M. (2015). An assessment of the human health impact of seven leading foodborne pathogens in the United States using disability adjusted life years. Epidemiology and Infection, 143: 2795-2804. https://doi.org/10.1017/S0950268814003185 [ Links ]
Silva, J., Leite, D., Fernandes, M., Mena, C., Gibbs, P. A. and Teixeira, P. (2011). Campylobacter spp. as a foodborne pathogen: A review. Frontiers in Microbiology, 2(SEP). https://doi.org/10.3389/fmicb.2011.00200 [ Links ]
Skarp, C. P. A., Hänninen, M. L. and Rautelin, H. I. K. (2016). Campylobacteriosis: The role of poultry meat. Clinical Microbiology and Infection, 22(2): 103-109. https://doi.org/10.1016/j.cmi.2015.11.019 [ Links ]
Skovgaard, N. (2007). New trends in emerging pathogens. International Journal of Food Microbiology, 120(3): 217-224. https://doi.org/10.1016/j.ijfoodmicro.2007.07.046 [ Links ]
Smole Možina, S. & Uzunović-Kamberović, S. (2005). Camplylobacter spp. as emerging food-borne pathogen - Incidence, detection and resistance. Medicinski Glasnik, 2: 1-15. [ Links ]
Speegle, L., Miller, M. E., Backert, S. and Oyarzabal, O. A. (2009). Use of cellulose filters to isolate Campylobacter spp. from naturally contaminated retail broiler meat. Journal of Food Protection, 72(12): 2592-2596. https://doi.org/10.4315/0362-028X-72.12.2592 [ Links ]
van Vliet, A. H. & Ketley, J. M. (2001). Pathogenesis of enteric Campylobacter infection. Symposium series (Society for Applied Microbiology)(30): 45S-56S. https://doi.org/10.1046/j.1365-2672.2001.01353.x [ Links ]
Williams, A. & Oyarzabal, O. A. (2012). Prevalence of Campylobacter spp. in skinless boneless retail broiler meat from 2005 through 2011 in Alabama, USA. BMC Microbiology, 12. https://doi.org/10.1186/1471-2180-12-184 [ Links ]
Zaidi, M. B., Campos, F. D., Estrada-García, T., Gutierrez, F., León, M., Chim, R. and Calva, J. J. (2012). Burden and transmission of zoonotic foodborne disease in a rural community in Mexico. Clinical Infectious Diseases, 55: 51-60. https://doi.org/10.1093/cid/cis300 [ Links ]
Zautner, A. E., Goldschmidt, A. M., Thürmer, A., Schuldes, J., Bader, O., Lugert, R., Groß, U., Stingl, K., Salinas, G. and Lingner, T. (2015). SMRT sequencing of the Campylobacter coli BfR-CA-9557 genome sequence reveals unique methylation motifs. BMC Genomics, 16(1). https://doi.org/10.1186/s12864-015-2317-3 [ Links ]
Información suplementaria
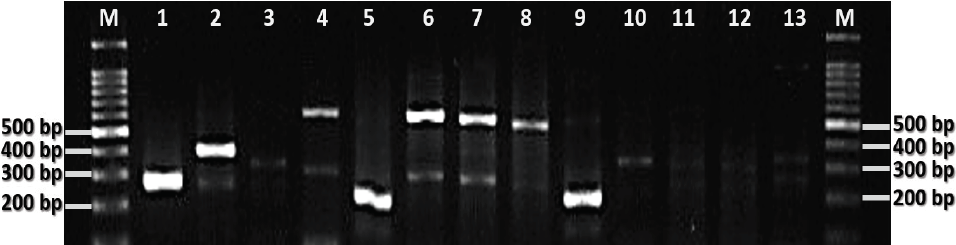
Figura suplementaria 1 Imagen representativa del análisis de PCR múltiple para corroborar la identificación de especies aisladas de Campylobacter recuperadas de muestras de pollo de mercados minoristas. Carriles M, marcador de DNA de 100 pb; carril 1, cepa de control positivo Campylobacter jejuni RM3145 (330 pb); carril 2, cepa de control positivo de Campylobacter coli RM4661 (390 pb); carriles 5 y 9, resultados de PCR positivos representativos para C. jejuni; carriles 3-4, 6-8 y 10-13, resultados de PCR negativos representativos para C. jejuni o C. coli.
Como citar este artículo: Soto Beltrán, M., Quiñones, B., Ibarra Rodríguez, A., Amézquita-López, B. A. (2020) . Use of Membrane Filtration for the Recovery of Campylobacter from Raw Chicken Carcasses Purchased at Retail Markets in Culiacan, Sinaloa, Mexico. Revista Bio Ciencias 7, e698. doi: https://doi.org/10.15741/revbio.07.e698
Recibido: 18 de Noviembre de 2020; Aprobado: 27 de Septiembre de 2019











 texto en
texto en 


