Introducción
La hojarasca foliar es la principal fuente de nutrientes en los suelos forestales y representa 80% del total de los que retornan a ellos (Santa-Regina y Tarrazona, 2001). La deposición de las hojas proporciona cobertura al suelo y favorece el ambiente edáfico; conforme se descomponen se convierten en fuente importante de materia orgánica y activa el ciclo biogeoquímico de los elementos (Gleissman, 2002).
La hojarasca constituye la fuente más importante en el reciclaje de elementos en cualquier ecosistema como el carbono, nitrógeno y fósforo, entre otros (Martín et al., 1996; Santa-Regina y Gallardo, 1989; Triska et al., 1984). Además, actúa como un estrato aislante que protege al suelo de cambios extremos de temperatura y humedad, disminuye la erosión y favorece la infiltración del agua (Aerts, 1997).
Su velocidad de descomposición y los factores que la controlan contribuyen al entendimiento de la fertilidad del suelo y a proponer acciones de manejo acordes a esta. Entre ellas se pueden citar: el clima, los componentes químicos, dureza y grosor de la propia hojarasca, la fauna desintegradora, los microorganismos y las características del suelo más relacionadas con la actividad de los desintegradores, tales como la aireación y el contenido de materia orgánica.
Así, la temperatura y la humedad influyen en la mineralización de la materia orgánica. La precipitación juega un papel importante, particularmente, en las primeras etapas de la desintegración de la hojarasca, debido al lixiviado de sustancias lábiles (Salamanca et al., 2003) e indirectamente en la activación de los microorganismos (Brandt et al., 2007).
Algunos autores plantean que la temperatura explica, en mayor medida que la precipitación, el proceso de descomposición de la hojarasca, ya que su disminución reduce la actividad de los organismos descomponedores (Trofymow et al., 2002), y un cambio en ella puede afectar la composición de la flora activa; y, por lo tanto en los procesos de descomposición (Bertsch, 1995).
En coincidencia, al estudiar la descomposición de la hojarasca en rodales a diferentes altitudes, Shanks y Olson (1961) citan que se redujo 2 % en promedio por cada grado centígrado que disminuyó la temperatura media.
La composición química de la hojarasca determina, también, su velocidad de descomposición. Se distinguen, básicamente, dos fracciones: la soluble, que representa a los componentes más lábiles, como los azúcares y las proteínas que se degradan con rapidez durante las primeras etapas de la descomposición, por el rápido crecimiento de los microorganismos que, en ecosistemas templados, son favorecidos con una alta concentración de carbono y nitrógeno lábiles (Swift et al., 1979). La fracción recalcitrante, de más lenta descomposición, está compuesta por ceras, lípidos, ligninas, carbohidratos lignificados y fenoles (Binkley, 1986)
El índice de lignocelulosa es un indicador de la resistencia de la hojarasca al ataque microbiano (Melillo et al., 1982). El contenido de lignina y el índice de lignina:nutrientes han sido inversamente relacionados con la tasa de descomposición de la hojarasca en el sur del Desierto de Sonora (Martínez-Yrízar et al., 2007). En particular, se ha descrito al eucalipto como una opción líder para el desarrollo de biocombustibles lignocelulósicos sustentables (Healy et al., 2015). Los contenidos de lignina y celulosa varían entre las especies de Eucalyptus, pero de manera general, Prinsen (2010) cita valores de 26.91 % de lignina y 48.07 % de celulosa en la parte leñosa de dicha planta.
Dado el rápido crecimiento y la adaptabilidad de diversos taxones de eucalipto al clima del noreste de México y su potencial uso en la producción de leña y carbón (Foroughbakhch et al., 2017) existe la posibilidad de que estas plantaciones tomen auge en la región y desplacen a los nativos del Matorral Espinoso Tamaulipeco (MET).
Diversas investigaciones han demostrado que los taxa vegetales invasores tienen un impacto variable en las tasas de descomposición de la hojarasca (Reinhart y VandeVoort, 2006; Fargen et al., 2015). Furey et al. (2014) documentan tasas de descomposición de hojarasca más lentas en parcelas monoespecíficas de especies exóticas que en parcelas de nativas, y señalan que la hojarasca de la mezcla natural de taxa nativos fue de mayor calidad que la proveniente en las parcelas de taxones introducidos.
Por el contrario, Jaeger et al., (2013) registran que la hojarasca de Cinchona pubescens Vahl (invasora) se descompone más rápidamente que la de nativas, probablemente, debido al contenido más alto de N, P y K en las hojas verdes de C. pubescens. Esta aparente contradicción se debe, probablemente, a la calidad de la hojarasca, en términos de la cantidad de algunos elementos, la que determina la mayor o menor tasa de descomposición.
Se han desarrollado numerosos estudios en relación con la dinámica de las etapas tempranas de la descomposición de hojarasca (Kang et al., 2009); sin embargo, la mayoría de ellos se han realizado en ecosistemas de bosque y los matorrales no están bien representados en este tipo de estudios (Zhang et al., 2008).
El Matorral Espinoso Tamaulipeco cubre una superficie de 200 000 km² del noreste de México y sur de Texas (Peñaloza y Reid, 1989; López-Hernández et al., 2013); es un ecosistema valioso, con especies importantes para la producción forestal y silvopastoril (Molina-Guerra et al., 2013), con notable complejidad ecosistémica (Villarreal y Alanís, 2015) y gran diversidad florística (Muller, 1939).
A pesar de la vasta extensión que cubre el MET, y de su importancia ecológica y económica, son muy pocos los trabajos existentes sobre la dinámica de descomposición de su hojarasca.
Aun cuando su utilidad a corto plazo es cuestionable para la predicción y elaboración de modelos de límite máximo de descomposición (Berg y Ekbohm, 1991; Harmon et al., 2009), se ha demostrado que son útiles para la caracterización de las etapas iniciales del proceso de degradación y permiten predecir, de manera confiable, las tasas de descomposición de la hojarasca de la mayoría de los ecosistemas (Prescott, 2010).
Los objetivos del presente estudio fueron: comparar la velocidad de descomposición de la hojarasca en sus etapas tempranas en un sitio de Matorral Espinoso Tamaulipeco (MET) constituido por especies nativas del lugar y en una plantación de Eucalyptus camaldulensis Dehnh., especie introducida en la región; además de, determinar la correlación entre la pérdida de peso, por el proceso de descomposición de la hojarasca, y la precipitación, temperatura y evaporación.
La primera hipótesis fue que la hojarasca de eucalipto tiene un proceso inicial de desintegración más lento que la del Matorral Espinoso Tamaulipeco, debido a las características físicas y químicas de cada tipo de hojarasca, ya que los factores de clima y suelo son iguales en ambos casos. La segunda hipótesis fue que, en el área de estudio, la temperatura tiene una mayor correlación con la descomposición de la hojarasca que la precipitación.
Materiales y Métodos
Descripción del área de estudio
El área de estudio se localiza dentro del Campus Universitario de la Facultad de Ciencias Forestales de la Universidad Autónoma de Nuevo León (24°47´N; 99°32´O); situada en la provincia fisiográfica de la Llanura Costera del Golfo Norte, próxima a la Sierra Madre Oriental.
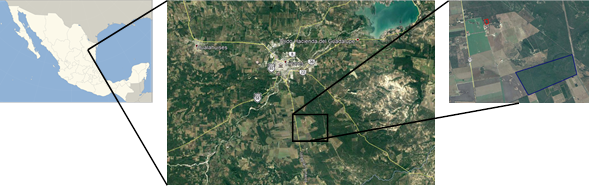
Rojo = Plantación de eucalipto; Azul = Matorral Espinoso Tamaulipeco.
Figura 1 Imagen satelital del Campus Linares de la UANL en el cual aparecen delimitados los sitios de estudio.
La topografía en los sitios seleccionados es plana o con pendiente muy ligera, de 2º a 5º de acuerdo con O. K. Leontiev y G. I. Richagov (Lugo, 1989); altitud de 350 m. Los suelos son vertisoles (FAO, 1988), de origen aluvio-coluvial, profundos y de color oscuro, con alto contenido de arcilla, pH moderadamente alcalino (6.5 -7.3) y alto contenido de carbonatos de calcio (Woerner, 1991).
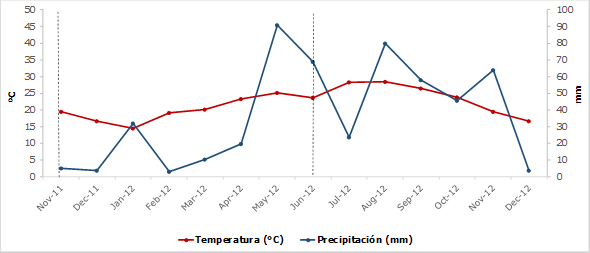
De acuerdo con la clasificación de Köppen, modificada por García (1973), el clima en el área es semicálido-subhúmedo, con dos épocas de lluvia estival, si bien muy irregulares: de marzo a junio y de septiembre a octubre, con veranos muy cálidos y heladas severas en algunos inviernos. La precipitación media anual es de 805 mm, de los cuales alrededor de 600 mm ocurren en los dos periodos de verano mencionados, con la mayor precipitación en el mes de septiembre. La lluvia restante, cerca de 20 %, se recibe en otoño-invierno y la evapotranspiración anual, estimada por el método de Thornthwaite, alcanza los 1 150 mm (Návar et al., 1994).
La temperatura media anual es de 22.6 °C, con una amplia variación a través del año; la máxima promedio mensual se registra en el mes de julio, con 39.8 °C; y la mínima promedio mensual en el mes de enero, con 3.7 °C (estación Camacho, datos 1971-2000) (SMN, 2012).
Sitios de estudio
Se ubicaron en un área, originalmente, ocupada por Matorral Espinoso Tamaulipeco, el cual está constituido por vegetación densa y muy diversa de plantas arbustivas y arbóreas que se distinguen por un amplio intervalo de grupos taxonómicos, con diferencias en hábitos de crecimiento, longevidad foliar y fenología (López-Hernández et al., 2013). Predominan las asociaciones caracterizadas por estratos arbustivos altos o medianos y arbóreos altos; son comunes las especies espinosas con hojas compuestas, entre las que destacan, por su abundancia y cobertura: Acacia berlandieri Benth., Cordia boissieri A.DC., Karwinskia humboldtiana (Schult.) Zucc., Bumelia celastrina Kunth, Acacia rigidula Benth., Acacia farnesiana (L.) Willd., Cercidium macrum I. M. Johnst., Havardia pallens Benth. y Prosopis sp. (Estrada y Marroquín, 1988).
Los sitios de estudio se establecieron en el MET y en una plantación de eucaliptos. El primero ha permanecido sin uso, por lo menos durante los últimos 30 años, y tiene una superficie de 10 hectáreas. La plantación de Eucalyptus camaldulensis data de 1988 y cubre una superficie de 1.528 hectáreas.
Los datos de temperatura mensual promedio, precipitación y evaporación para los meses en que se realizó el experimento (Cuadro 1) se obtuvieron de la estación meteorológica de la Facultad de Ciencias Forestales (FCF). El diagrama ombrotérmico se hizo con los datos de precipitación y temperatura mensual, correspondientes al año 2011-2012 (Figura 2), en que el que se realizó el experimento, permitió identificar un periodo de déficit hídrico de noviembre 2011 a abril 2012.
Cuadro 1 Datos climatológicos para las fechas del experimento de descomposición de hojarasca (noviembre 2011 - junio 2012).
| Mes de muestreo | Precipitación mensual promedio (mm) |
Temperatura mensual promedio (oC) |
Evaporación mensual promedio (mm) |
|---|---|---|---|
| Noviembre | 5.0 | 19.4 | 95.8 |
| Diciembre | 3.5 | 16.6 | 92.35 |
| Enero | 32.0 | 14.5 | 91.16 |
| Febrero | 3.0 | 19.1 | 118.98 |
| Marzo | 10.2 | 20.1 | 151.15 |
| Abril | 19.6 | 23.2 | 162.87 |
| Mayo | 90.9 | 25.1 | 174.56 |
Trabajo de campo y laboratorio
La recolecta de hojarasca se llevó a cabo en el mes de octubre de 2011; para ello se utilizaron cinco canastas de malla, con una superficie aproximada de 0.25 m2, situadas en puntos específicos en el sitio del MET (Figura 3) y en la plantación de eucalipto. Se hizo una mezcla con la hojarasca recolectada en cada sitio y se introdujo en bolsas de tela tipo tul, de 8 × 10 cm con luz de malla de 1 mm, hasta un peso de 10 g por bolsa para la hojarasca proveniente del MET y de 6 g para la hojarasca de la plantación. Posteriormente, se colectaron en los sitios de estudio (noviembre de 2011), distribuidos en cuatro puntos al azar (repeticiones) que se sortearon en cada sitio, el número de bolsas por punto fue de ocho, para un total de 32 por sitio. La diferencia en el peso inicial de la hojarasca por bolsa, se debió a la mayor disponibilidad de hojarasca en el MET en la fecha en que se inició el trabajo.

Figura 3 Canasta de malla utilizada para la captación de hojarasca en el sitio de MET (octubre de 2011).
Adicionalmente, cinco bolsas de hojarasca de cada sitio (MET y eucalipto) se secaron en un horno digital de secado Riossa HCF-102-D para y establecer la conversión de peso fresco a peso seco que se usaron para las determinaciones de pérdida de masa y masa remanente en las fechas de muestro.
Cada mes, de enero a junio de 2012, se retiraron mínimo cuatro bolsas de hojarasca (una por cada punto), que se llevaron al laboratorio, donde se limpiaron y lavaron para retirar cualquier acumulación de suelo que pudiera alterar su peso y posteriormente se secaron a 60 °C en un horno digital Riossa HCF-102-D hasta obtener peso constante. La pérdida de peso se utilizó como indicador de la descomposición de la hojarasca.
Análisis estadísticos
Los valores de masa remanente de hojarasca (n=4) por sitio, correspondientes a cada mes se compararon mediante un análisis de varianza de un solo factor, seguido de una prueba de Tukey (α=0.05) para determinar los meses con cambios significativos en la pérdida de masa. Previamente, se corroboraron los supuestos de normalidad (Shapiro-Wilk) y homocedasticidad (prueba de Levene).
El porcentaje de masa remanente de la hojarasca se calculó con la siguiente ecuación:
Donde:
w0 = Peso seco de la muestra en la bolsa de tul antes de ser colocada en campo
wt = Peso seco del mismo contenido en el tiempo transcurrido desde la colocación de las bolsas de hojarasca en campo hasta la fecha de recolecta
El valor de la constante de descomposición (tasa o velocidad de descomposición) k (k año‒1) se calculó con el programa SigmaPlot 12.5 (Systat Software Inc., Chicago IL, USA) para el periodo total del experimento (enero - junio de 2012). Las estimaciones se hicieron para cada repetición (n=4), con la finalidad de comparar estadísticamente el valor de k entre MET y la plantación. Para estimar k, se utilizó un modelo exponencial negativo (Olson, 1963) a partir de los valores porcentuales de masa remanente y el tiempo:
Donde:
X0 = Porcentaje del peso seco de la hojarasca en el tiempo inicial (año)
Xt = Porcentaje del peso seco de la hojarasca en el tiempo t (año)
k = Constante de descomposición (año-1)
Se realizaron análisis de correlación de Pearson para determinar si existía alguna correlación entre las variables climáticas (temperatura, precipitación y evaporación) y la masa perdida de hojarasca.
La comparación de k (año‒1) de ambos sitios, se hizo con una prueba de t para muestras independientes. Los valores de k año‒1 fueron transformados a log10 para cumplir con los supuestos de normalidad y homocedasticidad. Los análisis estadísticos se efectuaron con el programa SPSS versión18 (SPSS Inc., Chicago, IL, USA).
Resultados y Discusión
Los valores promedio (n=4) de masa remanente de la hojarasca fluctuaron entre 61.01 % y 70.78 %, para la vegetación del MET y de 75.09 % a 90.79 %, para la plantación de eucalipto (Cuadro 2).
Cuadro 2 Valores de masa remanente (%) de hojarasca para los sitios de estudio y tiempo de evaluación expresado en fracción de año a partir de la colocación de las bolsas de hojarasca en campo (tiempo 0).
| Sitio | Repetición | Tiempo (año) | |||||
|---|---|---|---|---|---|---|---|
| 0 | 0.17 | 0.25 | 0.33 | 0.42 | 0.5 | ||
| MET | 1 | 100 | 63.58 | 71.64 | 72.09 | 60.9 | 55.07 |
| 2 | 100 | 70.60 | 75.82 | 72.09 | 67.01 | 68.21 | |
| 3 | 100 | 88.81 | 71.79 | 72.99 | 70.90 | 70.15 | |
| 4 | 100 | 60.15 | 51.49 | 55.37 | 45.22 | 66.12 | |
| Promedio | 100a | 70.78 ±6.39b | 67.69 ±5.48b | 68.13 ±4.26b | 61.01 ±5.65b | 64.89 ±3.37b | |
| Eucalipto | 1 | 100 | 92.22 | 94.81 | 94.81 | 83.70 | 78.52 |
| 2 | 100 | 86.30 | 85.19 | 82.96 | 83.33 | 78.89 | |
| 3 | 100 | 99.26 | 96.30 | 94.07 | 86.30 | 70.74 | |
| 4 | 100 | 85.37 | 79.26 | 87.04 | 88.52 | 72.22 | |
| Promedio | 100a | 90.79 ±3.21ab | 88.89 ±4.05ab | 89.72 ±2.85ab | 85.46 ±1.21bc | 75.09 ±2.11c | |
Se muestra el promedio ± error estándar (n=4). Letras diferentes indican diferencias significativas (Tukey, P<0.05) entre fechas de muestreo de cada sitio.
El porcentaje de descomposición fue mayor en el MET (35.11 %) que en el sitio de eucalipto (24.91 %) (Figura 4). Este último contrasta con lo que citado por García-Arrese (1997), al comparar la velocidad de descomposición de hojarasca de Quercus robur L., Eucalyptus globulus Labill., Pinus pinaster Ait. y Pinus radiata D. Don en bosques de Santiago Compostela, España; el autor indica que a los seis meses, la hojarasca de eucalipto había perdido alrededor de 32 % de su masa. Farfán-Valencia y Urrego (2007) registran pérdidas de 37 % del peso de la hojarasca a los seis meses en plantaciones de Eucalyptus grandis W.Hill ex Maiden en sistemas agroforestales en Colombia. Si bien, en ninguno de los casos anteriores se trabajó con la misma especie de Eucalyptus, hay que considerar que las áreas donde se realizaron esas investigaciones tienen una precipitación promedio de alrededor de 2 000 mm, muy superior al del presente estudio y con temperaturas promedio más bajas.
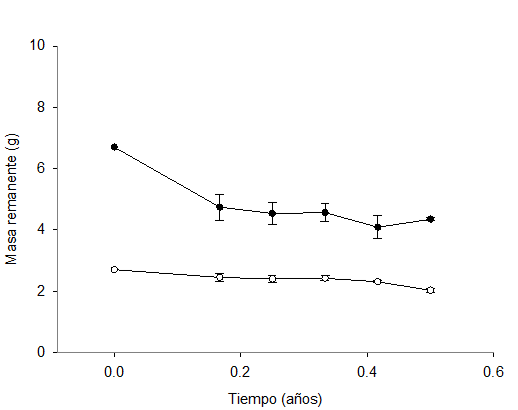
Las barras verticales representan el error estándar (n=4).
Figura 4 Masa remanente (gramos) de hojarasca de eucalipto (○) y de MET (●) en los seis meses del experimento.
La pérdida de masa en especies de eucalipto parece estar favorecida por la precipitación, tal como se observó en la correlación positiva, obtenida en el presente trabajo, entre la pérdida de masa y la precipitación.
La menor tasa de descomposición de E. camaldulensis, comparada con la del MET responde, probablemente, a los contenidos de lignina y celulosa. En las hojas de E. globulus se consignan valores de 33.34 % de celulosa y 24.10 % de lignina (Kiffer et al., 2018); mientras que para algunas especies de Acacia (A. dealbata Link) 17.4 % de holocelulosa y 19.10 % de lignina (Abubacker y Prince, 2013). Asimismo, existen registros en la literatura de que las tasas de descomposición de la hojarasca están positivamente relacionadas con su concentración de N o P (Aerts, 1996).
En un estudio previo en el área del Campus Linares de la UANL, se determinaron concentraciones de N de 1.03 % en la hojarasca del MET (López et al., 2015); Woods y Raison (1983) consignan valores de N de 0.40 a 0.71 % para E. delegatensis R. T. Baker, E. pauciflora Sieb. ex Spreng y E. dives Schau. El mayor contenido de N en la hojarasca del MET, probablemente, influye también en su alta tasa de descomposición.
Marmolejo et al. (2013) citan un porcentaje máximo de degradación de hojarasca, al cabo de 10 meses, de 25.8 % en promedio para cuatro sitios de MET. Dicho porcentaje es inferior a la degradación obtenida en este estudio de 34.48 % en seis meses. Si con la ecuación generada se calcula para un periodo de 10 meses el valor sería de 41.78 %. En un estudio con Prosopis velutina Woot., en Arizona, después de 32 semanas de iniciado el proceso de descomposición se alcanzó 100 % de masa remanente (0 % de degradación) en tratamientos de suelo seco, en contraste con 57 % en suelo húmedo (2 % y 12 % del espacio poroso del suelo con agua, respectivamente); por lo que, los autores consideran que la humedad del suelo controla el proceso de descomposición, especialmente, cuando los eventos de precipitación son pequeños y en pulsos discretos (Lee et al., 2014).
Pérdidas de masa de 20 a 47 % se han observado en Prosopis glandulosa Torr., para un periodo climático similar al del presente estudio en las Cruces, Nuevo México (Shaefer et al., 1985).
La degradación de la hojarasca en el MET fue también muy superior a las pérdidas anuales documentadas para la hojarasca de especies de matorral mediterráneo, de 15 % a 19 % (Schlesinger y Hasey, 1981). Lo anterior se debe, probablemente, a que la hojarasca recolectada e introducida en las bolsas estuvo compuesta, en su mayoría por hojas, y quizás, en otros casos, la proporción de ramas fue superior. Estas últimas, tienen más concentración de lignina, un grupo de polímeros aromáticos complejos presentes en las paredes celulares de la planta que son recalcitrantes a la degradación enzimática y que sirven como una barrera para el acceso de los organismos microbianos a los compuestos de carbono lábiles (Austin y Ballaré, 2010), durante las primeras etapas de la descomposición (O’Connell y Sankaran, 1997); por lo tanto, la descomposición de las hojas es más rápida.
Los resultados del análisis de varianza evidenciaron que la masa remanente de hojarasca difirió entre las fechas de muestreo (P=0.001 para MET y P=0.0001 para eucalipto) (Cuadro 2); en la cual, las mayores pérdidas se registraron en la cuarta y quinta fecha, que fueron iguales entre sí (P=0.135). Para la hojarasca en el MET, la pérdida más grande de masa se detectó desde la primer fecha, a partir de que se establecieron las bolsas en campo, con una reducción de 25.7 % de noviembre a enero (Figura 4).
Una fase de rápida disminución de la masa durante el proceso de descomposición se observó para Acacia mangium Willd. en una región con clima cálido-húmedo en India, aun cuando la fase inicial registrada como de rápida descomposición fue a los cinco meses con 60 % de la masa perdida y en los tres meses siguientes se consideró lenta con 30 % de pérdida de masa (Kunhamu et al., 2009).
La constante de descomposición (k año‒1) fue superior para MET (P=0.004), con un valor de 0.934 (r2=0.668) en comparación con eucalipto (k= 0.479; r2=0.722) (Figura 5). La tasa de descomposición k para Eucalyptus camaldulensis carece de registros en la literatura. A diferencia de otras especies de eucalipto, para las que hay datos por mes o por día (Farfan-Valencia y Urrego, 2007; Goya et al., 2008). Ello dificulta su comparación con las estimaciones de k año‒1. Sin embargo, en un ecosistema de bosque subalpino en Australia se estudió la tasa de descomposición de E. delegatensis (R. T. Baker), E. pauciflora (Sieb. ex Spreng) y E. dives (Schau.) por 29 meses y estimaron la tasa de descomposición (k día‒1) en 0.68, 0.53 y 0.47, respectivamente (Woods y Raison, 1983). Los autores consideran que las condiciones de mayor humedad en la exposición sur para E. pauciflora y E. dives respecto a exposición norte de E. delegatensis pudieron haber contribuido a explicar las diferencias observadas en las velocidades de descomposición.
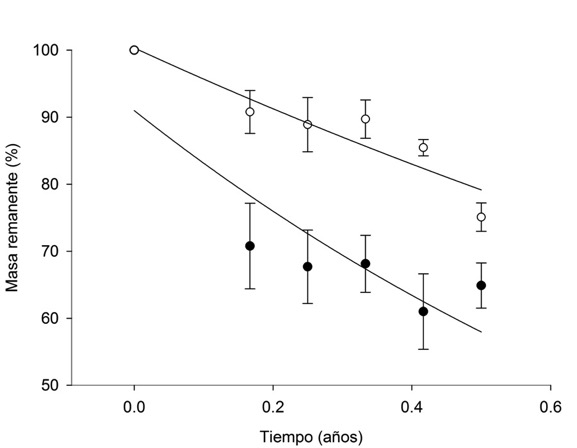
Las ecuaciones generadas son: Y=100.35 e-0.479x para hojarasca de eucalipto y Y=91.00 e-0.934x para matorral. Las barras verticales representan el error estándar (n=4).
Figura 5 Masa remanente en porcentaje de la descomposición de hojarasca de eucalipto (○) y de MET (●) en las diferentes fechas de muestreo.
La información existente sobre la constante de descomposición (k) para MET es escasa. En un trabajo de investigación previo en la misma área de este estudio, se indican valores de k de 0.50 (año‒1) para un matorral bien conservado (Marmolejo et al., 2013), valores que difieren, notablemente, de los estimados en el presente trabajo.
Las tasas de descomposición de la hojarasca, en general, tienen una amplia variación, debido a las diferencias en ubicación geográfica, condiciones climáticas (Salamanca et al., 2003) y calidad de la hojarasca (Swift et al., 1979; Binkley, 1986).
Asimismo, en ecosistemas con más variabilidad climática, la caída de hojarasca no es constante durante todo el año, y las especies suelen tener diversos, como es el caso del Matorral Espinoso Tamaulipeco. Esto explica, probablemente, las diferencias registradas en la tasa de descomposición señalada por Marmolejo et al., (2013) para el mismo tipo de vegetación.
Rodríguez-Pleguezuelo et al. (2009), al analizar la tasa de descomposición de la hojarasca foliar para especies de arbustos leñosos en un ecosistema mediterráneo, citan un valor de 1.01 para Retama sphaerocarpa (L.) Boiss; el cual es ligeramente superior al obtenido en el presente trabajo para el MET en su conjunto (0.934). En ambas áreas, la temperatura media anual es semejante, con 20.8 °C y 22.6 °C, si bien la precipitación es mucho menor en el área mediterránea (449 mm). Fioretto et al. (2003) estiman una tasa de descomposición (k) de hojarasca para Myrtus communis (L.) de 0.71 y de 0.31 para Cistus incanus (L.), lo que denota que, si la condición climática es uno de los factores que la afectan, también su composición química juega un papel preponderante (Berg et al., 1995; Fioretto et al., 1998).
En algunas especies de matorral del Desierto Chihuahuense se han realizado estimaciones anuales; por ejemplo, para Prosopis glandulosa Torr. k=0.654; y k=0.777 para una mezcla de plantas anuales (Schaefer et al., 1985).
Cuevas y Medina, 1988 y Landsberg y Gowers, 1997 indican que las tasas de descomposición de la hojarasca tienden a ser más altas en los bosques tropicales lluviosos que en los secos y, a su vez, mayores en el trópico que en otros ambientes. No obstante, debido a las grandes variaciones que existen a causa de todos los factores en ello involucrados, es muy posible detectar un traslape considerable en las tasas de descomposición entre diferentes ecosistemas o usos de suelo.
En este estudio, la masa remanente mostró una correlación negativa con la temperatura ambiental y la evaporación registradas, tanto para MET (r=-0.474, P=0.019; r=-0.571, P=0.004) como para eucalipto (r=-0.693, P=0.0001; r=-0.697, P=0.0001) y solo la hojarasca de eucalipto presentó correlación con la precipitación (r=-0.709, P=0.0001). Lo anterior, debido, probablemente, a que la precipitación para la región de estudio es más bien baja, en el intervalo de lo semiárido-subhúmedo, con 164.2 mm acumulados durante los seis meses de muestreo; por lo que, la descomposición de la hojarasca parece haber respondido más a la temperatura, cuyo promedio en los seis meses fue 20.6 °C.
Conclusiones
El porcentaje de masa perdida de la hojarasca en el Matorral Espinoso Tamaulipeco (35.11 %) fue 10 % más alta que la de eucalipto (24.91 %) a seis meses de colocadas las bolsas en campo. De igual manera, la constante de descomposición (k año‒1) fue mayor para el MET con un valor de 0.934 que para eucalipto (0.479). Por lo tanto, se acepta la primera de las hipótesis, de que la hojarasca de eucalipto tiene un proceso inicial de desintegración más lento que la del Matorral Espinoso Tamaulipeco. La menor tasa de descomposición de la hojarasca de eucalipto con respecto a la del MET implica que también la deposición de nutrientes al suelo será más lenta. En las regiones semiáridas, los pulsos de precipitación son claves para el crecimiento de la vegetación y una lenta descomposición puede limitar la disponibilidad de nutrientes cuando se presentan las lluvias. Lo anterior tendrá implicaciones en el manejo, prácticas silvícolas y posibilidades de regeneración de las especies por establecerse.
El porcentaje de masa remanente de la hojarasca tanto de la vegetación del MET, como la de eucalipto tienen una correlación negativa con la temperatura ambiente y la evaporación registrada y solo la hojarasca de eucalipto presenta correlación negativa con la precipitación.











 texto en
texto en