Introducción
La interacción entre los componentes de una comunidad microbiana en los sistemas agroforestales puede manifestarse o no, en algún atributo morfológico o fisiológico de interés antropocéntrico de la planta hospedante, especialmente, en sistemas de producción sustentables o de bajos insumos, pero su incidencia efectiva depende del microorganismo, de las condiciones ambientales y edáficas (Qiu et al., 2008). Algunas bacterias y hongos que viven en la porción de suelo influenciado por las raíces estimulan el crecimiento de los vegetales e inducen efectos positivos en su desarrollo y supervivencia (Artursson et al., 2006). Por ejemplo, las rizobacterias promotoras del crecimiento vegetal y los hongos micorrizógenos arbusculares (MA), que representan dos de los principales grupos de microorganismos benéficos de la rizosfera.
La inoculación con más de un microorganismo a la semilla o al suelo puede poner a disposición de la planta hospedante diversos mecanismos de acción para abastecerse de nutrientes y agua. Varios estudios han demostrado que la inoculación con hongos y bacterias produce un efecto sinérgico (Diouf et al., 2005; Lalitha et al., 2011), aunque en otros casos, no necesariamente induce un efecto aditivo o sinérgico en la planta hospedante (Trabelsi y Mhamdi, 2013).
En México, se han documentado incrementos en el rendimiento y sus componentes en cultivos anuales al inocular hongos (MA) y bacterias fijadoras de nitrógeno bajo condiciones de campo (Aguirre-Medina, 2006). En cultivos perennes, como Theobroma cacao L. en vivero, Aguirre-Medina et al. (2007) citan mayor desarrollo vegetal cuando se incorporan juntos R. intraradices (Schenck & Sm.) Walker & Schuessler y A. brasilense Tarrand, Krieg & Döbereiner. En Coffea canephora (Pierre) ex Froehner, el número de hojas y la biomasa del tallo fue superior cuando se usan por separado (Aguirre-Medina et al., 2011).
Los microorganismos inducen aumentos en el crecimiento en menor tiempo en las plantas producidas en vivero, y, en consecuencia, disminuyen el lapso necesario antes de su transplante en el campo. Esta ventaja se pretende estudiar en Tabebuia donnell-smithii Rose (primavera); árbol caducifolio de regiones tropicales y subtropicales de México (Miranda, 1998), cuya madera tiene alta demanda, lo que ha disminuido su abundancia natural, por un aumento en su explotación y regeneración poco exitosa.
Los programas de reforestación en México presentan una supervivencia menor a 50 %, debido, en parte, a la baja calidad de las plantas producidas en vivero y la sequía intermitente que ocurre todos los años (Semarnat, 2010). Bajo estas condiciones, es posible que los microorganismos ayuden a la supervivencia de las plantas en condiciones ambientales adversas (Andrade et al., 2009).
Los hongos (MA) incrementan la absorción de nutrientes, especialmente de fósforo (Richardson et al., 2009), e inducen tolerancia al estrés hídrico (Sylvia, 2005). Azospirillum incrementa el desarrollo radical de la planta hospedante, mediante la producción de hormonas y la fijación de nitrógeno (Bashan y De Bashan, 2010); y P. fluorescens Migula estimula el crecimiento de las plantas y solubiliza minerales (Lucy et al., 2004).
En este contexto, el objetivo de la presente investigación fue determinar la asignación de materia seca en Tabebuia donnell-smithii en interacción con la inoculación de Rhizophagus intraradices, Pseudomonas fluorescens y Azospirillum brasilense, y su efecto en la concentración de nitrógeno y fósforo en el tejido vegetal.
Materiales y Métodos
Localización geográfica y condiciones ambientales del sitio experimental
La investigación se desarrolló (febrero a noviembre del 2013) en un vivero del Campo Experimental Rosario Izapa-Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP), ubicado en el km 18 de la carretera Tapachula- Cacaohatan, municipio Tuxtla Chico, Chiapas; con coordenas son 14°40’ N y 92° 10’ O, a 435 msnm. En este lugar se colectaron las semillas de T. donnell-smithii de árboles de copa densa, fuste recto y sin presencia de daños por plagas y enfermedades. El clima en la zona es cálido húmedo con lluvias en verano e influencia de monzón. La precipitación promedio es de 4 720 mm anuales y la temperatura media, considerada isotermal, de 25.4 °C.
Análisis físicos y químicos del sustrato
El sustrato se conformó con una mezcla de suelo Andosol mólico y arena de río lavada, 1:1 (V/V), cuyas características fueron textura arena-migajonosa (Bouyucos) (80.66 % de arena, 16.36 % de limo, 2.98 % de arcilla), porosidad (34 %), densidad real (2.09 g mL-1); densidad aparente (1.38 g mL-1); 3.1 % materia orgánica (Walkley-Black); 0.12 ds. m-1, conductividad eléctrica; pH 5.71; 0.19 % N (Kjelddhal); 5.0 ppm P (colorimetría); 18.5 ppm K++ (espectrofotometría atómica); 59 ppm Ca++ (espectrofotometría atómica); 8.1 ppm Mg++; y 5 Meq. 100g-1 de capacidad de intercambio catiónico. Con el sustrato sin esterilizar se llenaron bolsas de plástico negro (calibre 700), con una capacidad de 5 kg de suelo por bolsa, y se perforaron en la parte inferior para favorecer el drenaje.
Microorganismos e inoculación
Los microorganismos que se utilizaron fueron Rhizophagus intraradices, producido en el Campo Experimental Rosario Izapa-INIFAP. El inoculo contenía 40 esporas por gramo de suelo estéril y raíces de Brachiaria decumbens L., con 95 % de colonización. Azospirillum brasilense fue adquirido en la Benemérita Universidad Autónoma de Puebla, con 9 x 106 bacterias g de turba-1. Pseudomonas fluorescens fue proporcionada por el Campo Experimental Celaya- INIFAP, con 9 x 106 bacterias g de turba-1. Las semillas se germinaron en charolas con el mismo sustrato y se trasplantaron a las macetas con dos hojas verdaderas. Al momento del trasplante se aplicaron, en el hoyo de siembra, 2 g de cada inóculo mezclado de acuerdo al tratamiento.
Los cinco tratamientos se describen a continuación: 1) Azospirillum brasilense + Pseudomonas fluorescens; 2) Rhizophagus intraradices + P. fluorescens; 3) R. intraradices + A. brasilense; 4) A. brasilense + R. intraradices + P. fluorescens; y 5) Testigo. Se usaron con cinco plantas como repeticiones en un diseño completamente al azar. La unidad experimental fue una maceta con una planta. Los riegos se hicieron con agua destilada.
Variables registradas
Se registraron variables morfológicas y fisiológicas del rendimiento con frecuencia de 28 días después de la siembra (dds); a partir del primer muestreo a los 46 dds, y los siguientes a los 74, 102, 130 y 158 dds. La colonización radical y el contenido de N y P en tejido vegetal se registraron al final del estudio.
La materia seca de la parte aérea y radical de la planta se determinó en estufa de aire forzado por 72 h a 75-80 °C (Sheldon, VWR 1390FM, USA) y los componentes del rendimiento se pesaron en báscula semianalítica (Ohaus, Adventurer Pro, USA).
El área foliar (cm2) se obtuvo con un integrador de área foliar (LI-COR, LI 3000A, USA).
Mediante la técnica de tinción y clareo de Phillips y Hayman (1970) se prepararon 100 segmentos de raíz, con longitud de 1.5-1.6 cm de cada muestreo y se observaron al microscopio óptico con objetivo de inmersión (100 X). Los resultados se expresaron en porcentaje de colonización micorrízica.
Finalmente, los contenidos de N (Micro-Kjeldahl) y P se cuantificaron en un espectrofotómetro (Thermo Fisher Scientific, modelo 400 ¼).
Análisis estadístico
Los efectos entre tratamientos se estimaron con un análisis de varianza para las variables morfológicas, fisiológicas, el contenido de nitrógeno y fósforo con el procedimiento PROC ANOVA. Posteriormente, se hizo una comparación de medias (Tukey, P ≤ 0.05) con el programa computacional Statistical Analysis System, versión 8.1 (SAS, 1999-2000).
Resultados y Discusión
Altura y área foliar
Los resultados de los diferentes tratamientos se presentan en el Cuadro 1. La inoculación combinada de R. intraradices, A. brasilense y P. fluorescens aumentó significativamente todos los parámetros de crecimiento.
Cuadro 1 Altura, área foliar y peso seco de raíz y vástago de las plantas de Tabebuia donnell-smithii Rose.
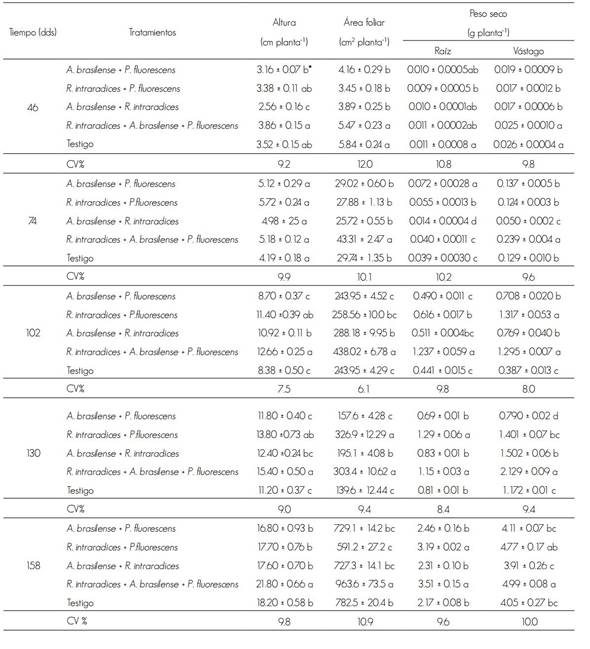
dds = Días después de la siembra; CV = Coeficiente de variación (%).
* Valores con diferente letra dentro de cada factor y columna son estadísticamente diferentes (p ≤ 0.05).
Las plantas tuvieron lento crecimiento los primeros 45 dds y, en consecuencia, alcanzaron poca altura. A los 28 días se observó incremento en todos los tratamientos. Esta dinámica se repitió en los siguientes muestreos. Las diferencias estadísticas significativas (P ≤ 0.05) correspondieron a los 46, 102, 130 y 158 dds. Entre los 46 y 74 dds, los tratamientos con los microorganismos presentaron mayor altura de planta en comparación al testigo, y los valores promedio variaron de 1.32 cm, con la inoculación de los tres microorganismos, a 2.42 cm en las plantas tratadas con R. intraradices y A. brasilense.
En todos los casos el siguiente periodo de evaluación, a los 102 dds, se registró incremento en altura de planta: 4.0 a los 7.0 cm; la mayor altura se obtuvo con la inoculación de los tres microorganismos y la menor con las dos bacterias A. brasilense y P. fluorescens y el testigo. Después del tercer muestreo y hasta el final de la evaluación, las diferencias en altura fueron superiores a 2 cm en los tratamientos con microrganismos, en comparación con el testigo.
En otras especies perennes como Theobroma cacao, AguirreMedina et al. (2007) señalan que a los 120 dds hay diferencias promedio en altura de planta de 9 cm en las inoculadas con R. intraradices, en relación con el testigo. Karthikeyan et al. (2009) citan aumento en la altura de planta al inocular las semillas de Catharanthus roseus (L.) G. Don. con A. brasilense y P. fluorescens; sin embargo, en el presente estudio fue la combinación con menor inducción de altura de planta.
En trigo, Naiman et al. (2009) muestran efectos diferentes en la utilización de las fuentes de carbono cuando se inoculan Azospirillum y Pseudomonas e indican su efecto en el crecimiento. Zambrano y Díaz (2008) citan que A. brasilense promueve mayor altura de planta en Gmelina arborea Roxb con Glomus manihotis Howeler, Sieverding & Schenk y Paraglomus occultum (Walker) Morton & Redecker. Estos antecedentes sugieren la contrastante funcionalidad de las coinoculaciones en interacción con las plantas (Jäderlund et al., 2008).
El área foliar evidenció valores de crecimiento, estadísticamente diferente (P ≤ 0.05) desde el primer muestreo con la simbiosis de los tres microorganismos. Solamente, a los 130 dds con las bacterias A. brasilense + P. fluorescens presentó diferencia estadística (P ≤ 0.05). En otras plantas, como el cacao y café con R. intraradices, también hay aumento del área foliar en condiciones de vivero (Aguirre-Medina et al., 2007; 2011). Al respecto, Sylvia (2005) cita que las plantas después de la colonización micorrízica incrementan su actividad fotosintética, lo que se expresa en más acumulación de biomasa.
Peso seco de raíz y vástago
La mayor biomasa acumulada en el sistema radical y el vástago durante el primer muestreo se registró con el tratamiento de los tres microrganismos y en el testigo, además fueron estadísticamente diferente (P ≤ 0.05) a los otros tratamientos. El lento crecimiento inicial en las plantas inoculadas con dos microorganismos juntos es probable que se relacione con la mayor demanda de fotosintatos por los microorganismos durante la fase de establecimiento, aun cuando, con los tres microorganismos el requerimiento de fuentes de carbono sea mayor y, en consecuencia, el crecimiento inicial es menor. Es posible que la combinación de mecanismos de acción entre los tres microorganismos dependa de la compatibilidad funcional en la fisiología y bioquímica de la interacción, entre los componentes microbianos (Vázquez et al., 2000).
En esta etapa, la disponibilidad de carbohidratos hacia el vástago disminuye, dado que la mayoría de los compuestos son requeridos por la raíz (Roveda y Polo, 2007). Wright et al. (2005) documentaron grandes concentraciones de carbohidratos solubles en las raíces micorrizadas de maíz, y agregan que después del periodo de establecimiento de la simbiosis, normalmente, inicia el mecanismo de transporte de nutrientes a la planta y el concomitante incremento en biomasa, como sucedió en los muestreos siguientes con la inoculación de hongos y bacterias.
Los resultados correspondientes a los 102, 130 y 158 dds evidencian que el crecimiento más grande en el sistema radical se presentó al inocular los tres microorganismos juntos. La combinación de bacterias y hongos, P. fluorescens + R. intraradices mejora el crecimiento radical. P. fluorescens puede estimular a proliferación de raíces (Sánchez et al., 2005) mediante la producción de ácido indolacético (Patten y Glick, 2002), el cual se relaciona con la promoción del crecimiento vegetal (Gamalero et al., 2003). La coinoculación con las dos bacterias A. brasilense y P. fluorescens produjo 30 % menos de biomasa radical y en el testigo 38 % al final del estudio, en comparación con el tratamiento que incluye a los tres microorganismos.
El peso seco del vástago fue superior y estadísticamente diferente (P ≤ 0.05) a los otros tratamientos con la inoculación de los tres microorganismos, durante toda la evaluación. En dos muestreos, a los 102 y 158 dds, en el tratamiento con R. intraradices + P. fluorescens se registró acumulación de biomasa semejante a la observada con la aplicación de los tres microorganismos, pero sin diferencia estadística entre ellos (P ≤ 0.05). En él se tuvo un comportamiento similar durante el primer muestreo (Cuadro 1).
La coinoculación con las dos bacterias generó menor cantidad de biomasa en raíz y vástago a los 74, 102 y 130 dds, en comparación con los tratamientos integrados por las bacterias en combinación con R. intraradices. En ellas no se obtuvo colonización radical por el hongo (MA) al inicio de la evaluación, pero sí a los 74, 102 y 130 dds, con un incremento de alrededor de 20 %; al final de la evaluación, el porcentaje fue de 26.
La colonización micorrízica es posible que corresponda a los hongos (MA) contenidos en el sustrato, cuya presencia se confirma, además, con los porcentajes del testigo (sin inocular). Los hongos (MA) autóctonos indujeron menor desarrollo vegetal en T. donnell-smithii y la mayor respuesta vegetal obtenida con R. intraradices sugiere efecto diferencial en la capacidad de los hongos para estimular el crecimiento de la planta, aun cuando existe la posibilidad de haber sido colonizada también por hongos (MA) autóctonos (Figura 1).
La coinoculación de R. intraradices + P. fluorescens propició un mayor incremento en la biomasa seca de raíz y del vástago, en comparación con la combinación R. intraradices + A. brasilense. El efecto fue más evidente a partir de los 74 y hasta los 158 dds, aunque la colonización micorrízica fue más alta con la combinación R. intraradices + A. brasilense durante todo el periodo de evaluación, en comparación con la combinación de R. intraradices + P. fluorescens, en la que se observó poca colonización radical del hongo (MA) al inicio, pero se incrementó cerca de 60 % al final del muestreo.
La coinoculación de las bacterias A. brasilense y P. fluorescens respondió de manera diferencial con el mismo hongo (MA). Lo anterior sugiere cierta especificidad entre las bacterias y R. intraradices. Así, la coinoculación del hongo con la bacteria específica, puede inducir sinergismo en el crecimiento (Trabelsi y Mhamdi, 2013). Con A. brasilense la colonización inicial fue a más alta y con P. fluorescens, resultó al final del estudio, y el mismo comportamiento se tuvo con la inoculación de las dos bacterias juntas con el hongo (MA). En trigo aumenta el crecimiento radical con Azospirillum y no se afecta la colonización radical, al inocularse junto a Glomus mosseae (Nicolson & Gerd.) Gerd. & Trappe y G. macrocarpum Tul & Tul (Russo et al., 2005).

La línea vertical indica ± el error estándar de cinco repeticiones.
Figura 1 Colonización micorrízica en la raíz de plantas de Tabebuia donnell-smithii Rose.
En los tratamientos con R. intraradices, el incremento en el desarrollo de la planta hospedera puede deberse a la mayor absorción de nutrientes, mediante la hifa del hongo. Posiblemente, por el aumento en la capacidad de absorción de las plantas micorrizadas (Leigh et al., 2009), por un efecto estimulatorio en el desarrollo del micelio, como lo cita Barea et al. (1998) con Pseudomonas sp. cepa F113 y G. mosseae; además de, la fijación de nitrógeno por las bacterias (Hungria et al., 2004). Los resultados confirman la capacidad de colonización de R. intraradices, y su efecto en inducir mayor crecimiento de la planta hospedante, en cultivos anuales, como en diferentes variedades de maíz en África (Wright et al., 2005); con maíces criollos, variedades e híbridos en México (AguirreMedina, 2006); y cultivos perennes, como Coffea arabica L. (Aguirre-Medina et al., 2011), Coffea canephora Pierre ex A. Froehner (Ibarra-Puón et al., 2014) y Cedrela odorata L. (Aguirre-Medina et al., 2014).
La colonización micorrízica asociada con las bacterias, no parece estar relacionada con la inducción del desarrollo vegetal de Tabebuia donnell-smithii, ya que varía de acuerdo a la combinación del hongo con la bacteria. Sin embargo, es de esperarse que la simbiosis micorrízica presente cambios en los niveles de colonización (Sylvia, 2005) debido a la interacción de diversos factores ambientales y de manejo (Andrade et al., 2009).
Existen evidencias de que la micorriza interactúa con una amplia variedad de organismos en la rizosfera, como los diazótrofos; aunque, la demanda por carbohidratos aumenta con la coinoculación de más de un microorganismo (Lugtenberg et al., 1999), y se ha estimado que alrededor de 20 % del total de carbono asimilado por la planta es transferido al hongo (Sylvia, 2005). En el estudio que se documenta, el incremento en la acumulación de biomasa en el tratamiento con los tres microorganismos juntos sugiere la compatibilidad funcional de los mismos con la planta hospedante, y que esta abasteció carbono suficiente a los microorganismos.
Contenido de N y P
Con respecto a los nutrientes, la Figura 2 muestra los contenidos en T. donnell-smithii a los 140 dds.
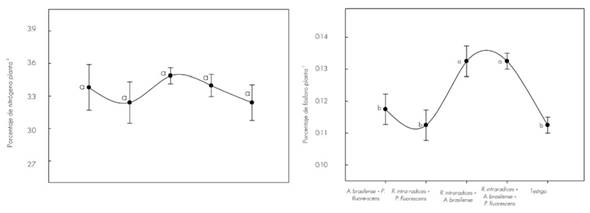
La línea vertical indica ± el error estándar de cinco repeticiones. Letras diferentes son estadísticamente significativas (P≤0.05). Coeficiente de variación en nitrógeno 6.4 % y en fósforo 6.0 %.
Figura 2 Variación del contenido de nitrógeno y fósforo en el tejido vegetal de Tabebuia donnell-smithii Rose por tratamiento a los 140 días.
El contenido de nitrógeno en el vástago de las plantas inoculadas con A. brasilense + P. fluorescens, R. intraradices + P. fluorescens; y los tres microorganismos juntos fue más alto en comparación con el resto de los tratamientos, pero sin diferencia estadística. Este resultado se puede relacionar con la competencia (Neuhauser y Fargione, 2004) o incompatibilidad (Oyekanmi et al., 2007) entre los microorganismos, ya que su incidencia funcional tiene efecto primario en la nutrición vegetal y, en consecuencia, en el crecimiento de la planta (Cano, 2011). Con Glomus fasciculatum (Thaxt.) Gerd. & Trappe no se presentó incremento del contenido de nitrógeno en el tejido vegetal de Astronium graveolens Jacq., Tectona grandis L.f., Terminalia amazonia (Gmel.) Exell y Gmelina arborea Roxb., pero sí de otros nutrimentos (Hernández y Salas, 2009). En diversas investigaciones, la inoculación de R. intraradices + A. brasilense aumentó el contenido de N en el tejido vegetal de C. arabica (Aguirre-Medina et al., 2011).
La mayor concentración de fósforo en el tejido vegetal se registró cuando se coinoculó R. intraradices con A. brasilense y con los tres microorganismos juntos. Los valores fueron estadísticamente diferentes (P ≤ 0.05). Muchos estudios han demostrado que las plantas micorrizadas absorben P del suelo de manera más eficiente que las plantas no colonizadas (Andrade et al., 2009). En Eleusine coracana Gaertn inoculada con Glomus fasciculatum y A. brasilense se consigna mayor absorción de P, en comparación con las plantas testigo (Geeta et al., 2013). Se ha indicado que las hifas fúngicas tienen más afinidad por el ion fosfato cuando su concentración es baja en la solución (Tajini y Drevon, 2012), y en sistemas de producción de pocos insumos, la actividad de la micorriza es más efectiva (Grant et al., 2005), con énfasis en suelos de escasa fertilidad (Mudge, 2003).
La coinoculación de P. fluorescens con R. intraradices no propició mayor contenido de P en el tejido vegetal. Es probable que este efecto se relacione con la funcionalidad de los dos microorganismos y su efecto en la planta de T. donnell-smithii.
Conclusiones
La inoculación de los tres microorganismos juntos incrementó el peso seco de raíz y vástago de T. donnell-smithii durante toda la evaluación, y al final de la misma la coinoculación de R. intraradices + P. fluorescens se expresó en similar acumulación de biomasa. El efecto de las combinaciones de microorganismos en la asignación de materia seca se expresó después de los 74 dds, momento en el cual se incrementó la colonización radical del hongo micorrizógeno arbuscular.
La coinoculación de los tres microorganismos y la coinoculación R. intraradices y A. brasilense promovieron mayor contenido de N y P en el tejido vegetal.











 texto en
texto en 


