Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista mexicana de ciencias pecuarias
On-line version ISSN 2448-6698Print version ISSN 2007-1124
Rev. mex. de cienc. pecuarias vol.11 n.2 Mérida Apr./Jun. 2020 Epub Oct 23, 2020
https://doi.org/10.22319/rmcp.v11i2.4912
Notas de investigación
Crecimiento, viabilidad y post-acidificación de Lactobacillus plantarum en la leche de transición bovina
a Instituto de Ciências Agrárias, Universidade Federal de Minas Gerais, Montes Claros, MG, Brasil.
b Universidade Federal de Viçosa, Campus Universitário, Viçosa. Departamento de Tecnologia de Alimentos. Grupo de Termodinâmica Molecular Aplicada, MG, Brasil.
En este estudio se analizaron cuatro sustratos de la leche para evaluar la viabilidad de la cepa de Lactobacillus plantarum de origen bovino después de 24 y 48 horas de fermentación. Además, se evaluó la viabilidad celular y la post-acidificación en la leche de transición fermentada por estas bacterias durante un periodo de almacenamiento de 60 días a 4 y 25 °C. Se observó una reducción significativa (de 30.9 %) de la viabilidad celular después de 48 horas de fermentación para la formulación con leche entera. Sin embargo, en la leche de transición fermentada almacenada a 4 °C, la viabilidad celular y la acidez se mantuvieron en niveles aceptables a lo largo del periodo de 60 días. La viabilidad de L. plantarum en la leche de transición fermentada permaneció aceptable hasta los 50 días, y se analizaron los valores de pH mínimo después de 38 días de almacenamiento y los niveles máximos de acidez después de 56 días. Tomando en cuenta estos resultados, la leche de transición puede ser conservada mediante la fermentación con L. plantarum como un sustituto de la leche en la alimentación artificial para terneros como alimento funcional.
Palabras clave Salud animal; Alimentación de los terneros; Fermentación; Conservación de alimentos; Probióticos
In this study, four milk substrates were analyzed to evaluate bovine Lactobacillus plantarum strain viability after 24 and 48 h of fermentation. In addition, cell viability, and post-acidification in transition milk fermented by these bacteria were assessed over a 60-d storage period at 4 and 25 °C. Significant reduction (30.9 %) of cell viability after 48 h of fermentation was observed for the formulation with whole milk. However, in fermented transition milk stored at 4 °C, cell viability and acidity were maintained at acceptable levels throughout the 60-d storage period. The viability of L. plantarum in fermented transition milk stored at 25 °C remained acceptable up to 50 d and minimum pH values were analyzed after 38 d of storage and maximum acidity levels after 56 d. Considering these results, transition milk may be preserved by L. plantarum fermentation as a substitute for milk in the artificial feed for calves as functional food.
Key words Animal health; Calves’ feeding; Fermentation; Food preservation; Probiotic
El uso de probióticos en el alimento para animales promueve la salud animal y mejora la productividad1 y, por ende, representa una posible estrategia para controlar y prevenir la colonización del tracto gastrointestinal por bacterias patógenas2. Se ha caracterizado el potencial probiótico de las bacterias de ácido láctico, y las especies del género Lactobacillus han revelado efectos benéficos in vitro e in vivo en el control de la diarrea en los terneros3.
El principal reto que presenta la creciente demanda de probióticos en el mercado mundial es que una cepa probiótica se debe cultivar en las concentraciones adecuadas en un producto determinado, y la viabilidad celular se debe mantener durante toda la vida útil de éste4,5. Se evaluaron los alimentos que contienen probióticos en tanto tecnologías para el suministro de probióticos, así como la incorporación de estos microorganismos a la leche fermentada ha dado como resultado productos con una viabilidad celular y una funcionalidad elevadas1,6.
Se puede utilizar calostro fermentado (del primer al tercer día del posparto) o la leche de transición (hasta el séptimo día de posparto) como sustitutos de leche para la alimentación artificial, con lo cual se reducen los costos y se promueve el desarrollo saludable de los terneros7,8. Se han sugerido estas secreciones iniciales del periodo de lactancia como sustitutos para la producción de probióticos animales6, dado que no tienen ningún valor comercial, pese a su elevado contenido de proteínas y vitaminas9,10. Además, las células de inmunoglobulina en el calostro fermentado tienen la misma viabilidad que el calostro in natura y son capaces de transferir inmunidad pasiva a los terneros recién nacidos11. No obstante, se han registrado pérdidas por putrefacción durante la fermentación. Éstos pueden asociarse con la proliferación de organismos patógenos o de descomposición7.
Se considera que los productos lácteos son las mejores matrices portadoras de bacterias de ácido láctico, que son el principal grupo de especies probióticas12. En este estudio preliminar fue selecionada una cepa de Lactobacillus del tracto intestinal de un ternero que presentaba efectos inhibitorios de las cepas de Escherichia coli que provocan diarrea a los terneros. Además, se observó un mayor aumento de peso diario en terneras alimentadas con la leche fermentada que contenía la cepa de especies de Lactobacillus13. Sería pertinente realizar un análisis más profundo de esta cepa de probióticos en la leche de transición y de los tiempos de almacenamiento adecuados, con lo cual se reducirían los costos de la alimentación artificial y mejoraría la salud de los terneros.
En este estudio se evaluó el potencial de cuatro sustratos lácteos para el crecimiento de Lactobacillus plantarum durante dos periodos de fermentación. Además, se evaluó la viabilidad celular y la post-acidificación en la leche de transición fermentada por esta bacteria en un periodo de almacenamiento de 60 días a dos temperaturas diferentes.
La cepa de bacterias analizada se aisló de las heces de un ternero – Holstein y ¼ Gyr destetado de 4 meses de edad. La bacteria se seleccionó por tener una mayor resistencia al pH ácido y a las sales biliares in vitro; ambas son características importantes de los probióticos para demostrar un efecto antagónico mayor entre dos cepas de Escherichia coli que provocan colibacilosis en los terneros13.
A fin de llevar a cabo la identificación molecular de estas bacterias, se extrajo ADN y se lo amplificó mediante la reacción de la cadena de polimerasa (PCR) mediante el uso de los cebadores 27F (5′-AGAGTTTGATCCTGGCTCAG-3′) y 1492R (5′-GGTTACCTTGTTACGACTT-3′) como lo describe Lane14, y se secuenció el gen 16S ARNr15 con el secuenciador automático MegaBACE® 1000 (GE Life Sciences, Chicago, EEUUA) en el Laboratorio Biotecnológico Myleus (Belo Horizonte, Brasil). La secuencia del gen 16S ARNr fue verificada con el software SeqScanner® versión 1.0 (Applied Biosystems, Foster City, EEUUA) y cotejada con la base de datos del Centro Nacional de Información Biotecnológica de Estados Unidos (NCBI) mediante el servidor BLAST (http://www.ncbi.nlm.nih.gov/BLAST/). Se reconoció la cepa como Lactobacillus plantarum, considerando un umbral de similitud del 99 %. Además, la cepa de bacterias tuvo puntajes de identificación superiores a 2.0 cuando se la analizó mediante una espectrometría de masas de tiempo de vuelo con ionización por desorción con láser asistida por matrices (MALDI-TOF MS), utilizando el software MALDI-Biotyper v2.016.
Las bacterias se conservaron en congelación (a -18 °C) en tubos con una mezcla de caldo de cultivo de Man, Rogosa y Sharpe (MRS) y 20% (m/m) de glicerol. A fin de activar los microorganismos, se añadieron 0.2 mL de cultivos congelados a 10 mL de MRS y se incubaron durante 24 h a 37 °C. Posteriormente se realizaron dos inoculaciones sucesivas en tubos de ensayo que contenían 10 ml de la leche descremada reconstituida a una concentración de 10 % de sólidos no grasos. Por cada inoculación se incubaron los tubos durante 24 h a 37 °C.
Principalmente, se probó la viabilidad de esta bacteria en dos periodos de fermentación diferentes y en cuatro formulaciones distintas de sustratos: (1) leche descremada reconstituida (LDR), que constó de la leche descremada en polvo (Molico, Nestlé) reconstituida en agua destilada a una concentración de 10% (m/v) sólidos no grasos, (2) leche de transición (LT) de vacas Holstein al tercer día después del parto, (3) leche entera (LE) de animales de la misma raza y granja lechera que los de la formulación de LT, y (4) mezcla de 50 % de LE y 50 % de LT (LET).
Se vertió cada formulación (25 ml) en tubos de ensayo, y a cada tubo se le añadió un 0.3 % (m/v) de citrato de sodio como estabilizador. Luego se pusieron los tubos en una autoclave a 121 °C durante 15 min. Después, se los enfrió hasta alcanzar la temperatura ambiente (25 ± 2 °C) y se añadió a cada formulación 2 % (v/v) de cultivo de L. plantarum (8 log UFC ml-1), puesto que las primeras concentraciones fueron de 6.6 log UFC·ml-1. Los tubos fueron agitados e incubados en una incubadora BOD a 37 °C durante 24 y 48 h. La Figura 1 muestra el flujograma de producción para cada formulación.

Figura 1 Flujograma del proceso de producción de cuatro productos lácteos fermentados con Lactobacillus plantarum con potencial probiótico
En un segundo ensayo, se evaluó la viabilidad de las bacterias, así como la post-acidificación de la leche de transición fermentada preparada como se describe arriba, pero incubada solamente durante 24 h a 37 °C. Después de la fermentación, se almacenaron las muestras a 4 y 25 °C para someterlas a análisis microbiológicos y fisicoquímicos, como puede verse en la Figura 2.

Figura 2 Flujograma del proceso de producción de leche de transición fermentada con Lactobacillus plantarum con potencial probiótico
Los conteos de bacterias viables para las cuatro fermentaciones se hicieron inmediatamente después de las 24 o 48 h de incubación. Para la leche de transición fermentada a dos temperaturas diferentes, los conteos de células viables se evaluaron a los 0, 10, 20, 30, 40, 50 y 60 días de almacenamiento.
Los sustratos fermentados se diluyeron serialmente a 10-7 en 0.1 % (m/v) de agua de peptona estéril, y se transfirieron porciones alícuotas de 1 ml a cajas de Petri esterilizadas. Luego se añadió medio de agar MRS (HiMedia, Mumbai, India), y se homogeneizó el material mediante el método de vertido en placa. Éste se aplicó dos veces para todos los análisis. Las placas fueron incubadas a 37 °C durante 72 h bajo condiciones aeróbicas, y se realizó un conteo de las unidades formadoras de colonias (UFC). Los resultados se expresaron como log UFC por mililitro de sustrato fermentado.
El pH de los sustratos fermentados se midió utilizando un potenciómetro digital con un electrodo de vidrio combinado (marca Hanna, modelo pH21). La acidez titulable, expresada como % (m/v) de ácido láctico, se determinó mediante titulación ácido-base. Ambos análisis se realizaron después de 0, 10, 20, 30, 40, 50 y 60 días de almacenamiento.
Los datos se sometieron a un análisis de varianza, y se evaluó la significancia de las diferencias entre las medias usando la prueba de Tukey con un intervalo de confianza del 95 % (P<0.05). Se llevaron a cabo análisis de regresión para describir la viabilidad celular, el pH y la acidez titulable como una función del tiempo de almacenamiento a cada temperatura de almacenamiento. Ambos experimentos utilizaron un esquema factorial con cuatro réplicas para cada condición, y el diseño experimental fue totalmente aleatorizado. Los análisis se realizaron usando el Sistema de Análisis Estadístico SAS versión 9.4 (SAS, 2014).
La viabilidad de los microorganismos en los alimentos probióticos es el principal determinante de la funcionalidad de estos productos. En este estudio, los conteos de células viables de los cultivos probióticos fueron superiores a 8.40 log UFC·ml-1 (Cuadro 1). No hubo diferencia significativa en la concentración de L. plantarum en los cuatro sustratos lácteos después del mismo periodo de incubación. La leche de transición permitió el crecimiento viable de las células probióticas a las mismas concentraciones que la leche entera, lo cual sugiere que se debe elegir ésta como sustrato de crecimiento puesto que carece de valor comercial para la industria de los lácteos.
Cuadro 1 Conteos de células viables (log UFC ml-1) de Lactobacillus plantarum en la leche descremada reconstituida (LDR), la leche de transición (LT), la leche entera (LE), y la mezcla de 50 % de LT + 50 % de LE (LET) después de 24 y 48 h de fermentación a 37 °C
| Tiempo de fermentación | Sustrato | |||
|---|---|---|---|---|
| LDR | LT | LE | LET | |
| 24 h | 8.77Aa | 8.67Aa | 8.91Aa | 8.62Aa |
| 48 h | 8.58Aa | 8.82Aa | 8.40Ab | 8.64Aa |
Coeficiente de variación: 2.61 %. Las letras mayúsculas en la misma fila y las letras minúsculas para los valores de la misma columna indican diferencias significativas (P<0.05).
Para la formulación de LE, hubo una reducción significativa (de 30.9 %) en los conteos de células viables entre las 24 y las 48 h de fermentación. En contraste, para las formulaciones de LDR, LT y LET, los conteos de células viables de L. plantarum fueron similares después de 24 y 48 h de fermentación, lo que indica que sólo se requieren 24 h para que el microorganismo alcance concentraciones elevadas en estos sustratos.
En otro estudio, se analizó el crecimiento de las cinco cepas de probiótico en la leche UHT suplementada con triptona y fructuosa, y todas las cepas alcanzaron conteos máximos de células viables de 8.7 a 9.2 log UFC ml-1 después de 6 a 16 h de incubación. Sin embargo, tres cepas presentaron una reducción de 0.4 a 1.1 log UFC en el conteo de células viables a entre 24 y 72 h de incubación17. También se evaluó la fermentación de seis cepas de probióticos durante un periodo de 48 h a diferentes temperaturas con un sustrato de la leche UHT. El máximo crecimiento y los conteos más altos de células viables (8.65 a 9.21 log UFC ml-1) para todas las cepas de Lactobacillus spp. evaluadas se obtuvieron a una temperatura de 37 °C y un tiempo de incubación de 12 a 24 h18.
El sustrato, la cepa y su adaptación al medio de cultivo influyen fuertemente en la tasa de fermentación y la duración de la fase de crecimiento celular. El crecimiento más rápido ocasiona un consumo de nutrientes y una producción de ácido más rápidos, los cuales tienen un impacto ambiental negativo que conduce a una rápida progresión a la fase de disminución. En general, la duración de la fermentación está determinada por el pH; la fermentación continúa hasta que el pH alcanza un valor de 4.5 a 4.6. En la producción de yogurt con diversas especies de probióticos, se reportó una fermentación más rápida en la leche entera que en la leche descremada19. En otro estudio, el tiempo total de fermentación de la leche entera osciló entre 16 y 31 h, dependiendo de la especie evaluada de Lactobacillus spp20.
En este estudio, todas las formulaciones arrojaron conteos de células viables superiores a 6 log UFC g-1 (Cuadro 1), que es el conteo mínimo de células viables requerido para que los productos de Lactobacillus spp. funcionen como probióticos21. Los fabricantes de cultivos de probióticos también recomiendan un conteo mínimo de células viables de 6 log UFC g-1 en la leche fermentada por estas bacterias22. Los resultados de este estudio fueron similares a los reportados por Coman et al23, quienes citan conteos de células viables por encima de 8 log UFC·ml-1 de L. rhamnosus y Lactobacillus paracasei, individualmente o en combinación, al final de la fermentación de la leche entera.
Se considera que la viabilidad y la estabilidad duraderas son prerrequisitos fundamentales para los productos probióticos. Por lo tanto, se midió la viabilidad celular, el pH y la acidez titulable en la leche de transición fermentada durante un periodo de almacenamiento de 60 días a 4 y 25 °C. Como era de esperarse, cada parámetro dependió de la temperatura de almacenamiento (Cuadro 2). Después de 40 días de almacenamiento, los conteos de células viables de la leche de transición fermentada almacenada a 25 °C fueron significativamente inferiores a los del producto almacenado a 4 °C. Asimismo, el almacenamiento de la leche de transición fermentada a 25 °C arrojó un pH significativamente menor después de 10 días y una acidez titulable significativamente mayor después de 20 días, comparada con el almacenamiento a la temperatura de 4 °C.
Cuadro 2 Conteo de células viables, pH y acidez titulable (expresada como % de ácido láctico) de la leche de transición fermentada y almacenada durante 60 días a 4 y 25 °C
| Tiempo (días) | Células viables (log UFC ml-1) |
pH | Ácido láctico (%) |
|||
|---|---|---|---|---|---|---|
| Temperatura | Temperatura | Temperatura | ||||
| 4 °C | 25 °C | 4 °C | 25 °C | 4 °C | 25 °C | |
| 0 | 8.89Aa | 8.89Aa | 5.70Aa | 5.70Aa | 0.37Aa | 0.37Ac |
| 10 | 8.72Aa | 8.56Aa | 5.52Aab | 5.01Bb | 0.42Aa | 0.73Ab |
| 20 | 8.79Aa | 8.02Aab | 5.47Aab | 4.78Bb | 0.53Aa | 0.90Bab |
| 30 | 8.50Aa | 7.63Abc | 5.36Ab | 4.85Bb | 0.55Aa | 0.98Bab |
| 40 | 8.71Aa | 7.63Bbc | 5.36Ab | 4.86Bb | 0.53Aa | 1.03Bab |
| 50 | 8.67Aa | 6.88Bc | 5.43Aab | 4.89Bb | 0.48Aa | 1.14Ba |
| 60 | 8.48Aa | 5.65Bd | 5.37Ab | 4.95Bb | 0.55Aa | 1.19Ba |
Las letras mayúsculas diferentes para los valores de cada parámetro en la misma fila y las minúsculas diferentes para los valores de la misma columna indican diferencias significativas (P<0.05).
Coeficientes de variación: 4.47% (Conteo de células viables); 2.36% (pH); 19.41% (ácido láctico).
El conteo de células viables fue de 8.48 log UFC ml-1 después de 60 días de almacenamiento a 4 °C y se mantuvo sin cambios significativos (P>0.05) durante el periodo de almacenamiento. Sin embargo, cuando el producto se almacenó a 25 °C, hubo una reducción significativa en la viabilidad celular de > 1 ciclo log después de 30 días de almacenamiento. Sin embargo, la reducción fue más pronunciada después de 60 días de almacenamiento, y mostró un conteo de células viables de 5.65 log UFC·ml-1 al final del periodo de almacenamiento (Cuadro 2). La disminución de la viabilidad celular a esta temperatura de almacenamiento podría justificarse por un pH más bajo y una mayor acidez. Utilizando el análisis de regresión, se infiere que el conteo de células viables del producto permaneció dentro de los límites aceptables (>6.5 log UFC ml-1) durante más de 50 días en refrigeración y hasta 50 días a 25 °C (Cuadro 2 y Figura 3). Para un producto probiótico, la estabilidad del conteo de células viables a lo largo de su vida útil es esencial, y la estabilidad de los probióticos a temperatura ambiente es particularmente relevante porque permite a los productores ahorrar energía al almacenar la leche de transición para la alimentación artificial de los terneros.
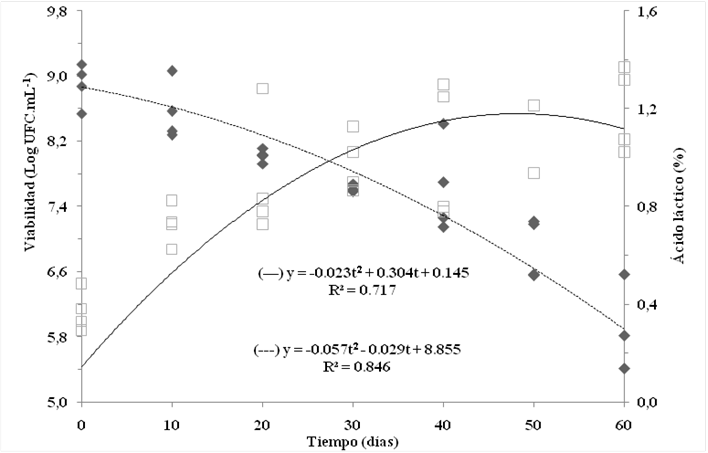
Figura 3 La regresión cuadrática de la viabilidad (---) y la acidez (---) del Lactobacillus plantarum de la leche de transición fermentada como una función del tiempo de almacenamiento (hasta 60 días) a 25 °C. R2: coeficiente de determinación; y: viabilidad o acidez; t: tiempo de almacenamiento
Se han utilizado diferentes tiempos de almacenamiento en refrigeración antes de evaluar la viabilidad de los microorganismos probióticos en los productos fermentados. En el desarrollo de una leche fermentada con L. plantarum, hubo una reducción de 1.2 log UFC en los conteos de células viables cuando el producto se almacenó durante 70 días a 10 °C, lo cual es un resultado satisfactorio24. El análisis de ensilajes de calostro y de la leche de transición demostró que las muestras fermentadas adecuadamente tuvieron una concentración promedio de Lactobacillus spp. de 5.15 log UFC después de 33 días de almacenamiento a 25 °C7.
La leche probiótica fermentada puede ser almacenada durante varias semanas con una pérdida mínima de viabilidad si se logra reducir la acidificación por medio de la refrigeración25. En este estudio, el pH del producto disminuyó significativamente después de 30 días de almacenamiento a 4 °C, llegando a un valor de 5.36 después de ese periodo (Cuadro 2). Cuando el producto se almacenó a 25 °C, su pH bajó de 5.70 a 5.01 después de 10 días de almacenamiento. Según las ecuaciones de regresión, la leche de transición fermentada podría alcanzar su valor mínimo de pH después de 44 y 38 días de almacenamiento a 4 °C y a 25 °C, respectivamente (Figura 4).
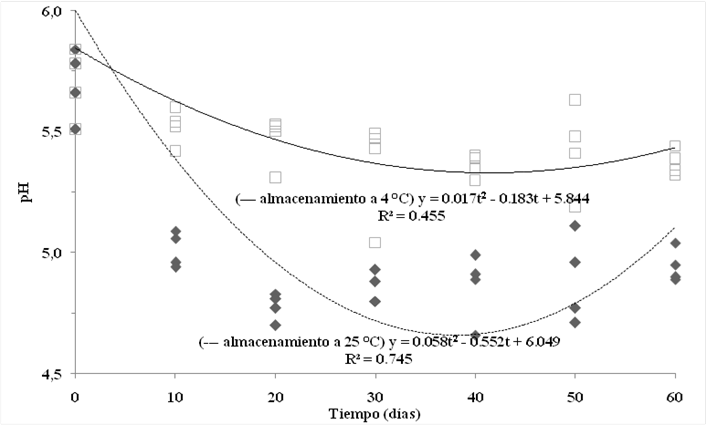
Figura 4 Regresión cuadrática del pH de la leche de transición fermentada como una función del tiempo de almacenamiento (hasta por 60 días) a 25 °C (---) y 4 °C (-). R2: coeficiente de determinación, y: pH; t: tiempo de almacenamiento
El pH afecta la conformación de las proteínas, la actividad de las enzimas y la disociación de los ácidos, y por ende es el parámetro más importante para caracterizar la acidez de la leche y los productos lácteos. Coman et al23 demostraron que, después de la fermentación y del almacenamiento durante 4 semanas a 4 °C, la leche entera fermentada con L. paracasei y L. rhamnosus alcanzó valores mínimos de pH de 5.60 y 4.31, respectivamente26. Otro hecho que debe tomarse en consideración es la disponibilidad de los nutrientes; por ejemplo, la leche fermentada presentó valores de pH de 5.81 para la muestra testigo (sin nutrientes añadidos) y 3.82 para las muestras con nutrientes añadidos (aminoácidos, vitaminas, minerales y nucleótidos) después de 72 h de fermentación27.
La reducción del pH ocasiona un flujo pasivo de protones hacia las células microbianas, que exportan protones de manera activa. El influjo incontrolado de protones debería reducir el pH celular interno, inhibiendo la síntesis de los componentes celulares y la multiplicación de las células. El ácido láctico no disociado puede penetrar la membrana celular y contribuir a la acidificación del citoplasma bacteriano28.
El pH inicial y final, así como otros factores como la producción de ácido orgánico y la exposición a diferentes temperaturas durante el almacenamiento pueden afectar la viabilidad celular durante la fermentación. El crecimiento de los microorganismos indeseables se reduce en los productos con un pH menor de 5.026. En este estudio, el pH de la leche de transición fermentada a 25 °C permaneció por debajo de ese nivel desde los 20 hasta los 50 días (Figura 4).
Ferreira et al29 observaron una rápida reducción del pH cuando el calostro se fermentó naturalmente a 32.5 °C; los productos con valores de pH por debajo de 4.5 se obtuvieron a los 35 días de fermentación. En estudios anteriores, los calostros bovinos, desde la segunda ordeña después del parto, presentaron un valor medio de pH de 5.41 después de 33 días de fermentación a 25 °C7.
En este estudio, la acidez titulable de la leche de transición fermentadas no cambió significativamente (P>0.05) durante el periodo de almacenamiento en refrigeración. Sin embargo, cuando el producto se almacenó a 25 °C, la acidez titulable casi se duplicó después de 10 días, aumentando de 0.37 a 0.73 % de ácido láctico; otro incremento significativo en la acidez ocurrió después de 50 días, llegando al 1.14 %. El análisis de regresión indicó que la leche de transición fermentada almacenada a 25 alcanzó valores máximos de acidez titulable después de 56 días (Figura 4). Estos resultados demuestran que la estabilidad y la viabilidad del producto pueden ser influidas por la acidez, puesto que la cepa utilizada en este estudio es sensible a los ácidos.
La cepa de L. plantarum con potencial probiótico evaluada mostró un crecimiento satisfactorio en cada una de las formulaciones a base de la leche que se sometieron a prueba, dando como resultado altas concentraciones de células viables (> 8 log UFC·ml-1). La leche de transición del tercer día después del parto representa un sustrato útil para el crecimiento de esta bacteria y se puede almacenar hasta por 50 días a temperatura ambiente. Por ende, se ha demostrado que la fermentación de la leche de transición con la cepa L. plantarum es un método viable para producir esos probióticos.
Agradecimientos
Se agradece al Consejo Nacional de Desarrollo Científico y Tecnológico (Conselho Nacional de Desenvolvimento Científico e Tecnológico, CNPq) y a la Fundación de Apoyo a la Investigación de Minas Gerais (Fundação de Apoio à Pesquisa de Minas Gerais, FAPEMIG) por su apoyo financeiro.
REFERENCIAS
1. Chaucheyras-Durand F, Durand H. Probiotics in animal nutrition and health. Benef Microbes 2010;1(1):3-9. [ Links ]
2. Gaggìa F, Mattarelli P, Biavati B. Probiotics and prebiotics in animal feeding for safe food production. Int J Food Microbiol 2010;141(Suppl):S15-28. [ Links ]
3. Nagashima K, Yasokawa D, Abe K, Nakagawa R, Kitamura T, Miura T, et al. Effect of a Lactobacillus Species on Incidence of Diarrhea in Calves and Change of the Microflora Associated with Growth. Biosci Microflora 2010;29(2):97-110. [ Links ]
4. Sanders ME. Probiotics: Definition, sources, selection, and uses. Clin Infect Dis 2008;46(s2):S58-61. [ Links ]
5. Tripathi MK, Giri SK. Probiotic functional foods: Survival of probiotics during processing and storage. J Funct Foods 2014;9(1):225-241. [ Links ]
6. Champagne CP, Raymond Y, Pouliot Y, Gauthier SF, Lessard M. Effect of bovine colostrum, cheese whey, and spray-dried porcine plasma on the in vitro growth of probiotic bacteria and Escherichia coli. Can J Microbiol 2014;60:287-295. [ Links ]
7. Azevedo RA De, Guimarães F, Viegas CR, De Almeida PNM, Geraseev LC, Pinto MS, et al. Silagem de colostro: Riscos microbiológicos e caracterização do pH em função do dia de coleta. Rev Bras Med Vet 2014;36(3):271-276. [ Links ]
8. Saalfeld MH, Pereira DIB, Silveira KRK, Schramm R, Valente J de SS, Borchardt JL, et al. Anaerobically fermented colostrum: an alternative for feeding calves. Ciência Rural 2013;43(9):1636-1641. [ Links ]
9. Azevedo RA De, Araújo L, Coelho SG, Emygdio D, Filho DF. Desempenho de bezerros alimentados com silagem de leite de transição. Pesqui Agropecuária Bras 2013;48(5):545-552. [ Links ]
10. Uruakpa FO, Ismond MAH, Akobundu ENT. Colostrum and its benefits: a review. Nutr Res 2002;22:755-767. [ Links ]
11. Saalfeld MH, Pereira DIB, Borchardt JL, Sturbelle RT, Rosa MC, Guedes MC, et al. Evaluation of the transfer of immunoglobulin from colostrum anaerobic fermentation (colostrum silage) to newborn calves. Anim Sci J 2014;85(11):963-967. [ Links ]
12. Silva KF, Faria, BKA, Reis IMF, Costa MX, Soares ACM, Mariano EGA, et al. Desempenho de bezerras leiteiras suplementadas com Lactobacillus sp.1. In: SBZ 2015. Anais da SBZ 2015- Sociedade Brasileira de Zootecnia. Belo Horizontes: SBZ, 2015. [ Links ]
13. Mattila-Sandholm T, Millärinem R, Crittenden R, Mogensen G, Fondén R, Saarela M. Technological challenges for future probiotic foods. Int Dairy J 2002;12(2-3):173-182. [ Links ]
14. Lane DJ. 16S/23S rRNA sequencing In: Stackebrandt E, Goodfellow M, editors. Nucleic acid techniques in bacterial systematics. Chichester: Wiley; 1991:115-175. [ Links ]
15. Sanger F, Coulson AR. A rapid method for determining sequences in DNA by primed synthesis with DNA polymerase. J Mol Biol 1975;94(3):441-448. [ Links ]
16. Farfour E, Leto J, Barritault M, Barberis C, Meyer J, Dauphin B, et al. Evaluation of the andromas matrix-assisted laser desorption ionization-time of flight mass spectrometry system for identification of aerobically growing gram-positive bacilli. J Clin Microbiol 2012;50(8):2702-2707. [ Links ]
17. Ostlie HM, Helland MH, Wicklund T, Narvhus JA. Growth and metabolism of selected strains of probiotic bacteria in milk. Int J Food Microbiol 2003;87:17-27. [ Links ]
18. Ostlie HM, Treimo J, Narvhus JA. Effect of temperature on growth and metabolism of probiotic bacteria in milk. Int Dairy J 2005;15(10):989-997. [ Links ]
19. Espírito Santo AP do, Perego P, Converti A, Oliveira MN. Influence of milk type and addition of passion fruit peel powder on fermentation kinetics, texture profile and bacterial viability in probiotic yoghurts. LWT - Food Sci Technol 2012;47(2):393-399. [ Links ]
20. Lanciotti R, Patrignani F, Iucci L, Saracino P, Guerzoni ME. Potential of high pressure homogenization in the control and enhancement of proteolytic and fermentative activities of some Lactobacillus species. Food Chem 2007;102(2):542-550. [ Links ]
21. Champagne CP, Ross RP, Saarela M, Flemming K, Charalampopoulos D. International Journal of Food Microbiology Recommendations for the viability assessment of probiotics as concentrated cultures and in food matrices. Int J Food Microbiol 2011;149(3):185-193. [ Links ]
22. Sanders ME. Probiotics: considerations for human health. Nutr Rev 2003;61(3):91-99. [ Links ]
23. Coman MM, Verdenelli MC, Cecchini C, Silvi S, Vasile A, Bahrim GE, et al. Effect of buckwheat flour and oat bran on growth and cell viability of the probiotic strains Lactobacillus rhamnosus IMC 501®, Lactobacillus paracasei IMC 502® and their combination SYNBIO®, in synbiotic fermented milk. Int J Food Microbiol 2013;167(2):261-268. [ Links ]
24. Souza AHP de, Costa GAN, Miglioranza LH da S, Furlaneto-Maia L, Oliveira AF. Microbiological, physical, chemical and sensory characteristics of milk fermented with Lactobacillus plantarum. Acta Sci Heal Sci 2013;35(1):125-131. [ Links ]
25. Soto LP, Frizzo LS, Bertozzi E, Diaz A, Marti LE, Santina RD, et al. Milk evaluation as growth and cold preservation medium of a probiotic inoculum for young calves. J Anim Vet Adv 2009;8(7):1353-1560. [ Links ]
26. Donkor ON, Henriksson A, Vasiljevic T, Shah NP. Effect of acidification on the activity of probiotics in yoghurt during cold storage. Int Dairy J 2006;16(10):1181-1189. [ Links ]
27. Ma C, Cheng G, Liu Z, Gong G, Chen Z. Determination of the essential nutrients required for milk fermentation by Lactobacillus plantarum. LWT - Food Sci Technol 2016;65:884-889. [ Links ]
28. Kashket ER. Bioenergetics of lactic acid bacteria: cytoplasmic pH and osmotolerance . FEMS Microbiol Rev 1987;46:233-244. [ Links ]
29. Ferreira LS, Silva JT, Paula MR de, Soares MC, Bittar CMM. Colostrum silage: fermentative, microbiological and nutritional dynamics of colostrum fermented under anaerobic conditions at different temperatures. Acta Sci Anim Sci 2013;35(4):395-401. doi: 10.4025/actascianimsci.v35i4.19870. [ Links ]
Recibido: 23 de Mayo de 2018; Aprobado: 04 de Junio de 2019











 text in
text in 


