La recuperación de la competencia reproductiva posparto en las vacas lecheras depende principalmente del tiempo que tome la involución uterina y del inicio de la actividad ovárica1. Las patologías uterinas posparto incrementan el periodo del parto al primer servicio, generan bajas tasas de gestación en el primer servicio, incrementan el número de días abiertos, aumentan el número de vacas eliminadas y provocan importantes pérdidas económicas por baja en la producción y por el costo de los tratamientos1,2. Entre los principales factores de riesgo de las patologías uterinas posparto, está la retención de las membranas fetales (RMF)1,3,4.
Dentro de las estrategias para prevenir y tratar las patologías uterinas se ha considerado el uso de la prostaglandina F2α (PGF2α). La evaluación del uso de la PGF2α como herramienta de manejo en la prevención de patologías uterinas ha arrojado resultados contradictorios5. Uno de los primeros hallazgos que demuestran la importancia de las PGF2α en la involución uterina, es la correlación negativa entre las concentraciones de PGF2α posparto con el tiempo de involución uterina6,7. Gross et al8 encontraron un efecto favorable de la administración de PGF2α inmediatamente después del parto en la disminución de la incidencia de RMF en animales a los cuales se les indujo el parto con dexametasona; sin embargo, estos resultados contrastan con lo obtenido en otro estudio similar9.
Ortega et al10, observaron que la administración de dos inyecciones de prostaglandinas en las primeras 48 h posparto, disminuyó el porcentaje de vacas que presentaron RMF, redujo el tiempo del parto al primer estro, y aumentó el número de vacas gestantes en el día 90 posparto; sin embargo, no hay otro estudio que corrobore dichos resultados. Por tanto, en el presente trabajo se probó si la administración de dos inyecciones de PGF2α en las primeras 48 h posparto (primeras 12 y 48 h posparto), disminuye la incidencia de RMF y de patologías uterinas en vacas lecheras.
El presente trabajo se realizó durante los meses de agosto a noviembre de 2014, en un establo lechero de manejo intensivo de 3,200 vacas en ordeño, con una producción promedio de 10,000 kg por lactación. Se utilizaron 800 vacas de diferente número de partos alimentadas con una ración integral, según las recomendaciones del NRC11.
Veintiún días antes del parto las vacas se trasladaron a un corral de acuerdo con su número de parto (primíparas o multíparas). Después del parto, las vacas se alojaron en el corral de vacas frescas de acuerdo, también, con su número de parto, en los cuales permanecieron hasta el día 21 posparto (pp).
Todas las vacas recibieron sistemáticamente tres inyecciones de PGF2α con un intervalo de 14 días a partir del día 26 ± 3 pp. Las vacas que se detectaron en estro después del periodo voluntario de espera (45 días), se inseminaron. Los animales no detectados en estro se enrolaron en un protocolo de sincronización e inseminación artificial a tiempo fijo (CoSynch). El diagnóstico de gestación se realizó por medio de palpación transrectal entre los días 40 y 50 post inseminación.
El manejo de los animales durante el experimento fue aprobado por el Subcomité Institucional para el Cuidado y Uso de Animales Experimentales (SICUAE) del Posgrado en Ciencias de la Producción y de la Salud Animal de la Universidad Nacional Autónoma de México.
Diez días antes del parto las vacas se asignaron aleatoriamente a dos diferentes tratamientos: PGF2α (n= 400), recibieron 500 μg de Cloprostenol sódico (Celosil®; MSD Animal Health, México) vía intramuscular dentro de las primeras 12 h posparto (1 a 12 h) y una segunda inyección 48 h después; testigo (n= 400), no recibieron PGF2α. La proporción de vacas primíparas (33 %) y multíparas (67 %), la condición corporal al parto (3.8 ± 0.3), la proporción de partos gemelares (2.9 %) y partos asistidos (44 %) fueron similares entre las vacas tratadas con PGF2α y las testigo (P>0.10).
Todas las vacas se examinaron por vía transrectal en los días 14, 21 y 28 posparto, para determinar el grado de involución y hacer el diagnóstico de patologías uterinas. Se registró la incidencia de patologías uterinas de acuerdo con el criterio de Sheldon et al12. Se consideró como RMF a aquellas vacas que no eliminaron la placenta en las siguientes 24 h posparto; metritis, vacas con retraso en la involución uterina con descargas purulentas (primeros 21 días pp), sin signos de enfermedad sistémica, y endometritis vacas con descargas mucopurulentas (~50 pus % y 50% moco) (después de 21 días pp). A los animales que resultaron positivos a cualquiera de las patologías descritas, se les aplicaron los tratamientos farmacológicos utilizados en el hato. Se evaluó el tiempo trascurrido del parto al primer servicio; tasa de gestación en el primer servicio (proporción de vacas gestantes del total inseminado) y tasa de gestación acumulada en el día 150 posparto.
El efecto de cada factor en la presentación de RMF se determinó por medio de regresión logística múltiple. La RMF se consideró como variable dependiente, mientras que el tratamiento, tipo de parto (simple o gemelar), dificultad de parto (asistido o no asistido), número de partos (primíparas o multíparas), sexo de la cría (macho o hembra) se consideraron como variables independientes13. La tasa de gestación en el primer servicio y la tasa de gestación acumulada en el día 150 posparto, también se analizaron mediante modelos de regresión logística múltiple considerando, además de la variables independientes mencionadas anteriormente, a la RMF (vacas con o sin RMF) y la salud uterina al día 28 posparto [involución normal o patologías uterinas (metritis o endometritis)]. El modelo se estableció de acuerdo al método propuesto por Hosmer y Lemeshow14 de modo análogo al usado por López-Gatius et al15. El modelo final se construyó mediante la técnica de eliminación manual paso a paso, que comprende: la selección preliminar de todas la variables para las asociaciones univariadas; la construcción de un modelo completo utilizando las variables significativas que resultaron del análisis univariado; la eliminación gradual de las variables no significativas del modelo completo; la comparación del modelo reducido con el modelo anterior para el ajuste del modelo y los factores de confusión; la evaluación de las interacciones entre las variables y la evaluación del ajuste del modelo mediante estadística de Hosmer-Lemeshow14. En el análisis univariado el valor de P<0.25 se utilizó como criterio de inclusión en el modelo inicial y se continuó depurando el modelo dejando sólo los efectos principales (P<0.05).
La proporción de vacas con metritis o endometritis en los días 14, 21 y 28 posparto de los grupos tratado con PGF2α y testigo, así como entre vacas con RMF y sin RMF, se comparó mediante un análisis de sobrevivencia (Kaplan-Meier). Las curvas se compararon mediante la prueba de Log-rank. Los días al primer servicio, se analizaron mediante un análisis de varianza (ANOVA).
El tratamiento con PGF2α en las primeras horas posparto redujo la incidencia de RMF (17.5 vs 11 %; testigo y PGF2α, respectivamente; razón de probabilidades 1.69; intervalo de confianza 95%= 1.12-2.55; P<0.01). La disminución de la incidencia de RMF observada en este trabajo concuerda con lo encontrado por Ortega et al10, quienes aplicaron el mismo tratamiento en condiciones similares a las del presente estudio y obtuvieron una reducción en la RMF (3 vs 10 %; vacas tratadas y testigo, respectivamente). Cabe destacar que en el presente estudio la reducción de la RMF fue de 37 % con respecto a las vacas testigo, mientras que en el trabajo de Ortega et al10 fue de 70 %. No obstante, los resultados son alentadores, ya que muestran que aún en un hato con incidencia elevada de RMF (17.5 %), en el cual habría más factores de riesgo de RMF16, el tratamiento con PGF2α reduce esta patología.
El mecanismo por el cual la administración de PGF2α en las primeras horas posparto reduce la RMF se desconoce. En algunos estudios se ha propuesto que la PGF2α facilita el proceso de separación y expulsión de la placenta; así, se ha encontrado a nivel caruncular una alteración en la síntesis de PGF2α en vacas con RMF17. Además, la relación de PGF2α:PGE2 en las vacas que no presentan RMF es mayor a favor de la PGF2α, lo que indica la importancia de altos niveles de esta hormona a nivel caruncular para la expulsión de la placenta18,19. Dentro de la patogenia de la RMF, se destaca el papel de los neutrófilos; se menciona que existe una alteración en la actividad de los neutrófilos a nivel uterino en aquellos animales que presentan RMF20,21. Se ha observado que la inducción del parto con dexametasona es un factor de riesgo para la RMF, ya que este tratamiento inhibe la actividad de los neutrófilos en la unión de la carúncula y el cotiledón16. Cabe señalar que en el presente estudio, la inyección que pudo influir en la eliminación de la placenta fue la que se aplicó en las primeras 12 h posparto, ya que al momento de la segunda inyección (48 h después) ya se había determinado qué vacas tuvieron RMF; es prudente mencionar que el tiempo de corte para diagnosticar un caso de RMF fue a las 24 h posparto. No obstante, el tratamiento con las dos inyecciones de PGF2α tuvo efectos en otras variables reproductivas que se discuten más adelante.
Un mecanismo del efecto favorable de la administración de PGF2α en la RMF propuesto por Salgado et al22, está asociado con las concentraciones sanguíneas de calcio. Así, en su estudio las vacas que recibieron PGF2α en un tratamiento similar al del presente trabajo, tuvieron mayores concentraciones circulantes de calcio en los primeros siete días posparto que las vacas testigo. Estos investigadores proponen que la administración de PGF2α incrementa la calcemia, lo cual subsana parcialmente las hipocalcemia subclínica que padecen las vacas lecheras durante los primeros días posparto23. Estos hallazgos tendrían relación con el proceso de expulsión de la placenta y con las patologías uterinas, ya que se ha encontrado mayor incidencia de patologías uterinas en vacas con hipocalcemia24,25. El efecto negativo de los bajos niveles de calcio posparto, puede explicarse por la disminución de la actividad fagocitaria de los neutrófilos en vacas con hipocalcemia25; asimismo, los neutrófilos liberan proteasas y colagenasa que favorecen la expulsión de la placenta, procesos calcio dependientes26. No obstante el desconocimiento del mecanismos de acción de la inyección de PGF2α, la obtención de una respuesta positiva en la incidencia de RMF similar a la observada por Ortega et al10 ofrece bases consistentes para realizar futuras investigaciones que expliquen en qué procesos influye la PGF2α para facilitar la expulsión de la placenta.
Por otro lado, se observó en el presente estudio que el parto gemelar incrementa la probabilidad de presentar RMF (razón de probabilidades 5.19; intervalo de confianza 95%= 2.5-13.85; P<0.01), lo cual es congruente con la información publicada, ya que la manipulación uterina durante el parto gemelar incrementa el riesgo de RMF27. Sin embargo, la asistencia en el parto no tuvo un efecto significativo en la RMF (P>0.05), lo cual es diferente a lo esperado, ya que la distocia también es un factor de riesgo de RMF16. Cabe mencionar que el dato de distocias no aparece en los registros del hato, sólo se anota asistencia en el parto independientemente del grado de ayuda; así, la asistencia al parto registrada fue de 43.7 % en el grupo tratado con PGF2α y 45.2 % en el testigo.
De acuerdo con el análisis de Kaplan-Meyer, las vacas tratadas con PGF2α tuvieron menor prevalencia de metritis o endometritis (Figura 1; P<0.05) que las vacas testigo (90.3 vs 91.5; 70.5 vs 73.5; 29.8 vs 36.7; en los días 14, 21 y 28, respectivamente), lo cual pudo ser un efecto de la menor incidencia de RMF observada en las vacas tratadas con PGF2α. Esta posibilidad es congruente con los resultados del análisis de sobrevivencia realizado en vacas con RMF y sin RMF, en el cual se observa que las vacas con RMF tuvieron mayor prevalencia de patologías uterinas que las vacas sin RMF (Figura 2; P<0.01); se menciona que la RMF es uno de los principales factores de riesgo de metritis y endometritis3,4.

Una inyección de PGF2α en las primeras 12 h posparto y una segunda inyección a las 48 h posparto (─▲─), y testigos (─■─); P<0.05.
Figura 1 Curva de sobrevivencia para la proporción de vacas con patologías uterinas en los primeros 28 días posparto tratadas con prostaglandinas (PGF2α)
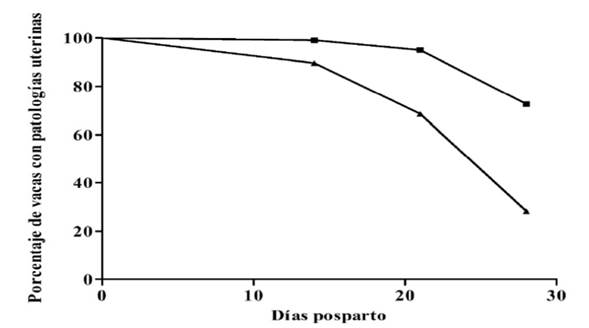
Figura 2 Curva de sobrevivencia para la proporción de vacas con patologías uterinas en los primeros 28 días posparto en vacas con RMF (─■─) y sin RMF (─▲─); P<0.01
El tratamiento con PGF2α no afectó la probabilidad de gestación en el primer servicio. Las vacas de parto asistido tuvieron la misma probabilidad de quedar gestantes en su primer servicio en comparación con las vacas de parto no asistido (Cuadro1). Las variables sexo de la cría, tipo de puerperio, RMF, tipo de parto y su interacción con el tratamiento no afectaron la probabilidad de gestación en el primer servicio (P>0.10).
Cuadro 1 Razón de probabilidades (RP) para la gestación en el primer servicio de acuerdo a las variables en el modelo de regresión logística
| Variables | Clases | n | Tasa de gestación | RP | IC 95% | P |
|---|---|---|---|---|---|---|
| Tratamiento | Testigo | 344 | 24.1 | Referencia | ||
| PGF2α | 350 | 22.8 | 0.91 | 0.64-1.30 | 0.62 | |
| Dificultad al | No asistido | 389 | 24.9 | 1.38 | 0.95-2.00 | 0.08 |
| Parto | Asistido | 305 | 21.6 | Referencia | ||
| Número de | Primíparas | 236 | 31.3 | 2.02 | 1.40-2.92 | 0.01 |
| partos | Multíparas | 458 | 19.4 | Referencia |
El tratamiento con PGF2α no afectó la tasa acumulada de gestación en el día 150 posparto. Las vacas que padecieron patologías uterinas en el día 28 posparto tuvieron menor probabilidad de estar gestantes en el día 150 posparto (Cuadro 2). El mecanismo por el cual una infección uterina posparto afecta negativamente el establecimiento de la gestación no está determinado; algunas evidencias muestran efectos nocivos de las endotoxinas en el endometrio, en el desarrollo folicular y en el desarrollo embrionario28. Además, las vacas con patologías uterinas tienen mayor riesgo de padecer endometritis subclínica, la cual afecta negativamente la tasa de gestación en el primer servicio e incrementa el riesgo de pérdidas embrionarias y fetales29. Los factores como sexo de la cría, dificultad de parto y tipo de parto no afectaron la probabilidad de gestación acumulada en el día 150 posparto, ni hubo interacción con el tratamiento (P>0.10).
Cuadro 2 Razón de probabilidades (RP) para la gestación en el día 150 posparto de acuerdo a las variables en el modelo de regresión logística
| Variables | Clases | n | Tasa de gestación | RP | IC 95% | P |
|---|---|---|---|---|---|---|
| Tratamiento | Testigo | 336 | 59.8 | Referencia | ||
| PGF2α | 341 | 62.4 | 1.10 | 0.80-1.50 | 0.53 | |
| Número de | Primíparas | 236 | 67.3 | 1.47 | 1.06-2.06 | 0.02 |
| parto | Multíparas | 441 | 57.8 | Referencia | ||
| Salud uterina* | Normal | 377 | 64.9 | 1.40 | 1.02-1.92 | 0.03 |
| Patologías | 300 | 56.3 | Referencia | |||
| Tipo de parto | Simple | 657 | 61.9 | 2.46 | 0.96-6.34 | 0.06 |
| Gemelar | 20 | 35.0 | Referencia |
* Día 28 posparto.
El intervalo del parto al primer servicio fue similar (P>0.05) entre las vacas tratadas con PGF2α y las testigo [68 ± 1.1 vs 65 ± 1.1 días (media ± error estándar); grupos PGF2α y testigo, respectivamente]. Se esperaba, sin embargo, que los efectos en la salud uterina provocados por las dos inyecciones de PGF2α se reflejaran en menor intervalo del parto al primer servicio. No obstante, cuando se compararon los grupos con involución normal o patológica en el día 28 posparto independientemente de si fueron tratados o no con PGF2α, las vacas con patologías uterinas tuvieron mayor intervalo al primer servicio (71 ± 1.1 días; P<0.01) en comparación con las vacas con involución normal (62 ± 1.0 días), lo cual es congruente con los efectos que tienen las infecciones uterinas en el inicio de la actividad ovárica posparto y en la salud uterina al momento del primer servicio1,5.
Las vacas de primer parto fueron más fértiles que las vacas multíparas (Cuadros 1 y 2); así, tanto la tasa de gestación en el primer servicio, como la tasa acumulada de gestación en el día 150 posparto fue mayor en las vacas primíparas que en las multíparas. Esta observación es congruente con otros estudios30,31.
Se concluye que dos inyecciones de PGF2α, en las primeras 48 h posparto (primeras 12 y 48 horas posparto) disminuyen la incidencia de retención de membranas fetales y de patologías uterinas en vacas lecheras.











 nueva página del texto (beta)
nueva página del texto (beta)


