INTRODUCCIÓN
La mastitis bovina es una enfermedad compleja con alta prevalencia a nivel mundial, por lo que ésta continua siendo un problema para la industria lechera, debido a las pérdidas económicas por la reducción en la producción de leche, desecho del producto, descarte temprano de animales enfermos y servicios veterinarios1. Se han asociado a la enfermedad diversas especies de microorganismos, sin embargo, solo un grupo reducido de especies bacterianas son los agentes causales más comunes de la enfermedad, que de acuerdo con su origen se clasifican como patógenos contagiosos o ambientales2. Los primeros, son aquellos adaptados a sobrevivir dentro de la glándula mamaria y pueden causar infecciones asintomáticas. Los principales miembros de este grupo son Staphylococcus aureus, Streptococcus agalactiae y Mycoplasma spp2,3. Por otro lado, los patógenos ambientales son oportunistas y no están adaptados a sobrevivir en la glándula mamaria. Este grupo incluye a Streptococcus spp no agalactiae, Enterococcus spp, Staphylococus coagulasa-negativos y bacterias coliformes. De estos últimos el patógeno más importante es Escherichia coli2,3.
Generalmente, E. coli es considerada una bacteria no patógena que habita en el intestino de humano y animales. No obstante, se han descrito varios patotipos clasificados como patógenos intestinales o extraintestinales4. Para el caso de E. coli causante de mastitis, a la fecha no se han identificado cepas o factores de virulencia específicos, pero se ha propuesto que forman un nuevo patotipo denominado Mammary Pathogenic E. coli (MPEC)5. Sin embargo, se ha observado gran diversidad tanto genética como en los factores de virulencia entre esas bacterias6,7. De estos últimos factores, muchos son comunes con los patotipos de humanos e incluyen toxinas, adhesinas, producción de cápsula, la habilidad para resistir el complemento sérico y sistemas de adquisición de hierro7-9.
Entre las estrategias para el control de la mastitis, la principal es la terapia con antibióticos, aunque frecuentemente el tratamiento falla debido a la creciente resistencia bacteriana a dichos compuestos10. Además, el uso indiscriminado de antibióticos para el tratamiento de infecciones y como promotores de crecimiento en animales, ha favorecido el desarrollo de resistencia bacteriana, que puede ser transmitida a patógenos de animales o humanos11. Por esto, el ganado bovino es considerado un reservorio importante de bacterias que llevan genes de resistencia para antibióticos beta-lactámicos de espectro extendido, tetraciclinas, quinolonas, aminoglucósidos, entre otros10. Por lo anterior, la mastitis bovina es considerada un problema de salud pública debido a la contaminación de la leche con bacterias patógenas resistentes a los antibióticos12.
Entre los principales mecanismos de resistencia bacteriana a los antibióticos se encuentran la producción de beta-lactamasas de espectro extendido (BLEE), especialmente en bacterias Gram negativas. Las principales familias de BLEE son las de tipo CTX-M, TEM, CMY, SHV y OXA13,14. De acuerdo con lo anterior, se ha observado incremento en la detección de beta-lactamasas en bacterias de origen animal12. También, la resistencia a antibióticos en bacterias Gram negativas incluye la presencia de sistemas de expulsión, como los codificados por los genes tetA-G, asociados con resistencia a tetraciclina15. De igual forma, la resistencia puede ser debida a la presencia de enzimas que modifican e inactivan a los antibióticos, como aquellas que confieren resistencia a estreptomicina codificada por los genes strA-strB16. Frecuentemente los genes de resistencia están asociados a plásmidos conjugativos e integrones, que son los principales elementos involucrados en la diseminación de la resistencia a antibióticos entre bacterias Gram negativas17.
La región occidente de Michoacán, México, es una zona productora de leche muy importante, sin embargo, a la fecha no hay información sobre los principales patógenos causantes de la mastitis bovina, así como de los perfiles fenotípicos y genotípicos de su resistencia a los antibióticos. Por tanto, el objetivo del presente trabajo fue estudiar los patrones de resistencia a los antibióticos de E. coli aisladas de mastitis bovina, analizar la prevalencia de genes de virulencia y de resistencia para beta-lactámicos, tetraciclina, estreptomicina y quinolonas, así como su asociación con integrones clase 1.
MATERIAL Y MÉTODOS
Detección de mastitis y toma de muestras
Este trabajo se desarrolló durante 2013, como parte de un programa regional para el estudio de la mastitis en el occidente de Michoacán, México. En el estudio se incluyeron nueve establos con un tamaño de 7 a 64 vacas. La mastitis se detectó mediante la aplicación de la prueba de California (PC) (Sanfer, México), siguiendo las instrucciones del fabricante. La PC se realizó en los cuatro cuartos de cada vaca, y de los cuartos que dieron positivo a la prueba se colectó una muestra de 30 ml de leche en tubos estériles. Previo a la colecta de la muestra, los cuartos se desinfectaron con algodón humedecido con alcohol al 70 %, desechando los primeros chorros de leche. Las muestras colectadas se transportaron a 4 °C en hielo al laboratorio y se procesaron el mismo día.
Aislamiento de E. coli
De cada una de las muestras se inocularon 100 µl en agar MacConkey (Difco, USA) y se incubaron por 24 h a 37 °C. A partir de las muestras en que se observó crecimiento, se seleccionó al azar una colonia fermentadora de lactosa para su análisis, la cual fue estriada en agar Eosina Azul de Metileno (Difco, USA) y se le realizó tinción de Gram. De estas últimas se seleccionaron 34 colonias típicas de E. coli y se identificaron bioquímicamente de acuerdo a la literatura18. Las principales pruebas que se realizaron fueron fermentación de glucosa y lactosa, así como producción de gas y H2S en agar Kligler con Hierro, IMViC (indol, rojo de metilo, Voges-Proskauer y citrato), oxidasa, catalasa, ureasa y producción de fluorescencia en medio EC-MUG.
Extracción de ADN
El ADN se preparó a partir de 500 µl de un cultivo de toda la noche. Las células se centrifugaron a 13,000 rpm por 2 min. Después, el sobrenadante se descartó y las células se resuspendieron en 1 ml de agua destilada estéril y se llevaron a ebullición por 10 min. La mezcla resultante se centrifugó por 5 min a 13,000 rpm y el sobrenadante se utilizó directamente como DNA molde o se almacenó a -20 °C hasta su uso19.
Análisis molecular de los aislados de E. coli
Para confirmar la identidad de los aislados se amplificaron fragmentos de los genes uidA y lacZ con los primers uidA-F/uidA-R y lacZ-F/lacZ-R, respectivamente (Cuadro 1). Las amplificaciones por PCR se realizaron de acuerdo a la metodología descrita20. Por otro lado, mediante PCR multiplex con los primers enlistados en el Cuadro 1, se analizó la presencia de genes de virulencia característicos de las dos principales variantes de E. coli patógenas de humanos, E. coli enteropatógena (EPEC) y E. coli enterohemorrágica (EHEC). Los genes analizados fueron eaeA, que codifica para la intimina y es común a EPEC y EHEC, bfpA, que codifica para la pilina del pilus tipo IV de EPEC y stx2, que codifica para la toxina Shiga tipo 2 de EHEC. Las reacciones de PCR se realizaron como se describió previamente21.
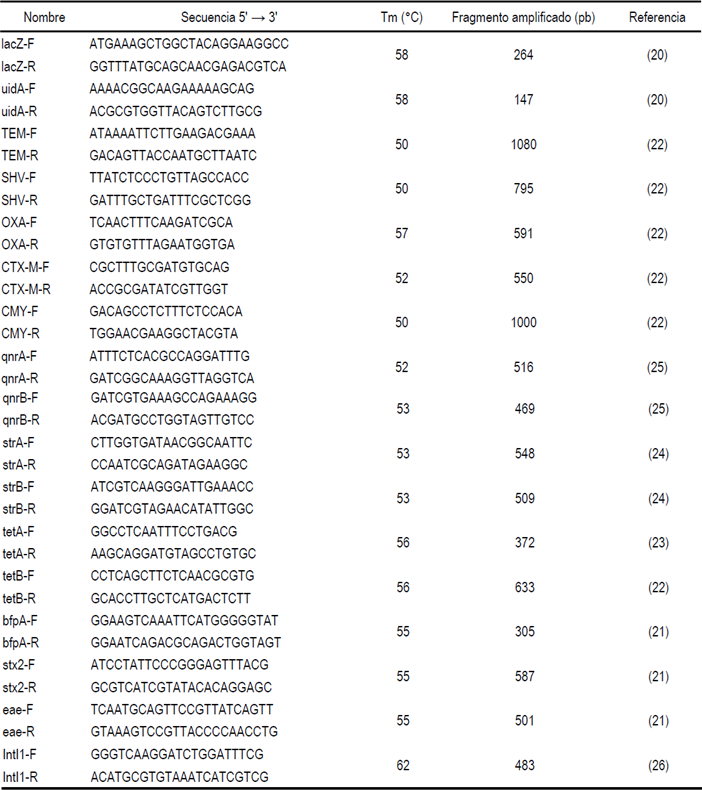
Cuadro 1 Oligonucleótidos usados con su temperatura de alineamiento (Tm) y el fragmento amplificado esperado
Para la detección de los genes de resistencia en E. coli, los extractos de ADN total se utilizaron para amplificar por PCR fragmentos de los genes bla TEM, bla SHV, bla CTX-M, bla CMY y bla OXA22. También, se amplificaron los genes de resistencia a tetraciclina tetA y tetB con primers descritos previamente22,23, así como genes de resistencia a estreptomicina strA y strB24 y de resistencia a quinolonas qnrA y qnrB25. Los genes se seleccionaron debido a los altos índices de resistencia de las E. coli a los antibióticos beta-lactámicos, tetraciclina y estreptomicina. Además, los genes de resistencia se han asociado frecuentemente a integrones clase 1, por lo cual se analizó la presencia del gen que codifica para la integrasa intI126. Las características de las secuencias de los primers se enlistan también en el Cuadro 1. En general, las mezclas de reacción para las amplificaciones se realizaron en un volumen de 25 µl conteniendo: 1X de Master mix (Promega, USA), 0.5 µM de cada primer y 1 µl de extracto total de ADN. Las reacciones de PCR se realizaron en un termociclador C1000 (Bio-Rad, México). La amplificación se inició con un ciclo de desnaturalización a 95 °C por 5 min seguido de 35 ciclos a las siguientes temperaturas: desnaturalización a 95 °C por 40 seg, alineamiento a la temperatura indicada en el Cuadro 1 para cada par de oligonucleótidos por 40 seg, extensión a 72 °C por 1 min y un ciclo final de extensión a 72 °C por 5 min. Los fragmentos amplificados se separaron por electroforesis en geles de agarosa al 1%, se tiñeron con bromuro de etidio y se visualizaron en un fotodocumentador Gel Doc Universal Hood II (Bio-Rad, México).
Pruebas de resistencia a los antibióticos
Las pruebas de susceptibilidad se realizaron por ensayos de difusión en disco en agar Mueller-Hinton (Difco, USA), para lo cual se preparó una suspensión bacteriana equivalente a la turbidez del tubo 0.5 de la escala de McFarland (1-2 x 108 UFC/ml). Después, se distribuyeron 200 μl de la suspensión bacteriana sobre la superficie del agar Müeller-Hinton (Difco, USA). Posteriormente, se colocaron los multidiscos para Gram negativos II (Bio-Rad, México), con los siguientes antibióticos a las cantidades indicadas: amikacina (30 µg), ampicilina (10 µg), levofloxacina (5 µg), cefalotina (30 µg), cefotaxima (30 µg), ceftriaxona (30 µg), cloramfenicol (30 µg), gentamicina (10 µg), netilmicina (30 µg), nitrofurantoina (300 µg), cefepima (30 µg) y trimetoprim-sulfametoxazol (25 µg). Las zonas de inhibición se midieron, y de acuerdo a las instrucciones del fabricante los aislados se clasificaron como resistentes (R), intermedios (I) o sensibles (S). La resistencia a tetraciclina, kanamicina y estreptomicina (Sigma Aldrich, México) se analizó mediante el método de microdilución y se interpretó de acuerdo a los criterios del CLSI27. Los aislados se clasificaron como resistentes si las concentraciones mínimas inhibitorias (CIM) fueron ≥16 µg/ml para tetraciclina, ≥25 µg/ml para kanamicina y ≥32 µg/ml para estreptomicina.
RESULTADOS
De acuerdo a la PC, la prevalencia de mastitis subclínica en el área estudiada fue de 49 %, ya que 148 de 302 vacas dieron positivo a la prueba en al menos uno de los cuartos. En total se colectaron 120 muestras de leche de las vacas con mastitis, 28 no se pudieron obtener por dificultades técnicas durante la toma de muestras. De las muestras colectadas, en 51 (42.5 %) se obtuvo crecimiento en agar MacConkey, de éstas se seleccionó una colonia representativa fermentadora de lactosa y se confirmó como Gram negativa. Treinta y cuatro (66.7 %) colonias fermentadoras de lactosa se identificaron bioquímicamente como E. coli y en todas ellas se amplificaron fragmentos de los genes uidA y lacZ (Figura 1A). Además, en 4/34 (11.8 %) aislados de E. coli, se detectó el gen de virulencia para la intimina (eaeA), pero en ningún aislado se identificaron los genes de virulencia bfpA o stx2 (Figura 1B).
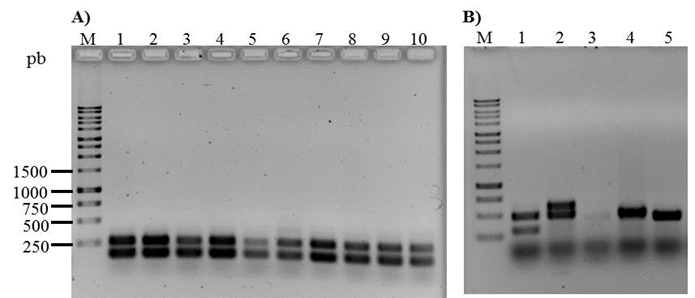
Figura 1 Confirmación molecular de E. coli y detección de genes de virulencia. A) M, marcador de ADN 1 Kb plus; 1, control positivo para lacZ/uidA (EPEC); 2-10, aislados representativos positivos para lacZ/uidA genes. B) M, marcador de ADN 1 Kb plus; 1, control positivo para eaeA/bfpA (EPEC); 2, control positivo para eaeA/stx2 (EHEC); 3, aislado negativo para eaeA/stx2/bfpA; 4 y 5, aislados representativos positivos para eaeA
Perfiles de resistencia a los antibióticos
Los ensayos de susceptibilidad a los antimicro-bianos de las E. coli (n= 34) revelaron que todas fueron resistentes a uno o más antibióticos (Cuadro 2). Los compuestos a los cuales mostraron mayores índices de resistencia fueron a tetraciclina (88.2 %), ampicilina (76.5 %) y cefalotina (73.5 %). Índices de resistencia menores que van de 38.2 al 2.9 % se observaron en los restantes 12 antibióticos. Además, se observó resistencia intermedia principalmente para cefotaxima (64.7 %), nitrofurantoína (52.9 %) y ceftriaxona (47 %). Por otro lado, se observaron altos índices de susceptibilidad para trimetoprim-sulfametoxazol (97 %), levofloxacina (91.2 %), kanamicina (88.2 %), cefepima (85.3 %), netilmicina (85.3 %), gentamicina (82.4 %), amikacina (73.5 %), cloranfenicol y estreptomicina (61.8 %), respectivamente. Se observaron 26 patrones de resistencia distintos entre los 34 aislados de E. coli, siendo los patrones observados con mayor frecuencia, los de resistencia a tetraciclina y ampicilina-cefalotina-nitrofurantoína-tetraciclina con cuatro aislados cada uno. Adicionalmente, 25 (73.5 %) aislados se clasificaron como multirresistentes, ya que toleraron tres o más antibióticos diferentes, de los cuales, 12 (35.3 %) presentaron resistencia de 5 a 8 antibióticos (Cuadro 3).
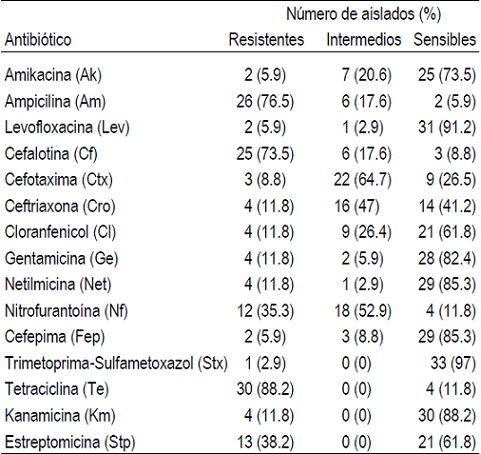
Cuadro 2 Perfiles de susceptibilidad a los antibióticos de las 34 E. coli aisladas de mastitis bovina
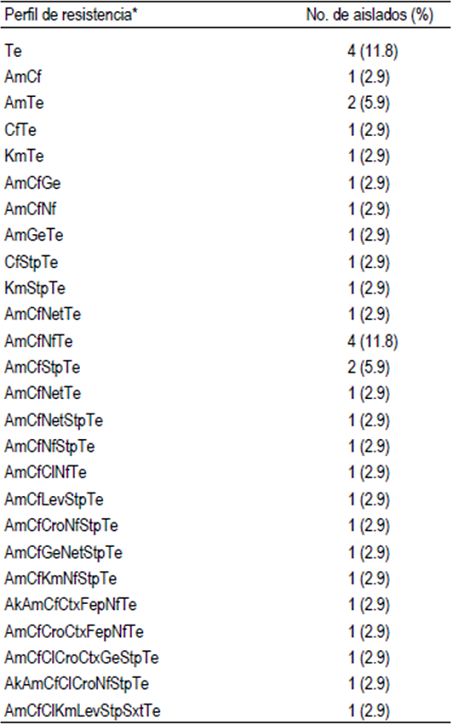
*Abreviaciones, Ak amikacina, Am ampicilina, Lev levofloxacina, Cf cefalotina, Ctx cefotaxima, Cro ceftriaxona, Cl cloranfenicol, Ge gentamicina, Net netilmicina, Nf nitrofurantoína, Fep cefepima, Sxt trimetoprima-sulfametoxazol, Te tetraciclina, Km kanamicina, Stp estreptomicina.
Cuadro 3 Patrones de resistencia de las E. coli
Presencia de genes de resistencia e integrones clase 1 en E. coli
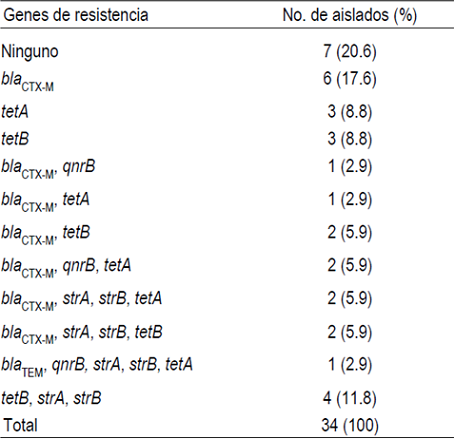
De los 11 genes de resistencia analizados, se logró detectar la presencia de 7 en 27 (79.4 %) E. coli (Figura 2A). El más frecuente fue bla CTX-M presente en 16 (47 %) aislados, seguido por tetB en 11 (32.3 %), tetA, strA, strB en 9 (26.5%), respectivamente; qnrB en 4 aislados y bla TEM en 1 (2.9 %) aislado (Cuadro 4). Adicionalmente, los genes de resistencia identificados se presentaron solos (12 aislados) o en diferentes combinaciones (15 aislados). De estos últimos, 10 aislados positivos para bla CTX-M presentaron seis arreglos distintos con los genes strA, strA, tetA, tetB y qnrB; mientras que el arreglo tetB-strA-strB se encontró en cuatro aislados y bla TEM-tetA-strA-strB en un aislado. Sin embargo, de las 34 E. coli, solo dos (5.9 %) aislados multirresistentes contienen el gen de la integrasa para integrones clase 1 (Figura 2B). De los cuales, uno presentó el gen tetB, mientras que en el segundo se identificó el arreglo blaCTX-M-tetA-strA-strB.

Figura 2 Amplificación por PCR de genes de resistencia y de integrasa tipo 1. A) M, marcador de ADN 1 Kb plus; 1 y 2, aislados positivos para bla CTX-M; 3, aislado positivo para bla TEM; 4 y 5, aislados positivos para qnrB; 6 y 7, aislados positivos para tetB; 8 y 9, aislados positivos para tetA; 10, aislado positivo strA; 11, aislado positivo para strB. B) M, marcador de ADN 1 Kb plus; 1 y 2, aislados positivos para intI1
DISCUSIÓN
La mastitis bovina es la enfermedad más importante del ganado bovino a nivel mundial. Su prevalencia, tipo de microorganismos causales y sus características son variables de un lugar a otro. E. coli es un patógeno ambiental importante causante de mastitis; cuando esta bacteria infecta la glándula mamaria se muestran síntomas de inflamación, reducción en la producción y cambios físico-químicos en la leche28.
Las E. coli aisladas en este trabajo pertenecen a 34 muestras distintas, lo cual representa un 28.3 % de muestras positivas para esta bacteria. Datos similares en la frecuencia de aislamiento de E. coli han sido reportados29, donde el 27.2 % de las muestras colectadas de vacas con mastitis fueron positivas para E. coli. Además, en cuatro de las E. coli se detectó el gen de virulencia de la intimina, aunque no se detectaron los genes bfpA o sxt2. Lo anterior sugiere que esas bacterias pueden ser E. coli enteropatógena atípicas (aECEP) o E. coli enterohemorrágica (ECEH) con otra variante del gen stx4. Sin embargo, el repertorio de genes de virulencia analizado en este trabajo fue limitado y se requieren más estudios para estudiar el catálogo completo de genes en las E. coli causantes de mastitis. En este sentido, se sabe que el ganado bovino es un reservorio importante de variantes de E. coli patógenas de humano, y varios estudios han reportado que los patotipos de humano también están asociados con mastitis bovina30-32. Por ejemplo, se han identificado diferentes arreglos de los genes stx 1 , stx 2 y eaeA en E. coli aislada de mastitis bovina30. También se han descrito aislados de E. coli asociados a mastitis que tienen el gen eaeA sólo o en combinación con otros genes de virulencia, pero esos aislados fueron negativos para stx 1 o stx 2 32. Aunque muchos de los genes identificados en E. coli aislada de mastitis bovina no son específicos para la enfermedad, se ha sugerido que esos y otros elementos aun no identificados pueden ser responsables de la mastitis6. En este sentido, varios estudios se han enfocado en la asociación de factores de virulencia específicos de E. coli causante de mastitis, pero no lo han logrado6,33,34.
Normalmente, para el control de la mastitis bovina se emplea la terapia con antibióticos; sin embargo, muchas veces el tratamiento falla debido al incremento en la resistencia bacteriana a los antimicrobianos10. En este sentido, las E. coli aisladas de mastitis bovina han desarrollado resistencia a los antibióticos comúnmente usados en medicina veterinaria para tratar la enfermedad35. En este estudio se encontraron elevados niveles de resistencia para tetraciclina (88.2 %), ampicilina (76.5 %) y cefalotina (73.5 %), principalmente. Lo anterior puede estar relacionado con el hecho de que esos compuestos pertenecen a los principales grupos de antibióticos usados para el tratamiento de infecciones en ganado o se utilizan como promotores de crecimiento animal36. En este sentido, se ha encontrado que E. coli aislada de mastitis bovina presentó resistencia a ampicilina (47.1 %), kanamicina (37.1 %) y estreptomicina (32.9 %)7. Mientras que otros autores han encontrado altos índices de resistencia a ampicilina (98.4 %), estreptomicina (40.3 %) sulfisoxazol (34.1 %) y tetraciclina (24.8 %), además de otros antibióticos37. Asimismo, 64.7 % de las E. coli analizadas en este estudio fueron multirresistentes, ya que fueron resistentes a tres o más antibióticos. Datos similares se han reportado10, donde el análisis de 70 aislados de E. coli resistentes a los antibióticos mostró que el 62.8 % fueron multirresistentes.
La resistencia bacteriana a los antibióticos es debida a la presencia de genes que le confieren la capacidad de tolerar esos compuestos a través de mecanismos como expulsión, modificación, entre otros. Asimismo, el ganado bovino se considera un reservorio de E. coli, las cuales frecuentemente tienen genes de resistencia a antibióticos que se pueden diseminar a través de los alimentos de origen animal11. De acuerdo con lo anterior, en este estudio se encontraron genes que codifican para beta-lactamasas, tetraciclina y estreptomicina en el 79.4 % de las E. coli aisladas de mastitis bovina y todas ellas presentaron resistencia o resistencia intermedia a esos antibióticos. Lo anterior demuestra que en el área de estudio de este trabajo, el ganado bovino es reservorio de bacterias resistentes a los antibióticos, con la alta prevalencia de genes de resistencia a los antibióticos y que aunado a la presencia de genes de virulencia, representa un riesgo a la salud por la contaminación de la leche. Otros autores han encontrado genes para BLEE en el 26 y 1.5 % de enterobacterias aisladas de excremento y leche de vacas con mastitis, respectivamente. En ese trabajo, se detectaron los genes bla CTX-M, bla SHV y bla TEM en 92, 5.5 y 2.2 % de las bacterias positivas para BLEE38. Además, diversos estudios han encontrado que E. coli multirresistentes causantes de mastitis contienen los genes bla CTX-M y bla TEM39,40.
También, el análisis genético de los determinantes de resistencia a tetraciclina y estreptomicina en E. coli aislada de mastitis bovina, reveló que todas contenían uno o más genes de resistencia a esos compuestos en diferentes combinaciones37. Además, en 33 E. coli analizadas en este trabajo presentaron al menos un plásmido grande (>50 kb, datos no mostrados), sugiriendo que los genes de resistencia pueden estar asociados con estos. De acuerdo con lo anterior se ha asociado a plásmidos >35 kb con la presencia y movilización de genes de resistencia a antibióticos41. Además, dos aislados presentaron integrones clase 1, cuya presencia se correlaciona comúnmente con aislados multirresistentes, sugiriendo que los genes pueden estar asociados a esos elementos. La asociación de genes de resistencia con integrones ha sido observada en otros estudios de E. coli causante de mastitis con altos índices de resistencia a los antibióticos42.
CONCLUSIONES E IMPLICACIONES
Se aislaron e identificaron E. coli asociadas a mastitis bovina y resistentes a antibióticos; aunque en baja frecuencia, éstas contienen genes de virulencia relacionados con patógenos entéricos de humano. También presentaron genes responsables de la resistencia a compuestos beta-lactámicos, tetraciclina, estreptomicina y quinolonas. Hasta donde se sabe, ésta es la primera vez que se determina la presencia de dichos genes de resistencia a antibióticos en E. coli asociada a mastitis bovina en México. Aunque se requieren más estudios para caracterizar el repertorio de genes de virulencia y de resistencia e investigar su movilidad por su posible asociación con plásmidos conjugativos. El estudio de las principales características de las bacterias patógenas asociadas a mastitis bovina, en el futuro podría contribuir a mejorar la situación de la enfermedad en los hatos ganaderos del estado, así como los riesgos a la salud asociados.











 nova página do texto(beta)
nova página do texto(beta)