Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias pecuarias
versión On-line ISSN 2448-6698versión impresa ISSN 2007-1124
Rev. mex. de cienc. pecuarias vol.3 no.1 Mérida ene./mar. 2012
Revisión de literatura
Importancia del Factor de Crecimiento del Endotelio Vascular (VEGF) y de sus receptores en el ciclo ovárico. Revisión
Role of Vascular Endothelial Growth Factor (VEGF) and its receptors during the ovarian cycle. Review
Ana María Rosales Torresª, Adrián Guzmán Sánchezª
ª Laboratorio de Bioquímica de la Reproducción. Departamento de Producción Agrícola y Animal. Universidad Autónoma Metropolitana–Xochimilco. Calzada del Hueso 1100, Col. Villa Quietud, Delegación Coyoacán, 04960, México, D.F. Edificio 34. Tel. 5483 7000 ext 3082. anamaria@correo.xoc.uam.mx. Correspondencia al primer autor.
Recibido el 10 de diciembre de 2010.
Aceptado el 25 de abril de 2011.
Resumen
El objetivo de esta revisión fue recopilar y analizar la información más reciente acerca del papel del Factor de Crecimiento del Endotelio Vascular (VEGF, por sus siglas en inglés), sus receptores de membrana (VEGFR1 y VEGFR2) y receptores solubles (sVEGFR1 y sVEGFR2), durante los procesos involucrados en el ciclo ovárico. La principal función del sistema VEGF (VEGF y sus receptores), es controlar la formación de nuevos vasos sanguíneos y la protección de células endoteliales y de la granulosa. Es conocido que durante el ciclo ovárico, los cambios vasculares son importantes para controlar el desarrollo folicular, la ovulación y la formación y regresión del cuerpo lúteo (CL). En la selección folicular, VEGF y el receptor VEGFR2 incrementan su expresión para favorecer el aporte de nutrientes al folículo. En la ovulación VEGF, VEGFR1 y VEGFR2 reducen su expresión para evitar una hemorragia, y se incrementa inmediatamente después para promover la formación de vasos sanguíneos y el desarrollo del CL. Finalmente durante la regresión del CL el VEGF y VEGFR2 reducen su expresión coincidiendo con la muerte de las células que lo forman. Las evidencias revisadas permiten sugerir que VEGF y VEGFR2 son los principales promotores de la angiogénesis y protección celular en el desarrollo del folículo y CL, sin embargo los otros miembros del sistema VEGF; VEGFR1 y sVEGFR1 y sVEGFR2, parecen desempeñar funciones anti–angiogénicas en los procesos ováricos mencionados.
Palabras clave: Sistema VEGF, Desarrollo folicular, Ovulación, CL.
Abstract
The aim of present review was to compile the more recent information related with the role of VEGF and its receptors during ovarian cycle. The main function of VEGF system (VEGF and its receptors), is to control the new blood vessels formation and the protection of endothelial and granulosa cells. It is known that during the ovarian cycle, the vascular changes are important to regulate the follicular and corpus luteum development (CL), as well that the ovulation. The evidences reviewed here shown that during follicular selection, VEGF and VEGF receptor–2 (VEGFR2) increase their expression to promote the nutrients supply and follicular cell protection, while in the ovulation VEGF system reduces the expression but this increases rapidly to induce the new blood vessel formation and thus the CL development. Finally, during the CL regression the expression of VEGF and VEGFR2 is reduced coinciding with the cell death of the gland. The results present herein suggest that VEGF and its receptor 2 are the main promoters of angiogenesis and cellular protection during follicular and CL development, however others members of VEGF system such as VEGF receptor–1 and the soluble receptors (sVEGFR1 and sVEGFR2) seem to have an anti–angiogenic role.
Key words: SEGF, Ovulation, CL, Receptors, Folicular development.
INTRODUCCIÓN
La función ovárica de las hembras depende del establecimiento y la remodelación continua de un sistema vascular complejo, que le suministre al folículo y al cuerpo lúteo el oxígeno, los nutrientes y las hormonas que demandan en cada una de las etapas de su desarrollo; además que le permitan la salida a los esteroides que se producen en las células foliculares y lúteas para alcanzar sus respectivos órganos blanco. Los folículos que llegan a la ovulación tienen una extensa red de capilares que soportan su crecimiento y maduración(1,2), mientras que la muerte de las células endoteliales de la teca(3) y la degeneración del lecho capilar del folículo que conllevan a un suministro vascular insuficiente, parecen ser disparadores de la atresia(2,4). El análisis del flujo sanguíneo por ultrasonido, sugiere que los folículos dominantes tienen mejor perfusión sanguínea que los subordinados(5). El folículo dominante que se desarrolla bajo el efecto del pico de la hormona luteinizante (LH), ocasionado por la alta frecuencia de pulsos de esta hormona, se luteinizará, ovulará y se convertirá en un cuerpo lúteo (CL). Durante este proceso de transformación, las células de la granulosa se diferencian a células lúteas grandes (LLC) y las de la teca a células lúteas pequeñas (SLC)(4), capaces de producir progesterona. Estos cambios en la producción de esteroides se dan por el incremento en la expresión de enzimas que convierten colesterol a progesterona (P450 ssc y 3ot–HSD), y el decremento en la expresión de las que convierten progesterona a estrógenos (P450 17–α y P450arom).
Además de las células lúteas, el CL está conformado por fibroblastos, por células de músculo liso y principalmente por células endoteliales, las cuales durante la formación y desarrollo del CL forman una red vascular que garantiza el suministro de hormonas, nutrientes y oxígeno. El funcionamiento del CL, se pierde por la muerte programada que ocurre en sus células, y por la vasoconstricción provocada por la prostaglandina PGF2o producida en el endometrio, que también conlleva a la muerte de las células lúteas y endoteliales(1).
La interacción del factor de crecimiento del endotelio vascular (VEGF), con sus receptores de membrana; VEGFR1 y VEGFR2, se reconoce como el principal estimulador de la angiogénesis (proliferación, migración y sobrevivencia de las células endoteliales), tanto en el ovario como en otros tejidos(6,7). Recientemente se conocen las formas solubles de los receptores de membrana para VEGF: sVEGFR1 y sVEGFR2, los cuales aparentemente tienen un efecto anti–angiogénico al capturar al ligando, evitando que tenga interacción con los receptores de membrana(8). Nosotros hemos llamado sistema VEGF, al ligando, a los receptores de membrana y a los receptores solubles, por lo cual en adelante así será referido. En este trabajo se describen las evidencias que existen de la participación del sistema VEGF en el desarrollo folicular, ovulación, formación y regresión del cuerpo lúteo.
Generalidades
Angiogénesis
El brote de un nuevo vaso a partir de uno ya existente, es el mecanismo más frecuente en la angiogénesis, la cual ocurre en varios procesos fisiológicos, entre los que destacan el desarrollo embrionario, el desarrollo folicular y el desarrollo del CL, así como en procesos patológicos, como es la formación de tumores. La angiogénesis, involucra varios pasos secuenciales(9); primero, los componentes del entorno de la matriz extracelular endotelial son degradados localmente por proteasas producidas por la propia célula endotelial. A esto le sigue la migración quimiotáctica de células endoteliales hacia el lugar donde se desarrollará el nuevo vaso sanguíneo. Subsecuentemente en la sección media del vaso en formación, las células endoteliales proliferan y se ensamblan para formar el lumen del vaso sanguíneo. El nuevo vaso sufre anastomosis con el vaso adyacente para ser perfundido con circulación sanguínea(9,10,11). Hasta este punto, el capilar recientemente formado, es frágil y puede ser remodelado. La maduración del nuevo vaso sanguíneo hacia un vaso estable y funcional, requiere la acumulación de una lámina basal, y el recubrimiento por pericitos y células de músculo liso para fortalecerlo(12).
Regulación de la angiogénesis
En un inicio, cuando se estudiaron las moléculas que regulan la angiogénesis, se propuso a los factores de crecimiento fibroblásticos (FGF) como los principales reguladores del proceso; sin embargo ratones nocaut para estos genes, no desarrollaron defectos vasculares(13), por lo que se pensó en la existencia de otras moléculas que controlan la formación de nuevos vasos sanguíneos. Así fue como en 1989, se descubrió el VEGF, al que se le ha considerado como el principal factor involucrado en la angiogénesis(14).
Dentro de las moléculas que regulan la neovascularización, VEGF juega un papel central durante el proceso angiogénico en condiciones tanto fisiológicas como patológicas; es un potente mitógeno de células endoteliales derivadas de arterias y venas, aunque también ha mostrado tener una importante actividad mitótica en otros tipos celulares(15), entre los que destacan las neuronas(9,16) y la actividad citoportectora en las células de la granulosa(17).
VEGF
La familia de proteínas del VEGF, incluyen al VEGF–A, VEGF–B, VEGF–C, VEGF–D y el factor de crecimiento placentario (PLGF)(7). Algunos otros autores incluyen dos miembros más que son referidos como VEGF–E(9) y VEGF–F(18). De esta familia de trascriptos, el más estudiado es el VEGF–A, que es referido simplemente como VEGF. El VEGF–B y PLGF se unen a VEGFR1 y modulan la actividad de VEGF–A en células endoteliales durante el desarrollo embrionario (VEGF–B) y durante la angiogénesis patológica (PLGF)(8). Aunque VEGF–C y VEGF–D se unen a VEGFR2 en células endoteliales de vasos sanguíneos, estos miembros de la familia de VEGF se unen a su receptor (VEGFR3) en tejido linfático para promover el desarrollo de vasos linfáticos durante el desarrollo embrionario(7,18). Finalmente VEGF–E es un homólogo de VEGF producido por el virus Orf que afecta a cabras y ovejas(9) mientras que del VEGF–F no se ha caracterizado del todo su función (18).
El VEGF ha sido caracterizado como un factor de crecimiento angiogénico que se une a heparina(19), y que exhibe una alta especificidad para las células endoteliales(20) de arterias, venas y vasos linfáticos(21). El VEGF parece tener tres formas de participación en el desarrollo vascular normal, primero es capaz de iniciar la angiogénesis promoviendo la proliferación y quimioatracción de las células endoteliales(22). En cultivo de células de la vena umbilical de humano, la adición de 3 o 10 ng/ml de VE GF al medio de cultivo, incrementa tanto la proliferación como la migración de dichas células. Este efecto se ve también reflejado como un incremento en la red vascular de alvéolos tratados con VEGF(23). Estos resultados coinciden con lo reportado anteriormente por otros autores en células endoteliales de la aorta porcina (EAP)(24) y de la vena umbilical de humano (HUVEC)(25). Segundo, mantiene la viabilidad de vasos sanguíneos inmaduros y tercero facilita el recubrimiento del vaso con pericitos(26). Con relación a la viabilidad de vasos sanguíneos inmaduros, VEGF participa en la supervivencia de las células endoteliales induciendo la expresión de proteínas antiapoptóticas tales como Bcl–2 y A1(26). La actividad antiapoptótica de VEGF está mediada por la activación de la vía del fofatidilinositol 3– cinasa/ akt(27).
La expresión del VEGF está modulada por un sin número de factores de crecimiento y citocinas. Los oncogenes, v–ras, K–ras, v–raf, src fos y v–yes, son fuertes inductores de la expresión de VEGF; sin embargo se sabe que la hipoxia y la hipoglicemia son los principales inductores de la síntesis de VEGF(20,28). Por ejemplo, en las regiones hipóxicas de algunos tumores existe un incremento en la expresión del ARNm de VEGF(19). Se ha reportado que el factor inductor de hipoxia 1(HIF–1) favorece la expresión del VEGF y de óxido nítrico (NO), y que al inhibir al HIF–1 por el FK228 (un potente inhibidor de la diacetilaza histona) se frena la expresión del VEGF en respuesta a la hipoxia tanto a nivel transcripcional como traduccional(29). Por otro lado el gen supresor del ciclo celular, p53 juega un papel importante en la inhibición de la angiogénesis y la expresión de VEGF. La proteína producto del gen p53 es la principal inductora de la apoptosis y participa en la secreción de la trombospondina 1 (TSP 1), una glicoproteína endógena que inhibe la angiogénesis(30). Mutaciones que inactivan al gen p53, estimulan la proliferación celular y ocasionan un incremento en la expresión de VEGF(31). Aunque la TSP 1 parece ser la molécula más importante para inhibir la expresión de VEGF, existen otras como la angiostatina, endostatina, prolactina, interferones (INF α INF α), factor plaquetario 4 (PF 4), interleucinas (IL 12 IL 4), inhibidoras de metaloproteinasas (TIMP 1, TIMP 2), testosterona, somatostatina, melatonina y metoxiestradiol, que también pueden bloquear la neo formación de vasos sanguíneos por medio de la inhibición de VEGF(31,32).
Isoformas del VEGF y angiogénesis
En humanos se han identificado cinco isoformas angiogénicas derivadas de un solo gen de VEGF; VEGF121, VEGF145, VEGF165, VEGF189 y VEGF206. Estas isoformas son resultado del proceso de maduración alternativo por corte y empalme del ARNm de VEGF, que contiene ocho exones(33). Tres tipos de DNA complementario (cDNA) del VEGF humano (hVEGF) se aislaron de una biblioteca de cDNA preparada de células leucémicas HL60. Los cDNAs codifican para una proteína con 95 % de similitud al VEGF bovino que tiene 165 aminoácidos a la que se le denomina VEGF165; de las otras dos proteínas una contiene 121 aminoácidos (VEGF121) y la otra 189 (VEGF189). La cuarta isoforma de VEGF fue identificada en bibliotecas de cDNA de hígado fetal, y la proteína madura está formada por 206 aminoácidos (VEGF206). Como mencionamos, estas cuatro isoformas de VEGF son originadas del corte y empalme al ternativo del ARNm inmaduro, y los cambios están relacionados con los exones 6 y 7 del gen. Una quinta isoforma, el VEGF145 ha sido identificada en el endometrio y miometrio humano(34,35). Las isoformas VEGF121 y VEGF165 son más ácidas y no se unen fácilmente a la heparina, y por lo tanto llegan fácilmente hacia la célula endotelial. En contraste, las isoformas VEGF189 y el VEGF206 son básicas y se unen a la heparina con mayor facilidad, permaneciendo completamente secuestradas en la matriz extracelular(21). Las isoformas 189 y 206 por acción de la plasmina, pueden dar lugar a la formación de una proteína de 110 aminoácidos (VEGF110) capaz de unirse a VEGFR1 y VEGFR2 en la célula endotelial(7). Este fenómeno es de vital importancia durante la angiogénesis, ya que las isoformas ácidas inician el proceso angiogénico, promoviendo la activación de proteasas que degradan la matriz, y con ello la liberación de las isoformas básicas que se encuentran secuestradas en la matriz extracelular para potenciar la proliferación y migración de células endoteliales(36). Finalmente VEGF145 es expresado principalmente por células cancerosas del sistema reproductor femenino(37). Cabe mencionar que en todos los animales, incluyendo los bovinos, todas las proteínas producto de las isoformas de VEGF tienen un aminoácido menos(2).
Receptores del VEGF
La actividad biológica del VEGF está mediada principalmente por dos receptores tipo tirosina cinasa: el VEGFR–1 ó Flt–1 (fms–like tyrosine kinase–1, por sus siglas en inglés), y el VEGFR–2 ó Flk–1 (fetal liver kinase–1, por sus siglas en inglés), sin embargo se han reportado otros receptores tales como el VEGFR–3 o Flt–4, la neuropilina 1 y 2 (NRP–1 y NRP–2 respectivamente) a los cuales también se une el VEGF(9,16,20,33). Los receptores de mayor importancia por su afinidad con el ligando son: VEGFR1 y VEGFR2, ambos receptores se caracterizan por tener siete dominios extracelulares de unión similares a inmunoglobulinas, una sola región transmembranal y un dominio tirosina cinasa intracelular(7,35).
El VEGF se une al VEGFR1 con una constante de disociación (Kd) de 10–20 pM, por lo que se considera que el factor tiene una alta afinidad para este receptor(38) en comparación con el VEGFR2 que tiene una Kd de 75 a 125 pM(24). Sin embargo, la capacidad de autofosforilación de VEGFR2 es al menos 10 veces mayor que la del VEGFR1, lo cual indica que el VEGFR2 tiene una mayor capacidad en la traducción de la señal de VEGF(24,25). Se considera que VEGFR2 es el mayor mediador de los efectos mitogénicos, angiogénicos y de permeabilidad de VEGF(36). En contraste, VEGF unido al VEGFR–1 también se le han atribuido efectos proliferativos(25), quimiotácticos y de protección de células endoteliales(36), aunque por su limitada capacidad de señalización, es generalmente considerado un receptor "anzuelo"(25).
Estas evidencias sugieren que ambos receptores desencadenan efectos diferentes en respuesta al ligando. Así, el VEGFR1 puede regular la angiogénesis haciendo poco disponible el ligando a VEGFR2(25). Adicionalmente por corte y empalme de los ARNm inmaduros de VE GF R–1 y VEGFR–2, se producen formas solubles de ambos receptores (sVEGFR–1 y sVEGFR–2), las proteínas de estos receptores pierden el dominio transmembranal e intracelular con lo cual no pueden traducir señales, sin embargo, mantienen los dominios de unión al ligando, conservando la misma afinidad por VEGF, que los receptores de membrana(39). Por lo anterior algunos autores sugieren que existe una competencia por el ligando entre los receptores solubles y los de membrana, que les confiere a los primeros un efecto antiangiogénico(40).
Participación de VEGF en el desarrollo folicular
Desarrollo folicular
El desarrollo folicular que se presenta en el ciclo estral/menstrual, ocurre en forma de ondas u olas, conformadas por cohortes o grupos de folículos que durante el reclutamiento inicial, son elegidos para continuar su crecimiento en respuesta a gonadotropinas (reclutamiento cíclico)(41,42). En cada ola, se establece entre los folículos reclutados una competencia por la dominancia, en la cual uno o varios folículos (dependiendo de la especie) de la cohorte adquiere el desarrollo competente que le permitirá seguir creciendo en un ambiente de bajas concentraciones de gonadotropinas, al tiempo en que sus compañeros de cohorte sufren atresia. El folículo dominante modifica el patrón de crecimiento de los folículos subordinados en ambos ovarios, mediante la producción de estradiol e inhibina que actúan en forma endocrina, autocrina o paracrina para autopotenciar su desarrollo e inhibir el de los subordinados. En las especies monotocas el folículo dominante de la primera ola del ciclo, emerge mientras está activo el CL, de tal manera que la progesterona secretada por esta glándula transitoria, reduce la frecuencia de pulsos de LH, evitando su ovulación y provocándole atresia. Lo mismo ocurrirá con todos los folículos dominantes que aparezcan durante la fase lútea del ciclo. El folículo dominante que se desarrolle en la fase folicular del ciclo será estimulado por la frecuencia alta de pulsos de LH para terminar su maduración y ovular(43,44). En la Figura 1 se muestra el esquema clásico de desarrollo folicular en una vaca con tres olas de crecimiento, donde sólo el folículo de la última ola podrá ovular.
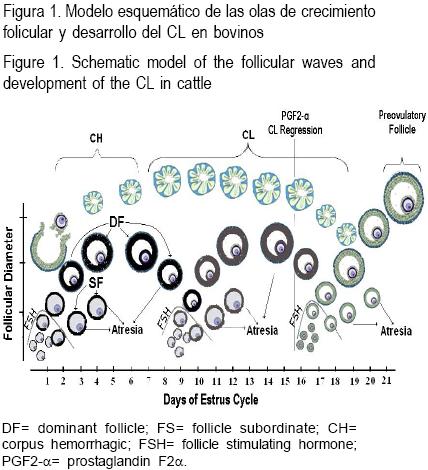
VEGF y sus receptores durante la selección y dominancia folicular
En el ovario de las hembras de los mamíferos, los folículos primordiales y primarios reciben oxígeno y nutrientes por difusión pasiva desde los vasos sanguíneos del estroma, debido a que en estos estadios, los folículos carecen de irrigación propia. La red capilar individual, se inicia en los folículos secundarios en cuanto aparece la capa celular de la teca(45). Durante la formación de los folículos preantrales, hay un gran incremento no sólo en el total de la vasculatura, sino también en la densidad vascular dado que aproximadamente el 40 % de las células que proliferan en la teca en este estadio, son de origen endotelial (46). En el estado antral de los folículos, la capa vascular está formada por dos redes concéntricas de vasos sanguíneos, una de ellas ubicada directamente por fuera de la membrana basal y la otra en la teca externa(47). Estas redes capilares, en un folículo íntegro no penetran hacia la granulosa(48,49,50), por lo que esta capa celular permanece avascular durante todo el desarrollo folicular(51).
El establecimiento del plexo capilar de la teca interna, coincide con el período de rápido crecimiento y diferenciación de los folículos, por lo que se ha propuesto que un factor que condiciona la selección del folículo dominante, además de su producción de estradiol y respuesta a gonadotropinas, es la capacidad de desarrollar una mayor red vascular, así como un incremento en la permeabilidad vascular(22). Se ha puesto en evidencia que los folículos dominantes tienen una mayor y mejor irrigación que los folículos subordinados, y que estos últimos presentan una rápida degeneración de la vasculatura de la teca como parte del proceso de atresia(52). De esta forma el VEGF y sus receptores de membrana han mostrado tener un papel importante como reguladores de la angiogénesis del folículo(45) y como protectores de las células de la granulosa(17).
El VEGF es producido por células de la teca, granulosa y lúteas. En el folículo, las células de la granulosa son las principales productoras de VEGF, lo cual parece crear un gradiente con dirección hacia la membrana basal, favoreciendo el aporte de oxígeno, nutrientes y hormonas a las células de la granulosa(35,53). El VEGF puede actuar como un factor de sobrevivencia para las células de la granulosa y con ello suprimir la atresia de los folículos antrales(54), al respecto Greenaway et al(17) demostraron que VEGF ejerce un efecto citoprotector, evitando la apoptosis de células endoteliales y de la granulosa en cultivo. Por otro lado, durante la selección del folículo dominante, los de mayor tamaño y concentración de estradiol (estrógeno–activos) corresponden a los que también tienen una vasta vascularización y una mayor concentración de VEGF en sus compartimientos(55). En ratas inmaduras de 21 días de edad, tratadas con eCG y hCG, la administración de fragmentos trasncripcionalmente activos del gen de VEGF, incrementa el número de ovocitos ovulados, el número de folículos antrales grandes y el de folículos preovulatorios, reduciendo así el porcentaje de folículos en atresia(56,57). Resultados similares se reportaron en ratones(58).
Investigaciones con el uso de inhibidores de VEGF en primates y humanos han permitido destacar las funciones más importantes de VEGF (59). El tratamiento con un antagonista de VEGF en ovarios de mono tití reduce el volumen folicular, así como el índice de proliferación de granulosa, teca y células endoteliales de folículos desde el estado secundario temprano hasta el de dominancia. El efecto sobre las células endoteliales se ve reflejado en una reducción de la vasculatura de los folículos tratados con el antagonista de VEGF(60).
Resultados de Quintana et al(61) y otros autores(62,63) muestran que las gonadotropinas (FSH y LH) y sus homólogas; la gonadotropina coriónica humana (hCG) y la gonadotropina coriónica equina (eCG), estimulan la producción de VEGF en células de la granulosa. Barboni et al(64) demostraron en cerdas, que el tratamiento con 1,250 UI eCG incrementa la producción de VEGF, así como la transcripción de su gen en células de la granulosa de folículos mayores de 5 mm de diámetro(65). La administración de 1 ng/ml de VEGF al cultivo de células de la granulosa provenientes de folículos de bovino con un diámetro de 4 a 8 mm, incrementa la proliferación celular, la cual se exacerbó cuando además se adicionó FSH (10 ng/ml)(66).
Se conoce poco sobre la participación y regulación de las diferentes isoformas de VEGF en el desarrollo folicular; las más abundantes en todos los mamíferos parecen ser VEGF120 y VEGF164. Se ha propuesto que en cultivos de células de la granulosa de bovinos, estradiol (1 ng/ml) en combinación con progesterona (10 ng/ml) regulan a la alta la expresión del ARNm de VEGF164 y a la baja el ARNm de VEGF120, mientras que la progesterona (10 ng/ml) sola, regula a la baja el ARNm de VEGF164 y a la alta el ARNm de VEGF120(67). Sin embargo en células de la granulosa de folículos seleccionados (estrógeno dominantes) de bovinos, la expresión de VEGF120 y VEGF1 64 es mayor que en aquéllos no seleccionados(68). En folículos de ovejas, Rosales et al(69) reportan la expresión del ARNm de VEGF120, VEGF164 y VEGF205 en granulosas y tecas de folículos sanos y atrésicos. La expresión de ARNm de VEGF120 y VEGF164 se redujo con un patrón muy similar conforme avanzó el grado de atresia, siendo en las células de la granulosa, en comparación con la teca donde se observó la menor expresión del ARNm de ambas isoformas. En el caso del ARNm de la isoforma VEGF205, se pudo observar en tecas y granulosa de folículos sanos, sin embargo durante la atresia prácticamente dejó de expresarse en las células de la granulosa, y solamente se detectó expresión en células de la teca.
En cuanto a los receptores de membrana para VEGF, se ha demostrado la presencia de ambos receptores en tecas y granulosa de folículos dominantes de bovinos, así como en CL de esta especie(35). La presencia de VEGFR2 en células de la granulosa, sugiere un efecto autocrino de VEGF. La adición de VEGF al cultivo de células de la granulosa evitó su apoptosis, por lo cual se considera que VEGF tiene un efecto citoprotector en células no endoteliales como la granulosa(17). En células de la granulosa de folículos seleccionados, la expresión de VE GF R2 se incrementa en relación con las células de folículos no seleccionados, mientras que la expresión de VEGFR1 no cambió entre tipo de folículos (Figura 2)(68). En folículos dominantes de bovino, se demostró que la proteína de VEGF está en mayor concentración en granulosa que en teca, sin embargo, VEGF R1, se encuentra en mayor concentración en células de la teca que en la granulosa, lo cual sugiere que este receptor considerado anzuelo podría atraer a VEGF desde la granulosa hacia la teca(70).

Hasta la fecha se desconoce la participación que tienen los receptores solubles para VEGF en el desarrollo folicular de las diferentes especies. Recientemente hemos demostrado la presencia de la proteína de sVEGFR1 y sVEGFR2 en líquido folicular(70) y el ARNm de ambos receptores solubles en células de folículos sanos y atrésicos. En folícul os atrésicos se encontró la mayor concentración relativa de sVEGFR2, mientras que en los folículos sanos, hubo mayor concentración relativa de sVEGFR1 que en los atrésicos. Esto indica que probablemente la pérdida de irrigación que presenta un folículo cuando se vuelve atrésico, es ocasionado por el efecto antiangiogénico que ejerce sVEGFR2 al competir por el ligando con los receptores de membrana(71).
Las evidencias mencionadas, permiten sugerir que VEGF es importante durante la selección del folículo dominante de dos maneras; 1) promoviendo la vasculatura del folículo y 2) como factor de sobrevivencia de las células foliculares, en especial de la granulosa. Respecto a los receptores de membrana, parece ser que al igual que en otros tejidos, VEGF ejerce sus efectos biológicos en el folículo por medio de VEGFR2, sin embargo se requiere más investigación para evaluar el papel de VEGFR1, VEGFR2, sVEGFR1 y sVEGFR2 en el desarrollo folicular.
Participación de VEGF en la ovulación
La ovulación es el proceso mediante el cual el ovocito reinicia la actividad meiótica y es liberado del folículo hacia el oviducto para ser fecundado, para esto se crea un poro en la pared apical del folículo. Este evento implica remodelación y diferenciación de las células foliculares para formar el cuerpo lúteo(72). Para que un folículo sea ovulado debe desarrollarse desde folículo primordial hasta folículo preovulatorio, proceso en el cual el ovocito, las células de la granulosa y células de la teca adquieren características funcionales que permiten llevar a cabo la ovulación(73). La FSH y LH son las principales hormonas encargadas de estimular el crecimiento y la maduración del folículo. La LH es la hormona que desencadena todos los mecanismos de ovulación, entre los que se encuentran la proteólisis de la pared folicular para liberar el ovocito, la activación de la meiosis del ovocito y la luteinización de las células foliculares(74).
La unión de LH a su receptor en la membrana plasmática de las células de la granulosa, desencadena, por medio del adenosin monofosfato cíclico (cAMP) la activación de cinasas activadas por mitógenos (MAPK), también conocidas como cinasas reguladas por señales extracelulares 1 y 2 (ERK1, 2); las cuales a nivel nuclear ocasionan la disminución en la síntesis de E2 y proliferación celular, y el incremento en la síntesis de P4 por modificar la trascripción y traducción de enzimas esteroidogénicas. Otro de los efectos ocasionados por la unión de LH a su receptor son la expansión del cumulus, la estimulación de la ruptura del folículo y la formación del CL(72–75).
Después del pico preovulatorio de LH hay un incremento de la circulación hacia el ovario que se acompaña de vasodilatación e incremento en la permeabilidad vascular en el folículo preovulatorio. Estos cambios vasculares causan edema en la teca interna, lo que provoca una condición edematosa en todo el folículo, la cual persiste a través de la ruptura folicular(75,76,77). El flujo sanguíneo hacia el folículo se reduce en el ápex mientras que se incrementa en la base de éste para facilitar la ruptura folicular(77). La inducción de la ovulación con LH o hCG incrementa la liberación de histamina por parte del ovario y la concentración de eicosanoides, leucotrienos, factor activador de plaquetas y bradiquinas, las cuales están asociadas con los procesos vasculares dentro del folículo(78). Después del pico preovulatorio de LH, las capas celulares del folículo y de la matriz extracelular del ápex folicular se hacen más delgadas y la membrana basal es degrada por proteólisis, así mismo todo el folículo es remodelado por medio de una rápida angiogénesis e infiltración de nuevos vasos sanguíneos, células de la teca y del sistema inmunológico en el antro folicular, mientras que las células foliculares se diferencian en células lúteas(72).
En folículos ovulatorios de yeguas, después de 36 h del tratamiento con hCG hay un incremento en el número de vasos sanguíneos en las tecas(79). Es muy probable que las gonadotropinas, en especial LH, sea la responsable no sólo de desencadenar los procesos fisiológicos, bioquímicos, hormonales y mecánicos que disparan la ovulación, sino también la hormona responsable de modular o regular la angiogénesis en el folículo ovulatorio, para que de alguna manera detenga de manera transitoria la afluencia sanguínea en el folículo al momento de la ovulación, y con ello evitar una probable hemorragia (existen evidencias bibliográficas en diferentes especies que apoyan esta idea).
En folículos de cerdos, el área endotelial y la proliferación endotelial son mayores en folículos preovulatorios en comparación con folículos periovulatorios tempranos (18 h después de hCG). Sin embargo en folículos periovulatorios tardíos (36 h después de hCG) el área endotelial y la tasa de proliferación endotelial se incrementan hasta valores mayores o similares a los observados en los folículos preovulatorios(46).
Los cambios vasculares durante la ovulación, al igual que en otros procesos angiogénicos, parecen estar mediados por el VEGF y sus receptores. En mono Rhesus(80) y macacos(81) la inyección intra–folicular de sVGFR1 en folículos preovulatorios ,altera la ovulación y la función del CL. En otro experimento en el que se indujo el desarrollo folicular a ratas pre púberes con 10 UI eGC y 48 h después 20 UI de hCG, y se disecaron los ovarios 0,6,12,18 y 24 h después del tratamiento con hCG, se pudo demostrar que estas hormonas provocan diferentes respuestas en la expresión de VEGF y sus receptores. En los ovarios de estos animales; el tratamiento con eCG incrementó el ARNm de VEGF120 VEGF164 y VEGFR1, pero no modificó la expresión de VEGFR2; sin embargo hCG no modificó la expresión del ARNm de los tres primeros genes en ninguno de los tiempos postratamiento, mientras que el ARN m de VEGFR2, disminuyó significativamente desde las 12 h de la aplicación de hCG(82). Este resultado es razonable si recordamos que VEGFR2 es el receptor con mayor capacidad de señalización, entonces aun cuando VEGF y VEGFR1 no modifiquen su expresión al acercarse la ovulación, basta que disminuya de manera significativa el receptor con mayor funcionalidad para que ocurra este proceso. Existen otras evidencias al respecto que sustentan lo anterior; la inducción de la ovulación con eCG (1,250 UI) y hCG (750 UI) en cerdas, muestra que alrededor de la ovulación (18 h después de hCG) la proteína de VEGF producida por las células de la granulosa y el área vascular del folículo se reducen en comparación con folículos preovulatorios (60 h de la estimulación con eCG), sin embargo, a las 36 h del tratamiento con hCG, VEGF y el área vascular se incrementa nuevamente(47). En cultivo de células de granulosa luteinizadas de humano, el uso de un antagonista de GnRH reduce la secreción de VEGF por estas células sin afectar la producción de esteroides gonadales(83). En folículos preovulatorios de bovinos, la expresión de ARNm de las isoformas 120, 164 y 188 de VEGF se reduce casi linealmente desde las 4 y hasta las 25 h (cerca de la ovulación) después de la aplicación de GnRH , incrementándose dramáticamente en el CL recién formado (60 h de GnRH). En este mismo trabajo no se observaron cambios en la expresión de VEGFR1 durante las primeras 25 h después de la aplicación de GnRH, pero la expresión de VEGFR2, sí se redujo a este tiempo, y se incrementó en el CL recién formado(84).
En un trabajo realizado por nuestro grupo de investigación, en el que se comparó la expresión del ARNm de VEGF120, VEGF164 y de los receptores VEGFR1, VEGFR2 y sVEGFR1 en folículos dominantes del día 6 del ciclo con folículos preovulatorios (18 h después del tratamiento con GnRH), reveló que la expresión del ARNm de VEGF164, VEGFR–1 y VEGFR–2 disminuyeron de forma significativa en los folículos preovulatorios, pero aumentó la expresión del ARNm de sVEGFR1, con lo cual se propone que en el bovino cuando el folículo se acerca a la ovulación, existe un proceso antiangiogénico transitorio (mayor expresión del receptor soluble que de los receptores de membrana), probablemente con el propósito de evitar una hemorragia durante la ovulación(85).
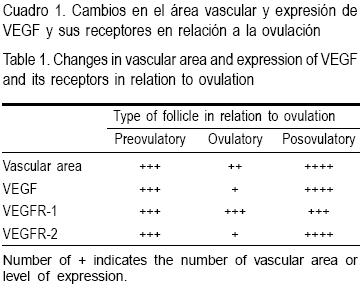
Parece claro que cerca de la ovulación hay una reducción de la actividad angiogénica de VEGF y sus receptores, que se ve reflejado en una reducción de la formación de vasos sanguíneos. Sin embargo, tan rápido como 35 h en bovinos, 18 h en cerdos o 6 h en roedores después de la ovulación, la angiogénesis se restablece para promover la vasculatura necesaria para la formación del CL (Cuadro 1).
Participación de VEGF en la formación del CL y la luteólisis
Después de la ovulación, las células de la teca y células endoteliales penetran hacia la cavidad folicular formando una mezcla de células de la granulosa, teca y endoteliales, entre otras(28,86), que da origen al CL, que es el tejido del organismo que más flujo sanguíneo recibe respecto a su masa (28), en buena medida debido a que está conformado en más del 50 % por células endoteliales(87). Durante la formación y maduración del CL más del 80 % de las células que están proliferando son células endoteliales(1,28).
La angiogénesis durante la formación, maduración y regresión del CL está regulada principalmente por el sistema VEGF(87,88), lo cual ha cobrado importancia en los últimos años(35,89,90). En cerdos la expresión de ARNm y proteína de VEGF en CL es elevada un día después de la ovulación y se reduce para el día 3 post–ovulación, manteniéndose constante hasta día 14 y disminuyendo significativamente el día 17 del ciclo. En el CL del día 60 de gestación, la expresión de VEGF es significativamente mayor a la expresión detectada en la fase lútea media y tardía del ciclo estral(91,92). Resultados similares han sido reportados por Boomyaprakob et al(89) respecto al ARNm de VEGF en CL de cerdos durante los días 5 al 15 del ciclo estral; además estos autores demuestran que la expresión de ARNm de VEGFR1, se incrementa paulatinamente del día 4 al día 15 del ciclo, mientras que el ARNm de VEGFR2 se mantiene elevado durante los primeros 13 días de iniciado el estro y se reduce significativamente el día 15(89). No obstante, en búfalos, la expresión de ARNm de VEGF y VEGFR2 no presenta cambios importantes durante la formación, maduración y lisis del CL, mientras que el ARNm de VEGFR1, se reduce en forma líneal durante la luteolisis(93). En bovinos el ARNm de VEGF y VEGFR2 es elevado durante la formación del CL (día 3–4 del ciclo estral) y se reduce conforme madura y se acerca la luteolisis, mientras que en ARNm de VEGFR1 no presenta cambios en su expresión a lo largo del ciclo estral(35). Los resultados analizados hasta este momento, sugieren que VEGF y VEGFR2 son los principales encargados de controlar la formación de nuevos vasos sanguíneos durante el desarrollo del CL en cerdos y bovinos, mientras que en búfalos VEGFR1 parece estar más involucrado en la lisis del CL.
El tratamiento intravenoso con un antagonista de VEGF (VEGFtrap 0.25 mgIkg) en la fase lútea temprana y media de macacos, reduce la secreción de progesterona por el CL, e incrementa la secreción de FSH(81). En el mono titi el tratamiento con este mismo antagonista (25 mgIkg) durante la fase lútea media, reduce el peso del ovario, el área del CL e incrementa la actividad de caspasa 3 en comparación con CL de fase lútea media sin tratamiento(94). La inyección intra–luteal de un anticuerpo contra VEGF (8.3 mg/100 μl/inyección tres veces por día) en vacas desde el día 1 hasta el día 7 después de la ovulación, reduce la concentración de progesterona en plasma y el volumen del CL, sin embargo no se afecta la expresión de ARNm de VEGF y la de sus receptores de membrana(95). Estos datos sustentan la importancia de VEGF en el desarrollo y mantenimiento de la funcionalidad del CL.
Con respecto a la los receptores solubles sVEGFR1 y sVEGFR2, sólo existe la evidencia de la presencia de ARNm de sVEGFR1 en CL de ciclo estral y de gestación en cerdas(96), sin que se tenga claro cuál es su función. Resultados preliminares de nuestro grupo indican que la expresión de sVEGFR1, no se modifica durante la fase lútea, en tanto que la expresión del ARNm de sVEGFR2, se incrementa en la fase lútea tardía con respecto a la fase lútea temprana(97).
Como se ha establecido, el sistema VEGF es importante para la formación de la red vascular del CL que le permita ser funcional, sin embargo se desconocen los mecanismos que regulan la expresión de VEGF para que pueda estimular la angiogénesis del CL. Si bien es cierto que existen evidencias de la participación de LH como moduladora de la expresión de VEGF durante el desarrollo folicular y del CL(98–101), es ampliamente conocido que VEGF es regulado principalmente por hipoxia(28), ya que durante la ruptura del folículo provocada en la ovulación, hay sangrado y presenci a de vasculatura inmadura que la propician(95) En cultivo de células lúteas, la reducción en la tensión de oxigeno de 20 a 3 %, incrementa la expresión de ARNm, y de la proteína de VEGF y HIF–1á desde las 6 y hasta las 24 h después del tratamiento(102).
La regresión del CL implica una reducción en su tamaño, la cual es acompañada de la muerte de las células que lo forman, incluyendo a las células endoteliales(103), por lo que se considera que existe una angioregresión durante el proceso de luteolisis. En bovinos la lisis inducida del CL con PGF2–ot, no reduce la expresión de ARNm de VEGF y VEGFR1 durante las primeras 48 h después del tratamiento, sin embargo la expresión del ARNm de VEGFR2 se reduce paulatinamente desde las 2h después de la aplicación de PGF2–α(104). Resultados similares se encontraron en ovejas, en los cuales además se muestra que la expresión de VE G F y sus receptores se correlacionan positivamente con la expresión de BS–1 y lectina (marcadores de células endoteliales) durante la lisis inducida del CL(105).
Todo lo anterior sugiere que el sistema VEGF es necesario no sólo para la angiogénesis inicial del CL durante su desarrollo, sino también para el mantenimiento de su función. En adición, durante la lisis del CL el sistema VEGF parece ser desestabilizado para evitar su acción y favorecer la regresión del CL. En el Cuadro 2 se muestran los cambios en la expresión relativa de VEGF y sus receptores durante la fase lútea temprana, media, tardía y en la regresión del CL.

CONCLUSIONES
Aun cuando falta mucho por conocer sobre la participación del sistema VEGF en el desarrollo de los folículos, la ovulación y la formación del cuerpo lúteo, lo que hasta ahora se conoce permite afirmar que los componentes de este complejo sistema, deben mantener un fino equilibrio para asegurar la integridad y funcionamiento de las estructuras ováricas. Las evidencias indican que en los procesos ováricos mencionados, las mayores modificaciones en la expresión del sistema VEGF, ocurren en los receptores de membrana y solubles, más que en el ligando. Adicional mente, es necesario seguir trabajando para conocer con mayor profundidad los mecanismos por los cuales los diferentes compartimentos foliculares y el CL regulan la expresión de los componentes del sistema VEGF.
AGRADECIMIENTOS
Al Consejo nacional de Ciencia y Tecnología por el apoyo otorgado #24735.
LITERATURA CITADA
1. Tamanini C, De Ambrogi M. Angiogenesis in developing follicle and corpus luteum. Reprod Domest Anim 2004;39:206–216. [ Links ]
2. Kaczmarek MM, Schams D, Ziecik AJ. Role of vascular endothelial growth factor in ovarian physiology–an overview. Reprod Biol 2005;5:111–136. [ Links ]
3. Clark LJ, Irving–Rodgers HF, Dharmarajan AM, Rodgers RJ. Theca interna: the other side of bovine follicular atresia. Biol Reprod 2004;71:1071–1078. [ Links ]
4. Feranil J, Isobe N, Nakao T. Apoptosis in the antral follicles of swamp buffalo and cattle ovary: TUNEL and caspase–3 histochemistry. Reprod Domest Anim 2005;40:111–116. [ Links ]
5. Acosta TJ, Hayashi KG, Ohtani M, Miyamoto A. Local changes in blood flow within the preovulatory follicle wall and early corpus luteum in cows. Reproduction 2003;125:759–767. [ Links ]
6. Ferrara N. Rol e of vascular endothelial growth factor in regulation of physiological angiogenesis. Am J Physiol Cell Physiol 2001;280:1358–1366. [ Links ]
7. Redmer DA, Doraiswamy V, Bortnem BJ, Fisher K, Jablonka–Shariff A, Grazul–Bilska AT, Reynolds LP. Evidence for a role of capillary pericytes in vascular growth of the developing ovine corpus luteum. Biol Reprod 2001;65:879–889. [ Links ]
8. Sallinen H, Anttila M, Narvainen J, Koponen J, Hamalainen K, Kholova I, Heikura T, et al. Antiangiogenic gene therapy with soluble VEGFR–1, –2, and –3 reduces the growth of solid human ovarian carcinoma in mice. Mol Ther 2009;17:278–284. [ Links ]
9. Jussila L, Alital o K. Vascular growth factors and lymphangiogenesis. Physiol Rev 2002;82:673–700. [ Links ]
10. Risau W. Mechanisms of angiogenesis. Nature. 1997;386:671–674. [ Links ]
11. Abulafia O, Sherer DM. Angiogenesis of the ovary. Am J Obstet Gynecol 2000;(1 Pt 1):240–246. [ Links ]
12. Hellström M, Gerhardt H, Kalén M, Li X, Eriksson U, Wolburg H, Betsholtz C. Lack of pericytes leads to endothelial hyperplasia and abnormal vascular morphogenesis. J Cell Biol 2001;153:543–553. [ Links ]
13. Miller DL, Ortega S, Bashayan O, Basch R, Basilico C. Compensation by fibroblast growth factor 1 (FGF1) does not account for the mild phenotypic defects observed in FGF2 null mice. Mol Cell Biol 2000;20:2260 2268. [ Links ]
14. Ferrara N, Henzel WJ. Pituitary follicular cells secrete a novel heparin–binding growth factor specific for vascular endothelial cells. Biochem Biophys Res Commun 1989;161:851–858. [ Links ]
15. Vieira JM, Ruhrberg C, Schwarz Q. VEGF receptor signaling in vertebrate development. Organogenesis 2010;6:97–106. [ Links ]
16. Petrova TV, Makinen T, Alitalo K. Signaling via vascular endothelial growth factor receptors. Exp Cell Res 1999;253:117–130. [ Links ]
17. Greenaway J, Connor k, Pedersen H, Coomber B, Lamarre J, Petrik J. Vascular endothelial growth factor and its receptor, Flk–1IKDR, are cytoprotective in the extravascular compartment of the ovarian follicle. Endocrinology 2004;145:2896–2905. [ Links ]
18. Augustin PD. Vascular morphogenesis in the ovary. Baillieres Clinical Obstet Gynecol;2000;(14):867–882. [ Links ]
19. Espinosa CR, Rosado GA. Angiogénesis en la fisiología reproductiva. Desarrollo folicular, formación y mantenimiento del cuerpo lúteo. Ginecol Obstet Méx 2002;70:17–27. [ Links ]
20. Neufeld G, Cohen T, Gengrinovitch S, Poltorak Z. Vascular endothelial growth factor (VEGF) and its receptors. FASEB J. 1999;3:9–22. [ Links ]
21 . Ferrara N, Davis–Smyth T. The biology of vascular endothelial growth factor. Endocr Rev 1997;18:4–25. [ Links ]
22. Reynolds LP, Redmer DA. Expression of the angiogenic factors, basic fibroblast growth factor and vascular endothelial growth factor, in the ovary. J Anim Sci 1998;76:1671–1681. [ Links ]
23. Fierro IM, Kutok JL, Serhan CN. Novel lipid mediator regulators of endothelial cell proliferation and migration: aspirin–triggered–15R–lipoxin A(4) and lipoxin A(4). J Pharmacol Exp Ther 2002;300:385–392. [ Links ]
24. Waltenberger J, Claesson–Welsh L, Siegbahn A, Shibuya M, Heldin CH. Different signal transduction properties of KDR and Flt1, two receptors for vascular endothelial growth factor. J Biol Chem 1994;269:26988–26995. [ Links ]
25. Zeng H, Dvorak HF, Mukhopadhyay D. Vascular permeability factor (VPF)Ivascular endothelial growth factor (VEGF) peceptor–1 down–modulates VPFIVEGF receptor–2–mediated endothelial cell proliferation, but not migration, through phosphatidylinositol 3–kinase–dependent pathways. J Biol Chem 2001;276:26969–26979. [ Links ]
26. Gerber HP, Dixit V, Ferrara N. Vascular endothelial growth factor induces expression of the antiapoptotic proteins Bcl–2 and A1 in vascular endothelial cells. J Biol Chem 1998;27:13313–13316. [ Links ]
27. Gerber HP, McMurtrey A, Kowalski J, Yan M, Keyt BA, Dixit V, Ferrara N. Vascular endothelial growth factor regulates endothelial cell survival through the phosphatidylinositol 3'–kinaseIAkt signal transduction pathway. Requirement for Flk–1IKDR activation. J Biol Chem 1998;273:30336–30343. [ Links ]
28. Fraser HM, Wulff C. Angiogenesis in the corpus luteum. Reprod Biol Endocrinol 2003;10:1:88. [ Links ]
29. Lee M, Hwang JT, Lee HJ, Jung SN, Kang I, Chi SG, Kim SS, Ha J. AMP–activated protein kinase activity is critical for hypoxia–inducible factor–1 transcriptional activity and its target gene expression under hypoxic conditions in DU145 cells. J Biol Chem 2003;278:39653–39661. [ Links ]
30. Dameron KM, Volpert OV, Tainsky MA, Bouck N. Control of angiogenesis in fibroblasts by p53 regulation of thrombospondin–1. Science 1994;265:1582–1584. [ Links ]
31. Stepien HM, Kolomecki K, Pasieka Z, Komorowski J, Stepien T, Kuzdak K. Angiogenesis of endocrine gland tumours—new molecular targets in diagnostics and therapy. Eur J Endocrinol 2002;146:143–51. [ Links ]
32. Huss WJ, Hanrahan CF, Barrios RJ, Simons JW, Greenberg NM. Angiogenesis and prostate cancer: identification of a molecular progression switch. Cancer Res 2001;61:2736–2743. [ Links ]
33. Jia H, Jezequel S, Löhr M, Shaikh S, Davis D, Soker S, Selwood D, Zachary I. Peptides encoded by exon 6 of VEGF inhibit endothelial cell biological responses and angiogenesis induced by VEGF. Biochem Biophys Res Commun 2001;283:164–173. [ Links ]
34. Otani N, Minami S, Yamoto M, Shikone T, Otani H, Nishiyama R, Otani T, Nakano R. The vascular endothelial growth factorI fms–like tyrosine kinase system in human ovary during the menstrual cycle and early pregnancy. J Clin Endocrinol Metab 1999;84:3845–3851. [ Links ]
35. Berisha B, Schams D, Kosmann M, Amselgruber W, Einspanier R. Expression and tissue concentration of vascular endothelial growth factor, its receptors, and localization in the bovine corpus luteum during estrous cycle and pregnancy. Biol Reprod 2000;63:1106–1114. [ Links ]
36. Ferrara N. Vascular Endothelial Growth Factor: Basic Science and Clinical Progress. Endocrine Reviews 2004;25:581–611. [ Links ]
37. Elias AP, Dias S. Microenvironment changes (in pH) affect VEGF alternative splicing. Cancer Microenviron 2008;1:131–139. [ Links ]
38. de Vries C, Escobedo JA, Ueno H, Houck K, Ferrara N, Williams LT. The fms–like tyrosine kinase, a receptor for vascular endothelial growth factor. Science 1992;255:989–991. [ Links ]
39. Robinson CJ, Stringer SE. The splice variants of vascular endothelial growth factor (VEGF) and their receptors. J Cell Sci 2001;114:853–865. [ Links ]
40. Sallinen H, Anttila M, Narvainen J, Koponen J, Hamalainen K, Kholova I, Heikura T, et al. Antiangiogenic gene therapy with soluble VEGFR–1, –2, and –3 reduces the growth of solid human ovarian carcinoma in mice. Mol Ther 2009;17:278–284. [ Links ]
41. Evans JLH, Ireland ME, Winn P, Lonergan GW, Smith PM. Coussens, Ireland JJ. Identification of genes involved in apoptosis and dominant follicle development during follicular waves in cattle. Biol Reprod 2004;70:1475–1484. [ Links ]
42. Webb R, Campbell BK, Garverick HA, Gong JG, Gutierrez CG, Armstrong DG. Molecular mechanisms regulating follicular recruitment and selection. Reproduction in Domestic Ruminants IV. J Reprod Fertil 1999;54(Suppl 1):33–48. [ Links ]
43. Mihm M, Austin EJ. The final stages of dominant follicle selection in cattle. Domest Anim Endocrinol 2002;23:155–166. [ Links ]
44. Ireland JJ, Mihm M, Austin E, Diskin MG, Roche JF. Historical perspective of turnover of dominant follicles during the bovine estrous cycle: key concepts, studies, advancements, and terms. J Dairy Sci 2000;83:1648–1658. [ Links ]
45. Wulff C, Wiegand SJ, Saunders PT, Scobie GA, Fraser HM. Angiogenesis during follicular development in the primate and its inhibition by treatment with truncated Flt–1–Fc (vascular endothel i al growth factor Trap(A40)). Endocrinology 2001;142:3244–3254. [ Links ]
46. Martelli A, Bernabò N, Berardinelli P, Russo V, Rinaldi C, Di Giacinto O, Mauro A, Barboni B. Vascular supply as a discriminating factor for pig preantral follicle selection. Reproduction 2009;137:45–58. [ Links ]
47. Martelli A, Berardinelli P, Russo V, Mauro A, Bernabò N, Gioia L, Mattioli M, Barboni B. Spatio–temporal analysis of vascular endothelial growth factor expression and blood vessel remodeling in pig ovarian follicles during the periovulatory period. J Mol Endocrinol 2006;36:107–119. [ Links ]
48. Goede V, Schmidt T, Kimmina S, Kozian D, Augustin HG. Analysis of blood vessel maturation processes during cyclic ovarian angiogenesis. Lab Invest 1998;78:1385–1394. [ Links ]
49. Tempel–Brami C, Neeman M. Non–invasive analysis of rat ovarian angiogenesis by MRI. Mol Cell Endocrinol 2002;187:19–22. [ Links ]
50. Wulff C, Wilson H, Wiegand SJ, Rudge JS, Fraser HM. Prevention of thecal angiogenesis, antral follicular growth, and ovulation in the primate by treatment with vascular endothelial growth factor Trap R1R2. Endocrinology 2002;143:2797–2807. [ Links ]
51 . Tamanini C, De Ambrogi M. Angiogenesis in developing follicle and corpus luteum. Reprod Domest Anim 2004;39:206–216. [ Links ]
52. Macchiarelli G, Jiang JY, Nottola SA, Sato E. Morphological patterns of angiogenesis in ovarian follicle capillary networks. A scanning electron microscopy study of corrosion cast. Microsc Res Tech 2006;69:459–468. [ Links ]
53. Greenaway J, Gentry PA, Feige JJ, LaMarre J, Petrik JJ. Thrombospondin and vascular endothelial growth factor are cyclically expressed in an inverse pattern during bovine ovarian follicle development. Biol Reprod 2005;72:1071–1078. [ Links ]
54. Shimizu T, Jiang JY, Iijima K, Miyabayashi K, Ogawa Y, Sasada H, Sato E. Induction of follicular development by direct single injection of vascular endothelial growth factor gene fragments into the ovary of miniature gilts. Biol Reprod 2003;69:1388–1393. [ Links ]
55. Grazul–Bilska AT, Navanukraw C, Johnson ML, Vonnahme KA, Ford SP, Reynolds LP, Redmer DA. Vascularity and expression of angiogenic factors in bovine dominant follicles of the first follicular wave. J Anim Sci 2007;85:1914–1922. [ Links ]
56. Shimizu T, Iijima K, Ogawa Y, Miyazaki H, Sasada H, Sato E. Gene injections of vascular endothelial growth factor and growth differentiation factor–9 stimulate ovarian follicular development in immature female rats. Fertil Steril 2008;89(Suppl 5):1563–1570. [ Links ]
57. Shimizu T, Iijima K, Miyabayashi K, Ogawa Y, Miyazaki H, Sasada H, Sato E. Effect of direct ovarian injection of vascular endothelial growth factor gene fragments on follicular development in immature female rats. Reproduction 2007;134:677–682. [ Links ]
58. Quintana R, Kopcow L, Sueldo C, Marconi G, Rueda NG, Barañao RI. Direct injection of vascular endothelial growth factor into the ovary of mice promotes follicular development. Fertil Steril 2004;82(Suppl 3):1101–1105. [ Links ]
59. Zimmermann RC, Xiao E, Bohlen P, Ferin M. Administration of antivascular endothelial growth factor receptor 2 antibody in the early follicular phase delays follicular selection and development in the rhesus monkey. Endocrinology 2002;143:2496–2502. [ Links ]
60. Taylor PD, Wilson H, Hillier SG, Wiegand SJ, Fraser HM. Effects of inhibition of vascular endothelial growth factor at ti me of sel ecti on on fol licular angi ogenesi s, expansion, development and atresia in the marmoset. Mol Hum Reprod 2007;13:729–736. [ Links ]
61. Quintana R, Kopcow L, Marconi G, Sueldo C, Speranza G, Barañao RI. Relationship of ovarian stimulation response with vascular endothelial growth factor and degree of granulosa cell apoptosis. Hum Reprod 2001;16:1814–1818. [ Links ]
62. Redmer DA, Dai Y, Li J, Charnock–Jones DS, Smith SK, Reynolds LP, Moor RM. Characterization and expression of vascular endothelial growth factor (VEGF) in the ovine corpus luteum. J Reprod Fertil 1996;108:157–165. [ Links ]
63. Neulen J, Raczek S, Pogorzelski M, Grunwald K, Yeo TK, Dvorak HF, Weich HA, Breckwoldt M. Secretion of vascular endothelial growth factorIvascular permeability factor from human luteinized granulosa cells is human chorionic gonadotrophin dependent. Mol Hum Reprod 1998;4:203–206. [ Links ]
64. Barboni B, Turriani M, Galeati G, Spinaci M, Bacci ML, Forni M, Mattioli M . Vascular endothelial growth factor production in growing pig antral follicles. Biol Reprod 2000;63(3):858–64. [ Links ]
65. Mattioli M, Barboni B, Turriani M, Galeati G, Zannoni A, Castellani G, Berardinelli P, Scapolo PA. Follicle activation involves vascular endothelial growth factor production and increased blood vessel extension. Biol Reprod 2001;65:1014–1019. [ Links ]
66. Doyle LK, Walker CA, Donadeu FX. VEGF modulates the effects of gonadotropins in granulosa cells. Domest Anim Endocrinol 2010;38:127–137. [ Links ]
67. Shimizu T, Miyamoto A. Progesterone induces the expression of vascular endothelial growth factor (VEGF) 120 and Flk–1, its receptor, in bovine granulosa cells. Anim Reprod Sci 2007;102:228–237. [ Links ]
68. Shimizu T, Jayawardana BC, Tetsuka M, Miyamoto A. Differential effect of follicle–stimulating hormone and estradiol on expressions of vascular endothelial growth factor (VEGF) 120, VEGF164 and their receptors in bovine granulosa cells. J Reprod Dev 2007;53:105–112. [ Links ]
69. Rosales–Torres AM, Alonso I, Vergara M, Romano MC, Castillo–Juárez H, Ávalos A, Rosado A, Gutiérrez CG. Vascular endothelial growth factor isoforms 120, 164 and 205 are reduced with atresia in ovarian follicles of sheep. Anim Reprod Sci 2010;122;111–117. [ Links ]
70. Pinzón EC, Vergara M, Gutiérrez CG, Fierro F, Rosales AF. Factor de crecimiento endotelio vascular (VEGF) y sus receptores Flk1, Flt1,sFlk1 y sFlt1 en folículos dominantes de bovinos [resumen]. Reunión Anual Academia de Investigación en Biología de la Reproducción. Universidad Veracruzana. México. 2010:25. [ Links ]
71. Macias RV, Vergara M, Gutiérrez CG, Fierro F, Rosales AM. Identificación de RNAm de los receptores solubles para el factor de crecimiento del endotelio vascular (VEGF) en células foliculares de bovinos [resumen]. Reunión Anual Academia de Investigación en Biología de la Reproducción. Universidad Veracruzana. México. 2010;22. [ Links ]
72. Russell DL, Robker RL. Molecular mechanisms of ovulation: co–ordination through the cumulus complex. Hum Reprod Update 2007;13:289–312. [ Links ]
73. Richards JS, Russell DL, Ochsner S, Hsieh M, Doyle KH, Falender AE, Lo YK, Sharma SC. Novel signaling pathways that control ovarian follicular development, ovulation, and luteinization. Recent Prog Horm Res 2002;57:195–220. [ Links ]
74. Duggavathi R, Murphy BD. Development. Ovulation signals. Science 2009;324:890–891. [ Links ]
75. Espey LL. Current status of the hypothesis that mammalian ovulation is comparable to an inflammatory reaction. Biol Reprod 1994;50:233–238. [ Links ]
76. Espey LL. Ovulation as an inflammatory reaction—a hypothesis. Biol Reprod 1980;22:73–106. [ Links ]
77. Acosta TJ, Miyamoto A. Vascular control of ovarian function: ovulation, corpus luteum formation and regression. Anim Reprod Sci 2004;82–83:127–140. [ Links ]
78. Gerdes U, Gåfvels M, Bergh A, Cajander S. Localized increases in ovarian vascular permeability and leucocyte accumulation after induced ovulation in rabbits. J Reprod Fertil 1992;95:539–550. [ Links ]
79. Kerban A, Doré M, Sirois J. Characterization of cellular and vascular changes in equine follicles during hCG–induced ovulation. J Reprod Fertil 1999;117:115–123. [ Links ]
80. Hazzard TM, Xu F, Stouffer RL. Injection of soluble vascular endothelial growth factor receptor 1 into the preovulatory follicle disrupts ovulation and subsequent luteal function in rhesus monkeys. Biol Reprod 2002;67:1305–1312. [ Links ]
81. Fraser HM, Wilson H, Morris KD, Swanston I, Wiegand SJ. Vascular endothelial growth factor Trap suppresses ovarian function at all stages of the luteal phase in the macaque. J Clin Endocrinol Metab 2005;90:5811–5118. [ Links ]
82. Miyabayashi K, Shimizu T, Kawauchi C, Sasada H, Sato E. Changes of mRNA expression of vascular endothelial growth factor, angiopoietins and their receptors during the periovulatory period in eCG/hCG–treated immature female rats. J Exp Zool A Comp Exp Biol 2005;303:590–597. [ Links ]
83. Asimakopoulos B, Nikolettos N, Nehls B, Diedrich K, Al–Hasani S, Metzen E. Gonadotropin–releasing hormone antagonists do not influence the secretion of steroid hormones but affect the secretion of vascular endothelial growth factor from human granulosa luteinized cell cultures. Fertil Steril 2006;86:636–641. [ Links ]
84. Berisha B, Steffl M, Welter H, Kliem H, Meyer HH, Schams D, Amselgruber W. Effect of the luteinizing hormone surge on regulation of vascular endothelial growth factor and extracellular matrix–degrading proteinases and their inhibitors in bovine follicles. Reprod Fertil Dev 2008;20:258–268. [ Links ]
85. Méndez HJ, Vergara OM, Fierro FF, Gutiérrez CG, Rosales AM. Expresión del VEGF y sus receptores en folículos dominantes de bovino y su modificación por la aplicación de líquido folicular. Reunión Anual Academia de Investigación en Biología de la Reproducción. Universidad Veracruzana. 2010;300–309. [ Links ]
86. Fraser HM, Lunn SF. Regulation and manipulation of angiogenesis in the primate corpus luteum. Reproduction 2001;121:355–362. [ Links ]
87. Miyamoto A, Shirasuna K, Sasahara K. Local regulation of corpus luteum development and regression in the cow: Impact of angiogenic and vasoactive factors. Domest Anim Endocrinol 2009;37:159–169. [ Links ]
88. Robinson RS, Woad KJ, Hammond AJ, Laird M, Hunter MG, Mann GE. Focus on vascular function in female reproduction angiogenesis and vascular function in the ovary. Reproduction 2009;138;869–881. [ Links ]
89. Boonyaprakob U, Gadsby JE, Hedgpeth V, Routh P, Almond GW. Expression and localization of vascular endothelial growth factor and its receptors in pig corpora lutea during the oestrous cycle. Reproduction 2003;126:393–405. [ Links ]
90. Galeati G, Forni M, Spinaci M, Zannoni A, Govoni N, Ribeiro LA, Seren E, Tamanini C. Fasting influences steroidogenesis, vascular endothelial growth factor (VEGF) levels and mRNAs expression for VEGF, VEGF receptor type 2 (VEGFR–2), endothelin–1 (ET–1), endothelin receptor type A (ET–A) and endothelin converting enzyme–1 (ECE–1) in newly formed pig corpora lutea. Domest Anim Endocrinol 2005;28:272–284. [ Links ]
91. Ribeiro LA, Turba ME, Zannoni A, Bacci ML, Forni M. Gelatinases, endonuclease and vascular endothelial growth factor during development and regression of swine luteal tissue. BMC Dev Biol 2006;6:58. [ Links ]
92. Ribeiro LA, Turba ME, Bernardini C, Zannoni A, Bacci ML, Forni M. Matrix metalloproteinases –2 and –9 in swine luteal tissue angiogenesis and angioregression. Vet Res Commun 2007;31(Suppl 1):193–196. [ Links ]
93. Papa PC, Moura CE, Artoni LP, Fátima LA, Campos DB, Marques JE Jr, Baruselli PS, et al. VEGF system expression in different stages of estrous cycle in the corpus luteum of non–treated and superovulated water buffalo. Domest Anim Endocrinol 2007;33:379–389. [ Links ]
94. Fraser HM, Wilson H, Wulff C, Rudge JS, Wiegand SJ. Administration of vascular endothelial growth factor Trap during the 'post–angiogenic' period of the luteal phase causes rapid functional luteolysis and selective endothelial cell death in the marmoset. Reproduction 2006;132:589–600. [ Links ]
95. Yamashita H, Kamada D, Shirasuna K, Matsui M, Shimizu T, Kida K, Berisha B, Schams D, Miyamoto A. Effect of local neutralization of basic fibroblast growth factor or vascular endothelial growth factor by a specific antibody on the development of the corpus luteum in the cow. Mol Reprod Dev 2008;75:1449–156. [ Links ]
96. Kaczmarek MM, Kiewisz J, Schams D, Ziecik AJ. Expression of VEGF–receptor system in conceptus during peri–implantation period and endometrial and luteal expression of soluble VEGFR–1 in the pig. Theriogenology 2009;71:1298–306. [ Links ]
97. Macías VR1, Guzmán SA, Vergara OM, Fierro FF, Gutiérrez CG, Rosales–Torres A. Expresión de las isoformas VEGF120a y VEGF164a y sus receptores de membrana y solubles en cuerpo lúteo de bovino. [Aceptado para su publicación] Reunión de la Academia de Investigación en Biología de la Reproducción. Juriquilla, Qro, México. [ Links ]
98. Taylor PD, Hillier SG, Fraser HM. Effects of GnRH antagonist treatment on follicular development and angiogenesis in the primate ovary. J Endocrinol 2004;183:1–17. [ Links ]
99. Duncan WC, van den Driesche S, Fraser HM. Inhibition of vascular endothelial growth factor in the primate ovary up–regulates hypoxia–inducible factor–1alpha in the follicle and corpus luteum. Endocrinology 2008;149:3313–320. [ Links ]
100. Neulen J, Yan Z, Raczek S, Weindel K, Keck C, Weich HA, Marmé D, Breckwoldt M. Human chorionic gonadotropin–dependent expression of vascular endothelial growth factor/ vascular permeability factor in human granulosa cells: importance in ovarian hyperstimulation syndrome. J Clin Endocrinol Metab 1995;80:1967–1971. [ Links ]
101. Hazzard TM, Molskness TA, Chaffin CL, Stouffer RL. Vascular endothelial growth factor (VEGF) and angiopoietin regulation by gonadotrophin and steroids in macaque granulosa cells during the peri–ovulatory interval. Mol Hum Reprod 1999;5:1115–1121. [ Links ]
102. Nishimura R, Okuda K. Hypoxia is important for establishing vascularization during corpus luteum formation in cattle. J Reprod Dev 2010;56:110–116. [ Links ]
103. Rosales AM. Guzmán A. Apoptosis in follicular atresia and luteal regression. Review. Téc Pecu Méx 2008;46:159–182. [ Links ]
104. Neuvians TP, Berisha B, Schams D. Vascular endothelial growth factor (VEGF) and fibroblast growth factor (FGF) expression during induced luteolysis in the bovine corpus luteum. Mol Reprod Dev 2004;67:389–395. [ Links ]
105. Vonnahme KA, Redmer DA, Borowczyk E, Bilski JJ, Luther JS, Johnson ML, Reynolds LP, Grazul–Bilska AT. Vascular composition, apoptosis, and expression of angiogenic factors in the corpus luteum during prostaglandin F2alpha–induced regression in sheep. Reproduction 2006;131:1115–1126. [ Links ]














