Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias pecuarias
versión On-line ISSN 2448-6698versión impresa ISSN 2007-1124
Rev. mex. de cienc. pecuarias vol.2 no.1 Mérida ene./mar. 2011
Artículos
Factores de riesgo asociados a la seroprevalencia de anticuerpos a Neospora caninum en ganado lechero de Aguascalientes, México
Risk factors associated with Neospora caninum antibody seroprevalence in dairy cattle in Aguascalientes, Mexico
Rocío Conzuelo Sierraa, Leticia Medina–Esparzaa Miguel Ramos Parraa, Zeferino García– Vázquezb, Carlos Cruz–Vázqueza
a Instituto Tecnológico El Llano Aguascalientes. Apartado Postal 74–2, Administración Postal No.2, 20041 Aguascalientes, México. Tel. (449) 916–12–51; lmedinaesparza@yahoo.com.mx Correspondencia al segundo autor.
b Centro Nacional de Parasitología Veterinaria, Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP).
Recibido el 13 de diciembre de 2009
Aceptado el 13 de septiembre de 2010
RESUMEN
El objetivo del presente trabajo fue identificar potenciales factores de riesgo, incluyendo la posible presencia de contaminación del agua de bebida con ooquistes del parásito, asociados con la seroprevalencia de anticuerpos a N. caninum en hatos lecheros de Aguascalientes, México. Se tomaron muestras de suero sanguíneo de 150 vacas, mismas que fueron analizadas por la técnica de ELISA, se detectó la presencia de ADN de N. caninum en el agua de bebida mediante una prueba de PCR anidada, y se aplicó una encuesta para identificar diferentes características y prácticas zootécnicas de los hatos. Se calculó la seroprevalencia a la infección por N. caninum, así como la frecuencia de detección de ADN del parásito en las muestras de agua de bebida. Se estimó la asociación entre la seroprevalencia y cada uno de los factores considerados como potenciales factores de riesgo, calculando la razón de momios (OR). La seroprevalencia a N. caninum fue de 30 %; se identificó ADN del parásito en el 90 % de la muestras de agua colectadas. Se identificaron a los siguientes potenciales factores de riesgo con un intervalo de confianza del 95 %: presencia de coyotes (OR= 2.40, 1.05 – 5.47, P<0.05), presencia de aves domésticas en el establo (OR= 2.32, 1.06 –5.3, P<0.05), antecedentes de la presencia de micotoxinas (OR= 4.16; 1.41 – 13.18, P<0.05), y los antecedentes de aborto (OR= 2.13, 0.95 – 4.81, P<0.05).
Palabras clave: Neospora caninum, Factores de riesgo, Seroprevalencia, ADN, Agua.
ABSTRACT
The purpose of this research was to study potential risk factors, including possible contamination of drinking water with parasite oocysts, associated with the seroprevalence of N. caninum antibodies in dairy herds in Aguascalientes, Mexico. Serum samples from 150 cows were analyzed using the ELISA technique. N. caninum DNA was determined in the drinking water using the nested PCR test. A survey was undertaken as to identify different characteristics and husbandry practices among herds. Both N. caninum antibody seroprevalence and the frequency of N. caninum DNA in drinking water samples were calculated. The association between seroprevalence and each of the factors considered as potential risk factors was calculated by determining the odds ratio (OR). N. caninum seroprevalence was 30 %, and the DNA of this parasite was found in 90 % of the water samples collected. The following potential risk factors were identified with a confidence interval of 95%: presence of coyotes (OR= 2.40, 1.05– 5.47, P<0.05), presence of domestic poultry in the farm (OR= 2.32, 1.06–5.30, P<0.05), history of mycotoxins (OR= 4.16; 1.41–13.18, P<0.05), and abortion background (OR= 2.13, 0.95–4.81, P<0.05).
Key words: Neospora caninum, Risk Factors, Seroprevalence, DNA, Water.
INTRODUCCIÓN
La neosporosis bovina es una enfermedad causada por un parásito Apicomplexa, Neospora caninum, que puede provocar abortos entre el tercer y noveno mes de gestación, mortinatos, muerte neonatal, muerte fetal temprana y reabsorción embrionaria, provocando un efecto importante en diferentes parámetros reproductivos y en la producción de leche; afecta principalmente al ganado lechero y ha sido reportada como una importante causa de aborto en diferentes partes del mundo(1). En México, se tiene información que permite conocer de la presencia de N. caninum y su amplia distribución en el país, principalmente en el ganado lechero, en el cual la enfermedad se considera endémica(2–5).
En la epidemiología de la neosporosis bovina, la transmisión vertical es reconocida como la principal ruta para mantener la infección en el ganado, los becerros son infectados vía transplacentaria en madres crónicamente infectadas; este mecanismo es altamente eficiente y permite el nacimiento de crías clínicamente sanas pero infectadas(1,6). La otra ruta de infección la representa la transmisión horizontal, en la cual el perro(7) y el coyote(8), que han sido descritos como huéspedes definitivos de N. caninum, aparecen como principales responsables al excretar ooquistes en las heces, y con ello contaminar agua de bebida y alimentos; a causa de las características intrínsecas de la transmisión horizontal, las rutas y posibilidades de infección pueden ser múltiples(1,6).
La identificación de factores de riesgo asociados a la infección por N. caninum utilizando el estatus serológico de la población, ha sido una herramienta empleada en diversos estudios con la finalidad de detectar elementos que permitan poner en práctica medidas de control que ayuden a reducir la frecuencia e impacto de esta parasitosis ante la ausencia de tratamientos efectivos(1).
El objetivo del estudio fue identificar potenciales factores de riesgo, incluyendo la posible presencia de contaminación del agua de bebida con ooquistes del parásito, asociados con la seroprevalencia de anticuerpos contra N. caninum en hatos lecheros de Aguascalientes, México.
MATERIALES Y MÉTODOS
El estudio se realizó en el estado de Aguascalientes, México, el cual se encuentra localizado en la región centro–norte del país, a 1,885 msnm, temperatura promedio de 16.9 ºC, precipitación de 475 mm por año, la cual se presenta en el verano, y clima semiárido templado y extremoso(9).
Se incluyeron en el estudio quince establos lecheros tecnificados, seleccionados por el método no probabilístico de conveniencia; en ellos se realizó un muestreo aleatorio de animales adultos, durante el periodo de enero a abril del 2008. Se colectaron muestras de sangre de 150 vacas, correspondiendo diez a cada uno de los establos incluidos en el estudio, por venopunción de la vena caudal con equipo vacutainer nuevo sin anticoagulante y se trasladaron al laboratorio para centrifugarse a 1,000 xg por 15 min; el suero recolectado se colocó en viales de polipropileno de 1.5 ml y se mantuvieron en congelación a –20 °C hasta su uso.
Los sueros se sometieron a la prueba de inmunoensayo enzimático (ELISA), para detectar IgG específicas a N. caninum, utilizando el paquete comercial Herd Check anti–N. caninum (IDDEX Laboratorios, Inc), con sensibilidad de 98.6 % y especificidad de 98.8 %, de acuerdo con el fabricante, siguiendo el procedimiento recomendado por el mismo. La prueba se realizó con una sola dilución de 1:100, identificando positivos y negativos a la absorbancia de 450 nm. Los sueros se probaron pareados, y el punto de corte fue de 0.50, considerándose como positivos los que tuvieron lecturas medias de > 0.50.
Con la finalidad de detectar la posible presencia de contaminación con ooquistes de N. caninum del agua de bebida usada en los establos, se llevó la detección de ADN del parásito de la siguiente forma: se tomaron 30 muestras de agua de bebida, dos por establo, correspondiendo una al bebedero ubicado en el corral de alojamiento principal, y la otra al depósito donde descarga el pozo de agua. Se colectaron dos litros de agua en una botella de vidrio estéril, para cada caso, homogenizando previamente el agua contenida en el bebedero o depósito y se trasladaron al laboratorio en condiciones de refrigeración. Para realizar la extracción de ADN se utilizó el paquete comercial Ultra Clean Water DNA Isolation (MOBIO Laboratorios, Inc.), siguiendo las instrucciones del fabricante. Las muestras de ADN se sometieron a una PCR anidada en un solo tubo con los iniciadores NF1, NS2, NR1 y SR1, similar a la descrita por Ellis et al(10), utilizando controles positivos y negativos previamente definidos(5). La concentración de ADN en cada muestra fue verificada por espectrofotómetro de luz UV y 5 µl de la muestra conteniendo 2 µg de ADN fueron usados en los ensayos de PCR. Los productos de la amplificación se analizaron en geles de agarosa al 2.5%, corriendo en cada gel un marcador de peso molecular (Phix 174 DNA, PROMEGA); para estimar el peso del producto amplificado, los geles fueron teñidos con bromuro de etidio y visualizados en una lámpara de luz UV. Se consideró como resultado positivo aquel que mostrara un producto de 146 pares de bases (pb).
Se diseñó una encuesta escrita cerrada en base a los reportes existentes en la literatura sobre los principales factores de riesgo que se han estudiado, la cual se aplicó directamente con los propietarios de cada establo incluido en el estudio, con el objetivo de identificar sus principales características y prácticas zootécnicas, mismas que pudieran relacionarse con la presencia de N. caninum. La encuesta se dividió en cuatro secciones las cuales fueron: a) huésped definitivo o intermediario, b) alimento–agua, c) población animal y manejo de corrales, y d) aborto. En el Cuadro 1 se resumen los factores de riesgo considerados en la encuesta.
Se calculó la seroprevalencia a la infección por N. caninum, para la población en estudio, así como la frecuencia de detección de ADN de N. caninum en las muestras de agua de bebida. Se estimó la asociación entre la seroprevalencia y cada uno de los potenciales factores de riesgo, calculando la razón de posibilidades o razón de momios (OR), en donde valores mayores de uno indicaron asociación, el cálculo se sometió a la prueba de Ji cuadrada con corrección de Yates (P<0.05), realizando los procedimientos mediante el paquete EpiInfo 3.5.1.
RESULTADOS
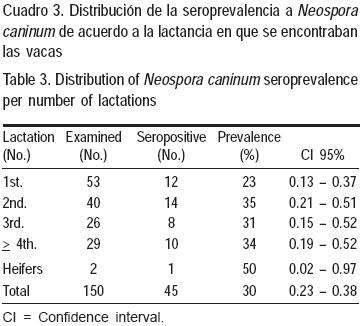
La seroprevalencia de anticuerpos a N. caninum en la población estudiada fue de 30 %; el 87 % (13/ 15) de los establos incluidos en el estudio tuvieron al menos un animal seropositivo; en estos establos se observó que la seroprevalencia se presentó en una escala de 10 al 60 % (Cuadro 2). La distribución de la seroprevalencia de acuerdo a la lactancia en que se encontraban los animales, se muestra en el Cuadro 3, (P>0.05) observándose que las vacas de primera lactancia mostraron la menor seroprevalencia; en el estudio se incluyeron únicamente dos vaquillas y una de ellas fue seropositiva.
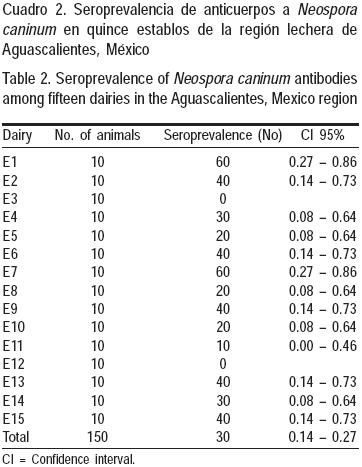
Se identificó ADN de N. caninum en el 90 % (27/ 30) de la muestras de agua colectadas; en las provenientes de los depósitos en donde descarga el pozo, se detectó 87 % (13/15) de las muestras como positivas y en las provenientes de bebederos fue el 93 % (14/15). En todos los establos hubo muestras de agua positivas.
Se identificaron como posibles factores de riesgo, a los siguientes: a) presencia de coyotes en los predios, en donde se observó una OR de 2.40 (IC 95%: 1.05 – 5.47; P<0.05), en este caso, la seroprevalencia fue de 45 % (18/40) en los establos con presencia de coyotes, y de 25 % (28/110) en los que no reportaron este evento; b) presencia de aves domésticas en el establo, en donde se observó una OR de 2.32 (IC 95%: 1.06 – 5.3; P<0.05), en este caso, la seroprevalencia fue de 38 % (31/80) en los establos con presencia de estas aves, y de 21 % (15/70) los que no reportaron esta situación; c) antecedentes de micotoxinas en el alimento, con una OR de 4.16 (IC 95%: 1.41 – 13.18; P<0.05), la seroprevalencia en establos con este antecedente fue de 37 % (41/110) y de 12 % (5/40) en los que estaba ausente, finalmente, d) antecedentes de aborto, con una OR de 2.13 (IC 95%: 0.95 – 4.81; P<0.05), la seroprevalencia en el grupo de vacas con antecedentes de aborto fue de 41 % (18/43), mientras que en el que no los presentó fue de 25 % (27/107). Para otros potenciales factores de riesgo incluidos en el estudio no fue posible demostrar asociación con la seroprevalencia.
DISCUSIÓN
La seroprevalencia general estimada en el presente estudio fue elevada pero menor que la reportada previamente para esta región, que ha sido de 57.5 y 59 %(3,11), y fue también más baja que la que se ha observado en otras regiones productoras de leche de México(4); la infección por N. caninum es considerada como endémica en Aguascalientes y en otras regiones lecheras del país(4,11). Las vacas de primera lactancia mostraron una menor seroprevalencia que las que contaban con más lactancias; en la literatura se informa que los animales de mayor edad generalmente muestran seroprevalencia más elevada pues tienen más posibilidades de tener contacto con el parásito(12,13). Al comparar los resultados de este trabajo con los reportes en ganado lechero a nivel internacional, se puede observar que en otras regiones se han obtenido resultados similares en este tipo de ganado(1).
El mantenimiento de la infección por N. caninum en los hatos generalmente está asociada no solamente con la transmisión vertical, sino también con la horizontal; el estado endémico y la elevada seroprevalencia en un hato o en una región sólo pueden explicarse por la acción simultánea de ambos mecanismos de transmisión, en donde la presencia de ooquistes excretados por el huésped definitivo representan la fuente de infección al ser ingeridos por los bovinos a través de agua y otros alimentos(6); algunos estudios han sugerido que la contaminación con ooquistes del agua de bebida y forraje pueden ser la causa de una infección reciente por N. caninum en brotes epidémicos de abortos(14,15). En el presente estudio, se ha podido identificar la presencia de ADN del parásito en el agua de bebida de todos los establos incluidos en el estudio, lo cual representa un riesgo potencial de infección aunque no se conoce si los ooquistes contenidos en los bebederos o depósitos eran viables. La contaminación con heces fecales de perros y coyotes, y por tanto con ooquistes viables puede realizarse de diversas formas, principalmente por el viento, y no necesariamente por el depósito de heces contaminadas en el agua o en los alrededores de los depósitos de la misma. La región de estudio posee un clima semiárido, en el cual la radiación solar intensa así como las altas temperaturas que se presentan durante el día, desecan en poco tiempo la materia fecal, asimismo es característico que ante la baja capa de cobertura vegetal, las tolvaneras sean comunes casi todo el año, particularmente en los meses secos que van de octubre a junio, así que el excremento de caninos puede fácilmente ser transportado como partículas suspendidas por el aire; los depósitos de agua de bebida son abiertos y susceptibles de ser receptáculos de las partículas de polvo transportadas por el viento. En ningún establo se filtra o potabiliza el agua de bebida que se distribuye a los corrales, aunque no se tiene información acerca del impacto de estas medidas para ooquistes de N. caninum.
La presencia de coyotes mostró ser un importante potencial factor de riesgo a la infección por N. caninum, indicando que existen 2.4 veces más la probabilidad de que ocurra la infección por la presencia o avistamiento de estos animales en los predios, los cuales debido a sus hábitos alimenticios y de comportamiento, tienen una presencia irregular en los predios, similar a la de los perros vagabundos; al respecto, sólo existen estudios en los que se determina a los coyotes como huésped definitivo, infiriéndose que la presencia de los mismos aumenta la probabilidad del contacto con ooquistes y por tanto de transmisión horizontal e infección(8). Es probable que el papel epidemiológico de estos animales pueda ser similar y tan importante como el de los perros vagabundos e igual de complicado para evaluarlo con precisión, ya que tiene las mismas oportunidades que ellos para consumir fetos y placentas, así como de depositar heces en diferentes sitios.
La presencia de aves evaluada en este estudio (OR= 2.32), se refiere a la existencia de aves domésticas, como gallinas y guajolotes, deambulando libremente en el predio, y a la de aves de engorda, ya que algunos ganaderos mantienen casetas de pollo aledañas a las instalaciones del establo. Recientemente, se ha reportado que los pollos (Gallus domesticus) son huéspedes intermediarios naturales de N. caninum(16), mientras que experimentalmente se ha logrado la infección en palomas domésticas, Columbia livia(17), previamente otros estudios han reportado como factor de riesgo la presencia de aves al asociarse con episodios de abortos epidémicos(18). La posibilidad de que los caninos se alimenten de pollos u otras aves domésticas positivas a N. caninum es latente, sin embargo el papel epidemiológico de esta situación así como de la convivencia entre estas aves, incluyendo a pájaros residentes o migratorios, y el ganado debe investigarse con más detenimiento.
Los antecedentes de micotoxinas en el alimento, mostraron un OR de 4.6; la literatura documenta que la mala calidad del alimento y la presencia de micotoxinas provocan un riesgo a la infección, ya que inducen a una inmunodepresión, facilitando la infección; en casos de animales crónicamente infectados, éste es un tópico todavía debatido, entre otras razones porque los mecanismos de reactivación de la infección son desconocidos(1,19). Sin embargo, debe de procurarse prevenir la ingestión de alimentos con micotoxinas, y ante la sospecha deben de emplearse las herramientas farmacológicas disponibles para neutralizar su riesgo toxicológico potencial y la inmunodepresión asociada.
En la literatura se informa que tanto en México como en otros países, se ha demostrado la asociación entre el riesgo de aborto y ser positivos a N. caninun(1,20), es interesante mencionar que la OR obtenida en el presente estudio (2.13), es más elevada que la observada en estudios anteriores realizados en Aguascalientes, donde Gutiérrez et al (11), mencionan una razón de prevalencia de 1.4 y García–Vázquez et al(3), una OR de 1.4, lo que indica que aunque la seroprevalencia ha disminuido, el riesgo de aborto es latente, aún cuando éste sea endémico.
CONCLUSIONES E IMPLICACIONES
El presente trabajo confirma la presencia de una elevada seroprevalencia de anticuerpos a N. caninum en el área de estudio y ha logrado detectar cuatro factores de riesgo potenciales asociados a la seroprevalencia, que incluyen a la presencia de coyotes y aves domésticas en los predios, los antecedentes de micotoxinas en el alimento y de aborto, adicionalmente se ha detectado la contaminación del agua de bebida con ooquistes de N. caninum, que pueden ser responsables de infecciones adquiridas por su ingestión; todos estos factores que deberían considerarse al implementar medidas para prevenir esta enfermedad parasitaria.
AGRADECIMIENTOS
Se agradece a los ganaderos participantes en este estudio por su invaluable colaboración. Este proyecto fue financiado por DGEST–SEP (593.07–P).
LITERATURA CITADA
1. Dubey JP, Schares G, Ortega–Mora LM. Epidemiology and control of neosporosis and Neospora caninum. Clin Microbiol Rev 2007; 20:323–367. [ Links ]
2. Morales E, Trigo FJ, Ibarra F, Puente E, Santacruz M. Neosporosis in Mexican dairy herds: lesions and immunohistochemical detection of Neospora caninum in fetuses. J Comp Path 2001; 125:58–63. [ Links ]
3. García–Vázquez Z, Cruz–Vázquez C, García TD, Medina EL, Chavarría MB. Serological survey of Neospora caninum infection in dairy cattle herds in Aguascalientes, México. Vet Parasitol 2002; 106:115–120. [ Links ]
4. García–Vázquez Z, Rosario–Cruz R, Ramos–Aragón A, Cruz–Vázquez C, Mapes SG. Neospora caninum seropositivity and association with abortions in dairy cows in Mexico. Vet Parasitol 2005; 134:61–65. [ Links ]
5. Medina EL, Cruz–Vázquez C, Quezada TT, Morales SE, García–Vázquez Z. Survey of Neospora caninum infection by nested PCR in aborted fetuses from dairy herds in Aguascalientes, Mexico. Vet Parasitol 2006; 136:187–191. [ Links ]
6. Dubey JP, Buxton D, Wouda W. Pathognesis of bovine neosporosis. J Comp Path 2006; 134:267–289. [ Links ]
7. McAllister MM, Dubey JP, Lindsay DS, Jolley WR, Wills RA, McGuire AM. Dogs are definitive host of Neospora caninum. Int J Parasitol 1998; 28:1473–1478. [ Links ]
8. Gondim LF, McAllister MM, Pitt WC, Zemlicka DE. Coyotes (Canis latrans) are definitive hosts of Neospora caninum. Int J Parasitol 2004; 34:159–161. [ Links ]
9. García E. Modificaciones al sistema de clasificación climática de Kopen. 4a. Ed. DF, México: Universidad Nacional Autónoma de México; 1988. [ Links ]
10. Ellis JT, McMillan D, Ryce C, Payne S, Atkinson R, Harper PAW. Development of a single tube nested polymerase chain reaction assay for the detection of Neospora caninum DNA. Int J Parasitol 1999; 29:1589–1596. [ Links ]
11. Gutiérrez GJ, Cruz–Vázquez C, Medina EL, Valdivia FA, Islas OE, García–Vázquez Z. Factores de manejo asociados con la seroprevalencia a la infección por Neospora caninum, en ganado lechero de Aguascalientes, México. Vet Mex 2007; 38:261–270. [ Links ]
12. Jensen AM, Björkman C, Kjeldensen AM, Wedderkopp A, Willadsen C, Uggla A, Lind P. Associations of Neospora caninum seropositivity with gestation number and pregnancy outcome in Danish dairy herds. Prev Vet Med 199; 40:151–163. [ Links ]
13. Dyer RM, Jenkins MC, Kwok OCH, Douglas LW, Dubey JP. Serologic survey of Neospora caninum infection in a closed dairy cattle herd in Maryland: Risk of serologic reactivity by production groups. Vet Parasitol 2000; 90:171–181. [ Links ]
14. McAllister MM, Björkman C, Anderson–Sprecher R, Rogers DG. Evidence of point–source exposure to Neospora caninum and protective immunity in a herd of beef cows. J Am Vet Med Assoc 2000; 217:881–887. [ Links ]
15. Jenkins MC, Caver JA, Björkman C, Anderson TC, Romand S, Vinyard B, Uggla A, Thulliez P, Dubey JP. Serological investigation of an outbreak of Neospora caninum–associated abortion in a dairy herd in southeastern United States. Vet Parasitol 2000; 94:17–26. [ Links ]
16. Costa KS, Santos SL, Uzeda RS, Pinheiro AM, Almeida MA, Araújo FR, McAllister MM, Gondim LF. Chickens (Gallus domesticus) are natural intermediate hosts of Neospora caninum. Int J Parasitol 2008; 38:157–159. [ Links ]
17. McGuire AM, McAllister MM, Wills RA, Tranas, JD. Experimental inoculation of domestic pigeons (Columbia livia) and zebra finches (Poephila guttata) with Neospora caninum tachyzoites. Int J Parasitol 1999; 29:1525–1529. [ Links ]
18. Bartels CMJ, Wouda W, Schukken. Risk factors for Neospora caninum–associated abortion storms in dairy herds in the Netherlands (1995–1997). Theriogenology 1999; 52:247–257. [ Links ]
19. Pfeiffer DU, Williamson NB, Reichel MP, Wichtel JJ, Teague WR. A longitudinal study of Neospora caninum infection on a dairy farm in New Zealand. Prev Vet Med 202; 54:11–24. [ Links ]
20. González–Warleta M, Castro–Hermida JA, Carro–Corral C, Cortizo–Mella J, Mezo M. Epidemiology of neosporosis in dairy cattle in Galicia (NW Spain). Parasitol Res 2008; 102:243–249. [ Links ]














