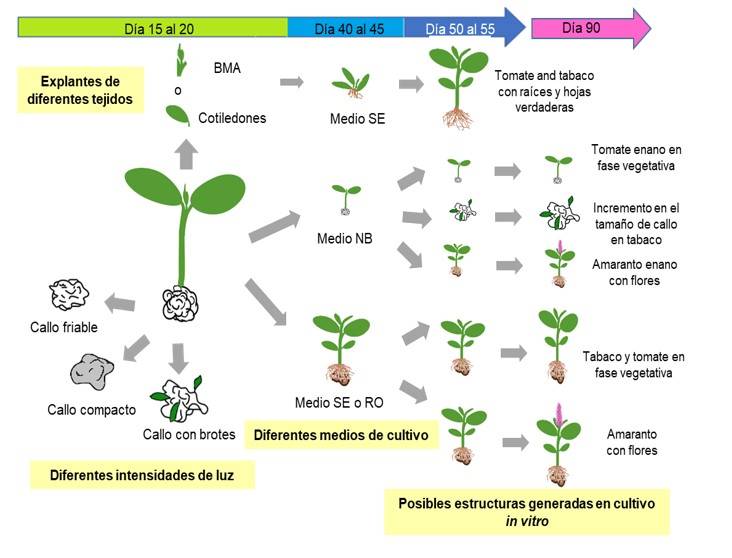
Introducción
El campo de investigación para la inducción de callos y regeneración de especies vegetales en condiciones in vitro se ha ido desarrollando a lo largo de los años debido al aumento en su demanda por el área de la biotecnología aplicada. En este momento, la industria se ha enfocado en técnicas de micropropagación in vitro para la multiplicación de plantas de variedades élite superiores o con características deseables específicas en gran escala (Kumar y Reddy, 2011). El cultivo in vitro de plantas representa una herramienta útil para la propagación y la conservación del acervo genético, la obtención de plantas axénicas y estructuras desdiferenciadas, así como para la transformación genética de plantas (Rajewski et al., 2019).
Varios estudios se han centrado en la regeneración de plantas usando hojas (Rahman et al., 2010; Khuong et al., 2013; Verma et al., 2016), epicótilos (Pal et al., 2013), hipocotilos (Le et al.. 1998; Yaacob et al., 2012; Gajdošová et al., 2013; Pal et al., 2013), cotiledones (Bhatia et al., 2004), meristemos apicales (Scotton et al., 2013; Jamous y Abu-Qaoud, 2015), protoplastos (Ganapathi et al., 2004) y tallos ( Arya et al., 1993; Bennici et al., 1997; Kumar y Dube 1997). Asimismo, el uso de callos friables, es el primer paso hacia la producción de metabolitos de forma in vitro (Gourguillon et al., 2018), su uso como biorreactores (Shibasaki et al., 1991; Ganapathi et al., 2004; Espinosa-Leal et al., 2018), entre otros.
Al ser el cultivo in vitro un sistema cerrado, existen factores externos que influyen en el desarrollo de los tejidos vegetales, ejemplo de ello es la luz; la cual es una señal que reciben los fotorreceptores para regular el crecimiento, el desarrollo, la diferenciación y el metabolismo de las plantas (Wang et al., 2001; Ouyang et al., 2003; Chen et al., 2020). La respuesta se ve afectada por mecanismos moleculares que incluyen factores de transcripción (Casal et al., 2004), fitocromos (Lau y Deng, 2010; Bian et al., 2015; Galvão y Fankhauser, 2015) y fotoreceptores (Casal et al., 2004; Nhut et al., 2015).
El efecto que tiene la luz sobre la inducción de callos ha sido estudiado en plantas como Brassica napus (40.5 µmol m-2 s-1) (Afshari et al., 2011), Cistanche deserticola (46.5 µmol m-2 s-1) (Ouyang et al., 2003), Cymbidium orchid (45 µmol m-2 s-1) (Huan y Tanaka 2004), Panax vietnamensis (20-25 µmol m-2 s-1) (Nhut et al., 2015) y Allium hirtifolium (40 µmol m-2 s-1) (Nasrin et al., 2017).
Se ha mostrado que la intensidad de la luz y la calidad espectral influyen en el crecimiento de callos (Ouyang et al., 2003; Bian et al., 2015). No obstante, se tiene poca información del efecto que tiene una alta intensidad lumínica (mayor a 50 µmol m-2 s-1). Aunado a ello, las fuentes de luz LED han sido recomendadas para regular los ambientes lumínicos en el cultivo de plantas bajo ambientes controlados debido a que brindan una óptima integración espectral (Wheeler, 2008; Bian et al., 2015; Yu et al., 2020).
Por lo anterior, es de gran interés determinar el efecto de la intensidad lumínica en la generación de plántulas y callos de importancia comercial y agrícola. Por tal motivo, el objetivo de este estudio fue analizar el efecto de diferentes intensidades de luz en semillas para la generación de callos y plántulas en tres especies vegetales, así como el aprovechamiento de plántulas para la obtención de explantes para la regeneración vegetal y formación de clones.
Material y métodos
Material vegetal
Amaranthus hypochondriacus variedad Gabriela (donada por el Instituto Tecnológico del Altiplano de Tlaxcala, Tlaxcala, México), Amaranthus hypochondriacus variedad CIBA-2 (obtenida en el Centro de Investigación en Biotecnología Aplicada del Instituto Politécnico Nacional), Nicotiana tabacum (donada por CINVESTAV, Irapuato, México) y Solanum lycopersicum de uso comercial (Vita® variedad Lycopersicon esculentum, Francia) fueron utilizadas en este estudio. Las semillas se esterilizaron sumergiéndolas en una solución compuesta por 20 ml de agua destilada estéril y 60 μl de detergente (Axion Tricloro®) en un tubo cónico de 50 ml, el cual se agitó en vortex durante 5 min. Luego, se lavaron cuatro veces con etanol al 70%, intercalando lavados con agua estéril. Posteriormente, las semillas se agitaron en vortex durante 2 min con solución de hipoclorito de sodio al 1% y se lavaron cinco veces con agua destilada estéril.
Preparación de medios
Medio Murashige y Skoog (MS) (M5519, Sigma-Aldrich, Saint Louis, USA) con 30 g L-1 de sacarosa (Meyer, CAT 2240, México) solidificado con 2 g L-1 de phytagel (Sigma-Aldrich 5519, Saint Louis, EE. UU.) Fue usado como medio basal. Con este medio basal se formuló el medio para la generación de callos y plántulas (medio NB) y se complementó con 3 mg L-1 (13.2 μmol) de N6-benciladenina (BA) y 0.2 mg L-1 (1.08 μmol) de ácido naftaleno acético (NAA). El medio utilizado para la elongación de brotes a partir de los explantes (medio SE) se formuló con el medio basal suplementado con 5 mg L-1 (5.8 μmol) de GA. El medio utilizado para la elongación de raíces (medio RO) fue el medio basal suplementado con 2 mg L-1 (5.7 μM) de IAA y 1 ml L-1 de solución de Nitsch. El pH del medio se ajustó a pH 5.8 utilizando NaOH 0.1 N y se esterilizó durante 20 min a 120 °C y 10.8 kPa.
Condiciones de cultivo e inducción de callos
Trece semillas se colocaron en cada frasco magenta que contenían 35 ml de medio NB. Los frascos se expusieron a 40.5 µmol m-2 s-1 (3 000 luxes), 108 µmol m-2 s-1 (8 000 luxes) o 162 µmol m-2 s-1 (12 000 luxes), se incubaron a 30 ±3 °C, 40 ±3% de humedad relativa y un fotoperíodo de 16 h luz/8 h oscuridad. Lámparas de luz LED fría (JWJ, Ciudad de México, México) proporcionaron la intensidad de luz. Todos los tratamientos se realizaron por triplicado, cada réplica contenía trece semillas o explantes por recipiente de cultivo. Se analizó la aparición de callos en la zona radical de las plántulas a partir de los 20 días pos siembra en medio NB. Se monitoreó el peso, número y tipo de callos generados en los diferentes tratamientos.
Se contaron los callos generados en seis frascos para cada tratamiento y se determinó el promedio. Los callos se separaron del medio NB y se enjuagaron con agua para eliminar el fitagel, antes de secarse brevemente con toallas de papel esterilizadas. Posteriormente, los callos se pesaron en una balanza semianalítica (Velab, Ciudad de México, México). Se consideraron algunos parámetros como la coloración, opacidad, consistencia del tejido y presencia de brotes para evaluar el tipo de callo. Para la consistencia del tejido se determinó si era friable o compacto. La morfología del callo se analizó mediante un microscopio estereoscópico Zeiss Stemi 508, con cámara Zeiss Axiocam ERC 5s Rev 2.0, esto se visualizó con el software ZEN lite (Zeiss, Jena, Alemania).
Generación de brotes a partir de explantes de plántulas
Veinte días después de la siembra, se utilizaron las plántulas obtenidas en cultivo in vitro para obtener explantes para ensayos de organogénesis y micropropagación clonal. Se utilizaron segmentos de 5 y 10 mm de cotiledones con pecíolos y brotes de meristemos apicales (BMA), respectivamente. Un promedio de 12 explantes con polaridad axial fueron colocados en frascos con medio NB y expuestos a una intensidad luminosa de 54 μmol m-2 s-1 por un fotoperíodo de 16 h luz/8 h oscuridad, a 22 ±3 °C y humedad relativa de 44 ±3%. Después de 15 días en medio NB, los brotes generados se transfirieron a medio SE. Una vez generadas las raíces, las plántulas se colocaron en el medio RO. Posteriormente, las plantas fueron aclimatadas a condiciones de invernadero.
Generación, mantenimiento y aclimatación de plantas a condiciones de invernadero
Veinte días después de la siembra en medio NB a 108 μmol m-2 s-1, 30 ±3 °C y humedad relativa de 40 ±3%, las plántulas se transfirieron a medio SE o RO y se monitorearon durante 40 a 50 días en condiciones in vitro. Las plantas regeneradas se colocaron en macetas de plástico o bolsas negras que contenían 1.6 L de sustrato estéril LM-GPS Lambert® con 7 g L-1 de osmocote. Las plantas se cultivaron en condiciones de invernadero a 28 ±10 °C. Se cubrieron con una bolsa de plástico transparente para su aclimatación. Después de tres días, se retiraron las bolsas. Cada tercer día se aplicó riego hasta concluir su ciclo de vida y se recolectaron semillas para su posterior propagación.
Análisis estadístico
Los experimentos tuvieron un diseño completamente al azar. Los datos se analizaron con Anova utilizando el software Statistical Analysis Software System (SAS) (SAS Institute, Cary, NC, EE. UU.). Las diferencias en las medias de los tratamientos se compararon mediante la Prueba de Duncan (GLM), se adoptó un valor de p menor o igual a 0.05 como indicador de significación estadística.
Resultados y discusión
Efecto de la intensidad de la luz en la germinación de semillas y generación de callos
Las semillas en medio NB de las tres especies fueron sometidas a tres diferentes intensidades de luz (40.5, 108 y 162 µmol m-2 s-1), la germinación ocurrió después de cuatro, siete y nueve días para amaranto, tomate y tabaco, respectivamente. El porcentaje de germinación fue 100% en amaranto, 92% en tabaco y 90% en tomate. Se observó la generación de plántulas con callos bajo las diferentes intensidades de luz (Figura 1). Las especies de tomate y tabaco generaron callos bajo las diferentes intensidades de luz. En el caso de la variedad Gabriela de amaranto, la generación de callos se observó a 108 y 162 μmol m-2 s-1; sin embargo, en la variedad CIBA-2 no se generaron callos (Figura 1). En general, el tamaño del callo y la robustez de las plántulas fueron proporcionales a la intensidad de la luz (Figura 1).

Figura 1 Efecto de la intensidad de la luz en la generación de callos y plántulas para diferentes especies de plantas. Estructuras generadas en medio NB después de 15 días pos siembra bajo diferentes condiciones de intensidad de luz. La barra de escala corresponde a 1 cm.
En este trabajo, tabaco exhibió el mayor número de callos con 108 μmol m-2 s-1, seguido de tomate (Cuadro 1). En amaranto, detectamos comportamientos diferentes entre las dos variedades (Figura 1), similar a lo reportado con fitohormonas (Bennici et al., 1997). El promedio en el peso de callos más grande se generó en tomate a 162 μmol m-2 s-1 (Cuadro 1). En tomate y tabaco el peso del callo fue proporcional a la intensidad de la luz. Asimismo, los callos mostraron diferentes tonalidades en el color, los callos de tomate mostraron una coloración blanca opaca a 45 y 108 μmol m-2 s-1 y una coloración verde a 162 μmol m-2 s-1. Los callos de tabaco exhibieron una coloración blanca con brotes verdes, y los callos de la variedad Gabriela de amaranto mostraron una coloración amarillo-marrón (Figura 2a). Este último hallazgo es similar al reportado por Yaacob et al. (2012); Comia-Yebron et al. (2017); debido a la presencia de betacianinas (Yaacob et al., 2012; Comia-Yebron et al., 2017).
Se considera el número y peso de callos de tomate y amaranto 15 días pos siembra. Los valores medios dentro de una columna seguida de la misma letra no son significativamente diferentes por la prueba de rango múltiple de Duncan (p≤ 0.05). a) los valores representan las medias (±SD) de tres experimentos independientes, se utilizaron seis matraces para cada tratamiento y se determinó el promedio; b) la letra mayúscula representa el efecto en cada especie a diferentes intensidades de luz; y c) la letra minúscula representa el efecto entre especies a diferentes intensidades de luz.
Cuadro 1 Efecto de la intensidad de la luz sobre el peso y el número de callos generados a partir de semillas germinadas en medio NB.
| Especies | Callos | Intensidad de luz (µmol m-2 s-1) | ||
| 40.5 | 108 | 162 | ||
| Tomate | Número de callos | 8.5 ±2 Ce | 11.8 ±0.75 Ab | 10 ±0 Bc |
| Peso de los callos (g) | 0.33 ±0.14 Cf | 0.72 ±0.07 Bb | 0.89 ±0.12 Aa | |
| Tabaco | Número de callos | 1.16 ±0.75 Cg | 12.2 ±0.75 Aa | 10 ±0 Bc |
| Peso de los callos (g) | 0.06 ±0.02 Ch | 0.14 ±0.06 Bg | 0.41 ±0.07 Ad | |
| Amaranto variedad Gabriela | Número de callos | 0 Ch | 9.5 ±1.87 Ad | 6.66 ±1.2 Bf |
| Peso de los callos (g) | 0 Ci | 0.47 ±0.1 Ac | 0.38 ±0.04 Be | |
| Amaranto variedad | Número de callos | 0 Ah | 0 Ah | 0 Ah |
| CIBA-2 | Peso de los callos (g) | 0 Ah | 0 Ah | 0 Ah |
Se identificaron callos friables, compactos y con brotes. Se agruparon los callos totales de cada especie para identificar el porcentaje del tipo de callo. En tomate y amaranto (variedad Gabriela) predominaron los callos de tipo compacto y friable, mientras que en tabaco los callos con brotes (Figura 2a). En tomate 51% fueron callos friables (a 162 μmol m-2 s-1) y 47% fueron callos compactos (a 40.5 μmol m-2 s-1). En tabaco 55% fueron callos con brotes. Para amaranto variedad Gabriela 76% de los callos fueron compactos a 108 μmol m-2 s-1 (Figura 2b). El porcentaje de callos con brotes para los cultivos de amaranto variedad Gabriela y tomate fue muy bajo (1.7 y 5.3%, respectivamente) (Figura 2b).
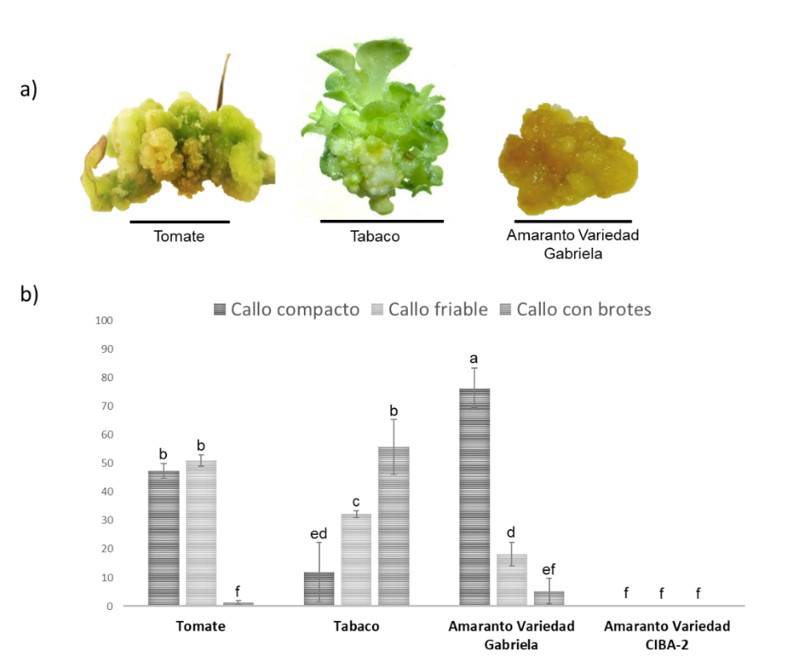
Figura 2 Callos generados en medio NB bajo diferentes condiciones de luz para tomate, tabaco y amaranto. a) tipo de callo generado a partir de tomate, tabaco y amaranto; y b) porcentaje de tipos de callos generados. La barra de escala corresponde a 1 cm.
La aparición de callos comenzó a observarse en todas las especies a los 15 días pos siembra (Figura 1), disminuyendo los tiempos establecidos en otros estudios en amaranto, donde los tiempos son de 30 a 40 días (Yaacob et al., 2012; Comia-Yebron et al., 2017), 27 días en tomate (Bhatia et al., 2004; Osman et al., 2010; Jehan y Hassanein, 2013) y 21 días en tabaco (Shibasaki et al., 1991; Ganapathi et al., 2004), lo que a nivel industrial representaría una reducción de costos. Por otro lado, se observó una variación en el tamaño, peso, color y tipo de callos entre especies (Figura 2, Cuadro 1), sugiriendo que la intensidad de la luz es crucial en la inducción y el desarrollo del callo y su efecto dependerá de la especie, lo que podría estar asociada con el tipo y número de fotorreceptores de cada especie (Ouyang et al., 2003; Bian et al., 2015; Nhut et al., 2015).
Ensayos de organogénesis y generación de clonas
La presencia de brotes con hojas se observó en los explantes desde los nueve días en medio NB (Figura 3a). Los explantes de BMA fueron más efectivos que los cotiledones para la regeneración de plantas en las diferentes especies (Figura 3b). El mayor porcentaje en regeneración a partir de explantes de BMA se obtuvo en tabaco y tomate con 80% aproximadamente (Figura 3b), más alta que la reportada previamente (Bhatia et al., 2004; Rahman et al., 2010; Jamous y Abu-Qaoud, 2015). Aquí se obtuvo entre 15% (variedad CIBA-2) y 30% (variedad Gabriela) de regeneración de BMA en amaranto, superior a lo reportado previamente en hojas e hipocotilos de amaranto (Mnzava y Masam, 1985; Gajdošová et al., 2013; Pal et al., 2013). Nuestros resultados sugieren que los explantes de BMA son una excelente alternativa para la regeneración de plantas y su eficiencia depende de la especie. Además, se obtuvo una reducción en los tiempos de regeneración a partir de explantes, respecto a lo reportado en tomate y tabaco (Osman et al., 2010; Rahman et al., 2010).

Figura 3 Regeneración de brotes y desarrollo de plantas. a) regeneración de brotes de explantes de BMAs y cotiledones en medio NB bajo una intensidad lumínica de 54 µmolm-2s-1, 9 días después de colocación en medio NB; b) porcentaje de regeneración de brotes de BMA y cotiledones en cada especie después de 15 días en medio NB; y c) regeneración de brotes de BMA después de 15 días en medio RO. La barra de escala corresponde a 1 cm.
Generación de plantas en fase vegetativa o reproductiva en condiciones in vitro
Siete días después de la transferencia de los brotes clonales a medio SE, se observó la generación de raíces en tabaco y tomate. Para el amaranto, los brotes iniciaron un proceso de oxidación, lo que limitó la generación de raíces. Las plántulas que se transfirieron a medio RO mostraron hojas y raíces verdaderas en tabaco y tomate (Figura 3c), logrando 100% de aclimatación en sustrato (Figura 4).
Obtención de callos, plántulas y plantas adultas en el mismo sistema
Las estructuras generadas en cultivo in vitro de las diferentes especies utilizando diferentes tejidos y medios de cultivo se resumen en la Figura 5. La germinación de semillas en medio NB bajo diferentes intensidades de luz permitió la generación de plántulas con callos al mismo tiempo, a excepción de la variedad CIBA-2. Las plántulas de 20 días posteriores a la siembra transferidas SE o RO alcanzaron la etapa vegetativa o reproductiva después de 90 días (Figura 4b, 5). Simultáneamente, se monitorearon las plántulas con callo en medio NB a los 90 días pos-siembra. Para el tabaco se logró obtener callos con brotes y callos friables, lo que permitió obtener callos de hasta cuatro centímetros sin mostrar signos de oxidación.
Para el amaranto se obtuvieron plantas pequeñas, pero que completaron su ciclo de vida, siendo el primer trabajo en demostrar que es posible concluir el ciclo de vida del amaranto en un sistema in vitro, lo que lleva a la producción de anteras asépticas que pueden ser utilizadas para la generación de células haploides. En resumen, este trabajo destaca la posibilidad de generar callos, plántulas o plantas adultas en un mismo sistema; tales partes podrían ser ampliamente utilizadas para diversas aplicaciones biotecnológicas; por ejemplo, para obtener plantas transgénicas o cultivos en suspensión para la introducción de moléculas de interés comercial, propagar tejidos, obtener clones, obtener anteras estériles para manipulación genética e incluso generar plantas haploides.
Conclusiones
Este estudio es el primero en demostrar que la intensidad de la luz afecta el desarrollo y tipo de callo y este efecto varía dentro y entre especies. La combinación de especies, medios e intensidad lumínica permiten obtener diferentes tipos de callos, plántulas y plantas en fase vegetativa y reproductiva, que da la posibilidad de generar estos tejidos en un sistema de cultivo in vitro y que podrían ser utilizadas con fines biotecnológicos. Por último, el reducido tiempo de cultivo y el uso mínimo de medios de cultivo para la generación de estructuras como plantas axénicas o callos, sugiere podría proponerse como un protocolo simple para el cultivo in vitro de plántulas con callos.











 texto en
texto en