Introducción
Los hongos silvestres son componentes funcionales y esenciales de los ecosistemas forestales, y proporcionan directamente a los seres humanos productos valiosos. Debido a sus propiedades gastronómicas y nutracéuticas, se ha incrementado su demanda en perjuicio de su distribución y abundancia en los ecosistemas naturales llegando incluso a su extinción (Pilz et al., 1996; Alvarado-Castillo et al., 2015).
De acuerdo con Sánchez y Mata (2012), los hongos silvestres comestibles han tenido impulso a nivel mundial desde mediados del siglo pasado y posiblemente continúe por las siguientes razones: incremento de la población, incremento en la demanda, diversificación de los hongos producidos, nuevas aplicaciones de los hongos en el campo de la alimentación y la medicina, y atractivo como actividad económica. Respecto a su comercialización, Contreras et al. (2018) indican que el precio del hongo comestible Totolcozcatl (Entoloma abortivum), de hábitat terrícola, simbionte y parásito, oscila entre $100.00 a $150.00 por kg, debido a la escasez en la región.
Alvarado et al. (2012) mencionan que existen dos opciones para el aprovechamiento racional de este recurso y su conservación: 1) el manejo y la gestión adecuada de las poblaciones naturales; y 2) el desarrollo de técnicas para la domesticación y producción comercial. Los hongos silvestres comestibles pueden ser cultivados en ambientes controlados, ya que al ser independientes de otros seres vivos sólo basta desarrollar un sustrato lignocelulósico determinado y controlar la temperatura, ventilación, humedad y luz adecuadas para lograr que crezcan y fructifiquen.
En este contexto, Ríos y Ruiz (1993) establecen que para la propagación de los hongos silvestres comestibles con fines comerciales, es necesario identificar las especies prevalecientes en la región y determinar los factores que influyen en su desarrollo y crecimiento. Una vez logrado lo anterior, las fases previas a su propagación son: obtención del micelio, elaboración de inóculo, preparación del sustrato, inoculación del sustrato, incubación y fructificación.
La obtención de micelio es una de las fases determinantes de éxito para la propagación del hongo, el cual depende sobremanera que el medio de cultivo proporcione los nutrientes necesarios para el desarrollo del micelio en el tiempo y la forma en que éste lo demande. Por lo anterior, el objetivo de esta investigación fue evaluar la dinámica de crecimiento del diámetro promedio micelial del hongo ‘Totolcozcatl’ en tres medios de cultivo: extracto de malta-extracto de levadura-polipeptona-agar (MYPA), peptona de carne-dextrosa-extracto de levadura-agar bacteriológico (CYM); y extracto de malta- salvado (EMS) y valorar mediante un modelo logístico, cuál de los medios proporciona las condiciones más favorables para el desarrollo del micelio como etapa determinante previa a su propagación.
Materiales y métodos
Localización del área de estudio
Ejemplares de la especie Entoloma sp. fueron colectados en relictos de bosque mesófilo de montaña ubicados en la finca Ocotitla, en la comunidad de Xaltepuxtla, en el estado de Puebla, entre las coordenadas 20° 11’ 23.06” a 20° 10’ 57.124” latitud norte y 97° 58’ 5.303” a 97° 57’ 30.836” longitud oeste, a una altura promedio de 1 280 msnm (Mateo-Guzmán, 2018). El clima corresponde a un semicálido húmedo con lluvias todo el año, precipitación del mes más seco mayor de 40 mm y menos de 18% de lluvia invernal con respecto a la lluvia total y su temperatura media anual oscila entre los 18° y 24 °C.
Colecta y desinfección del material
Se recolectaron hongos de cuerpo completo durante el período de emergencia de estos, entre diciembre y enero, cuando las condiciones de sustrato orgánico, temperatura y humedad son favorables para su crecimiento (Mateo, 2018). Se cubrieron con papel aluminio y se transportaron en una hielera para contar con material fresco para su aislamiento. En el laboratorio, este proceso consistió en seleccionar hongos enteros y sanos; desinfectar la superficie de los hongos por medio de un algodón embebido en una solución de agua con detergente, posteriormente con una solución de cloro al 10% y finalmente en una solución al 0.2% de antibiótico gentamicina de uso veterinario.
Obtención de micelio
La obtención del micelio en los tres medios de cultivo se hizo mediante la metodología de Ardón (2007); Silva et al. (2010), que consiste en aislamiento por contexto, proceso de purificación y prueba de crecimiento del micelio en medios de cultivo. Ésta última etapa consistió en: a) resembrar las cepas obtenidas del aislamiento por contexto (vegetativo) en tres medios de cultivo (extracto de malta-extracto de levadura-polipeptona-agar (MYPA); peptona de carne-dextrosa-extracto de levadura-agar bacteriológico (CYM) y extracto de malta-salvado (EMS); b) comparar su crecimiento en cada uno; c) definir el medio en el que mejor se adapta y crece el micelio; d) inocular más de cinco cajas por medio; e) escoger cinco de éstas con mejor apariencia y ausencia de contaminantes; f) extraer una fracción de cepa en forma circular de aproximadamente 0.5 cm; g) colocar ésta en el centro de una caja Petri; h) sellar ésta con parafilm y etiquetarla con el nombre del medio y la fecha de inoculación; i) colocar la caja sellada y etiquetada a temperatura ambiente; y j) medir el diámetro de crecimiento micelial cada dos días.
Análisis de datos
Para el análisis de datos del crecimiento del diámetro micelial en los tres medios de cultivo: MYPA, CYM y EMS, se aplicó un análisis de varianza (Anova) de una vía (1V) para medidas repetidas (MR), Anova-1V-MR (Davis, 2002), para determinar si estos tienen algún efecto en el crecimiento del diámetro del micelio del hongo Totolcozcatl, donde los medios de cultivo corresponden al factor categórico con tres niveles. El método consistió en: a) comprobar los supuestos de homogeneidad entre las varianzas de las diferencias entre todos los posibles pares de medio de cultivo y la normalidad de los errores por medio de la prueba de esfericidad de Mauchly y Shapiro-Wilk, respectivamente; b) aplicar la prueba de épsilon Greenhouse y Geisser o el enfoque multivariante, en los casos donde no se cumpla el supuesto de esfericidad; y c) aplicar el modelo estadístico
Para cada
Las pruebas de hipótesis se realizaron con un nivel de significancia α= 0.05 y la comparación entre medias mediante el método de Bonferroni (Morell, 2014) con el software SPSS (IBM Corp. Released, 2012).
Determinación de la dinámica del crecimiento micelial
La dinámica del crecimiento del diámetro fúngico o aumento de biomasa micelial está en función de los parámetros de fermentación e inclusive frente a situaciones de estrés (Deacon, 2006; Huang et al., 2010). Varios modelos se han aplicado para describir la cinética del crecimiento del diámetro micelial en distintos tipos de cultivo, como el modelo lineal, exponencial, modelo logístico, como también, modificaciones de éstos (Viniegra-González et al., 1993; Mitchell et al., 2004). Para la determinación de la dinámica del crecimiento del diámetro promedio micelial se utilizó la ecuación diferencial propuesta por Sarikaya y Ladisch (1997).
Donde: D= diámetro de crecimiento micelial (mm), t= tiempo (días),
El modelo de la dinámica del crecimiento micelial, obtenido de la integración de
Y esto sucedió cuando t es igual a:
Los parámetros
Resultados y discusión
Determinación del crecimiento del diámetro micelial
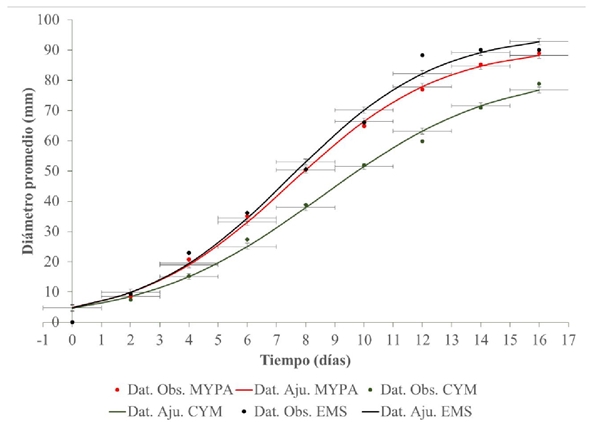
En el Cuadro 1, se muestran los resultados obtenidos del crecimiento promedio del diámetro micelial del hongo Totolcozcatl en los tres medios de cultivo. El crecimiento promedio neto del micelio fue 88.5, 78.3 y 89.5 mm, para el medio de cultivo MYPA, CYM y EMS, respectivamente. Diferenciando entre los medios de cultivo, en EMS se alcanzó un diámetro promedio máximo de crecimiento de 90 mm a los 16 días, seguido de MYPA y CYM con 89 y 78.8 mm, respectivamente, en el mismo período de tiempo.
Cuadro 1 Crecimiento del diámetro promedio del micelio del hongo Totolcozcatl, en los tres medios de cultivo, expresado en (mm).
Medio de cultivo |
Días de medición |
||||||||
0 |
2 |
4 |
6 |
8 |
10 |
12 |
14 |
16 |
|
MYPA |
0.05 |
8.5 |
20.8 |
35 |
50.4 |
64.8 |
77 |
85.3 |
89 |
CYM |
0.05 |
7.4 |
15.3 |
27.4 |
38.9 |
51.9 |
59.9 |
71.1 |
78.8 |
EMS |
0.05 |
9.3 |
23 |
36.2 |
50.6 |
66 |
88.3 |
90 |
90 |
Con base a la variabilidad observada durante el desarrollo del micelio y los datos ajustados, la Figura 1 muestra que el desarrollo en diámetro promedio micelial del hongo Totolcozcatl fue más favorable en el medio de cultivo EMS, logrando colonizar la caja Petri en un período de 14 días, seguido del MYPA y del CYM.
Análisis de varianza de medias repetidas de una vía (Anova-MR-1V) para medios de cultivo
Con la finalidad de determinar si los medios de cultivo tienen algún efecto en el crecimiento promedio del diámetro micelial del hongo Totolcozcatl, se aplicó la técnica estadística del Anova-MR-1V a los datos experimentales. El medio de cultivo correspondió al factor categórico con tres niveles; es decir, los medios de cultivo: 1-MYPA, 2-CYM y 3-EMS, respectivamente. El crecimiento del diámetro promedio del micelio se definió como la variable dependiente; es decir, caja petri 1. Efecto del MYPA, caja petri 2. Efecto del CYM y caja petri 3. Efecto del EMS. El tamaño de la muestra fue de ocho, que son veces que se tomaron los datos.
En el Cuadro 2, los resultados de la prueba de esfericidad de Mauchly indican que las varianzas de las diferencias entre cada dos niveles del factor no son iguales. Esto significa que la matriz de varianzas y covarianzas no es circular o esférica, dado que el nivel crítico asociado al estadístico (significancia: 0.014) no es mayor que 0.05. En consecuencia, se utilizó el estadístico F univariado, aplicando un índice corrector llamado épsilon, el cual expresa el grado en que la matriz de varianzas-covarianzas se aleja de la esfericidad. En condiciones de esfericidad perfecta, épsilon debe de valer 1. Épsilon fue estimado mediante el estadístico de Greenhouse-Geisser y Huynh-Feldt, siendo la primera de ellas más conservadora. Épsilon también se estimó con el valor límite inferior, el cual expresa el valor que adoptaría en el caso de incumplimiento extremo del supuesto de esfericidad.
Cuadro 2 Resultados de la prueba de esfericidad de Mauchly.
Efecto dentro de los sujetos |
Estadístico W de Mauchly |
Aproximación de Ji-Cuadrada |
Epsilon |
||||
Greehouse-Geisser |
Huynh-Feldt |
Límite inferior |
|||||
Tratamientos |
0.239 |
8.586 |
2 |
0.014 |
0.568 |
0.604 |
0.5 |
Gl= grado de libertad; p= significancia.
Por lo anterior, se hizo la corrección de los grados de libertad de F (tanto en el numerador como en el denominador) multiplicándolos por el valor estimado de épsilon. En consecuencia, en el Cuadro 3, los resultados obtenidos en los cuatro estadísticos F indican que se rechaza la hipótesis nula, dado que el nivel crítico asociado a cada una de las pruebas es menor que 0.05, esto significa que existen diferencias estadísticamente significativas en el desarrollo del hongo en al menos uno de los tres medios de cultivo.
Cuadro 3 Prueba de efectos intra-sujetos.
Fuente |
|
Suma de cuadrados Tipo III |
Grados de libertad |
Cuadrados medios |
F |
Significancia |
Tratamiento |
Esfericidad asumida |
727.85 |
2 |
363.92 |
21.06 |
0 |
Greenhouse-Geisser |
727.85 |
1.136 |
640.85 |
21.06 |
0.002 |
|
Huynh-Feldt |
727.85 |
1.208 |
602.35 |
21.06 |
0.001 |
|
Límite inferior |
727.85 |
1 |
727.85 |
21.06 |
0.003 |
|
Error (tratamiento) |
Esfericidad asumida |
241.972 |
14 |
17.28 |
|
|
Greenhouse-Geisser |
241.972 |
7.95 |
30.44 |
|
|
|
Huynh-Feldt |
241.972 |
8.458 |
28.61 |
|
|
|
Límite inferior |
241.972 |
7 |
34.57 |
Comparación de medias por medio de la prueba de Bonferroni
Los resultados obtenidos de las comparaciones dos a dos entre los medios de cultivo de acuerdo con los niveles críticos asociados a cada comparación indican que únicamente existen diferencias significativas entre el medio de cultivo 2 con respecto al 1 y 3, mientras que entre 1 y 3 no hay diferencias (Cuadro 4). Este primer análisis indicó que los medios de cultivo MYPA y EMS son los más favorables para el desarrollo del crecimiento del diámetro promedio micelial del hongo Totolcozcatl que el CYM.
Cuadro 4 Comparación de medias entre los medios de cultivo.
Tratamiento (I) |
Tratamiento (J) |
Diferencia de medias (I-J) |
Error estándar |
Significanciab |
95% intervalo de confianza para la diferenciab |
|
Límite inferior |
Límite superior |
|||||
1 |
2 |
10.006* |
1.81 |
0.003 |
4.344 |
15.669 |
3 |
-2.831 |
1.306 |
0.201 |
-6.916 |
1.254 |
|
2 |
1 |
-10.006* |
1.81 |
0.003 |
-15.669 |
-4.344 |
3 |
-12.838* |
2.825 |
0.008 |
-21.672 |
-4.003 |
|
3 |
1 |
2.831 |
1.306 |
0.201 |
-1.254 |
6.916 |
2 |
12.838* |
2.815 |
0.008 |
4.003 |
21.672 |
|
b= ajuste para comparaciones múltiple= Bonferroni.
Las diferencias encontradas en el crecimiento del diámetro entre los tres medios empleados se asocian a la composición química de estos. El medio EMS posee características nutritivas que favorecen el desarrollo de la especie, ya que proporciona nutrientes como maltosa, glucosa y el salvado de trigo, que suministra celulosa, polisacáridos y hemicelulosa, que, en el hábitat natural del hongo, la celulosa está siempre presente en la materia en descomposición (Mateo, 2018). Esto favorece que los hongos incrementen la ramificación de sus hifas y por consiguiente, la cantidad de biomasa y el área superficial del micelio (Harris, 2008). Por el contrario, si los nutrientes son limitados, el micelio tiende a ser menos ramificado (Prosser y Tough, 1991).
Determinación de la dinámica del crecimiento micelial
El modelo ajustado a los datos de crecimiento medido como diámetro promedio micelial del hongo Totolcozcatl, en los tres medios de cultivo fue el logístico, lo cual coincidió con lo expuesto por Sarikaya y Ladisch (1997), quienes mencionan que las mediciones del diámetro micelial presentan un buen ajuste con un modelo logístico, aunque, este ajuste resulta mejor cuando se utiliza el área de las colonias como variable.
De acuerdo con Madigan et al. (2004), este comportamiento característico del desarrollo microbiano, evidencia tres etapas. La primera es de latencia, asociada a la síntesis de enzimas que permiten la utilización de los nutrientes del medio de cultivo. La segunda es exponencial, obteniéndose en ésta el punto de crecimiento máximo
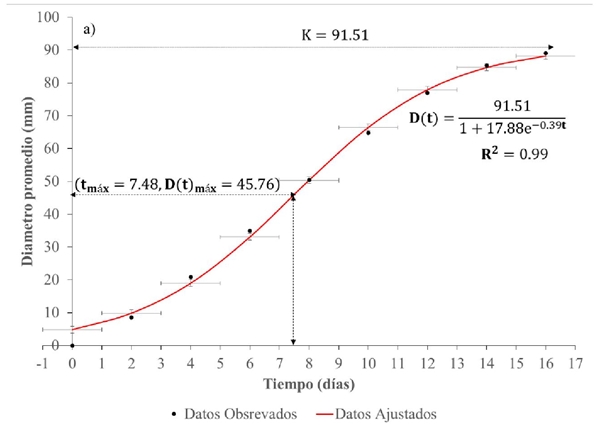
Figura 2a Desarrollo del diámetro promedio micelial de cepas de hongo Totolcozcatl cultivadas en el medio cultivo MYPA.
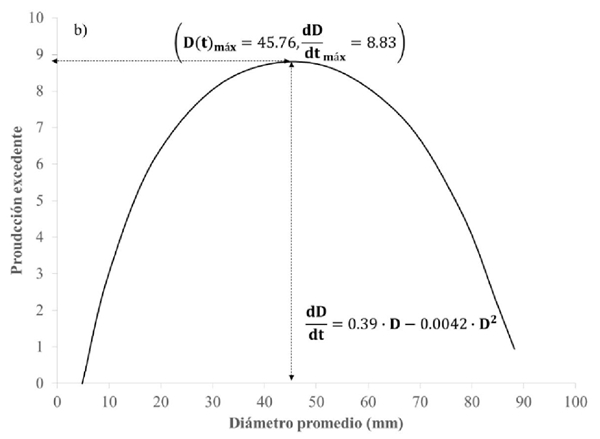
Figura 2b Producción excedente o número de hifas agregadas al micelio de un tiempo a otro, en función del tamaño de su población.
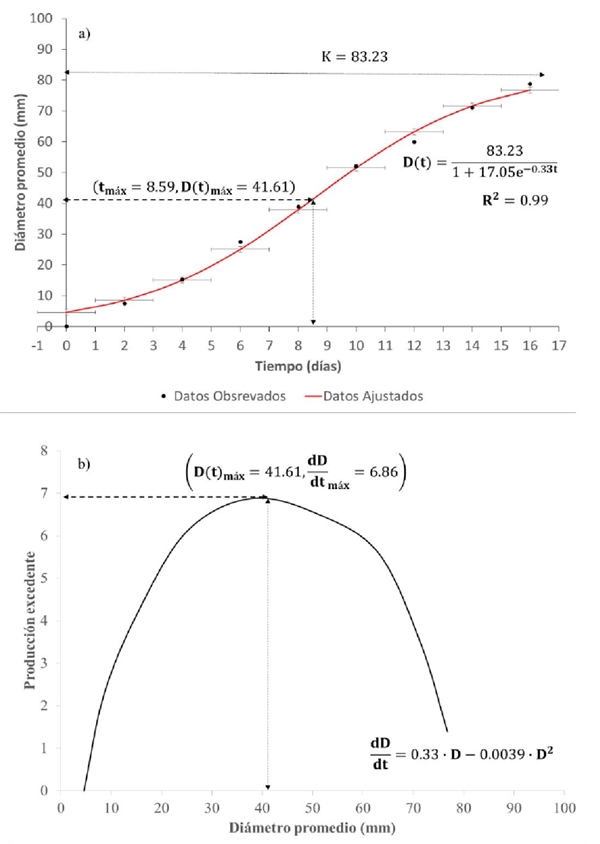
Figura 3 a) desarrollo del diámetro promedio micelial de cepas de hongo Totolcozcatl cultivadas en el medio cultivo CYM; y b) producción excedente o número de hifas agregadas al micelio de un tiempo a otro, en función del tamaño de su población.
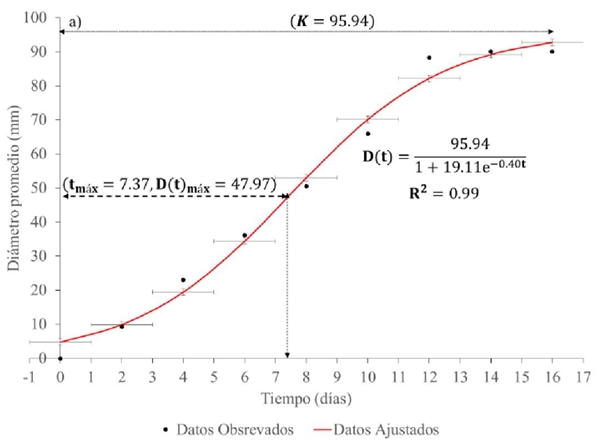
Figura 4a Desarrollo del diámetro promedio micelial de cepas de hongo Totolcozcatl cultivadas en el medio cultivo EMS.
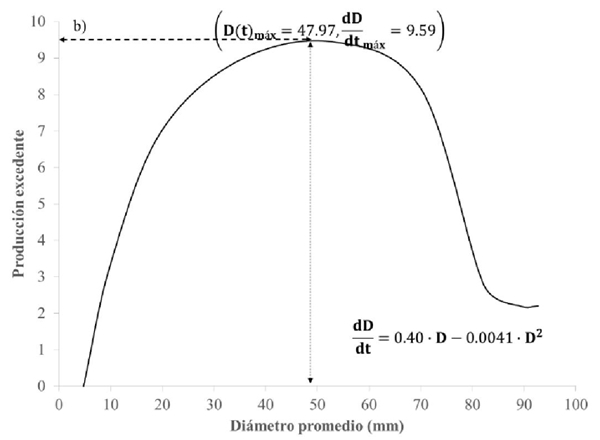
Figura 4b Producción excedente o número de hifas agregadas al micelio de un tiempo a otro, en función del tamaño de su población.
Respecto a la dinámica del desarrollo del diámetro del micelio del hongo Totolcozcatl en el medio MYPA, en la Figura 2, el modelo ajustado indica que su máximo crecimiento, conocido también como capacidad de carga, se consiguió en
De acuerdo con Madigan et al. (2004), al inicio, la suficiencia de recursos, en espacio y alimento, permite crecer a las hifas en número e individualmente casi sin restricciones, de manera geométrica, ya que cada unidad de diámetro incrementada significa una disminución en la disponibilidad de los recursos. En consecuencia, la velocidad con que venía creciendo las hifas se reduce paulatinamente hasta que todos los recursos del medio de crecimiento son consumidos tan rápido como se producen, y el micelio deja de crecer.
Este punto se le conoce como capacidad de carga tal y como ya se mencionó anteriormente (
El modelo ajustado a los datos experimentales con el medio de cultivo CYM y EMS (Figura 3 y 4) indican que su capacidad de carga y el punto de máximo crecimiento resultó cerca de
Conclusiones
Los modelos matemáticos ajustados que explican el crecimiento micelial en cada medio de cultivo, en términos de bondad de ajuste, revelaron un alto porcentaje de la variabilidad de los logaritmos de los recuentos o mediciones de las hifas en el tiempo. Asimismo, estas funciones permitieron estimar: punto de máximo crecimiento (K) del micelio (en diámetro), punto en el que las hifas crecen rápidamente de un tiempo a otro, producción excedente o número de hifas agregadas al micelio en cada medio de cultivo y menor tiempo en que se alcanza ésta. Con base a estos resultados, se concluye que el medio EMS es el medio más viable para el proceso de inducción de cultivo del hongo Totolcozcatl.











 texto en
texto en